Радиоактивность модели атомов 9 класс конспект
Обновлено: 04.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока по ФГОС
Физика, 9-В класс
Хабецкая Н.И., учитель физики МБОУ Школы № 12 г. о. Самара
Тема урока. Радиоактивность. Модели атомов.
Цель урока: продолжить формирование умения находить и выделять
необходимую информацию из различных источников в разных
формах (текст, рисунок, таблица, схема).
Задачи урока:
образовательные:
изучить с учащимися понятие радиоактивности, характеристики видов излучения и ядерную модель атома.
анализируя результаты эксперимента учить выделять главное и делать выводы
развивающие :
формировать мыслительные операции: умение делать выводы из представленного материала, сравнивать и сопоставлять характеристики видов излучения;
развивать познавательную активность;
воспитательные:
развивать умение работать самостоятельно и в паре;
формировать уважительное отношение к учебному труду и друг к другу.
Дидактический тип урока: изучение нового материала.
Методы обучения : объяснительно-иллюстративный, репродуктивный,
Формы работы : фронтальная, индивидуальная, в парах, в группах.
Оборудование для урока : компьютер, проектор, интерактивная доска,
презентация, составленная учителем, раздаточный
материал на столах учащихся.
Организационный момент – 2 мин.
У природы много тайн и загадок, раскрывает она их не охотно, поэтому каждая очередная разгадка – важный шаг человечества на путь к познанию мира. Вот и мы сегодня приоткроем занавес тайны…
Мотивация – 3 минуты
Задание: выберите из списка слова, обозначающие явления. Дайте определения этим явлениям. Ион, атом, протон, электризация , нейтрон, проводник, напряжённость, диэлектрик, электроскоп, заземление , поле, оптика, линза, сопротивление, напряжение, вольтметр, амперметр, заряд, мощность, электричество, радиоактивность , магнит, генератор, телеграф, компас, намагничивание .
Электричество или электрический ток – это направленное или упорядоченное движение заряженных частиц.
Намагничивание – это явление, при котором образуются постоянные магниты.
Заземление – передача заряда земле.
Электризация – способность тела после натирания притягивать другие тела.
Для какого явления мы ещё не можем дать определение?
А теперь сформулируем задачи, которые служат этапами нашей работы .
1. Рассмотреть понятие радиоактивность.
2. Опыт по обнаружению сложного состава радиоактивного излучения.
3. Рассмотреть виды излучений
4. Модели атомов.
Основные вопросы (должны быть заранее записаны на доске)
А каким способом мы можем добывать новые знания?
Учащиеся отвечают: из учебника, дополнительной литературы, интернета и т. д. Подходим к цели урока, которую сначала формулируют учащиеся, а затем учитель уточняет: продолжаем формировать умение находить и выделять необходимую информацию из различных источников в разных формах (текст, рисунок, таблица, схема).
Актуализация знаний – 3 мин.
Но с середины XIX в. стали появ ляться экспериментальные факты, которые ставили под сомнение представления о недели мости атомов. Результаты этих экспериментов наводили на мысль о том, что атомы имеют сложную структуру и что в их состав входят электрически заряженные частицы.
Давайте вспомним: какие факты и явления подтверждают сложное строение атома?
Сложное строение атома подтверждают:
Электризация – способность тела после натирания притягивать другие тела.
Электрический ток в металлах – это направленное движение электронов.
Явление электролиза – выделение вещества на катоде при прохождении электрического тока по электролиту.
Опыты Иоффе и Милликена - деление электрического заряда, определение заряда электрона.
Что называется атомом?
Атом — это наименьшая частица вещества, сохраняющая все его химические свойства.
Что представляет собой планетарная модель атома?
Также как планеты движутся вокруг Солнца, так и электроны движутся вокруг ядра.
Изучение нового материала – 25 мин.
Наиболее ярким свидетельством сложного строения атома явилось открытие явления радиоактивности, сделанное французским физи ком Анри Беккерелем в 1896 г.
Беккерель обнаружил, что химический эле мент уран самопроизвольно (т. е. без внешних воздействий) излучает ранее неизвестные не видимые лучи, которые позже были названы радиоактивным излучением. Поскольку радиоактивное излучение обладало необычными свойст вами, многие учёные занялись его исследованием. Оказалось, что не только уран, но и некоторые другие химические элементы (например, радий) тоже самопроизвольно испускают радио активные лучи . Способность атомов некоторых химических элементов к самопроизвольному излучению стали называть радиоактивност ью (от лат. radio - излучаю и activus - действенный).
В 1899 г. в результате опыта, проведённого под руководством английского физика Эрнес та Резерфорда, было обнаружено, что радио активное излучение радия неоднородно, т. е имеет сложный состав. Рассмотрим, как про водился этот опыт.
Кру пицу радия помещали на дно тол стостенного свинцового сосуда. Пучок радиоак тивного излучения радия выходил сквозь узкое отверстие и попадал н фотопластинку (излучение радия происходит во все стороны, но сквозь толстый слой свинца оно пройти не может). После проявления фотопластинки на ней обнаруживалось одно тёмное пятно - как раз в том месте, куда попадал пучок.
Потом опыт изменяли: создава ли сильное магнитное поле, действовавшее на пучок. В этом случае на проявленной пластин ке возникало три пятна: одно, центральное было на том же месте, что и раньше, а два дру гих - по разные стороны от центрального.
Какой вывод можно сделать из опыта?
Если два потока отклонились в магнитном по ле от прежнего направления, значит, они пред ставляют собой потоки заряженных частиц. Отклонение в разные стороны свидетельствует о разных знаках электрических зарядов частиц. В магнитном поле на движущиеся заряженные частицы действует сила Лоренца и по правилу левой руки в одном потоке присутствовали только положительно заряженные частицы, в дру гом - отрицательно заряженные. А централь ный поток представлял собой излучение, не имеющее электрического заряда, так как на него не действовала сила Лоренца.
Положительно заряженные частицы на звали альфа-частицами, отрицательно заряженные - бета-частицами, а нейтральные – гамма-частицами или гамма-квантами .
Прочитайте текст на карточке и заполните таблицу.
Свойства альфа-лучей - 1 группа
Свойства бета-лучей - 2 группа.
Свойства гамма-лучей - 3 группа.
Проникающая способность - насколько интенсивно они поглощаются различными веществами.
Лист бумаги толщиной
Алюминий или цинк – несколько мм
Свинец – 5 см, бетон – 30 см, грунт – 60 см
Что же такое естественная радиоактивность?
Радиоактивность – это способность атомов некоторых химических элементов к самопроизвольному излучению альфа, бета и гамма-излучения.
Что доказало явление радиоактивности?
Явление радиоактивности доказывало, что атомы вещества имеют сложное строение. А так как атом в целом нейтрален, это явление позволило сделать предположение, что в состав атома входят отрицательно и положительно заряженные частицы.
Английский физик Джозеф Джон Томсон предложил модель атома, которая объясняла известные к тому времени физические явления.
Самостоятельно изучаем модель атома Томсона в течение 2 мин на стр. 222 абзац 3.
Английский физик Томсон предложил в 1903 г. одну из первых моделей строения атома. По предположению Томсона, атом представляет собой шар, по всему объёму которого равномерно распределён положи тельный заряд. Внутри этого шара находятся электроны. Каждый электрон может совер шать колебательные движения около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрица тельному заряду электронов, поэтому электрический заряд атома в целом равен нулю.
Что же представляла модель атома Томсона?
Модель строения атома, предло женная Томсоном, нуждалась в экспериментальной проверке. Поэтому в 1911 г. Резерфорд совместно со своими сотрудниками провёл ряд опытов по исследованию состава и строения атомов.
В опытах использо вался свинцовый сосуд с радиоактивным веществом , излучающим α -частицы. Из этого сосуда α -частицы вылетают через узкий канал со скоростью порядка 15000 км/с.
Поскольку α -частицы непосредственно уви деть невозможно, то для их обнаружения служит стеклянный экран. Экран покрыт тонким слоем специального вещества, благодаря чему в местах попадания в экран α -частиц воз никают вспышки, которые наблюдаются с по мощью микроскопа. Такой метод регистра ции частиц называется методом сцинтилляций (т. е. вспышек).
Вся эта установка помещается в сосуд, из ко торого откачан воздух (чтобы устранить рас сеяние α -частиц за счёт их столкновений с молекулами воздуха).
Если на пути α -частиц нет никаких препятствий, то они падают на экран узким, слегка расширяющимся пучком . При этом все возникающие на экране вспышки сливаются в одно небольшое световое пятно.
Если же на пути α -частиц поместить тонкую фольгу из исследуемого металла , то при взаимодействии с веществом α -частицы рассеиваются по всем направлениям на разные углы. Наи большее количество вспышек расположено в центре экрана. Значит, основная часть всех α -частиц прошла сквозь фольгу, почти не изме нив первоначального направления (рассеялась на малые углы). При удалении от центра экра на количество вспышек становится меньше. Следовательно, с увеличением угла рассеяния количество рассеянных на эти углы частиц резко уменьшается.
Н екото рое (очень небольшое) число частиц рассеялось на углы, близкие к 90° , а некоторые единичные частицы - на углы порядка 180°, т. е. в резуль тате взаимодействия с фольгой были отброше ны назад.
Именно эти случаи рассеяния α -частиц на большие углы дали Резерфорду наиболее важ ную информацию для понимания того, как устроены атомы веществ.
А как вы думаете: Почему α-частицы отклонялись на большие углы? Сильное отклонение α- частиц воз можно только в том случае, если внутри атома имеется сильное электрическое поле. Такое поле могло быть создано зарядом, сконцентрированным в очень малом объёме (по сравнению с объёмом атома). Т. к. масса электрона намного меньше массы α -частицы, электроны не могли существен ным образом изменить направление движения α -частиц. Поэтому α -частицы могут отталкиваться от одноимённо заряженной части атома, масса которой значительно больше массы α -частицы. Значит в центре атомы сосредоточен положительный заряд.
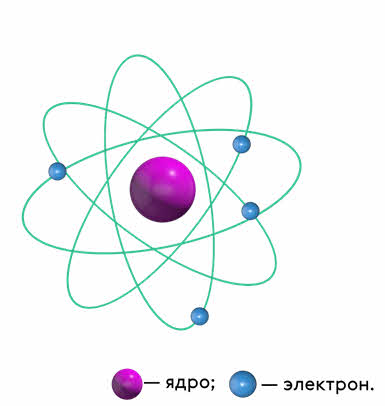
Резерфорд создаёт ядерную модель атома, с которой мы знакомились в 8 классе. Что представляет собой ядерная модель атома?
В центре атома находится положительно заряженное ядро, занимающее очень малый объём атома. Вокруг ядра дви жутся электроны, масса которых значительно меньше массы ядра. Атом электрически ней трален, поскольку заряд ядра равен модулю суммарного заряда электронов.
Резерфорд оценил размеры атомных ядер. Оказалось, что в зависимости от массы атома его ядро имеет диаметр порядка 10 -14 – 10 -15 м, т. е. оно в десятки и даже сотни тысяч раз меньше атома (атом имеет диаметр около
Теперь мы можем объяснить опыт Резерфорда. Как же объясняется движение α -частиц в опыте Резерфорда?
Напряжённость создаваемого ядром электрического поля, а зна чит, и сила действия на α -частицу довольно быстро убывают с увеличением расстояния от ядра. Поэтому направление полёта частицы сильно меняется только в том случае, если она проходит очень близко к ядру.
Т. к. диаметр ядра намного меньше диаметра атома, то большая часть всех α-частиц проходит сквозь атом на таких расстояниях от ядра, где сила отталкивания создаваемого им поля слишком мала, чтобы су щественно изменить направление движения α-частиц . И только очень немногие частицы пролетают рядом с ядром, т. е. в области силь ного поля, и отклоняются на большие углы. Именно такие результаты и были получены в опыте Резерфорда.
В результате опытов по рас сеянию α -частиц была доказана несостоятель ность модели атома Томсона, выдвинута ядер ная модель строения атома и проведена оценка диаметров атомных ядер.
Первичное закрепление знаний во внешней речи (фронтальный опрос) – 3 мин.
В чём заключалось открытие, сделанное Беккерелем в 1896 г.?
О чём сви детельствовало явление радиоактивности?
3. Какой вывод был сделан Резерфордом на основании того, что неко торые α -частицы при взаимодействии с фольгой рассеялись на боль шие углы?
4. Что представляет собой атом согласно ядерной модели,
выдвинутой Резерфордом?
Домашнее задание – 2 мин.
§ 52; № 1846 (письменно в тетради для тех, кто сдаёт ОГЭ). Параграф прочитать и ответить на вопросы после параграфа, определения знать наизусть. Определять состав атома по таблице Менделеева – индивидуальные задания выполняются на карточках.
Рефлексия – 2 мин.
Сегодня мы изучили явление радиоактивности, опыт Резерфорда, который определил состав атома, ядерную модель атома.
Самостоятельная тестовая работа с последующей взаимопроверкой по эталону – 5 мин.

На данном уроке мы поговорим о таком явлении, как радиоактивность и истории её открытия. Рассмотрим опыт Эрнеста Резерфорда по изучению явления радиоактивности и узнаем, каков состав радиоактивного излучения. А также познакомимся с некоторыми первыми моделями строения атомов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Радиоактивность. Модели атомов"
Но примерно с середины 19 века стали появляться экспериментальные факты, которые ставили под сомнение представления о неделимости атомов. Одним из первых таких доказательств стало открытие в тысяча восемьсот девяносто шестом году Анри Беккерелем естественной радиоактивности. Это открытие оказалось случайным, поскольку на самом деле Беккерель изучал воздействие солнечного излучения на различные соли и минералы.
В это время уже было известно такое явление, как фосфоресценция, то есть свечение некоторых веществ, возникающее после их облучения солнечными лучами. Так вот, экспериментируя с солями урана, Беккерель завернул фотопластинку в плотную чёрную бумагу, положил на неё сверху маленький кусочек урановой соли и выставил всё это на солнечный свет. После проявления фотопластинки на ней обнаружилось тёмное пятно на том месте, где лежала крупинка соли. Беккерель полагал, что это следствие явления фосфоресценции. Но однажды из-за облачной погоды опыт пришлось отложить, и пластинка с солью урана была помещена в светонепроницаемый ящик стола. Несколько дней спустя Беккерель на всякий случай проявил фотопластинку и с удивлением обнаружил на ней тёмное пятно. Учёный понял, что соли урана самопроизвольно без всякого освещения излучают какие-то неизвестные лучи.
Многие учёные стали повторять опыты Беккереля, и прежде всего супруги Пьер и Мария Кюри. Они пытались проверить, нет ли среди веществ, не исследованных Беккерелем, таких, которые обладают таинственными свойствами урана.
В первых экспериментах поиски велись с помощью электроскопа. Вам уже известно, что воздух — это изолятор, поэтому положение листочков заряженного электроскопа не должно меняться. Но если воздух подвергнуть действию излучения, тогда он становится проводником.

Радиоактивность — это способность атомов некоторых химических элементов к самопроизвольному излучению.
Такую радиоактивность ещё называют естественной радиоактивностью.
В 1899 году английский физик Эрне́ст Резерфорд провёл серию опытов, в результате которых было обнаружено, что радиоактивное излучение имеет сложный состав. Суть его опытов такова. Резерфорд построил установку, которая представляла собой толстостенный свинцовый ящик с прорезью. Внутрь ящика помещались крупицы радия.

Из ящика сквозь узкое отверстие выходил направленный и сфокусированный пучок радиоактивного излучения и попадал на фотопластинку. После проявления фотопластинки на ней обнаруживалось одно тёмное пятно в том месте, куда попадал пучок.
Затем всю установку Резерфорд поместил в сильное магнитное поле. Он рассуждал так: если радиоактивное излучение является потоком частиц с положительным зарядом, то под действием сил магнитного поля поток частиц отклонится вверх. Если радиоактивное излучение — это поток частиц, имеющих отрицательный заряд, то он отклонится вниз. Ну а если это поток частиц, не имеющих заряда, то пучок не будет отклоняться.

Каково же было удивление Резерфорда, когда после проявления на фотопластинке были обнаружены три пятна: центральное, которое было и раньше, и два дополнительных — по разные стороны от центрального. Отсюда следовало, что в пучке излучения действительно присутствовали частицы, обладающие зарядами противоположных знаков.
Положительно заряженные частицы были названы α-частицами, а отрицательно заряженные — β-частицами. Центральный поток, очевидно, представлял собой излучение, не содержащее заряженных частиц. Это излучение получило название γ-излучения.
Также Резерфорду удалось доказать, что α-излучение является потоком атомов гелия, потерявших оба своих электрона. При этом путь α-частиц в воздухе не велик, и он полностью задерживается простым листом бумаги.

В том же году Беккерель доказал, что β-лучи являются потоком электронов. Этот поток имеет большую проникающую способность и задерживается лишь цинковой пластинкой толщиной несколько миллиметров.

В 1900 году французский физик Поль Виллар установил, что третья составляющая радиоактивного излучения представляет собой электромагнитное излучение с очень малой длиной волны. Гамма-лучи легко проходят через вещество, и чтобы их остановить, нужна либо свинцовая пластинка, толщиной в 5 сантиметров, либо 30 сантиметров бетона, или же 60 сантиметров грунта.

Явление радиоактивности, то есть самопроизвольное излучение веществом α-, β- и γ-излучений, наряду с другими экспериментальными фактами, послужило основанием для предположения о том, что атомы вещества имеют сложный состав. И что скорее всего, в состав атома входят отрицательно и положительно заряженные частицы. Кроме того, было известно, что атом в целом электрически нейтрален.
Опираясь на эти и некоторые другие факты англичанин Джозеф Джон Томсон в тысяча девятьсот третьем году предложил одну из первых моделей атома. Согласно его модели, атом представляет собой однородный шар из положительно заряженного вещества, внутри которого находятся электроны.

Однако модель строения атома по Томсону нуждалась в проверке, в частности важно было проверить, действительно ли положительный заряд распределён по всему объёму атома.
Поэтому в тысяча девятьсот одиннадцатом году Эрнестом Резерфордом была проведена серия опытов по изучению состава и строения атома. Суть опыта достаточно проста. Резерфорд брал свинцовый сосуд, внутри которого находился радиоактивный элемент, испускающий α-частицы через узкое отверстие в сосуде.
Для регистрации этих самых частиц учёный использовал экран, на который была нанесена тонкая плёнка специального вещества. α-частицы, взаимодействуя с этим веществом, вызывали кратковременные вспышки, которые можно было наблюдать в микроскоп. Такой метод регистрации частиц называется методом сцинциляций (то есть вспышек).
Итак, чтобы устранить рассеяние альфа-частиц на молекулах воздуха, Резерфорд поместил всю установку в сосуд, из которого был откачан воздух. Если на пути частиц нет никаких препятствий, то они попадают на экран узким пучком, а возникающие вспышки сливаются в одно небольшое световое пятно.

Однако если на пути α-частиц поместить тонкую золотую фольгу, то при взаимодействии с ней, площадь пятна увеличивалась. Это свидетельствовало о рассеянии α-частиц.

Но Резерфорд на этом не остановился. Он немного модифицировал исходную установку, с целью выяснить: могут ли α-частицы отклоняться на ещё большие углы. Для этого, он окружил фольгу экранами и повторил опыт. К его великому удивлению, некоторые частицы отклонились на углы, превышающие 90 о . То есть, фактически небольшое число частиц были отброшены назад.

Действительно, такой результат предвидеть было очень сложно, поскольку расчёты говорили о том, что электрическое поле положительного заряда, распределённого по всему атому, не может быть достаточно сильным, чтобы отбросить α-частицу назад. А поскольку масса электрона почти в 8000 раз меньше массы α -частицы, то и они не могли существенно поменять траекторию α -частиц. Это навело учёного на мысли о том, что более 99,9 % массы и весь положительный заряд атома сосредоточены в чрезвычайно малой области в его центре. Эта область была названа ядром атома.

И только те немногие частицы, которые пролетают рядом с ядром атома, отклоняются на большие углы.
На основании своих опытов Резерфорд смог оценить размеры атома и его ядра.

Все эти данные привели Резерфорда к созданию ядерной (или планетарной) модели атома, о которой вы уже не раз слышали. Напомним, что в этой модели в центре атома находится положительно заряженное ядро, а вокруг него, подобно планетам вокруг Солнца, вращаются электроны.
После открытия Резерфордом атомного ядра многочисленные эксперименты подтвердили, что атомные ядра, так же, как и сами атомы, имеют сложную структуру.
Раздел ОГЭ по физике: 4.1. Радиоактивность. Альфа-, бета-, гамма-излучения. Реакции альфа- и бета-распада.
Радиоактивностью называют явление самопроизвольного излучения некоторых химических элементов, а вид этого излучения называют радиоактивным излучением. Первым радиоактивное излучение обнаружил Анри Беккерель, который, проводя эксперименты с солями урана, по почернению фотопластинки установил, что они самопроизвольно испускают невидимое излучение сильной проникающей способности. В дальнейшем было обнаружено, что не только уран, но и такие элементы, как радий и полоний, тоже испускают невидимое излучение.
Радиоактивность, которой обладают вещества, существующие в природе, называют естественной радиоактивностью. Она проявляется у всех элементов таблицы Д.И. Менделеева, порядковый номер которых больше 83. В дальнейшем было установлено, что и некоторые искусственно полученные вещества радиоактивны.

Резерфорд, изучая радиоактивное излучение, обнаружил его сложный состав. Он поместил радиоактивный препарат в свинцовый сосуд с отверстием. Над сосудом расположил фотопластинку, на которую падало радиоактивное излучение, выходившее через отверстие и прошедшее через магнитное поле.
Когда фотопластинку проявили, то на ней обнаружили три тёмных пятна. Одно пятно располагалось точно напротив отверстия. Это значит, что магнитное поле на него не действовало и заряженных частиц в этом излучении нет. Его назвали гамма-излучением (γ-излучение). Гамма-излучение представляет собой электромагнитное излучение или поток фотонов.
Наличие двух боковых пятен по разную сторону от центрального означает, что существуют два излучения, состоящие из частиц, имеющих заряды противоположных знаков. Эксперимент показывает, что одно из них представляет собой поток положительно заряженных частиц. Их назвали α-частицами. Другое излучение состоит из отрицательно заряженных частиц. Их назвали β-частицами.

Радиоактивный распад
Радиоактивные элементы, испуская излучение, превращаются в другие элементы. При этом, поскольку излучение приводит к появлению нового химического элемента, можно сделать вывод, что изменения происходят именно с ядром атома. Радиоактивное превращение ядер одних элементов в ядра других элементов называют радиоактивным распадом. Существует три вида радиоактивного распада: альфа–, бета– и гамма–излучения.
Если – материнское ядро, то превращение этого ядра при альфа–распаде происходит по следующей схеме (правило смещения): , где – символ дочернего ядра; – ядро атома гелия.
При альфа–распаде происходит смещение химического элемента на две клетки влево в таблице Менделеева.

Бета–распад. Радиоактивные ядра могут выбрасывать поток электронов, которые рождаются, согласно гипотезе Ферми, в результате превращения нейтронов в протоны. В соответствии с правилом смещения массовое число ядра не изменяется: .
При бета–распаде химический элемент перемещается на одну клетку вправо в периодической системе Менделеева и, кроме электронов, испускается антинейтрино.
Гамма–излучение. Возникает при ядерных превращениях и представляет собой электромагнитное излучение. Имеет высокую энергию.
Э. Резерфорд установил, что воздух сильнее всего ионизуют альфа–лучи, в меньшей степени – бета–лучи и совсем плохо – гамма–лучи. Поэтому проникающая способность оказалась самая малая у альфа–лучей (лист бумаги, несколько сантиметров слоя воздуха), а бета–лучи проходят сквозь алюминиевую пластину толщиной в несколько миллиметров. Очень велика проникающая способность у гамма–лучей (например, для алюминия – пластины толщиной в десятки сантиметров).
Период полураспада
В процессе радиоактивного распада число радиоактивных атомов уменьшается. Распад разных радиоактивных веществ происходит с разной интенсивностью. Например, радиоактивные изотопы йода распадаются значительно быстрее, чем изотопы стронция. Характеристикой интенсивности радиоактивного распада является величина, называемая периодом полураспада.
Периодом полураспада Т называют промежуток времени, в течение которого распадается половина первоначального числа атомов радиоактивного вещества. Чем меньше период полураспада, тем быстрее распадутся все радиоактивные атомы.
Например, имеется 4 • 10 8 атомов радиоактивного изотопа йода, период полураспада которого 25 минут. Это означает, что в течение 25 минут распадается половина ядер изотопа иода, т.е. 2 • 10 8 ядер, а 2 • 10 8 ядер останется нераспавшимися. Еще через 25 минут нераспавшимися останется 10 8 ядер йода, еще через 25 минут — 0,5 • 10 8 ядер и так далее.
Особенностью закона радиоактивного распада является то, что невозможно предсказать, когда произойдет распад каждого конкретного атома. Оно может произойти во время одного периода полураспада, или двух, или трех. Период полураспада относится не к конкретному атому, а к совокупности атомов радиоактивного вещества.
Но примерно с середины XIX в. стали появляться экспериментальные факты, которые ставили под сомнение представления о неделимости атомов. Результаты этих экспериментов наводили на мысль о том, что атомы имеют сложную структуру и что в их состав входят электрически заряженные частицы.
Наиболее ярким свидетельством сложного строения атома явилось открытие явления радиоактивности, сделанное французским физиком Анри Беккерелем в 1896 г.

Анри Беккерель (1852—1908)
Французский физик. Один из первооткрывателей радиоактивности
Беккерель обнаружил, что химический элемент уран самопроизвольно (т. е. без внешних воздействий) излучает ранее неизвестные невидимые лучи, которые позже были названы радиоактивным излучением.
Поскольку радиоактивное излучение обладало необычными свойствами, многие учёные занялись его исследованием. Оказалось, что не только уран, но и некоторые другие химические элементы (например, радий) тоже самопроизвольно испускают радиоактивные лучи. Способность атомов некоторых химических элементов к самопроизвольному излучению стали называть радиоактивностью (от лат. radio — излучаю и activus — действенный).

Эрнест Резерфорд (1871—1935)
Английский физик. Обнаружил сложный состав радиоактивного излучения радия, предложил ядерную модель строения атома. Открыл протон
В 1899 г. в результате опыта, проведённого под руководством английского физика Эрнеста Резерфорда, было обнаружено, что радиоактивное излучение радия неоднородно, т. е. имеет сложный состав. Рассмотрим, как проводился этот опыт.
На рисунке 156, а изображён толстостенный свинцовый сосуд с крупицей радия на дне. Пучок радиоактивного излучения радия выходит сквозь узкое отверстие и попадает на фотопластинку (излучение радия происходит во все стороны, но сквозь толстый слой свинца оно пройти не может). После проявления фотопластинки на ней обнаруживалось одно тёмное пятно — как раз в том месте, куда попадал пучок.

Рис. 156. Схема опыта Резерфорда по определению состава радиоактивного излучения
Потом опыт изменяли (рис. 156, б): создавали сильное магнитное поле, действовавшее на пучок. В этом случае на проявленной пластинке возникало три пятна: одно, центральное, было на том же месте, что и раньше, а два других — по разные стороны от центрального. Если два потока отклонились в магнитном поле от прежнего направления, значит, они представляют собой потоки заряженных частиц. Отклонение в разные стороны свидетельствовало о разных знаках электрических зарядов частиц. В одном потоке присутствовали только положительно заряженные частицы, в другом — отрицательно заряженные. А центральный поток представлял собой излучение, не имеющее электрического заряда.
Положительно заряженные частицы назвали альфа-частицами, отрицательно заряженные — бета-частицами, а нейтральные — гамма-частицами или гамма-квантами.

Джозеф Джон Томсон(1856—1940)
Английский физик. Открыл электрон. Предложил одну из первых моделей строения атома
Некоторое время спустя в результате исследования различных физических характеристик и свойств этих частиц (электрического заряда, массы и др.) удалось установить, что β-частица представляет собой электрон, а α-частица — полностью ионизированный атом химического элемента гелия (т. е. атом гелия, потерявший оба электрона). Выяснилось также, что γ-излучение представляет собой один из видов, точнее диапазонов, электромагнитного излучения (см. рис. 136).
Явление радиоактивности, т. е. самопроизвольное излучение веществом α-, β- и α-частиц, наряду с другими экспериментальными фактами, послужило основанием для предположения о том, что атомы вещества имеют сложный состав. Поскольку было известно, что атом в целом нейтрален, это явление позволило сделать предположение, что в состав атома входят отрицательно и положительно заряженные частицы.
Опираясь на эти и некоторые другие факты, английский физик Джозеф Джон Томсон предложил в 1903 г. одну из первых моделей строения атома. По предположению Томсона, атом представляет собой шар, по всему объёму которого равномерно распределён положительный заряд. Внутри этого шара находятся электроны. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрицательному заряду электронов, поэтому электрический заряд атома в целом равен нулю.
Модель строения атома, предложенная Томсоном, нуждалась в экспериментальной проверке. В частности, важно было проверить, действительно ли положительный заряд распределён по всему объёму атома с постоянной плотностью. Поэтому в 1911 г. Резерфорд совместно со своими сотрудниками провёл ряд опытов по исследованию состава и строения атомов.
Чтобы понять, как проводились эти опыты, рассмотрим рисунок 157. В опытах использовался свинцовый сосуд С с радиоактивным веществом Р, излучающим α-частицы. Из этого сосуда α-частицы вылетают через узкий канал со скоростью порядка 15 000 км/с.

Рис. 157. Схема установки опыта Резерфорда по исследованию строения атома
Поскольку α-частицы непосредственно увидеть невозможно, то для их обнаружения служит стеклянный экран Э. Экран покрыт тонким слоем специального вещества, благодаря чему в местах попадания в экран α-частиц возникают вспышки, которые наблюдаются с помощью микроскопа М. Такой метод регистрации частиц называется методом, сцинтилляций (т. е. вспышек).
Вся эта установка помещается в сосуд, из которого откачан воздух (чтобы устранить рассеяние α-частиц за счет их столкновений с молекулами воздуха).
Если на пути α-частиц нет никаких препятствий, то они падают на экран узким, слегка расширяющимся пучком (рис. 157, а). При этом все возникающие на экране вспышки сливаются в одно небольшое световое пятно.
Если же на пути α-частиц поместить тонкую фольгу Ф из исследуемого металла (рис. 157, б), то при взаимодействии с веществом α-частицы рассеиваются по всем направлениям на разные углы φ (на рисунке изображены только три угла: φ1, φ2 и φ3).
Когда экран находится в положении 1, наибольшее количество вспышек расположено в центре экрана. Значит, основная часть всех α-частиц прошла сквозь фольгу, почти не изменив первоначального направления (рассеялась на малые углы). При удалении от центра экрана количество вспышек становится меньше. Следовательно, с увеличением угла рассеяния φ количество рассеянных на эти углы частиц резко уменьшается.
Перемещая экран вместе с микроскопом вокруг фольги, можно обнаружить, что некоторое (очень небольшое) число частиц рассеялось на углы, близкие к 90° (это положение экрана обозначено цифрой 2), а некоторые единичные частицы — на углы порядка 180°, т. е. в результате взаимодействия с фольгой были отброшены назад (положение 3).
Именно эти случаи рассеяния α-частиц на большие углы дали Резерфорду наиболее важную информацию для понимания того, как устроены атомы веществ. Проанализировав результаты опытов, Резерфорд пришёл к выводу, что столь сильное отклонение α-частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле. Такое поле могло быть создано зарядом, сконцентрированным в очень малом объёме (по сравнению с объёмом атома).
Один из примеров схематичного изображения ядерной модели атома, предложенной Э. Резерфордом

Рис. 158. Траектории полёта α-частиц при прохождении сквозь атомы вещества
Поскольку масса электрона примерно в 8000 раз меньше массы α-частицы, электроны, входящие в состав атома, не могли существенным образом изменить направление движения α-частиц. Поэтому в данном случае речь может идти только о силах электрического отталкивания между α-частицами и положительно заряженной частью атома, масса которой значительно больше массы α-частицы.
Эти соображения привели Резерфорда к созданию ядерной (планетарной) модели атома (о которой вы уже имеете представление из курса физики 8 класса). Напомним, что, согласно этой модели, в центре атома находится положительно заряженное ядро, занимающее очень малый объём атома. Вокруг ядра движутся электроны, масса которых значительно меньше массы ядра. Атом электрически нейтрален, поскольку заряд ядра равен модулю суммарного заряда электронов.
Резерфорд сумел оценить размеры атомных ядер. Оказалось, что в зависимости от массы атома его ядро имеет диаметр порядка 10 -14 — 10 -15 м, т. е. оно в десятки и даже сотни тысяч раз меньше атома (атом имеет диаметр около 10 -10 м).
Рисунок 158 иллюстрирует процесс прохождения α-частиц сквозь атомы вещества с точки зрения ядерной модели. На этом рисунке показано, как меняется траектория полёта α-частиц в зависимости от того, на каком расстоянии от ядра они пролетают. Напряжённость создаваемого ядром электрического поля, а значит, и сила действия на α-частицу довольно быстро убывают с увеличением расстояния от ядра. Поэтому направление полёта частицы сильно меняется только в том случае, если она проходит очень близко к ядру.
Поскольку диаметр ядра значительно меньше диаметра атома, то большая часть из числа всех α-частиц проходит сквозь атом на таких расстояниях от ядра, где сила отталкивания создаваемого им поля слишком мала, чтобы существенно изменить направление движения α-частиц. И только очень немногие частицы пролетают рядом с ядром, т. е. в области сильного поля, и отклоняются на большие углы. Именно такие результаты и были получены в опыте Резерфорда.
Таким образом, в результате опытов по рассеянию α-частиц была доказана несостоятельность модели атома Томсона, выдвинута ядерная модель строения атома и проведена оценка диаметров атомных ядер.
Читайте также:

