Конспект по химии кислоты основания соли оксиды
Обновлено: 02.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Гаврилова Ольга Юрьевна,
учитель химии 1 квалификационной категории
Задачи урока:
Обучающая. Повторение и закрепление сведений об основных классах неорганических соединений: определение, составление названий, классификация.
Воспитывающая . Формирование интереса к учению, стремления добиться успеха в учебе за счет добросовестного отношения к своему труду, создание положительной психологической атмосферы, воспитание чувства взаимного уважения между ребятами для максимального раскрытия способностей на уроке.
Тип урока: Урок повторения
Формы организации учебной деятельности:
работа с опорным конспектом;
Методы и методические приемы:
объяснительно – иллюстративный ( опорный конспект );
словесный (слово учителя, беседа с учащимися);
репродуктивный ( создание проблемной ситуации, ответы на вопросы);
частично – поисковый (игры, работа с заданиями при повторении основных классов неорганических веществ.).
Оборудование:
рабочий лист - опорный конспект - содержащий задания.
Предполагаемые результаты обучения:
знать: понятия оксид, основание, кислота, соли. Знать формулы оксидов, оснований, кислот, солей. Классификацию оксидов, оснований, кислот, солей.
уметь: выбирать формулы оксидов, оснований, кислот, солей среди предложенных формул веществ, классифицировать их, уметь составлять формулы оксидов, оснований, кислот, солей. Уметь работать с таблицей растворимости.
Организационный момент
Здравствуйте, ребята. Я рада приветствовать вас на сегодняшнем уроке. Я вижу, что у вас хорошее настроение, и надеюсь, что оно сохранится у вас до конца урока. И мы с вами эффективно поработаем.
Актуализация знаний.
Ребята, на предыдущих уроках химии вы знакомились с неорганическими соединениями различных классов. Какие классы неорганических веществ вы знаете?
- Оксиды, основания, кислоты, соли.
Русская народная пословица гласит: Повторение – мать учения. Как вы думаете, чем же мы с вами будем заниматься на сегодняшнем уроке?
Возможные ответы учащихся:
- Повторим понятия оксиды, основания, кислоты, соли.
- поупражняемся в составлении названий, формул оксидов, оснований, кислот, солей;
- вспомним классификацию оксидов, оснований, кислот, солей;
Помощником в нашей с вами работе сегодня будет опорный конспект, который лежит у вас на партах.
На слайде написаны формулы неорганических веществ.
Обратите внимание на задание 1.
Пользуясь нижеприведенной таблицей, распределите по группам следующие соединения:
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка. Общая формула кислот:
НхКО, где Нх – атом водорода, а КО – кислотный остаток.
Как правило, кислотные остатки образуют элементы- неметаллы.
Кислоты- это электролиты, которые при электролитической диссоциации образуют в качестве катионов только ионы водорода.
Существует несколько классификаций кислот. Поскольку существует несколько различных определений кислот, то их классификация и номенклатура являются весьма условными.
- по основности: одноосновные (HCl, HCN, HNO3); многоосновные: двухосновные, трехосновные и т.д. Основность кислот определяется количеством атомов водорода.
- По содержанию атомов кислорода в молекулах кислот:
3. по степени диссоциации в водных растворах: сильные \((HCl,~HBr,~HI,~HNO_3,~H_2SO_4,~HClO_3,~HClO_4)\)
и слабые \((HF,~H_2S,~HNO_2,~H_2SO_3~и ~др.).\)
Соль+менее летучая кислота
Кислоты можно распознавать с помощью индикаторов.
Окраска индикатора в кислотной среде
Оксиды - это соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
Состав оксидов выражается общей формулой: \(Э_xO_y\)
где x – число атомов элемента, у – число атомов кислорода.
Числовые значения х и у определяется степенью окисления элементов.
Классификация оксидов.
Оксиды делятся на две группы: солеобразующие и несолеобразующие, а каждую из групп, в свою очередь, подразделяют на несколько подгрупп.
Несолеобразующие оксиды - это оксиды, которые не взаимодействуют ни с кислотами , ни со щелочами и не образуют солей.
Солеобразующие оксиды - это оксиды, которые взаимодействуют с кислотами или щелочами с образованием солей и воды. Солеобразующие оксиды делятся на основные, кислотные, амфотерные.
По агрегатному состоянию оксиды делятся на твердые (CaO, MgO, SiO2, P2O5), жидкие (SO3, H2O, Cl2O7) и газообразные ( CO2, N2O, NO, SO2).
По растворимости в воде оксиды делятся на растворимые (основные оксиды щелочных и щелочноземельных металлов, практически все кислотные оксиды(кроме SiO2)) и нерастворимые ( все остальные основные оксиды, амфотерные оксиды, SiO2).
Химические свойства оксидов.
Общими свойствами основных, кислотных и амфотерных оксидов являются кислотно-основные взаимодействия, которые можно выразить следующей схемой:
Основания – сложные вещества, молекулы которых состоят из атомов металлов и гидроксо-групп, способных замещаться на металл Ме(ОН)n, n- число гидроксо-групп. По современной номенклатуре их принято называть гидроксидами элементов с указанием степени окисления: NaOH – гидроксид натрия, КОН – гидроксид калия, Сu(OH)2 – гидроксид меди (II).
Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. Растворимые основания (щелочи) измненяют окраску индикаиорап лакмус-синий, нерастворимые основания не изменяют окраску индикатора. Все основания (гидроксиды металлов) – твердые вещества. Гидроксиды s-металлов бесцветны, гидроксиды многих d-металлов окрашены.
Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как растворимые, так и нерастворимые основания.
Щелочи в технике обычно получают электролизом водных растворов хлоридов:
Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
Общим химическим свойством растворимых и нерастворимых гидроксидов является их способность взаимодействовать с водой – вступать в реакцию нейтрализации.
Щелочи взаимодействуют с кислотными оксидами.
Для щелочей характерны качественные реакции, т.е. реакции с помощью которых распознают вещества. Для щелочей это реакции с индикаторами (от лат слова «указатели). Если к раствору щелочи добавить 1-2 капли раствора индикатора, то он изменит свою окраску.
Окраска индикатора в кислотной среде
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков.
Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на атомы металла, в кислых солях они замещены частично, а в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Средние соли образуются при взаимодействии:
1) Оснований с кислотами (реакция нейтрализации)
2) Кислот с основными оксидами
3) Солей с кислотами
4) Двух различных солей
5) Солей с кислотными оксидами (кислотный оксид должен быть менее летуч, чем образующийся в ходе реакции)
6) Оснований с кислотными оксидами
7) Оснований с солями
8) Основных оксидов с кислотными
9) Металлов с неметаллами
10) Металлов с кислотами
11) Металлов с солями
12) Амфотерных металлов с расплавами щелочей
13) Неметаллов со щелочами
14) Неметаллов с солями
15) При нагревании некоторых солей кислородсодержащих кислот образуются соли с меньшим содержанием кислорода или вообще не содержащие его
С какой группой веществ взаимодействует раствор серной кислоты?
В уравнении \(Ca(OH)_2 + H_2SO_4 \rightarrow\) основная соль +. сумма коэффициентов составляет
Для получения 44,8 л углекислого газа (н. у.) было израсходовано карбоната кальция
Какова масса 60%-ной серной кислоты, которая была получена из 300 кг пирита, состоящего из 90% дисульфида железа (II) \((FeS_2)\) ?
Формула оксида элемента Э, образующего хлорид состава \(ЭCl_5\)
Катализатор, применяемый для ускорения протекания второй стадии производства серной кислоты контактным способом
Из 585 г хлорида натрия в присутствии \(H_2SO_4\) (к.) (при комнатной температуре) был получен хлороводород, который далее растворили в 1460 г воды. Вычислите массовую долю НСl в растворе.
Сколько объема (мл) 2%-ной хлороводородной кислоты с плотностью 1 г/мл потребуется для нейтрализации 100 мл 1 М раствора гидроксида бария?
На первой ступени гидролиза хлорида магния образуется соль, тип и молярная масса которой (г/моль)
Масса вещества \(X_4\) из 0,25 моль \(FeS_2\) в результате превращений \(FeS_2\xrightarrowX_1<\over>X_2\xrightarrowX_3\over>X_4\) равна
Название соединения \(NaHSO_4\)
Для получения какого элемента из оксида может быть применена алюминотермия?
В цепочке превращений \(Al_4C_3\xrightarrowX_1\xrightarrowX_2\xrightarrowX_3\) масса 0,3 моль вещества \(X_3\) равна
Чему равна сумма молярных масс (г/моль) солей, которые гидролизуются по катиону: \(K_2S, ZnCl_2,Fe(NO_3)_2,Na_2CO_3,NaCl?\)
В уравнении реакции взаимодействия концентрированной серной кислоты и углерода коэффициент перед окислителем равен
Заполните схему реакции \(2NO+4+. +2H_2SO_4\rightarrow 2Fe_2(SO_4)_3+. +2H_2O\) .
Сульфиды 5-элементов 1-й группы периодической системы хорошо растворяются в воде. Какова среда их растворов и цвет лакмуса?
При взаимодействии 12,8 г меди с концентрированной серной кислотой выделяется газ объемом (н. у.)
При взаимодействии 1 кг 36,5% раствора соляной кислоты с оксидом марганца (IV) выделился хлор. Какова масса хлора, если известно, что кислота прореагировала полностью?
В результате обжига 100 г известняка выделилось 33 г оксида углерода (IV). Каково содержание карбоната кальция в этом образце?
Для получения 36,8 г вещества С (выход составляет 80%) в цепи превращений \(CaC_2\xrightarrow A\xrightarrow B\xrightarrow C\xrightarrow D+E\uparrow \) необходимо вещество А (20% примесей) объемом (н. у.)
Формула дигидроортофосфата кальция
В какой реакции продуктом является основная соль?
При взаимодействии \(AlBr_3\;и\;NaOH\) сумма коэффициентов в уравнении реакции образования нерастворимого основания равна
Какая реакция используется для получения хлорида железа (III)?
Чему равна масса вещества \(X_4\) , полученная из 224 л аммиака в результате превращений \(NH_3\over> X_1\xrightarrow X_2\xrightarrow X_3\xrightarrowX_4\) ?
Чему равна масса 0,1 моль вещества \(X_3\) в цепочке превращений \(Al_4C_3\over> X_1\xrightarrow X_2\xrightarrow X_3\) ?
Известно, что раствор \(Na_2S\) был добавлен к растворам солей с содержанием катионов металлов. Какой катион не образует осадок?
Что образуется, если через избыток щелочи пропустить диоксид углерода?
Какие из следующих веществ обладают окислительно-восстановительной двойственностью: \( А) \ MgCl_2; \ Б)\ I_2; \ В)\ HIO; \ Г)\ NaClO_4; \ Д)\ KIO_3\) ?
Рассчитайте количество оксида углерода (II), затраченного для полного восстановления 4 г оксида железа (III).
Для нейтрализации кислоты, полученной при растворении в воде \(NO_2\) в присутствии кислорода, потребовалось 3,2 г гидроксида натрия. Чему равен объем \(NO_2\) в этой реакции (н. у.)?
В результате взаимодействия гидроксида железа с серной кислотой была получена основная соль. Чему равна сумма коэффициентов в уравнении реакции?
В какой реакции с оксидом железа (II) наблюдается процесс окисления вещества?
Чему равен объем выделившегося газа (н. у.), если смесь натрия (9,2 г) и оксида натрия (6,2 г) обработали избытком воды?
Чему равна масса железа в смеси, если при растворении в соляной кислоте 10,4 г смеси железа и магния выделилось 6,72 л водорода (н. у.)?
В замкнутом сосуде смешали два газа, один из которых получен разложением 68 г нитрата натрия, а другой – при действии избытка раствора соляной кислоты на 26 г цинка. Образовавшуюся смесь взорвали. Чему равна масса полученного вещества?
В замкнутом сосуде смешали два газа, один из которых получен разложением 12,25 г хлората калия, а другой – при действии избытка раствора соляной кислоты на 7,2 г магния. Образовавшуюся смесь взорвали. Чему равно количество полученного вещества?
При электролизе раствора, содержащего 53,4 г хлорида алюминия, выделяется хлор объемом (н. у.)
Определите продукт взаимодействия 13,35 г хлорида алюминия и 32 г гидроксида натрия.
Какое количество твердого продукта FеО получили при обжиге на воздухе 5,64 кг технического сульфида железа (II) со степенью чистоты 75%?
В замкнутом сосуде смешали два газа, один из которых получен разложением 79 г перманганата калия, а другой – при действии избытка воды на 39 г калия. Образовавшуюся смесь взорвали. Чему равна масса полученного вещества?
Чему равно соотношение масс солей железа в молекулярном уравнении второй ступени гидролиза нитрата железа (III)?
Укажите уравнение реакции первой стадии обжига пирита.
6 г щелочи и 2,8 л газа образовались на аноде при электролизе раствора соли одновалентного металла. Какая соль подверглась электролизу?
Известно, что на первой ступени гидролиза хлорида железа (II) образуется соль. Какой тип и молярная масса соли (г/моль)?
Чему равно мольное соотношение продуктов реакции к исходным веществам в молекулярном уравнении второй ступени гидролиза сульфата цинка?
В замкнутом сосуде смешали два газа, один из которых получен разложением 24,5 г хлората калия, а другой – при действии избытка раствора соляной кислоты на 14,4 г магния. Образовавшуюся смесь взорвали. Чему равна масса полученного вещества?
Чему равна масса 20%-ного раствора карбоната натрия, полученного из диоксида углерода (IV) количеством вещества 0,1 моль?
Какой выделился объем газа (н. у.), если на мрамор массой 40 г воздействовали избытком соляной кислоты?
Кислотными оксидами являются
Основным оксидом является
Гидроксид калия взаимодействует с
Соляная кислота взаимодействует с
Оксид бария реагирует с
Амфотерными оксидами являются
Оксид углерода (IV) взаимодействует с
Укажите название и массу соли, которая образуется при взаимодействии 20 г гидроксида натрия и 49 г серной кислоты.
Оксид кальция реагирует с
Только кислотные оксиды в ряду
При взаимодействии 508 мл 25%-ного раствора одноосновной неорганической кислоты (плотность составляет 1,15 г/мл) с барием выделилось 44,8 л газа (н. у.). Укажите формулу и название кислоты.
Кислая соль образуется, если смешать
Веществами X, Y, Z в схеме превращений Mg \(\xrightarrow\) X \(\xrightarrow\) Y \(\xrightarrow\) Z являются
Оксид углерода (IV) взаимодействует с
С водным раствором гидроксида натрия взаимодействует
Определите название и массу соли, которая образуется при взаимодействии 11,2 г гидроксида калия и 8,2 г сернистой кислоты.
При взаимодействии цинка с концентрированной серной кислотой может образовываться
Укажите формулы основных солей.
Металлы, образующие амфотерные оксиды со степенью окисления +2
Определите вещества X и Y в схеме превращений ZnS → X → Zn \(\xrightarrow\) Na \(_2\) ZnO \(_2\) .
К солеобразующим оксидам относятся
При взаимодействии 0,5 моль гидроксида калия и 1 моль серной кислоты образовалась соль. Формула соли, ее количество вещества и среда полученного раствора
Химические вещества неорганической природы повсюду нас окружают. Вода, кругом вода, а известно Вам, что название этого вещества оксид водорода. При дыхании поглощается кислород, и выделяется оксид углерода (IV), знаменитый названием углекислый газ. Формулы оксидов этих Н2О и СО2. А в детстве забравшись в малинник, чувствуете жжение, виной тому служит крапива, похожие ощущения можете ощутить при встрече с рыжими муравьями. Причиной является содержание муравьиной кислоты. Кислое яблоко, лимон также содержат кислоты. Они относятся к органическим кислотам. А вот раствор кислоты соляной, который является основой желудочного сока, относится к неорганическим кислотам. Остаток фосфорной кислоты входит в состав молекулы ДНК. Прибегая с улицы, идём руки мыть мылом и садимся обедать. На столе всегда хлеб и соль.
План урока:
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.
Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции - соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы - ОН.
Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN − , равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
Неорганическая химия - раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO - соответствует основанию Cu(OH)2
- Li2O - соответствует основанию LiOH
- FeO - соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 - соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 - соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
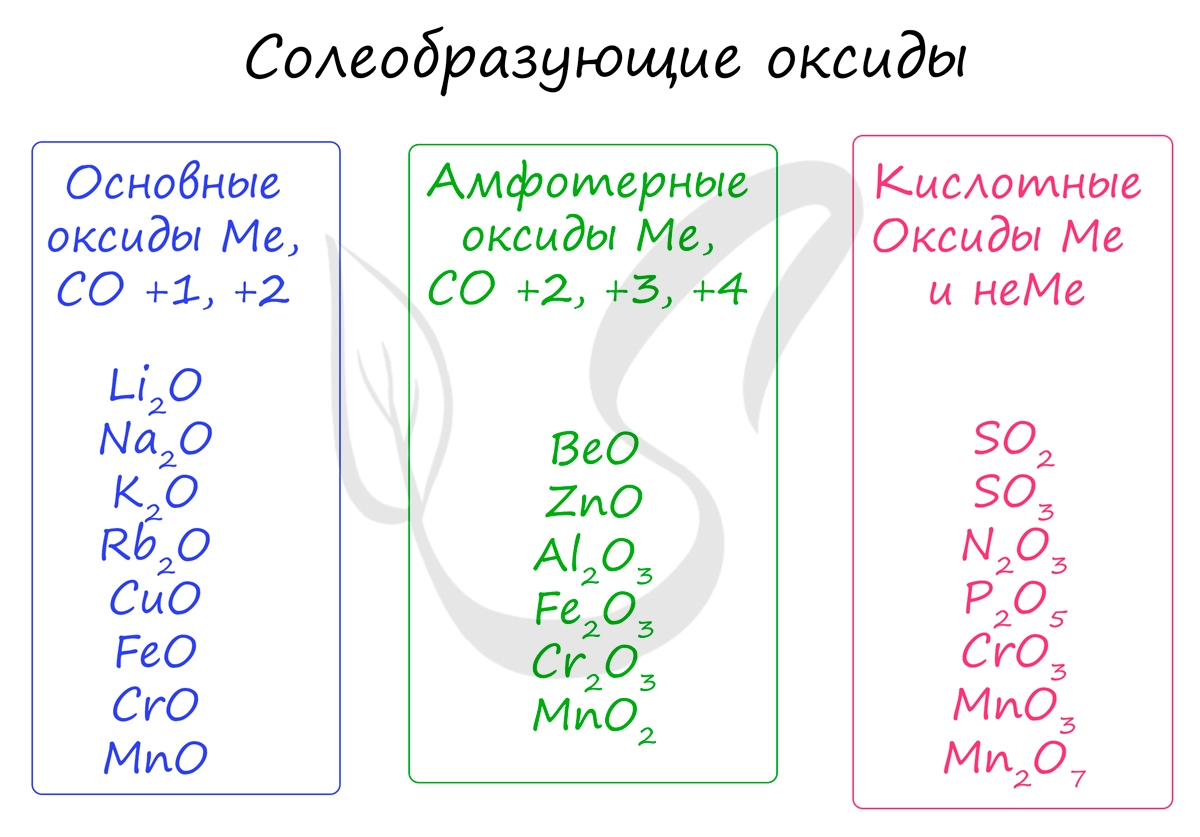
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
- SO2 - H2SO3
- SO3 - H2SO4
- P2O5 - H3PO4
- N2O5 - HNO3
- NO2 - HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 - не реагирует с водой, так как продукт реакции - H2SiO3 является нерастворимой кислотой.

- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания - химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр - NaOH, едкое кали - KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода - реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами - с образованием соли и воды, так и с основаниями - с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода - при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота - химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней - часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 - двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода - реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Записать эти кислоты в растворе в виде "H2CO3 или H2SO3" - будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде - виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной - серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной - соляной кислоты - получили более слабую - сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной - серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота - H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
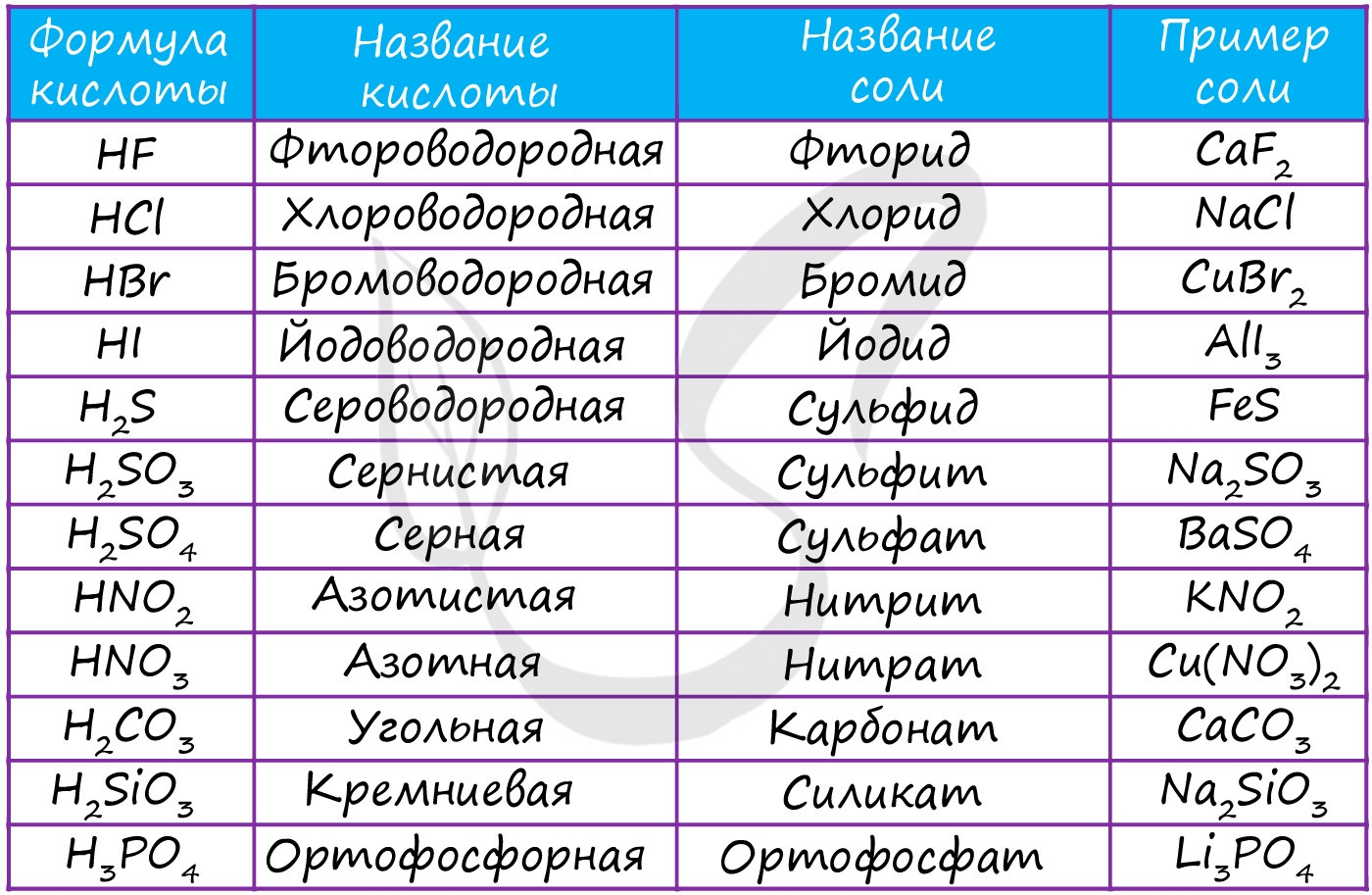
Соль - ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль - NaCl.
- Средние - продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые - продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные - продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные - содержат два разных металла и один кислотный остаток (NaCr(SO4)2
Читайте также:
- Строчная и заглавная буква т конспект урока 1 класс школа россии презентация
- Конспект семейного консультирования по вопросам развития детей
- Распространение реформации в европе контрреформация 7 класс конспект и презентация
- Конспект занятия по аппликации в средней группе на тему насекомые
- Конспект уроку заломлення світла на межі поділу двох середовищ закон заломлення світла

