Химия наука о веществах их свойствах и превращениях конспект урока
Обновлено: 06.07.2024
План урока:
Знакомство с химией
Химия — наука о веществах, их свойствах и превращениях в другие вещества.
Но также можно сказать, что химия – это вред. Неоднократно слышали о кислотных дождях, о гибели морских жителей из-за нефтяных пятен, о нитратах в овощах и фруктах и т. д.
Химия тесно связана с человечеством, является неотъемлемой его частью. Чтобы не наносить вред нашей планете, необходимо применять химические знания и рационально использовать вещества.
Именно благодаря своей многогранности химия применяется в каждой области:
- Медицина: лекарственные препараты, вакцины, искусственные органы, косметические средства;
- Искусство: живопись, архитектура, фотографии, изготовление ювелирных изделий, ковка, литье;
- Сельское хозяйство: удобрение, средства для борьбы с вредителями;
- Криминалистика: опознание личности по ДНК, отпечаткам пальцев, определение состава ядовитых и взрывчатых веществ;
- Строительство: производство строительных материалов, обработка древесины;
- Металлургия: без металлов не существует ни одна отрасль. Металлы и сплавы окружают нас повсюду;
- В быту: средство бытовой химии, при приготовлении обеда также применяем химические знания;
- Пищевая промышленность: молочная, мясная продукция, соусы, кондитерские изделия и т. д.;
- Охрана окружающей среды. На данный момент остро стоит проблема охраны окружающей среды. Деятельность человека губительно действует на планету. Но с помощью химических знаний, которые базируются на свойствах веществ, учёные находят способы очистки воды, почвы, воздуха от вредных веществ.
Химия – наука очень обширная и включает в себя много разделов, которые имеют своё назначение и изучают вещества, их строение и свойства.
- Неорганическая химия или её ещё называют химия неживой природы. Предмет изучения химические элементы и их соединения;
- Биохимия изучает процессы, которые происходят в организмах при обмене веществ, дыхании и т. д.;
- Органическая химия или химия углерода. Это увлекательный раздел знакомит о множестве соединений, благодаря уникальным свойствам углерода;
- Физическая химия рассматривает закономерности реакций;
- Аналитическая химия, благодаря качественному и количественному анализу позволяет исследовать смеси.
Чтобы овладеть химическими знаниями, необходимо изучить физику, биологию, а также математику. Как видно из схемы, химия тесно перекликается с другими науками.
Атомно-молекулярное учение. Мельчайшие частицы
Как и каждая наука, химия имеет свои термины и понятия, которые изучаются на протяжении всего курса. Эти термины для вас будут не новыми, вы с ними знакомились на уроках физики и природоведения. А речь пойдёт об атомах, молекулах, химических элементах и веществах. Эти понятия являются основой атомно-молекулярного учения.
Рассмотрим подробно каждое понятие.
Наверняка вы в учебнике или кабинете химии видели периодическую систему химических элементов (ПСХЭ). Она имеет разный вид и структуру, с которой вы позже подробно познакомитесь. Классический вид периодической системы химических элементов изображён на рисунке.
С уроков природоведения вам известно, что атомы это кирпичики мироздания.
Атом – мельчайшая частица химического элемента, которая отвечает за его свойства и химически неделима.
На данный момент известно 126 видов атомов – химических элементов. Какая связь между химическим элементом и атомом? Химический элемент состоит из атомов определённого вида. В чём состоит отличие этих понятий. Почему алхимики не могли найти философский камень? Почему железо или медь не превращаются в золото? Чтобы ответить на эти вопросы, необходимо рассмотреть строение атома.
Абсолютно каждый атом имеет положительно заряженное ядро и, вращающиеся вокруг него, отрицательные электроны.
Самое тяжёлое в атоме – это ядро, которое состоит с протонов (имеют заряд +) и нейтронов (заряд 0).
Атом не имеет никакого заряда, иными словами нейтрален.
Число протонов = число электронов
Чтобы узнать количество частиц, необходимо определить порядковый номер элемента в ПСХЭ.
Например, если в состав атома входит 10 электронов и 10 протонов, посмотрев в периодическую систему, увидим, что данный набор частиц отвечает химическому элементу – Неон. Химический элемент Золото имеет 79 протонов и 79 электронов. Состав атомов, а точнее, количество протонов, не изменяется в ходе химических реакций. Именно по этой причине, алхимики не смогли найти рецепт философского камня.
Атомы (подобно буквам, которые соединяются в слоги, а потом в слова) соединяются в молекулы.
Молекула
Молекула – наименьшая частица вещества
Как образуются молекулы? Снова проведём аналогию с буквами. Чтобы получилось читаемое и со смыслом слово, необходима определённая комбинация букв и чёткие правила. Также происходит и при образовании молекулы. Атомы соединяются в молекулу с помощью химических связей. Свойства молекул зависят от того, атомы каких элементов входят в их состав, а также каким образом они соединены между собой.
Рассмотрим на примере молекул веществ, которые образованные атомами кислорода, это кислород и озон. Обе эти молекулы образованы атомами химического элемента Кислород, но в состав озона, химическая формула которого О3, входит 3 атома Кислорода, а в молекулу кислорода, формула вещества О2 – два атома химического элемента Кислород.
Данное явление называется аллотропией. Это явление существования простых веществ, образованных одинаковым химическим элементом, но различным по свойствам и строению.
Рекордсменом по образованию аллотропных форм является углерод, который существует в виде алмаза, графита, карбина, фуллеренов, углеродных нанотрубок.
Как видно из определения, атомы и молекулы – это частицы, но в чём их разница? Снова проведём аналогию с буквами и словами. Буквы – это атомы, слова – это молекулы. Буквы не могут состоять из слов, так же как и атомы не могут состоять из молекул.
Молекула сернистого газа SO2 состоит из одного атома Серы и двух атомов Кислорода. Молекула аммиака состоит из одного атома Азота и трёх атомов Водорода и т. д.
Таким образом, мы видим, что все вещества состоят из атомов химических элементов. Живая и неживая природа – это также комбинация химических элементов.
Что происходит с атомом, если он присоединяет или отдаёт электроны? Он становится заряженной частицей.
Ионы – частицы, которые положительно или отрицательно заряжены.
Обобщив все вышесказанное, выделим основные постулаты атомно-молекулярного учения, которое является фундаментом в химии, физике и естествознании:
- Вещества состоят из молекул;
- Атомы являются частью молекулы;
- Атомам и молекулам характерно самопроизвольное движение;
- Во время химических реакций происходит изменение состава молекулы и образуются новые вещества.
Вещество. Классификация веществ
От активности химических элементов зависит - будут они существовать в свободном виде или будут частью вещества.
Вещество – это совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии.
Вещества делятся: простые и сложные.
Определение достаточно несложное и легко запоминается.
Закономерно возникает вопрос: чем сложное вещество отличается от смеси простых и сложных веществ?
На рисунке обозначено:
А) молекулы простого вещества кислород О2;
Б) молекулы простого вещества водород Н2;
В) смесь простых веществ О2 и Н2;
Г) молекула сложного вещества вода Н2О;
Д) смесь молекул простого вещества водород Н2 и сложного вещества Н2О.
Смеси образуются в результате физического воздействия, например, смешивание железных опилок и воды, а сложные вещества – с помощью химического воздействия, например, ржавчина на железе, вызванная взаимодействием железа и воды.
В зависимости от того, какими частицами образованы вещества, их различают молекулярного и немолекулярного строения.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Конспект урока в 8 классе по химии УМК О.С. Габриелян
Конспект урока по химии 8 класс
Тема урока: Химия - наука о веществах, их свойствах и превращениях.
Образовательные: сформировать представление о предмете химии; узнать первоначальные понятия о веществе, химическом элементе, о простых и сложных веществах, о трех формах существования химического элемента.
Воспитательные: Способствовать патриотическому, нравственному воспитанию учащихся. В оспитывать наблюдательность и внимание.
Методы и методические приемы. Рассказ, беседа, фронтальный опрос, лабораторная работа, работа по учебнику, работа с таблицей.
Изучение нового материала.
1. Организационный момент.
Предмет химии требует взрослого, серьезного отношения. Знания химии помогут глубже понять другие естественные науки (биологию, физику, географию). Без химических знаний представления об окружающем мире будут неполными, поверхностными.
Далее учитель сообщает, что для изучения химии потребуется
Учебник. Автор О.С.Габриелян
Тетрадь для работы в классе и дома – объемную (толстую), в клеточку, с полями. Она будет проверяться, и оценки за ее ведение выставляться в журнал.
Тетрадь для контрольных и практических работ. Ее сдают учителю и хранят в кабинете.
2. Изучение нового материала.
Учитель: Что такое химия? Звучат ответы учащихся.
А что она изучает? (Предположения учащихся)
Учитель просит поставить цели урока. 2 слайд
Запись на доске и в тетрадь: 3слайд
Химия изучает:
Вещества
Свойства веществ
Превращения веществ.
Учитель демонстрирует коллекцию изделий из стекла и ставит вопрос:
Учитель предлагает описать свойства вещества алюминия.
Физкультминутка.
Учитель спрашивает: Для чего необходимо знать свойства веществ?
Итог беседы оформляется на доске схемой и в тетради: 7слайд
Свойства Применение
Состав
Учитель спрашивает: из курса физики, вы уже знаете из чего состоят вещества? Звучат ответы учащихся.
В заключение этой части урока учитель объясняет, что каждый химический элемент имеет три формы существования: свободные атомы, простые вещества и сложные вещества. Демонстрирует таблицу или слайд презентации. 9слайд
Обобщение о том, какие вещества называются простыми (устроены просто – из одного химического элемента), а какие сложными (состоят из двух и более элементов), дают сами учащиеся. 10 слайд
3. Закрепление.
Для закрепления можно предложить учащимся при прослушивании зачитываемых учителем предложений поднять правую руку, если речь идет о простом веществе, и левую – если об элементе.
Предложения зачитать по учебнику стр. 11 №8 и 9.
4. Итоги урока. Рефлексия.
Итак, что вы узнали нового?
Что понравилось? не понравилось?
Что вам запомнилось?
Как мы поработали?
5. Домашнее задание 11слайд
По учебнику изучить параграф §1.
Выполнить в тетради упр. 3, 6, 10. Стр.10 – 11.
Источники информации.
О.С. Габриелян, Н.П. Воскобойникова, А.В. Яшукова. Настольная книга учителя. Химия. 8 класс. – М.: Дрофа, 2002. – 416с.
Химия. 8 класс.: учебник для общеобразоват. учреждений. / О.С.Габриелян. – М.: Дрофа, 2007. – 257с.: ил.

Цели урока: Дать понятие о предмете химии. Сформировать первоначальные представления:
О веществе, а также о простых и сложных веществах.
О химическом элементе и о трех формах его существования.
Начать формировать умение характеризовать вещества, используя для этого их физические свойства.
Сегодня вы начинаете изучать одну из самых древних и важных наук - химию. Многими химическими знаниями люди пользовались уже в глубокой древности.
Эти знания были необходимы для получения металлов и сплавов, стекла, керамики, красок и духов. И в наши дни ни одному человеку не обойтись в жизни без знания химии.
Предмет химии вводится в обучение довольно поздно, лишь в 8 классе, по сравнению с другими предметами, такими как биология, физика, география. Это связано с тем, что для изучения химии необходимы определенные знания из других предметов, в первую очередь из физики.
Как вы думаете, что же изучает химия?
Химия – это наука о веществах, их свойствах и превращениях.
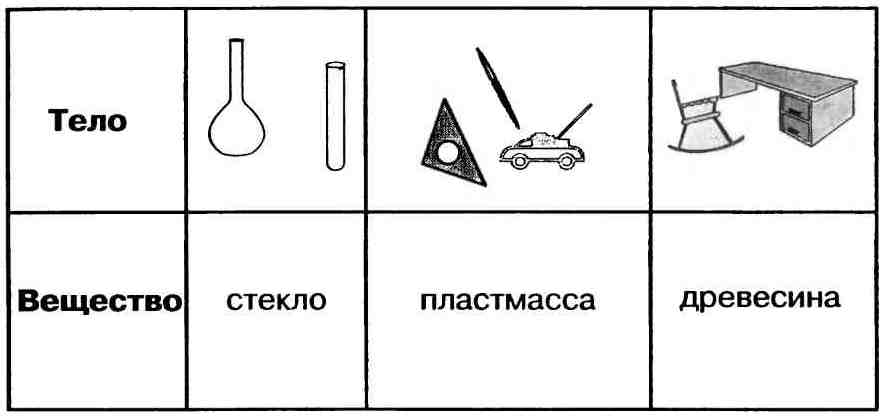
Вспомните из курса физики определение физического тела.
Физические тела – это все предметы, которые нас окружают, т.е. физическим телом может быть любой предмет.
На столе учителя стоят предметы из стекла. Что общего у этих предметов или физических тел? (все эти предметы состоят из стекла, т.е. из одного и того же вещества.)
Вещество – это то, из чего состоят физические тела.
В настоящее время существует более 15 млн. веществ, причем каждый год появляются новые, и их число непрерывно растет.
Почему такие тела, как окно и стакан изготавливают и стекла, а не из другого вещества (дерево или металлы)?
Например, дерево и металлы непрозрачны, поэтому их не применяют для изготовления окон, для этих целей применяют только стекло, которое обладает необходимыми свойствами.
Свойства веществ – это признаки, по которым одни вещества отличаются от других.
Так, водород – это газ, очень легкий, без цвета, запаха и вкуса, кипит при температуре - 253 гр, а павится при температуре -259 гр. Эти свойства вещества называют физическими.
Физические свойства веществ:
Агрегатное состояние;
Растворимость в воде или других растворителях;
Плотность, температура плавления и кипения;
Цвет, вкус, запах.
Какие агрегатные состояния вы знаете?
Существует 3 агрегатных состояния: твердое, жидкое, газообразное.
При обычных условиях разные вещества находятся в разных агрегатных состояниях. Например,
твердые вещества – соль, сахар, металлы. Какие вам известны металлы? Единственный жидкий при обычных условиях металл – это всем известная ртуть, которая используется в термометрах.
Жидкие вещества – вода, серная кислота, масло, ацетон.
Газообразные вещества – кислород, водород, углекислый газ, метан.
Можно ли твердые металлы получить в жидком состоянии? Что произойдет, если мы начнем нагревать какой либо металл?
Жидкие металлы получаются при плавлении, или при нагревании твердого вещества, оно начинает плавиться.
Любое вещество при изменении условий(температуры, давления) может переходить из одного агрегатного состояния в другое. Жидкая при обычных условиях вода при нагревании до 100 гр С превращается в пар, т.е. переходит в газообразное состояние. При понижении температуры до 0 С вода превращается в лед, т.е. переходит в твердое состояние.
Алюминий – твердое вещество (при обычных условиях), серебристо-белого цвета, без запаха. Это легкий пластичный металл, который обладает высокой тепло- и электропроводностью.
Основой изучения курса химии служит атомно-молекулярная теория. Вещества состоят из молекул, а молекулы из атомов. Атомы чрезвычайно малы и на кончике иглы помещаются миллиарды атомов. Тем не менее, наука достигла такого уровня, что различает атомы по размерам, массе и свойствам. В настоящее время различают 110 видов атомов, из которых и состоят все вещества.
Определенный вид атомов называют химическим элементом.
Каждый элемент имеет 3 формы существования – свободные атомы, простые вещества и сложные вещества. Атомы могут существовать изолированно друг от друга в виде свободных атомов, а могут объединятся друг с другом в молекулы. Если соединяются одинаковые атомы, то образуются простые вещества, если разные – сложные вещества.
Из отдельно изолированных атомов состоят такие вещества как неон, аргон, криптон, гелий. Их еще называют благородными или инертными газами, потому что их атомы не соединяются друг с другом и почти не соединяются с атомами других химических элементов. Совсем другое дело – атомы водорода. Они могут существовать поодиночке, как на Солнце, которое более чем на половину состоит из отдельных атомов водорода. Могут соединятся в молекулы по два атома, образуя самый легкий газ, который, как и химический элемент, называют водородом. Атомы водорода также могут соединяться с атомами других химических элементов. Например, два атома водорода соединяясь с одним атомом кислорода, образуют хорошо известное вам вещество – воду.
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
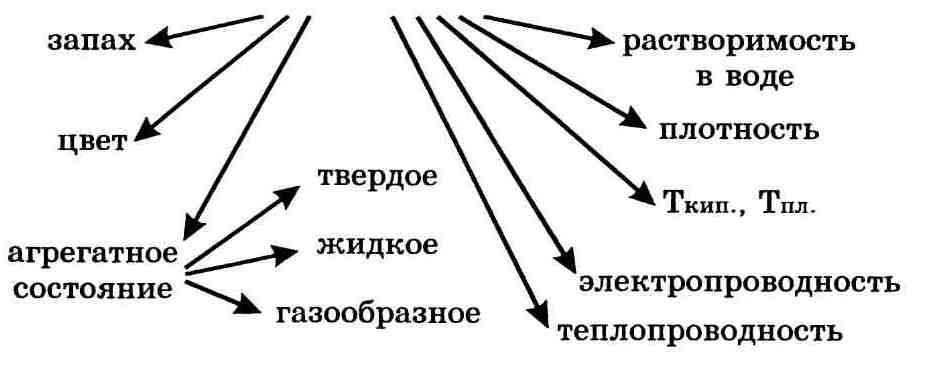
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Читайте также:

