Химия 8 класс параграф 31 конспект
Обновлено: 23.07.2024
Цель урока: повторить физические свойства воды и изучить химические свойства, значение воды для живых организмов, а так же выяснить экологические проблемы, связанные с загрязнением воды.
Образовательные: сформировать знания учащихся о зависимости свойств воды, от состава и строения закрепить знания о типах химических реакций, начать формировать представления о важнейших классах неорганических соединений: основаниях.
Развивающие: развивать наблюдательность, память при просмотре компьютерной презентации и проведении демонстрационного эксперимента. Развивать умение сравнивать, прогнозировать, обобщать и делать выводы. Развивать информационную культуру учащихся.
Воспитательные: воспитывать бережное и экономное отношение к водным ресурсам, продолжить экологическое просвещение школьников, прививать заботу к окружающей среде и своему здоровью, развивать чувство прекрасного.
учебно-познавательная компетенция: развитие умений сравнивать, анализировать, доказывать, составлять схемы на основе работы с текстом, быть способными решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды, выдвижение своих идей по охране водных ресурсов родного края;
коммуникативная компетенция: развитие умений вести беседу, диалог, задавать вопросы.
Формы организации работы детей: групповая (просмотр презентации, практическая работа, решение задач), индивидуальная (беседа, работа с рабочей тетрадью), проблемное обучение (решение проблемных вопросов).
Метапредметные связи: химия, биология, география, экология, литература, русский язык, физика.
- В организме человека воды содержится … (65%)
- Химическая формула воды… (Н 2 О)
- Максимальная плотность воды при t = 4 0 C… (1 г/см 3 )
- Метод определения состава вещества … (анализ)
- Получение сложных веществ из более простых … (синтез)
- Температура кипения воды … (100 0 С)
- Температура замерзания воды … (0 0 С)
- Можно ли назвать природную воду чистым веществом … (нет)
- Процесс очищения воды от растворенных в ней веществ … (дистилляция)
- Насыщение воды кислородом… (аэрация)
Взаимопроверка и обсуждение
- – за 10 вопросов 4 – за 6-9 вопросов 3 – за 1 – 5 вопросов
Подготовка и организация восприятия нового материала . До 18 века предполагалось, что вода является элементарным веществом. Лавуазье отнёс воду к соединениям. Эта мысль развилась, когда Лавуазье наблюдал за работой кузнеца: после охлаждения раскаленного железа в воде поверхность железа окислилась и образовалась железная окалина.
О чем сегодня пойдет речь на уроке? (обсуждение)
Послушайте как красиво о воде пишут поэты:
В кружево будто одеты
Деревья, кусты, провода.
И кажется сказкою это,
А все это просто вода.
Безбрежная ширь океана
И тихая заводь пруда,
Каскад водопада и брызги фонтана,
А в сущности, это вода.
Высокие волны вздымая,
Бушует морская вода,
И топит, и губит, играя,
Большие морские суда.
Вот белым легли покрывалом
На землю родную снега.
А время придет — все растает,
И будет простая вода.
Химические свойства воды определяются особенностями ее строения.
- Вода довольно устойчивое вещество, она начинает разлагаться на водород и кислород при нагревании по крайней мере до 2000°С ( происходит термическая диссоциация) или под действием ультрафиолетового излучения (фотохимическая диссоциация).
2H 2 O = 2H 2 + О 2 Видео "Электролиз воды"
- Взаимодействие с самыми активными металлами , находящимися в периодической системе в I(А) и I I(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Щелочные металлы – это I(А) группа – Li, Na, K, Rb, Cs, Fr
Щелочноземельные металлы – это II(А) – Ca, Sr, Ba, Ra (Be, Mg не относятся)
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Образующееся сложное вещество гидроксид (основание), а выделяющийся газ это водород . Растворимые в воде основания называются щелочами. Объяснение алгоритма составления формул оснований согласно валентности и правила названий оснований.
Внимание! Алюминий и магний ведут себя также.
Алюминий: 2Al + 6H 2 O = 2Al(OH) 3 +3H 2
Магний (в горячей воде): Mg + 2H 2 O = t°C = Mg(OH) 2 +H 2
- Взаимодействие с менее активными металлами , которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Например, бериллий с водой образует амфотерный оксид: Be + H 2 O = BeO + H 2
- Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
(Валентность металла можно легко определить по ряду активности металлов, над их символом стоит значение, например, +2, это означает, что валентность этого металла равна 2) .
Cl 2 + H 2 O = HCl + HClO
C + H 2 O = t°С = CO + H 2
Si + 2H 2 O = t°С = SiO 2 + 2H 2
6. Взаимодействие с оксидами
а) Взаимодействие с основными оксидами
С водой взаимодействуют только основные оксиды активных металлов, которые расположены в I(А) и II(А) группах, кроме Ве и Mg .
Реакция соединения протекает при обычных условиях, при этом образуется растворимое основание – щёлочь.
H 2 O + ОКСИД МЕТАЛЛА = Ме(ОН) n (р. соединения)
Na 2 O + H 2 O = 2NaOH
BaO + H 2 O = Ba(OH) 2
Al 2 O 3 + H 2 O ≠ нет реакции
BeO + H 2 O ≠ нет реакции
б) Взаимодействие кислотных оксидов с водой.
Кислотные оксиды реагируют с водой все. Исключение составляет только SiO 2 .
При этом образуются кислородсодержащие кислоты (см. таблицу кислот) . Во всех кислотах на первом месте расположен водород, поэтому уравнение реакции записывают так:
H 2 O + ОКСИД НЕМЕТАЛЛА = H n A (р. соединения)
Внимание! SiO 2 + H 2 O ≠ нет реакции


АНГИДРИД , химическое соединение, полученное из другого соединения путем удаления воды. Таким образом, триоксид серы (SО 3 ) является ангидридом серной кислоты (H 2 SO 4 ).
4. Задание для закрепления:
Закончить уравнения практически осуществимых реакций, назвать продукты реакции
- сегодня я узнал…
- было интересно…
- было трудно…
- я выполнял задания…
- я понял, что…
- теперь я могу…
- я почувствовал, что…
- я приобрел…
- я научился…
- у меня получилось …
- я смог…
- я попробую…
- меня удивило…
- урок дал мне для жизни…
- мне захотелось…
Итог урока: Выставление оценок за работу.
Дома: параграф 31 учить, тестовые задания стр. 109
Предварительный просмотр:
Подписи к слайдам:
Химические свойства воды. Применение. Учитель химии ФГКОУ КК СК РФ г . Севастополя, Зубенко В.А.
В организме человека воды содержится … Химическая формула воды… Максимальная плотность воды при t = 4 0 C … Метод определения состава вещества … Получение сложных веществ из более простых … Температура кипения воды … Температура замерзания воды … Можно ли назвать природную воду чистым веществом … Процесс очищения воды от растворенных в ней веществ… Насыщение воды кислородом… (65%) (Н 2 О) (1 г/см 3 ) (анализ) (синтез) (100 0 С) (0 0 С) (нет) (дистилляция) (аэрация)
Вода довольно устойчивое вещество, она начинает разлагаться на водород и кислород при нагревании по крайней мере до 2000°С ( происходит термическая диссоциация) или под действием ультрафиолетового излучения (фотохимическая диссоциация). 2 H 2 O = 2 H 2 + О 2 Электролиз воды . wmv
Взаимодействие с самыми активными металлами , находящимися в периодической системе в I(А) и I I(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород . Щелочные металлы – это I(А) группа – Li , Na , K, Rb , Cs , Fr Щелочноземельные металлы – это II(А) – Ca , Sr , Ba , Ra ( Be , Mg не относятся) Me + H 2 O = Me(OH) n + H 2 ( р . замещения ) Внимание! Алюминий и магний ведут себя также. Алюминий: 2Al + 6H 2 O = 2Al(OH) 3 +3H 2 Магний (в горячей воде): Mg + 2H 2 O = t°C = Mg (OH) 2 +H 2 Щелочные металлы с водой .mp4
Взаимодействие с менее активными металлами , которые расположены в ряду активности от алюминия до водорода. Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be , Fe , Pb , Cr , Ni , Mn , Zn – реагируют с образованием оксида металла и водорода Me + Н 2 О = Ме х О у + Н 2 (р. замещения) (Валентность металла можно легко определить по ряду активности металлов, над их символом стоит значение, например, +2, это означает, что валентность этого металла равна 2) .
Взаимодействие воды c неметаллами Cl 2 + H 2 O = HCl + HClO C + H 2 O = t° С = CO + H 2 Si + 2H 2 O = t° С = SiO 2 + 2H 2
Взаимодействие с оксидами а) Взаимодействие с основными оксидами С водой взаимодействуют только основные оксиды активных металлов, которые расположены в I(А) и II(А) группах, кроме Ве и Mg . H 2 O + ОКСИД МЕТАЛЛА = Ме (ОН) n (р. соединения) Основные оксиды с водой.wmv б) Взаимодействие кислотных оксидов с водой. H 2 O + ОКСИД НЕМЕТАЛЛА = H n A (р. соединения) Кислотные оксиды с водой.wmv Внимание! SiO 2 + H 2 O ≠ нет реакции
Название кислоты Формула кислоты Соответствующий оксид Азотистая HNO 2 N 2 O 3 Азотная HNO 3 N 2 O 5 Сернистая H 2 SO 3 SO 2 Серная H 2 SO 4 SO 3 Угольная H 2 CO 3 CO 2 Кремниевая H 2 SiO 3 SiO 2 Фосфорная H 3 PO 4 P 2 O 5 АНГИДРИД , химическое соединение, полученное из другого соединения путем удаления воды. Таким образом, триоксид серы (SО 3 ) является ангидридом серной кислоты (H 2 SO 4 ).
Закончить уравнения практически осуществимых реакций, назвать продукты реакции CaO + H 2 O = SO 2 + H 2 O = Li + H 2 O = Ba + H 2 O = ZnO + H 2 O = Al + H 2 O = Cu + H 2 O = K 2 O + H 2 O = Mg + H 2 O = N 2 O 5 + H 2 O =
По теме: методические разработки, презентации и конспекты

Урок химии в 10 классе с применением модульной технологии по теме: "Алканы, свойства и получение".
Урок химии в 10 классе с применением модульной технологии по теме: "Алканы, свойства и получение". Тип урока– урок изучения и первичного закрепления нового материала. Формы и приемы раб.
10 класс (БУП 1час в неделю)Цели урока: 1. ОбразовательнаяСоздать условия для воспроизведения знаний и умений учащихся по данной теме.

Урок изучения нового материала. на основе предыдущих знаний, содержащих похожую структуру.

Конспект урока по живому миру "Свойства воды", 2 класс
ЦЕЛЬ: Познакомить детей с некоторыми свойствами воды.Расширить кругозор, пассивный словарь.Воспитывать бережное отношение к природе.
Конспект урока по окружающему миру "Свойства воды"
Данный конспект предназначен для 3 -го класса. Учитель использует ТСО, групповую, парную работу, что актуально в современном мире. Дети самостоятельно формулируют учебную задачу, соотрудничают, .

Урок природоведения 5 класс "Свойства воды"
На уроке, благодаря проведению лабораторной работы, созданы условия для формирования у детей с ОВЗ знаний о свойствах воды.

Урок по химии на тему: Физические и химические свойства воды. Применение воды"
Урок по химии на тему: Физические и химические свойства воды. Применение воды".
Составьте конспект ответа, характеризующего гидроксиды NaOH, Са(ОН)2 и Fe(OH)3, придерживаясь стандартного плана.
Гидроксид натрия NaOH
Общая характеристика. Гидроксид натрия — растворимое основание. Самая распространенная щелочь. Так же называют едкой щелочью за счет способности разъедать ткани, кожу, бумагу.
Получение.
а) в лаборатории:
Na2O + Н2O → 2 NaOH;
Na + Н2O → NaOH + Н2.
б) в промышленности:
Na2CO3 + Са(ОН)2 → 2 NaOH + СаСO3.

Na2CO3 + Fe2O3 → Na2O · Fe2O3 + CO
Na2O · Fe2O3 + NH2O → 2 NaOH + Fe2O3
Электролиз:
2 NaCl + 2 H2O → H2 + Cl2 + 2 NaOH
Физические свойства. Твердое вещество представляет собой бесцветные ромбические кристаллы. Температура плавления 323°С. Температура кипения 14030С. Растворим в воде, глицерине, этиловом и метиловом спиртах, практически не растворим в диэтиловом эфире. Гигроскопичен.
Химические свойства.
NaOH + HCl → NaCl + Н2O
ZnO + 2 NaOH → Na2ZnO2 + H2O
2 NaOH + CuSO4 → Cu(OH)2 + Na2SO4
3S + 6 NaOH → 2 Na2S + Na2SO3 + 3 H2O
6 NaOH + 3I2 → NaIO3 + 5 Nal + 3 H2O
2 Al + 2 NaOH + 6 H2O → 3 H2 + 2 Na[Al(OH)4]
SiO2 + 4 NaOH → (2Na2O) · SiO2 + 2 H2O·
NaOH + CO2 → Na2CO3 + H2O
Применение. Для омыления жиров при производстве мыла, в химической промышленности для нейтрализации кислот, а также в количественном анализе, входит в состав многих чистящих средств, в косметологии, в пищевой промышленности в качестве БАД.
Гидроксид кальция Са(OН)2
Общая характеристика. Гидроксид кальция — сильное основание. Так же известен как гашеная известь и известковая вода.
Получение.
а) в лаборатории:
СаСO3 + 2 NaOH → Са(ОН)2 + Na2CO3;
Са + 2 Н2O → Са(ОН)2 + Н2 ↑.
б) в промышленности:
СаО + Н2O → Са(ОН)2.
Этот способ используется для промышленного и лабораторного получения гидроксида кальция.
Физические свойства. Порошок белого цвета, плохо растворим в воде.
Химические свойства.
Са(ОН)2 + H2SO4 → CaSO4 + 2 Н2O
Са(ОН)2 + СO2 → СаСO3 ↓ +Н2O
Са(ОН)2 + Na2SO3 → CaSO3 ↓ +2NaOH
Применение. В строительстве для побелки помещений, для изготовления известкового раствора, для приготовления бетона. Так же для производства удобрений, в качестве БАД, для дубления кож, в стоматологии для дезинфекции.
Гидроксид железа (III) Fe(OH)3
Общая характеристика. Гидроксид железа (III) — амфотерный гидроксид с преобладанием основных свойств.
Нахождение в природе. В природе встречается в виде оксидной руды железа — лимонита Fe2O3∙NH2O и минерала гётита — FeO(OH).
Получение.
а) в лаборатории:
FeCl3 + 3 NaOH → Fe(OH)3 ↓ +3 NaCl.
б) в промышленности.
Осаждение из раствора солей железа (III) гидрата Fe2O3 · NН2O и его частичное обезвоживание
Физические свойства.
Имеет бурый цвет. При нагревании разлагается без плавления. Не растворяется в воде. Является слабым окислителем и восстановителем.
Химические свойства. Гидроксид Fe (III) обладает амфотерными свойствами с преобладанием основных. Поэтому он легко растворяется в кислотах:
2 Fe(OH)3 + 3 H2SO4 = Fe2(SO4)3 + 6 H2O
и не растворяется в щелочах. Подтверждением наличия у Fe(OH)3 кислотных свойств является существование гидроксокомплексов, простейшими из которых являются [Fe(OH)4] и [Fe(OH)6]3-. Их можно получить, добавляя по каплям раствор соли Fe(III) в избыток концентрированной щёлочи:
Fe3+ + 4 ОН → [Fe(OH)4]
Применение. Применяются в cocтаве пигментов.
Конспекты по химии 8 класс собраны по порядку на этой странице. Они помогут вам наглядно показать учебный материал на своих уроках, а ученик с их помощью сможет самостоятельно изучить любую тему урока по видео или конспекту. Это готовые материалы для учителя химии, которые можно удобно использовать на каждом своем уроке.

21. Кислоты
Химия 8 класс

22. Соли
Химия 8 класс

23. Кристаллические решетки
Химия 8 класс

24. Чистые вещества и смеси
Химия 8 класс
25. Физические явления
Химия 8 класс
26. Химические явления. Закон сохранения массы веществ
Химия 8 класс

27. Химические уравнения
Химия 8 класс
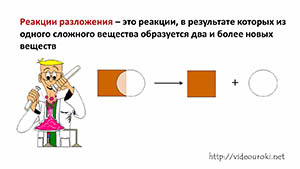
28. Реакции разложения
Химия 8 класс
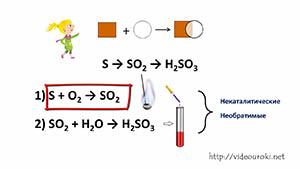
29. Реакции соединения
Химия 8 класс
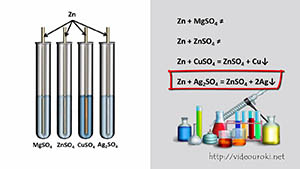
30. Реакции замещения
Химия 8 класс

Получайте новое первыми










Лицензия на право ведения образовательной деятельности №5251 от 25.08.2017 г.
| Реакции соединения — это такие реакции, в результате которых из одного или нескольких исходных веществ образуется одно сложное вещество. |
Рассмотрим этот тип реакций с помощью ещё одной, новой для вас формы записи химических процессов — так называемых цепочек переходов, или превращений. Например, схема

показывает превращение фосфора в оксид фосфора (V) Р2O5, который, в свою очередь, затем превращается в фосфорную кислоту Н3РO4.
Число стрелок в схеме превращения веществ соответствует минимальному числу химических превращений — химических реакций. В рассматриваемом примере это два химических процесса.
1-й процесс. Получение оксида фосфора (V) Р2O5 из фосфора. Очевидно, что это реакция соединения фосфора с кислородом.
Поместим немного красного фосфора в ложечку для сжигания веществ и подожжём его. Фосфор горит ярким пламенем с образованием белого дыма, состоящего из маленьких частичек оксида фосфора (V):
2-й процесс. Внесём ложечку с горящим фосфором в колбу. Она заполняется густым дымом из оксида фосфора (V). Вынем ложечку из колбы, прильём в колбу воду и взболтаем содержимое, предварительно закрыв горлышко колбы пробкой. Дым постепенно редеет, растворяется в воде и, наконец, исчезает совсем. Если к полученному в колбе раствору добавить немного лакмуса, он окрасится в красный цвет, что является доказательством образования фосфорной кислоты:
Реакции, которые проводят для осуществления рассматриваемых переходов, протекают без участия катализатора, поэтому их называют некаталитическими. Рассмотренные выше реакции протекают только в одном направлении, т. е. являются необратимыми.
Проанализируем, сколько и каких веществ вступало в рассмотренные выше реакции и сколько и каких веществ в них образовалось. В первой реакции из двух простых веществ образовалось одно сложное, а во второй — из двух сложных веществ, каждое из которых состоит из двух элементов, образовалось одно сложное вещество, состоящее уже из трёх элементов.
Одно сложное вещество может также образоваться и в результате реакции соединения сложного и простого веществ. Например, при производстве серной кислоты из оксида серы (IV) получают оксид серы (VI):


Эта реакция протекает как в прямом направлении, т. е. с образованием продукта реакции, так и в обратном, т. е. происходит разложение продукта реакции на исходные вещества, поэтому в них вместо знака равенства ставят знак обратимости .
| Химические реакции, которые протекают одновременно в двух противоположных направлениях — прямом и обратном, называют обратимыми. |
В этой реакции участвует катализатор — оксид ванадия (V) V2O5, который указывают над знаком обратимости:

Сложное вещество также может быть получено и в реакции соединения трёх веществ. Например, азотную кислоту получают по реакции, схема которой:
Рассмотрим, как подобрать коэффициенты для уравнивания схемы этой химической реакции.
Число атомов азота уравнивать не нужно: и в левой, и в правой частях схемы по одному атому азота. Уравняем число атомов водорода — перед формулой кислоты запишем коэффициент 2:
но при этом нарушится равенство числа атомов азота — в левой части остался один атом азота, а в правой их стало два. Запишем коэффициент 2 перед формулой оксида азота (IV):
Подсчитаем число атомов кислорода: в левой части схемы реакции их семь, а в правой части — шесть. Чтобы уравнять число атомов кислорода (по шесть атомов в каждой части уравнения), вспомним, что перед формулами простых веществ можно записать дробный коэффициент 1/2:
Сделаем коэффициенты целыми. Для этого перепишем уравнение, удвоив коэффициенты:
Следует отметить, что почти все реакции соединения относятся к экзотермическим реакциям.
Лабораторный опыт № 15
Прокаливание меди в пламени спиртовки
-
Рассмотрите выданную вам медную проволоку (пластину) и опишите её внешний вид. Прокалите проволоку, удерживая её тигельными щипцами, в верхней части пламени спиртовки в течение 1 мин. Опишите условие проведения реакции. Опишите признак, подтверждающий, что произошла химическая реакция. Составьте уравнение проведённой реакции. Назовите исходные вещества и продукты реакции.
- Реакции соединения — антонимы реакций разложения.
- Каталитические (в том числе и ферментативные) и некаталитические реакции.
- Цепочки переходов, или превращений.
- Обратимые и необратимые реакции.
-
Запишите уравнения реакций соединения, протекающих согласно схемам:
Читайте также:

