Газовые законы химия 11 класс конспект
Обновлено: 05.07.2024
Урок изучается в теме "Строение вещества". По типу урок относится к урокам объяснения нового материала. Методы , используемые на уроке: информационно - коммуникативные, обучение в сотрудничестве, личносто - ориентированные, проблемно - поисковые. Целью урока было обобщение знаний о газообразных веществах, выявление отличий свойств газообразных веществ от твердых и жидких. При проведении урока было использовано мультимедийное оборудование, видеофрагменты опытов, воздушный шар, аэрозоль, набор минералов, химическая посуда, реактивы для демонстрационных опытов.
| Вложение | Размер |
|---|---|
| urok_na_seminar.docx | 28.84 КБ |
Предварительный просмотр:
Тип урока: объяснение нового материала.
Методы обучения : информационно-коммуникационные, обучение в сотрудничестве, личностно-ориентированное и проблемно-поисковое обучение.
Цель : Обобщить знания о газообразных веществах, установить отличия от твердых и жидких веществ, повторить з-н Авогадро, систематизировать знания о способах получения и применения наиболее известных газов.
- Образовательные - закрепить знания о газообразных веществах, рассмотреть основных представителей, выявить распространение в природе.
- Развивающие - развивать познавательный интерес, развивать умение сравнивать, анализировать, обобщать, делать выводы.
- Воспитательные - воспитывать умение работать в сотрудничестве, совершенствовать коммуникативные умения в ходе выполнения заданий, развивать умение формулировать и аргументировать собственное мнение, заинтересовать процессами, происходящими в окружающем мире.
- Коррекционные - развивать слуховое восприятие, корректировать навыки соотносительного анализа, группировки и классификации, установление причинно-следственной связи. Коррекция восприятия, памяти и внимания, сенсорных представлений.
Оборудование: компьютер, мультимедийный проектор, видеофрагменты опытов, карточки с формулами газов, воздушный шарик, чайник с паром, бутылка газводы, аэрозоль.
1. Организационный момент.
2. Актуализация знаний и активация мотивации учащихся.
Однажды Сократ, окружённый учениками, поднимался к храму. Навстречу им спускалась известная афинская гетера. “Вот ты гордишься своими учениками, Сократ, - улыбнулась она ему, - но стоит мне только легонько поманить их, как они покинут тебя и пойдут вслед за мной”. Мудрец же ответил так: “Да, но ты зовёшь их вниз, в тёплую весёлую долину, а я веду их вверх, к неприступным, чистым вершинам”.
Вот и мы с вами сегодня должны подняться на одну ступеньку вверх, “преодолевая” задания, которые будут рассмотрены на сегодняшнем уроке.
Девиз урока: Приобретать знания – храбрость,
Приумножать их – мудрость,
А умело применять – великое искусство.
Учитель: У меня к вам вопрос, что объединяет столь разнородные предметы на моем столе (воздушный шарик, газированная вода, чайник с паром, аэрозоль в баллоне)? Возможна негромкая музыка.
Ученики : газ, газообразные вещества.
Учитель: тогда прошу назвать тему нашего урока - газообразные вещества. Записываем в рабочие листы тему.
3. Основная часть урока.
Вступительное слово учителя: вспомним физику, сколько агрегатных состояний вещества вы знаете?
Ученики: твердые, жидкие, газообразные.
Учитель : хорошо, можно еще добавить, 4 состояние вещества – плазма (в-ва находятся в атомарном состоянии). Пример: пламя. Что характерно для каждого агрегатного состояния?
Учитель+ ученики : твердые тела – молекулы расположены очень близко друг к другу. Такие вещества сохраняют форму, объем. Жидкие - имеют объем, но не имеют формы. Молекулы жидких веществ находятся чуть дальше друг от друга, поэтому жидкости текучие, но имеют объем. Их трудно сжать.
Демонстрация, учитель : твердое вещество - кусок мрамора; воду переливаем в сосуды разной формы, тем самым показывая изменения формы, но сохранение объема.
А теперь, давайте подумаем, если это вещество – газ? Какими свойствами оно должно обладать? Давайте обратимся к нашим рабочим листам и попробуем заполнить схему: свойства газов.
В центре страницы слово ГАЗ и от него стрелочки.
1.Свойство : газ не имеет ни формы, ни объема, принимает любую форму, занимает любой объем (сдуем немного шарик и можем изменить его форму и размер). Почему? Потому, что молекулы газов находятся очень далеко друг от друга и слабые силы притяжения между ними не могут удержать их рядом. Поэтому объем любого сосуда в сотни тысяч раз больше объема любого газа в сосуде. Отсюда вытекает з-н Авогадро : в равных V любого газа содержится одно и то же число молекул при одинаковых условиях. Следствие этого закона: 1 моль любого газа = 22,4 л. Его называю молярным Vm . Vm =22, 4л.
Учитель: если молекулы расположены далеко, их можно приблизить? Как это сделать?
Ученики : сжать, сделать жидким.
Учитель : верно, записываем еще одно свойство – легко сжимаются, сжижаются . Что при этом происходит с молекулами? Изменяется расстояние между ними. Где человек использует эти свойства газов?
Ученики: газовые баллоны, аэрозоли, сухой лед …
3.Чтобы узнать 3 свойство газообразных веществ обратимся к иллюстрации. Что это? Атмосфера, что из себя представляет атмосфера? Смесь газов. Кто напомнит состав атмосферы с математической точки зрения, процентное соотношение компонентов? А с исторической точки зрения: атмосфера всегда имела такой состав? Первичная атмосфера Земли состояла в основном из CH4,CO2, NH3.Кто изменил на протяжении миллионов лет состав атмосферы? Верно, - растения, они выделяли и продолжают выделять O2. Значимость O2 в чем? Нужен для дыхания (обмена веществ) всех живых организмов. Без него невозможен процесс горения (не работали бы двигатели внутреннего сгорания, турбины и т.п.)
Третье свойство - равномерно смешиваться в любых пропорциях.
Учитель: для того чтобы продолжить работу на уроке вам необходимо, из имеющихся формул выбрать формулы только газообразных веществ. Формулы веществ записаны на доске. Прошу вас рассказать о тех веществах, формулы которых вы выбрали. Это именно те газы, с которыми мы сталкиваемся чаще всего, используем их в самых разных областях. Они важные составляющие природы, участники многих процессов жизнедеятельности.
1 ученик – H2. Самый легкий газ. Рассказывает о водороде. В лабораторных условиях его получают:
Zn + 2HCl = ZnCl 2 + H 2 ↑. чтобы распознать водород, подносим горящую лучину к сосуду и слышим хлопок (образуется гремучий газ 2 V H2 и V O2).( Заполняем рабочий лист)
В некоторых реакциях водород может являться побочным продуктом. Например, при взаимодействии металлического натрия с водой.Na+H2O=NaOH+H 2 .(демонстрационный опыт)
Учитель - Способы получения: 2KMnO 4 = K 2 MnO 4 + MnO 2 + О 2 ↑; либо 2H 2 O 2 = 2Н 2 О + О 2 ↑ . Как можем его распознать? Поддерживает горение. Тлеющая лучина. Видеофрагмент ( заполняем рабочий лист)
3 ученик – CO2, Углекислый газ или оксид углерода (IV) СО 2 – бесцветный, не имеющий запах газ. Он примерно в полтора раза тяжелее воздуха. Растворим в воде. В лаборатории углекислый газ получают действием соляной кислоты на карбонат кальция:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑. В промышленности углекислый газ получают обжигом известняка: CaCO 3 = СаО + СО 2 ↑ (демонстрационный опыт)
Учитель - Как можем распознать углекислый газ? Не поддерживает горение, при пропускании через раствор известковой воды он вызывает помутнение в следствии образования угольной кислоты и гидрокарбоната кальция .
4 ученик - Аммиак NH 3 – газ с резким запахом, бесцветный, хорошо растворим в воде, в промышленном масштабе: 3H 2 + N 2 = 2NH 3 .В лаборатории аммиак получают взаимодействием щелочей с солями аммония: NH 4 Cl + NaOH = NaCl + H 2 O + NH 3 ↑. Распознают аммиак по запаху (всем знаком нашатырь ). (демонстрация видеофрагмента)
5 ученик – C2H4 на уроках органической химии мы познакомились с газом этиленом. Этилен – газ без цвета и запаха. В промышленности его получают дегидрированием этана (отъем H2): СН 3 − СН 3 > СН 2 = СН 2 + Н 2 . В химической лаборатории: путем дегидратации этилового спирта: С 2 Н 5 ОН → С 2 Н 4 + Н 2 О .
4. Рефлексия. Закрепление материала.
1. Какое вещество существует на Земле в 3-х агрегатных состояниях?
2. Какой газ, находящийся в атмосфере защищает нас от УФО?
3. Атмосфера – смесь газов. Назовите еще одну природную смесь газов?
У нас осталось последнее задание – ответить на вопросы теста.
5 . Подведение итогов, домашнее задание.
2017 год был объявлен Годом экологии. Как вы считаете, состояние атмосферы, процентное соотношение газов в ней, как то влияет на экологию Земли? Какие газы загрязняют атмосферу, и какие оказывают положительное воздействие? Что влияет на озоновый слой?
Итогом работы учащихся на уроке является заполненная таблица, которая имеет следующий вид:
Получение (уравнения реакций)
Водород (Н 2 ) – самый
не имеет запаха.
Вытеснением водорода металлами из растворов кислот:
Zn + 2HCl = ZnCl 2 + H 2 ↑.
В перевернутую вверх дном пробирку.
Кислород (О 2 ) без запаха и цвета, тяжелее воздуха, мало растворим в воде.
1.Разложением перманганата калия:
2KMnO 4 = K 2 MnO 4 + MnO 2 + О 2 ↑;
2.Разложением пероксида водорода
2H 2 O 2 = 2Н 2 О + О 2 ↑ .
Вспыхивание тлеющей лучинки, внесенной в сосуд с кислородом.
Углекислый газ – оксид углерода (IV) – СО 2 . Бесцветный, не имеет запаха, не поддерживает горение, тяжелее воздуха. Растворим в воде.
1.В промышленности:
CaCO 3 = СаО + СО 2 ;
2.В лаборатории:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑.
1.Горящая лучина гаснет в сосуде с СО 2 .
2.По помутнению известковой воды:
СО 2 + Са(ОН) 2 = СаСО 3 v + Н 2 О
Аммиак (NН 3 ) имеет резкий характерный запах, без цвета, хорошо растворим в воде, легче воздуха.
1.В промышленности:
3H 2 + N 2 = 2NH 3 ;
2.В лаборатории:
NH 4 Cl + NaOH = NaCl + H 2 O + NH 3 ↑.
В перевернутую вверх дном пробирку.
2.По изменению цвета влажной лакмусовой бумажки (синеет).
3.По появлению дыма при поднесении стеклянной палочки, смоченной в соляной кислоте.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока
Химия, 11 класс
Урок № 1. Химический элемент. Нуклиды. Изотопы. Законы сохранения массы и энергии в химии
Перечень вопросов, рассматриваемых в теме
Атом – это наименьшая частица химического элемента, которая несет все его свойства.
Изотопы – это нуклиды с одинаковым зарядом ядра, но разным массовым числом и числом нейтронов
Нейтрон – это незаряженная элементарная частица.
Нуклиды – это различные виды ядер, которые отличаются зарядом или массовым числом.
Протон – это положительно заряженная элементарная частица.
Элементарная частица – это объект, который нельзя разделить на более мелкие составляющие.
Радиоактивный распад – это превращение ядер нуклидов, сопровождающиеся изменением числа протонов или нейтронов в ядре и испусканием элементарных частиц, гамма-квантов или кластеров.
Химический элемент – это вид атомов с определенным зарядом ядра.
Электроны – это отрицательно заряженные элементарные частицы, которые движутся по орбиталям вокруг ядра.
Ядро – это положительно заряженная центральная часть атома.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Одним из основных понятий химии является атом. Атом – это наименьшая частица химического элемента, которая несет все его свойства. Согласно планетарной модели, атом состоит из ядра и электронов. Электроны – это отрицательно заряженные элементарные частицы, которые движутся по орбиталям вокруг ядра. Ядро – это положительно заряженная центральная часть атома. Ядра атомов превращаются друг в друга в ходе ядерных реакций.
Ядро состоит из двух типов элементарных частиц: протонов (Z) и нейтронов (N). Заряд нейтронов равен нулю. Протоны обладают зарядом +1. Общее число нейтронов и протонов в ядре называется массовым числом (А). Оно близко, но не равно по значению к атомной массе элемента, указанной в Периодической таблице. Заряд ядра равен числу протонов и порядковому номеру элемента в Периодической системе.
Вид атомов с определенным зарядом ядра называется химическим элементом. Химический элемент существует в виде простого вещества (металла или неметалла) или соединений с другими элементами. К характеристикам химического элемента относятся: атомный номер, относительная атомная масса, изотопный состав, положение в Периодической системе, строение атома, электроотрицательность, степени окисления, валентность, энергия ионизации, сродство к электрону, распространенность в природе.
Нуклидами называют различные виды ядер, которые отличаются зарядом или массовым числом. Они обозначаются следующим образом: вверху перед символом нуклида пишется массовое число, внизу – порядковый номер элемента. Нуклиды с одинаковым зарядом ядра, но разным массовым числом и числом нейтронов называются изотопами. Изотопы одного элемента обладают одинаковыми химическими свойствами и почти не отличаются по физическим свойствам. Элементы представляют собой совокупность изотопов с разными массовыми числами, поэтому атомные массы многих элементов представлены дробными числами.
Химические реакции подчиняются законам сохранения массы и энергии. Закон сохранения массы веществ впервые сформулировал великий ученый М.В. Ломоносов. Экспериментально его доказал А.Л. Лавуазье. Формулируется закон следующим образом: масса исходных веществ, вступивших в химическую реакцию, равна массе продуктов реакции. В ходе реакции атомы веществ только перегруппировываются.
В двадцатом веке ученые обнаружили, что закон сохранения массы не соблюдается в случае ядерных реакций. После того, как А. Эйнштейн открыл взаимосвязь между массой и энергией, выраженную в его знаменитой формуле E=mc2, стало понятно, что закон сохранения массы лишь частный случай закона сохранения энергии. Закон сохранения энергии гласит: в изолированной системе энергия системы не исчезает и не появляется, а только переходит из одного вида в другой. Для составления ядерных реакций важно помнить, что суммарный заряд ядер и массовое число сохраняются.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на работу с Периодической системой.
Условие задачи : Введите формулу простого вещества, при бета-распаде которого образуется висмут.
Решение: Висмут – элемент с порядковым номером 83. При бета распаде один из нейтронов превращается в протон, таким образом заряд ядра атома увеличивается на единицу. Следовательно, химический элемент, образующий исходное вещество, находится на одну клетку левее висмута. Это свинец.
2.Решение задачи на закон сохранения массы или закон сохранения числа атомов.
Условие задачи : Расставьте коэффициенты в реакции и выберите правильное значение их суммы.
Решение: Составим электронный баланс. Каждый атом алюминия присоединил 3 электрона, а каждый атом серы отдал два электрона. Тогда коэффициенты 2Al + 3S = Al2S3
Цели урока: получить практические навыки применения газовых законов для решения химических задач,
установить межпредметные связи с физикой и экологией.
Тип урока: урок закрепления и обобщения изученного материала
Форма урока: практическое занятие
Основные методы: объяснительно-иллюстративный, метод проблемного изложения учебного материала, самостоятельная работа учащихся.
Средства обучения: справочный материал; тексты задач.
I. Блок мотивации и актуализации.
- Сегодня на занятии мы должны научиться решать конкурсные задачи с использованием газовых законов. Для этого придется вспомнить курс физики.
II. Блок изучения материала.
(весь изложенный ниже теоретический материал имеется у учащихся в виде карточек)

- Итак, какие газовые законы известны вам из курса физики?
(ученики называют законы, учитель записывает их на доске)
а) Закон Бойля-Мариотта
При постоянной температуре произведение давления газа на его объем есть величина постоянная, или объем газа обратно пропорционален давлению, при котором он находится.
б) Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре.
в) Закон Шарля
При постоянном объеме давление прямо пропорционально температуре.
г) Объединенный газовый закон
д) Уравнение Клапейрона – Менделеева
Давайте более подробно рассмотрим уравнение Клапейрона – Менделеева и вспомним, что означают входящие в него величины
Вопрос учащимся: Что означает величина R?
(универсальная газовая постоянная).
Вопрос учащимся: Что означает величина ?
- Это количество вещества.
Вопрос учащимся: В каких единицах измеряется количество вещества?
- Для измерения количества вещества используют особую величину “моль” . 1 моль содержит столько структурных частиц, сколько атомов углерода содержится в 12 г изотопа C12.
В 1 моль содержится примерно структурных частиц.
Вопрос учащимся: Как можно найти количество вещества?
- Для того, чтобы найти количество вещества, надо массу разделить на молярную массу:
Часто используют понятие молярного объема V(m), который равен объему одного моль вещества.
С использованием понятия молярного объема уравнение Клапейрона – Менделеева
может быть записано в виде:
- Теперь вспомним один из важнейших законов химии - Закон Авогадро.
е) Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Для химических расчетов применяют следствия из Закона Авогадро:
Следствие 1 Моль любого газа при нормальных условиях занимает один и тот же объем, равный приблизительно 22,4 л.
Вопрос учащимся: Какие параметры характеризуют состояние газа при нормальных условиях? ( ученики перечисляют, учитель записывает).
Нормальными условиями считаются: давление
Таким образом, в соответствии с законом Авогадро:
Вопрос учащимся: При решении задач часто приходится проводить расчеты для условий, отличающихся от нормальных. Как привести параметры газа к нормальным условиям?
Для приведения объема газа к нормальным условиям можно пользоваться объединенным газовым законом:
где V - объем газа при давлении P и температуре T
– параметры, характеризующие параметры газа при нормальных условиях.
Масса одного и того же объема газа тем больше, чем больше масса его молекул. Если в равных объемах газов при одинаковых условиях содержится одинаковое число молекул, то очевидно, что отношение масс равных объемов газов будет равно отношению их молекулярных масс или отношению численно равных им молярных масс, то есть m1/m2 = M1/M2, где
m1 - масса объема первого газа,
m2 - масса такого же объема второго газа,
M1 - молярная масса первого газа,
M2 - молярная масса второго газа.
Отношение массы определенного объема одного газа к массе такого же объема другого газа, взятого при тех же условиях, называется относительной плотностью первого газа по второму (обозначается буквой - D).
Тогда m1/m2 = D и D = M1/M2, откуда M1 = M2 • D.
Обычно плотность газов определяют по отношению к водороду M(H2) = 2 г/моль или к воздуху М(возд.) = 29 г/моль. В итоге получим: М = 2D (H2) и M = 29 D( возд.).
Таким образом, зная плотность газа по водороду или по воздуху, можно легко определить его молярную, а, следовательно, и относительную молекулярную массу и сформулировать II следствие из закона Авогадро.
Следствие 2 Относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее (легче) другого, т.е. равна отношению плотностей газов или молярных масс.
Молярная масса вещества (M), а значит, и относительная молекулярная масса (Mr) вещества в газообразном состоянии, численно равна удвоенной плотности паров этого вещества по водороду.
Измерения объемов газов обычно производят при условиях, отличных от нормальных.
Если мы рассматриваем смесь газов, необходимо использовать закон Дальтона
ж) Закон Дальтона (для газовой смеси)
Общее давление газовой смеси равно сумме парциальных давлений газов, входящих в эту смесь:
Пояснение. В некоторых текстах задач встречаются внесистемные единицы измерений различных величин; необходимо уметь их переводить в систему СИ.
Внесистемные единицы давления: 1 атм.=101325 Па; 1 мм рт. ст. = 133,3 Па.
T - температура по шкале Кельвина, t 0 C - температура по шкале Цельсия.
- Итак, мы повторили основные теоретические положения и сейчас перейдем к практике и научимся решать задачи этого типа. У Вас на столах находятся тексты задач – разбираем 1-ю задачу.
I этап
(учитель сам решает с объяснением задачу у доски)
Задача 1.
Какой объем (н.у.) займут 0,4•10 -3 м 3 газа, находящегося при 50 о С и давлении 0,954•10 5 Па?
Учитель записывает на доске, ученики в тетради условие:
(текст задачи читают сами учащиеся, записывают условие задачи в тетрадь; учитель комментирует решение, записывая его на доске)
Масса 0,327•10 -3 м 3 газа, при 13 о С и давлении 1,04•10 5 Па равна 0,828•10 -3 кг. Вычислить молярную массу газа.
(Учитель предлагает составить план решения данной задачи; опрашивает 2-3 учеников, затем решает задачу на доске с их помощью).
t = 50 o C; T=323 К
Для решения задачи применим уравнение Клапейрона – Менделеева
Задача 3, аналогичная предыдущей; дается время (3-5 минут), чтобы все решали на местах. Для выполнения задания учитель вызывает сильного ученика, чтобы он объяснил у доски решение данной задачи.
Задача 3.
Определить молярную массу ацетона, если он в парообразном состоянии при температуре 87 о С и давлении 720 мм рт. ст. занимает объем 0,5 л навеска взятого вещества 0,93 г.
Решение этой задачи аналогично решению предыдущей. Особенностью является необходимость перевода давления из мм рт. ст. в Паскали.
Предлагаются тексты задач по мере их усложнения. Каждый решает индивидуально. Учитель наблюдает, как учащиеся справляются с заданиями. Первый решивший выписывает на доске свое решение и комментирует его.
225 г паров хлорбензола, находясь при температуре 25 о С в резервуаре на 10 л, создают давление в 0,51 МПа. Оцените отклонение состояния этих паров от идеального газа. Чем можно объяснить такое отклонение?
V = 10 л =10 -2 м 3 t = 25 o C; T=298 К М=142,5•10 -3 кг/моль
По данным задачи определяем, какое могло бы быть давление идеального газа при тех же условиях, и сравниваем с давлением реального газа
Подставляем значения величин данные в условии задачи.
Изменение давления можно объяснить взаимодействием молекул.
III. Блок подведения итогов и рефлексии
Сегодня на уроке мы вспомнили основные газовые законы, их математические выражения, единицы измерения, потренировались на конкретных примерах в решении задач на газовые законы, в основном на уравнение Клапейрона – Менделеева. На следующем занятии мы разберем задачи на смеси газов.
- Задачи для самостоятельной работы типовые и нестандартные можно найти в приложении 1. Там же представлены решения пяти различных по сложности задач
-
Архангельская О.В. Использование универсальной газовой постоянной при решении

На этом уроке мы познакомимся с изопроцессами, при которых один из макроскопических параметров газа остается постоянным. Мы исследуем зависимости других макроскопических параметров газа в различных случаях.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Газовые законы"
Напомним, что в одном из прошлых уроков мы вывели уравнение состояния идеального газа (или уравнение Менделеева-Клапейрона):
Рассматривая случаи, когда масса и один из макроскопических параметров постоянны, можно вывести количественные зависимости между двумя другими макропараметрами. Такие зависимости называют газовыми законами.
Процессы, протекающие при постоянном давлении, постоянном объеме или постоянной температуре, называют изопроцессами.
Надо сказать, что это, опять же, идеализированные модели реальных процессов, поскольку поддерживать постоянство того или иного параметра с высокой точностью достаточно сложно. Тем не менее, в лабораторных условиях это возможно.
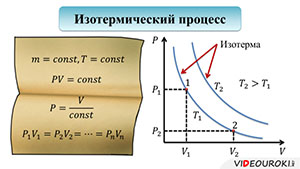
Итак, существует три изопроцесса: изотермический, изобарный и изохорный. Изотермический процесс — это процесс, происходящий при постоянной температуре.
Изобарный процесс — это процесс, происходящий при постоянном давлении.
Изохорный процесс — это процесс, происходящий при постоянном объеме.
Начнем с изучения изотермического процесса. Итак, рассмотрим уравнение состояния идеального газа при постоянной массе и температуре:
Сразу заметим, что постоянная масса означает постоянное количество вещества. Тогда, правая часть уравнения становится константой.
Из этого вытекает следующий закон: для газа данной массы при постоянной температуре произведение давления газа и его объема постоянно:
Этот закон был открыт двумя учеными: Робертом Бойлем и Эдмом Мариоттом, которые пришли к такому выводу, работая независимо друг от друга. Но, свое открытие они совершили приблизительно в одно и то же время, поэтому, закон стал называться законом Бойля-Мариотта.
Из уравнения, описывающего закон Бойля-Мариотта, выразим давление через объем, чтобы построить график:
Чисто логически, вы понимаете, что если произведение объема и давления остается постоянным, то это значит, что во сколько раз уменьшится объем, во столько же раз увеличится и давление. И наоборот: во сколько раз увеличится объем, во столько же раз уменьшиться давление. График зависимости давления от объема при постоянной температуре представляет собой гиперболу:
Кривая, отображающая этот график, называется изотермой. Изотерма, соответствующая более высокой температуре, будет лежать выше на графике зависимости давления от объема, поскольку при повышении температуры при постоянном объеме, повышается давление. Отметим на графике две произвольные точки 1 и 2. Точке 1 будут соответствовать давление Р1 и объем V1. Аналогично, точке 2 будут соответствовать давление Р2 и объем V2. Тогда мы можем записать, что
Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изотерме.
Надо сказать, что для осуществления изотермического процесса, сжатие или расширение газа должно происходить очень медленно.
Теперь поговорим об изобарном процессе. Запишем снова уравнение состояния идеального газа и рассмотрим его при условии, что давление и количество вещества постоянно:
Соответственно, следующий газовый закон звучит так: для газа данной массы при постоянном давлении отношение объема к температуре постоянно. Этот закон открыл Жозеф Гей-Люссак, поэтому, газовый закон, соответствующий постоянному давлению, называется законом Гей-Люссака.
Если мы выразим объем через температуру, то придем к линейной зависимости:
Поэтому, график зависимости объема от температуры при постоянном давлении является прямой линией. Эта линия называется изобарой.
Изобара, соответствующая бо́льшему давлению, лежит ниже изобары, соответствующей меньшему давлению, поскольку с ростом давления объем газа уменьшается при постоянной температуре. Опять же, если мы отметим на графике две произвольные точки 1 и 2, то им будут соответствовать значения V1, T1 и V2, T2. Тогда можем записать, что
Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изобаре. Обратите внимание, что точки изобары вблизи абсолютного нуля обозначаются пунктиром. Дело в том, что, во-первых, абсолютный ноль недостижим, а во-вторых, при таких низких температурах, данный газовый закон перестает выполняться.
Для осуществления изобарного процесса, нужно нагревать газ, помещенный в цилиндр с подвижным поршнем (при условии, что внешнее давление постоянно).
Наконец, давайте поговорим об изохорном процессе. В этом случае, мы рассматриваем уравнение состояния идеального газа при постоянной массе и объеме:
Исходя из этого, можно заключить следующее: для газа данной массы при постоянном объеме отношение давления к температуре постоянно. Этот закон был открыт Жаком Шарлем и, соответственно, называется законом Шарля. Если теперь мы выразим давление через температуру, то опять же придем к линейной зависимости:
То есть, график зависимости давления от температуры будет являться прямой линией. Эта линия называется изохорой.
Изохора, соответствующая большему объему, лежит ниже изохоры, соответствующей меньшему объему, поскольку с ростом объема падает давление при постоянной температуре. Мы снова можем взять произвольные точки на графике. Тогда
Подобное равенство будет выполняться для любой пары точек, принадлежащих одной и той же изохоре. Изохоры вблизи абсолютного нуля обозначаются пунктиром, опять же из-за того, что данный закон перестает выполняться при абсолютном нуле.
Изохорный процесс проще всего осуществить технически: нужно взять какую-либо герметичную емкость. С нагреванием газа в этой емкости давление будет увеличиваться прямо пропорционально температуре. Именно этот закон лежит в основе создания газового термометра.
Как вы видите, все газовые законы являются частными случаями уравнения состояния идеального газа. На самом деле, сначала был открыт закон, соответствующий изотермическому процессу. В 1662 году его открыл Роберт Бойль и независимо от него в 1676 году этот закон заново открыл Эдм Мариотт. Спустя более ста лет, а точнее, в 1787 году, Жак Шарль открыл закон, соответствующий изохоному процессу. Позднее, в 1802 году Гей-Люссак открыл закон, соответствующий изобарному процессу. Наконец, в 1834 году, КлапейрОн, основываясь на газовых законах, вывел свое уравнение состояния идеального газа для постоянной массы. А через 40 лет, в 1874 году, Менделеев преобразовал это уравнение для произвольной массы газа. Но сегодня мы, так сказать, пошли в обратном направлении: от общего к частному.
Примеры решения задач.
Задача 1. Газ изотермически расширяется от объёма, равного 1 л до объёма, равного 3 л. Если начальное давление газа было равно 360 кПа, то каким станет его давление, когда газ закончит расширяться?
Задача 2. На графике показан некий процесс, происходящий с кислородом, масса которого 20 г. Определите объём газа, соответствующий указанной на графике точке.
Читайте также:

