Физические и химические свойства бензола конспект урока
Обновлено: 05.07.2024
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Бензол: физические и химические свойства, получение и применение
I. Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Таблица. Физические свойства некоторых аренов
Бензол – легкокипящая (t кип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
II. Получение аренов (бензола и его гомологов)
1. В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
2. Реакция Вюрца-Фиттинга: (здесь Г – галоген)
С6H5-Г + 2Na + R-Г → C6H5-R + 2NaГ
2. В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:

2. Тримеризация ацетилена (только для бензола) – реакция Зелинского

3. Дегидрированием циклогексана и его гомологов
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов)

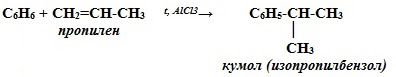
4. Алкилирование бензола (получение гомологов бензола) – реакция Фриделя-Крафтса
III. Химические свойства аренов
I. Реакции окисления
1. Горение (коптящее пламя):
Видео-опыт: “ Горение бензола ”
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
а) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
б) в нейтральной и слабощелочной до солей бензойной кислоты
II. Реакции присоединения (труднее, чем у алкенов)
1. Галогенирование

2. Гидрирование

3. Полимеризация
III. Реакции замещения – ионный механизм (легче, чем у алканов)
1. Галогенирование
a) бензола

б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
в) гомологов бензола в присутствии катализатора
2. Нитрование (с азотной кислотой)

2,4,6-тринитротолуол (тол, тротил)
IV. Применение бензола и его гомологов
Бензол C6H6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C6H5NO2 (растворитель, из него получают анилин), хлорбензола C6H5Cl, фенола C6H5OH, стирола и т.д.
Толуол C6H5–CH3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C6H4(CH3)2. Технический ксилол – смесь трех изомеров (орто-, мета- и пара-ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C6H5–CH(CH3)2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле атомов Н атомами хлора – гексахлорбензол С6Сl6 – фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против твердой головни. Продукт присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С6Н6Сl6 – инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества относятся к пестицидам – химическим средствам борьбы с микроорганизмами, растениями и животными.
Стирол C6H5 – CH = CH2 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
V. Тренажеры
ЦОРы
Видео-опыт: “ Горение бензола ”
Видео-опыт: “ Бромирование бензола ”
Видео-опыт: “ Нитрование бензола ”
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Тема: Физические и химические свойства бензола.
Цель и задачи урока: - систематизировать знания учащихся о строении
молекулы бензола, о способах его получения;
- сформировать представление о физических и
химических свойствах бензола, научить составлять
уравнения химических реакций, характерных для
- продолжить формирование умений учащихся
работать с видеоматериалами и мультимедийными
Формы работы: фронтальная, индивидуальная.
1. Организационный момент.
Учитель: Тема, цели, и задачи урока.
1. Активизация знаний учащихся.
1. Фронтальный опрос .
· Ароматические углеводороды – АРЕНЫ
· Дайте определение ароматическим углеводородам.
· Почему их называют ароматическими?
· Типичным представителем ароматических углеводородов является .
· С чьими именами связано происхождение бензола?
· Какова молекулярная формула бензола?
· Сколько структурных формул бензола?
· Какие связи в молекуле бензола и скольких?
· Важнейшие источники получения ароматических углеводородов?
· Другие методы получения?
· Назовите гомологов бензола.
2. Самостоятельная работа учащихся (на 5-7 минут). (Слайд 5).
· заполните пропуски в определении ароматических углеводородов;
· напишите формулы заданных веществ;
· закончите уравнения реакций получения ароматических углеводородов.
1. Изучение нового материала.
1. Физические свойства бензола.
Бензол – бесцветная, летучая, огнеопасная жидкость с неприятным запахом. Он легче воды ( =0,88 г/см3) и с ней не смешивается, но растворим в органических растворителях, и сам хорошо растворяет многие вещества. Бензол кипит при 80,1 С, при охлаждении легко застывает в белую кристаллическую массу. Бензол и его пары ядовиты. Систематическое вдыхание его паров вызывает анемию и лейкемию.
- Видеоматериал (физические свойства бензола).
2. Химические свойства бензола.
1) Химические свойства бензола определяется строением его молекулы.
2) Ароматическая π-система обладает повышенной устойчивостью.
3) Поэтому хотя бензол является непредельным углеводородом, он проявляет свойства, характерные для предельных (склонность к реакциям замещения, устойчивость к действию окислителей).
Реакции замещения.
- видеоматериал (бромирование бензола)
С6Н6 + НО-NO2 C6H5-NO2 + H2O
в) алкилирование – замещение атома водорода в бензольном кольце на углеводородный радикал
С6Н6 + СН3-СI C6H6-CH3 + HCI
Реакции присоединения
При определенных условиях бензол может вступать и в реакции присоединения. В этих реакциях разрушается ароматическая система, поэтому для их протекания требуется жесткие условия.
С6Н6 + 3Н2 С6Н12
С6Н6 + 3СI2 C6H6CI6
- видеоматериал (хлорирование бензола)
Реакции окисления .
а) отношение бензола к бромной воде и к перманганату калия (видеоматериал)
б) горение бензола
1. Закрепление.
1. Бензол реагирует с каждым веществом набора:
Напишите уравнения реакций бензола с веществами этого набора, укажите условия их протекания.

Цель: сформировать представление обучающихся о строении бензола, познакомить с его физическими и химическими свойствами, способами получения и рассмотреть применение бензола.
Задачи:
- образовательные: обеспечение усвоения обучающимися основных понятий темы: бензол, реакция присоединения, реакции замещения, реакция тримеризация ацетилена.
- развивающие: развитие химического языка, обучение составлению уравнений химических реакций для бензола, навыков работы с компьютером.
- воспитательные: привитие познавательного интереса к химии, развитие мыслительной деятельности и познавательной активности.
Оборудование: мультимедиа, компьютеры.
Методы: наглядно – иллюстративный, эвристический.
Формы: фронтальная беседа, вопросно – ответная форма, индивидуальная,
Мы с вами уже изучили предельные углеводороды - алканы, непредельные углеводороды - алкены, алкадиены, алкины. Сегодня мы с вами познакомимся с ароматическими углеводородами или аренами. Определите симантику слову ароматические (аромат). Дайте лексическое значение слову аромат. Почему эти вещества названы ароматическими? Ароматическими эти углеводороды были названы потому, что первые известные представители их обладали приятным запахом. Позднее оказалось, что большинство веществ, которые принадлежат к этой группе не имеют ароматного запаха. Однако исторически сложившееся название этих соединений осталось. Простейший и самый важный представитель ароматических углеводородов – бензол. Мы познакомимся со строением, изучим удивительные свойства бензола, узнаем о его применение в народном хозяйстве, посмотрим занимательные опыты.
III. Изучение нового материала.
1. Понятие об аренах.
Арены – углеводороды с общей формулой CnH2n-6, молекулы которых, содержат бензольное кольцо. Молекулярная формула бензола C6H6А теперь давайте рассмотрим историю его открытия. Слушая мой рассказ и просматривая слайды сделайте краткий конспект истории открытия бензола.
2. История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа
В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)
Проверим ваши конспекты.
Мы узнали о истории его открытии теперь посмотрим какое же строение имеет молекула бензола
Строение молекулы бензола.
В 1865г. Кекуле предложил структурную формулу бензола.
Как вы видите, молекула соответствующая формуле Кекуле, содержит двойные связи, следовательно для него характерны должны качественные реакции на кратные связи.
А какие качественные реакции характерны для алкенов и алкинов? (Обесчвечивание перманганата калия и бромной воды)
Но бензол не обесчвечивает перманганата калия и бромную воду. Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензола.
В настоящее время бензол обозначают или формулой Кекуле или что наиболее логично шестиугольником, в котором изображают окружность. Молекула бензола имеет циклическое строение.
Гомологи бензола.
А теперь познакомимся с гомологами бензола. Какие вещества называют гомологами? (это вещества, сходные по составу и свойствам и отличающиеся на одну или более групп - CH2)
Следующий момент урока – получение бензола.
4. Получение бензола.
Бензол получают из каменноугольной смолы, образующейся при коксовании угля.
В настоящее время бензол получают из нефти.
Бензол получают синтетическими методами.
Одним из синтетических способов - тримеризация ацетилена.
Теперь посмотрим какими же физическими свойствами обладает это вещество.
5. Физические свойства.
По ходу моего рассказа запишите основные свойства.
· Бензол представляет собой бесцветную жидкость с температурой кипения +80ºС и температурой плавления + 5ºС.
· Он обладает характерным запахом, токсичен.
· Легче воды и не растворяется в ней.
Что вы для себя отметили.
Рассмотрев физические свойства бензола можно перейти к изучению химических свойств.
6. Химические свойства.
1. Бензол горит. (Просмотр опыта) Пламя бензола коптящее из-за высокого содержания углерода в молекуле.
2 C6 H6 + 15 O2 → 12CO2 + 6H2O
Расставьте коэффициенты в уравнении.
Из-за особенного строения молекулы, бензол занимает как бы промежуточное положение между алканами иалкенами, т.е. может вступать в реакции присоединения, так и в реакции замещения. Однако, в отличие от алканов, реакции замещения с бензолом протекают легче, а реакции присоединения – труднее, чем у алкенов.
2. Реакции замещения в бензоле протекают легче, чем в алканах.
а) реакция галогенирования (просмотр опыта).
А теперь сами напишите как бензол будет реагировать с хлором.
б) реакция нитрования – взаимодействие с азотной кислотой.
Нитробензол – исходное соединение для получения анилина.
3. Реакции присоединения в бензоле протекают труднее, чем в алкенах.
а) реакция гидрирования
б) реакция хлорирование.
Несмотря на высокую непредельность молекулы бензола (по составу), он не дает характерных, качественных реакций для непредельных углеводородов: не обесцвечивает бромную воду и раствор перманганата калия.
Это связано с особым строением молекулы бензола.
Какие реакции характерны для бензола?
А теперь узнаем где находит применение бензол
7. Применение бензола.
1-добавка к бензину;
IV. Закрепление.
Проверить полученные на уроке знания предлагаю, вам с помощью комбинированного задания I группа работает с тестом (см. приложение), II группа решает задачу.
Задача
Из 7,8 г бензола получено 8,61 г нитробензола. Определите выход (в%) продукта реакции.
7,8г 8,61 г
C6H6 + HNO3 → C6H5NO2 + H2O
n = 1 моль n = 1 моль
M = 78 г/моль M = 123 г/моль
m = 78 г m = 123г
7,8 г/78 г = х/123г
х = 7,8 *123 / 78 = 12,3 г
V. Рефлексия.
Чтобы урок остался в памяти, выскажите свое мнение, продолжив предложение. На уроке я узнала, что….
Арены. Бензол
Цель: сформировать представление обучающихся о строении бензола, познакомить с его физическими и химическими свойствами, способами получения и рассмотреть применение бензола.
- образовательные: обеспечение усвоения обучающимися основных понятий темы: бензол, реакция присоединения, реакции замещения, реакция тримеризация ацетилена.
- развивающие: развитие химического языка, обучение составлению уравнений химических реакций для бензола, навыков работы с компьютером.
- воспитательные: привитие познавательного интереса к химии, развитие мыслительной деятельности и познавательной активности.
Оборудование: мультимедиа, компьютеры.
Методы: наглядно – иллюстративный, эвристический.
Формы: фронтальная беседа, вопросно – ответная форма, индивидуальная,
Организационный момент.
Мотивация учащихся.
Мы с вами уже изучили предельные углеводороды - алканы, непредельные углеводороды - алкены, алкадиены, алкины. Сегодня мы с вами познакомимся с ароматическими углеводородами или аренами. Определите симантику слову ароматические (аромат). Дайте лексическое значение слову аромат. Почему эти вещества названы ароматическими? Ароматическими эти углеводороды были названы потому, что первые известные представители их обладали приятным запахом. Позднее оказалось, что большинство веществ, которые принадлежат к этой группе не имеют ароматного запаха. Однако исторически сложившееся название этих соединений осталось. Простейший и самый важный представитель ароматических углеводородов – бензол. Мы познакомимся со строением, изучим удивительные свойства бензола, узнаем о его применение в народном хозяйстве, посмотрим занимательные опыты.
III. Изучение нового материала.
1. Понятие об аренах.
Арены – углеводороды с общей формулой CnH2n-6, молекулы которых, содержат бензольное кольцо. Молекулярная формула бензола C6H6А теперь давайте рассмотрим историю его открытия. Слушая мой рассказ и просматривая слайды сделайте краткий конспект истории открытия бензола.
2. История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа
В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)
Проверим ваши конспекты.
Мы узнали о истории его открытии теперь посмотрим какое же строение имеет молекула бензола

Строение молекулы бензола.
В 1865г. Кекуле предложил структурную формулу бензола.
Как вы видите, молекула соответствующая формуле Кекуле, содержит двойные связи, следовательно для него характерны должны качественные реакции на кратные связи.
А какие качественные реакции характерны для алкенов и алкинов? (Обесчвечивание перманганата калия и бромной воды)
Но бензол не обесчвечивает перманганата калия и бромную воду. Пытаясь объяснить эти несоответствия , многие ученые предлагали различные варианты структуры бензола.
В настоящее время бензол обозначают или формулой Кекуле или что наиболее логично шестиугольником, в котором изображают окружность. Молекула бензола имеет циклическое строение.
Гомологи бензола.
А теперь познакомимся с гомологами бензола . Какие вещества называют гомологами? (это вещества, сходные по составу и свойствам и отличающиеся на одну или более групп - CH2)

Следующий момент урока – получение бензола.
4. Получение бензола.
Бензол получают из каменноугольной смолы, образующейся при коксовании угля.
В настоящее время бензол получают из нефти.
Бензол получают синтетическими методами.
Одним из синтетических способов - тримеризация ацетилена.
Теперь посмотрим какими же физическими свойствами обладает это вещество.
5. Физические свойства.
По ходу моего рассказа запишите основные свойства.
Бензол представляет собой бесцветную жидкость с температурой кипения +80ºС и температурой плавления + 5ºС.
Он обладает характерным запахом, токсичен.
Легче воды и не растворяется в ней.
Что вы для себя отметили.
Рассмотрев физические свойства бензола можно перейти к изучению химических свойств.
6. Химические свойства.
1. Бензол горит. (Просмотр опыта) Пламя бензола коптящее из-за высокого содержания углерода в молекуле.
Расставьте коэффициенты в уравнении.
Из-за особенного строения молекулы, бензол занимает как бы промежуточное положение между алканами иалкенами, т.е. может вступать в реакции присоединения, так и в реакции замещения. Однако, в отличие от алканов, реакции замещения с бензолом протекают легче, а реакции присоединения – труднее, чем у алкенов.
2. Реакции замещения в бензоле протекают легче, чем в алканах.
а) реакция галогенирования (просмотр опыта).
А теперь сами напишите как бензол будет реагировать с хлором.
б) реакция нитрования – взаимодействие с азотной кислотой.
Нитробензол – исходное соединение для получения анилина.
3. Реакции присоединения в бензоле протекают труднее, чем в алкенах.
а) реакция гидрирования
б) реакция хлорирование.
Несмотря на высокую непредельность молекулы бензола (по составу), он не дает характерных, качественных реакций для непредельных углеводородов: не обесцвечивает бромную воду и раствор перманганата калия.
Это связано с особым строением молекулы бензола.
Какие реакции характерны для бензола?
А теперь узнаем где находит применение бензол
7. Применение бензола.
1-добавка к бензину;
IV. Закрепление.
Проверить полученные на уроке знания предлагаю, вам с помощью комбинированного задания I группа работает с тестом (см. приложение), II группа решает задачу.
Из 7,8 г бензола получено 8,61 г нитробензола. Определите выход (в%) продукта реакции.
n = 1 моль n = 1 моль
M = 78 г/моль M = 123 г/моль
m = 78 г m = 123г
7,8 г/78 г = х/123г
х = 7,8 *123 / 78 = 12,3 г
V. Рефлексия.
Чтобы урок остался в памяти, выскажите свое мнение, продолжив предложение. На уроке я узнала, что….
урок по теме"Свойства и применение бензола" -урок изучения и первичного закрепления знания учащихся о бензоле и его гомологах.
Содержимое разработки

Тема урока: Свойства и применение аренов.
Цель: Дать понятие учащимся о свойствах и применении аренов.
Образовательные:
Сформировать знания учащихся о свойствах и применении (с использованием компьютерной презентации на тему: “Свойства и применения аренов ”), на примере толуола дать представление о взаимном влиянии атомов и групп атомов в молекулах органических веществ.
Продолжить формирование умений решать расчетные задачи различных типов.
Развивающие:
Развивать наблюдательность, память (при просмотре компьютерной презентации, при изучении свойств и применении аренов).
Развивать умение сравнивать (например, сравнение свойств гомологов аренов).
Научить учащихся обобщать и делать выводы.
Воспитательные:
Продолжить формирование диалектико-материалистического мировоззрения на основе представлений о применении ароматических углеводородов.
Методы ведения урока:
Словесные (беседа, объяснение, рассказ).
Наглядные (компьютерная презентация, плакат по строению ароматических углеводородов).
Практические (демонстрация видеоопытов, составление моделей молекул)
Тип урока: Комбинированный.
I .Организационный момент. ( на экране 1 слайд презентации с названием темы урока)

II. Актуализация знаний, умений и навыков:
Беседа по вопросам:
Учитель: .Что такое ароматические углеводороды? Какие виды ароматических углеводородов можно выделить?
(Арены – это углеводороды с общей формулой СnH2n-6, в молекулах которых содержится хотя бы одно бензольное кольцо. Существуют несколько основных видов аренов: 1. Моноциклические арены, 2. Арены, содержащие два или несколько изолированных цикла, 3. Арены с сопряженными циклами (сопряженные и конденсированные))
Далее знакомлю учащихся с происхождением термина “ароматические соединения”. Сообщаю, что это название возникло в начальный период развития химии. Было замечено, что соединения бензольного ряда получаются при перегонке некоторых приятно пахнущих (ароматических) веществ – природных смол и бальзамов. Однако большинство ароматических соединений не имеют запаха или пахнут неприятно. Но данный термин сохранился в химии. Учитель: Да, вы правы (слайд 2, 3)
Учитель: Каково строение бензола?
Ученик выходит к доске и рассказывает о строении бензола (Демонстрация плаката по строению бензола). Учащийся рассказывает о строении бензола по плакату(слайд 4)
Вызываю к доске 3-х учеников.
соберите модели молекул:
Б) метилбензола (толуола)
В) 1, 4 диметилбензола (п-ксилола)


Какие вещества называют гомологами бензола? (слайд5)
Вызываю 2-х учеников для решения задач о гомологах бензола.
1.Чему равна масса ароматического углеводорода, содержащего 12 атомов водорода? Предложите две различные структурные формулы этого арена и назовите их.
2.Определите молекулярную формулу ароматического углеводорода, молекулярная масса которого равна 134. Предложите две различные структурные формулы этого арена и назовите их.
В это время предлагаю учащимся класса решить задачи в тетради. (слайд 6)
(Определите количество вещества
1, 2-диметилбензола, масса которого равна 212г.(ответ:2моль)
Определите массу этилбензола, количество вещества которого составляет 0,5моль.(ответ: 53г)
Проверяем выполнение заданий.
Решение расчетных задач на получение аренов.(3 ученика)
Какой объем ацетилена (при н.у.) потребуется для получения 156 г бензола?
Какую массу бензола можно получить в результате дегидрирования циклогексана массой 336г?(Отв: 312г)
Какую массу бензола можно получить в результате дегидрирования гексана массой
172 г? (отв:156г)


Вспомним теперь способы получения аренов(слайды 7-11)
Подвожу итоги опроса.
III. Изучение нового материала:
Физические свойства аренов.(слайд 12)
(Демонстрация образцов ароматических углеводородов: бензола, толуола ксилола, стирола, нафталина)
Учитель: Рассказ о физических свойствах аренов. В обычных условиях низшие арены - бесцветные жидкости, с характерным запахом. Они не растворимы в воде, но хорошо растворимы в неполярных растворителях: эфире, четыреххлористом углероде, лигроине.
Обращаю внимание учащихся на то, что бензол является сильно токсичным веществом. Вдыхание его паров вызывает головокружение и головную боль. При высоких концентрациях бензола возможны случаи потери сознания. Его пары раздражают глаза и слизистую оболочку.
Жидкий бензол легко проникает в организм через кожу, что может привести к отравлению. Поэтому работа с бензолом и его гомологами требует особой осторожности.
Рассказываю о вреде курения. Исследования дёгтеобразного вещества, полученного из табачного дыма, показали, что в нём содержатся, помимо никотина, ароматические углеводороды типа бензпирена, обладающие сильными канцерогенными свойствами, Канцерогенами называются химические вещества, воздействие которых достоверно увеличивает частоту возникновения опухолей или сокращает период их развития у человека или животных, т. е. эти вещества действуют как возбудители рака. Показано, что около 90% случаев рака лёгких есть следствие неумеренного курения. Табачный дёготь при попадании на кожу и в лёгкие вызывает образование раковых опухолей. Курильщики чаще заболевают раком губы, языка, гортани, пищевода. Они намного чаще страдают стенокардией, инфарктом миокарда. Отмечаю, что около 50% ядовитых веществ курильщик выделяет в окружающее пространство, создавая вокруг себя кольцо “пассивных курильщиков”, у которых быстро появляется головная боль, тошнота, общее недомогание, а затем могут развиваться и хронические заболевания.
Помимо этого бензол и его гомологи могут сами выступать в роли растворителей.
Химические свойства аренов (слайд 13)
Учитель: А теперь давайте с вами разберем, какие же химические свойства характерны для веществ класса “Арены”. (Учитель ставит перед учащимися проблему: вспомнив строение аренов сделать предположение об их реакционной способности. Ученики, исходя из строения бензола, предполагают, какие свойства характерны для класса аренов).
Учитель: Для разрыва ароматической системы аренов необходимо затратить большую энергию, поэтому арены вступают в реакции присоединения только в жестких условиях: при значительном повышении температуры или в присутствии очень активных реагентов. В связи с этим, наиболее характерными для них будут реакции замещения атомов водорода, протекающие с сохранением ароматической системы.
Учащиеся записывают в тетрадь все реакции характерные для бензола и его гомологов.

Демонстрация 16слайда презентации “Реакция нитрования бензола”
Обсуждаем вопрос: почему при нитровании бензола происходит замещение только одного атома водорода на нитрогруппу, а при нитровании толуола на нитрогруппы замещаются три атома водорода? ( Это объясняется влиянием метильного радикала на бензольное кольцо. Метильная группа смещает плотность связи от себя. В результате смещения электронной плотности от метильной группы в сторону бензольного кольца в положениях 2. 4, 6 электронная плотность в бензольном кольце увеличивается и атомы водорода легче ступают в реакции замещения)
Реакции присоединения (слайд 18).
Реакции присоединения в ароматических углеводородах проходят в более жестких условиях, чем у ненасыщенных углеводородов.
Демонстрация 18 слайда презентации “Гидрирование бензола”
Демонстрация 19 слайда презентации “Хлорирование бензола”
Бензол устойчив к действию окислителей, в обычных условиях он не обесцвечивает раствор перманганата калия.
Демонстрация 21 слайда презентации “Горение бензола”

В этом случае уже бензольное кольцо так влияет на метильный радикал. Что в нем, по сравнению например с СН4 электронная плотность связей уменьшается и под действием такого сильного окислителя, как перманганат калия, метильная группа окисляется и превращается в карбоксильную группу СООН)
Таким образом, мы с вами видим, что не только метильная группа может оказывать влияние на бензольное кольцо, но и бензольное кольцо оказывает влияние на метильную группу, т.е. группы атомов в молекуле оказывают взаимное влияние друг на друга.
Ученик получает на предыдущем уроке опережающее задание и рассказывает о применении бензола с использованием презентации (слайд 25)
Обобщение нового материала.
Учитель: Итак, мы с вами разобрали класс ароматических углеводородов, узнали об их особенностях, об их получении, свойствах и применении.
V. Домашнее задание (слайд 26)
Выучить параграф 5.3

IV. Закрепление изученного материала
Учитель: Ну, что же вы сегодня очень хорошо работали, теперь давайте еще раз вспомним, все то, о чем мы с вами говорили. А помогут нам в этом тесты. Учащиеся получают тесты.
Читайте также:

