Альдегиды и кетоны конспект лекции
Обновлено: 03.07.2024
учащиеся должны рассмотреть строение молекул альдегидов и кетонов, их номенклатуру и виды изомерии.
Изучить особенности строения карбонильной группы
Изучить химические свойства альдегидов.
Рассмотреть способы получения альдегидов и кетонов
учащиеся должны сформировать умения использовать химическую терминологию
совершенствовать умения обобщать, делать выводы, анализировать, сравнивать, устанавливать причинно-следственную зависимость между составом, строением и свойствами веществ.
учащиеся должны убедиться на примере генетической связи органических веществ разных гомологических рядов о единстве материального мира
совершенствовать информационно- познавательную компетенцию
Методы и методические приемы:
объяснение нового материала с демонстрацией опытов
Знать: строение молекул альдегидов и кетонов, их функциональные группы; сходство и различие в свойствах альдегидов и кетонов; о токсичности действия альдегидов и кетонов на живые организмы.
Уметь : составлять структурные формулы альдегидов и кетонов; называть альдегиды по рациональной и систематической номенклатуре; составлять уравнения реакций, характеризующих свойства альдегидов.
Межпредметные и внутрипредметные связи:
химия (О.С. Габриелян Тема: Спирты §17 стр. 138).
Оборудование и реактивы:
О.С. Габриелян учебник по химии 10 класс
Для ДО: раствор AgNO 3 , раствор NaOH, раствор NH 4 OH, формальдегид, спиртовка, раствор CuSO 4 , штатив с пробирками
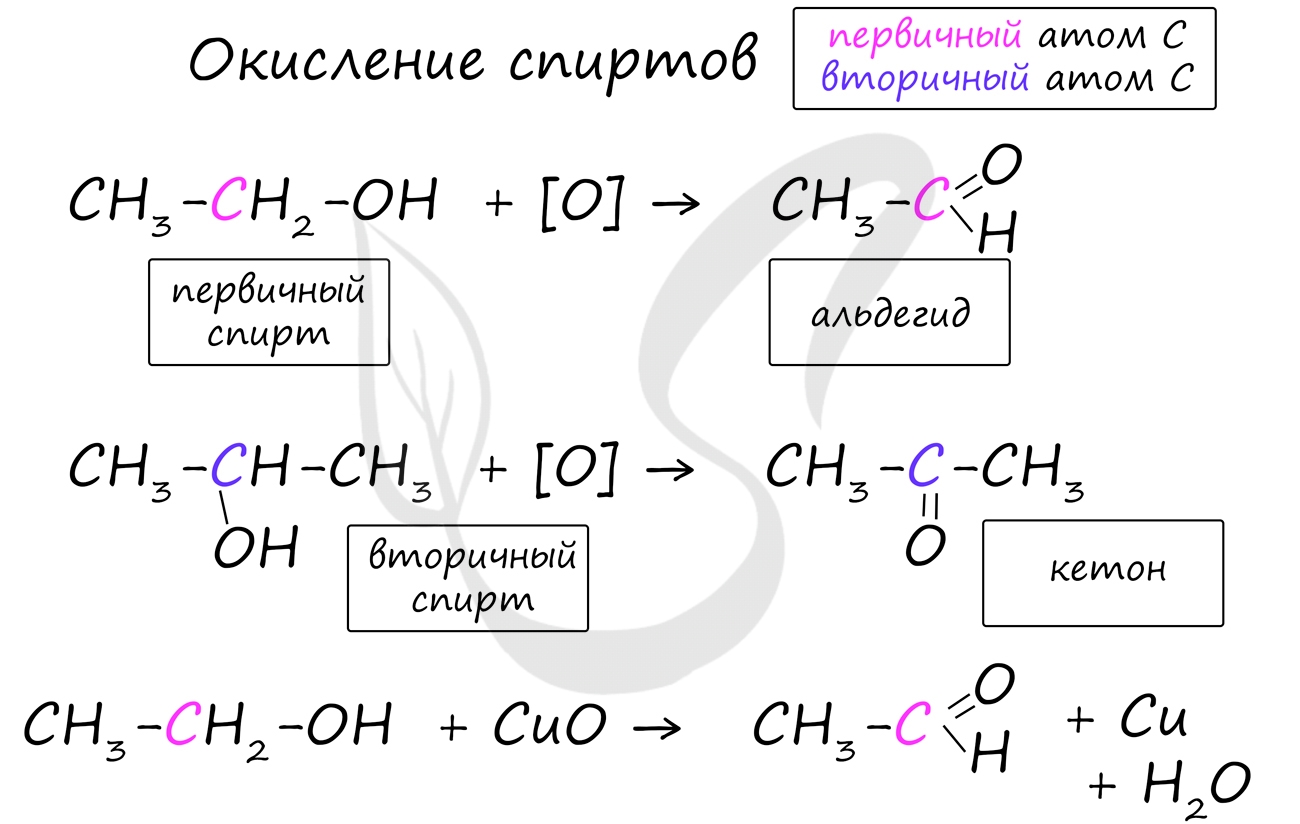
Впервые с альдегидами вы познакомились в 9 классе и упоминали их пр изучении спиртов, когда при окислении первичного спирта вы получили альдегид.
C 2 H 5 OH + CuO CH 3 COH + H 2 O + Cu
Пришло время подробнее познакомиться с этим классом органических веществ.
Изучать данный класс соединений мы будем по следующему плану:
Номенклатура и изомерия
Общая формула альдегидов C n H 2n O

– органические вещества, молекулы которых содержат функциональную группу -СО (карбонильную), связанную с атомами водорода и углеводородным радикалом.

– органические вещества, молекулы которых содержат карбонильную группу – СО, связанную с двумя углеводородными радикалами.

Альдегиды классифицируют в зависимости от насыщенности углеводородного заместителя:

непредельные - акролеин (пропаналь)

ароматические - бензальдегид
В соответствии с номенклатурой названия предельных альдегидов образуются из названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса – аль.
Перед вами алгоритм составления названий, для альдегидов и кетонов.
Алгоритм составления названий альдегидов
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
Назовите соединение по алгоритму для углеводородов.
В конце названия допишите суффикс -аль.
Алгоритм составления названий кетонов
1. Пронумеровать самую длинную углеродную цепь, начиная с того конца, где ближе карбонильная группа.
2. Указать положение радикала и его название.
3. Назвать углеводород.
4. Принадлежность к классу кетоны указать суффиксом он .
5. Указать положение функциональной группы
Кроме систематического названия у альдегидов и кетонов также есть тривиальные названия. Запишем самые основные:
HCHO метаналь (формальдегид, муравьиный альдегид)
CH 3 CHO этаналь (ацетальдегид, уксусный альдегид)
CH 3 CH 2 CHO пропаналь (пропионовый альдегид)
CH 3 CH 2 CH 2 CHO бутаналь (масляный альдегид)
CH 3 —CO—CH 3 пропанон (ацетон)
CH 3 —CO—CH 2 CH 3 бутанон (метилэтилкетон)
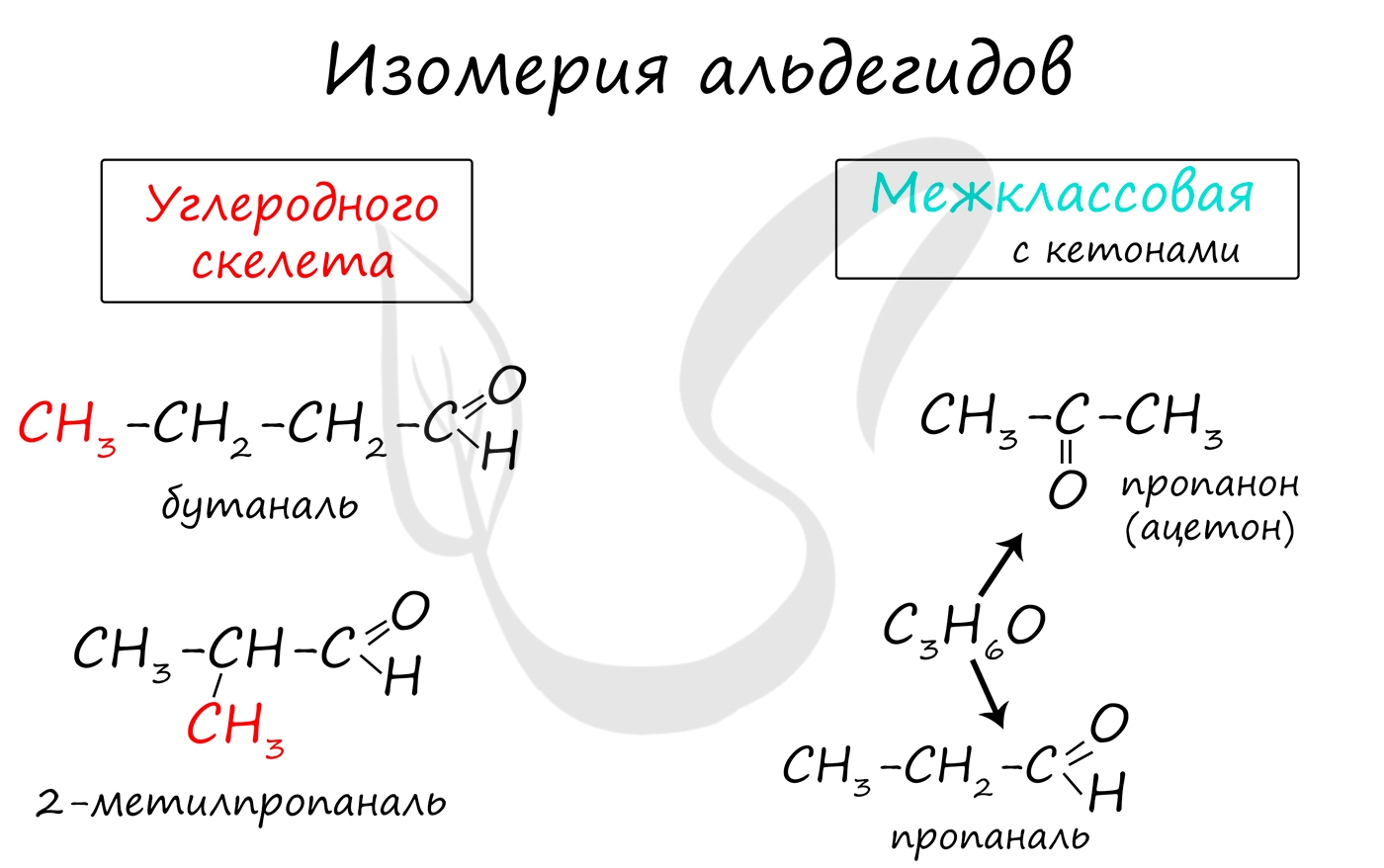
Для альдегидов характерна только изомерия углеродного скелета, которая возможно с бутаналя.
- изомерия углеродного скелета
- изомерия положения карбонильной группы
- межклассовая изомерия (пропаналь и пропанон)
На них мы останавливаться не будем, скажу лишь, что между молекулами у альдегидов не возникают водородные связи, метаналь – газ (далее жидкости, высшие альдегиды – твердые).

HCHO + H 2 CH 3 OH

CH 3 —CO—CH 3 + H 2 CH 3 —CH(OH)—CH 3
Альдегид – первичный спирт
Кетон – вторичный спирт
CH 3 COH + HCN = CH 3 CHC(OH)N
Присоединение NaHSO 3 – эта реакция позволяет не только обнаружить альдегиды, но и выделить их из смеси с другими веществами.
CH 3 COH + NaHSO 3 = CH 3 CH(OH)SO 3 Na
Прежде чем записать данную реакцию, давайте проведем опыт и получим сами зеркало. Для этого нам понадобится 4-5 мл AgNO 3 , 2-3 капли NaOH, 5-8 капель NH 4 OH, формальдегид, нагреем немного данную смесь. Что мы заметили?
Запишем уравнение реакции
CH 3 CHO + Ag 2 O 2Ag + CH 3 COOH
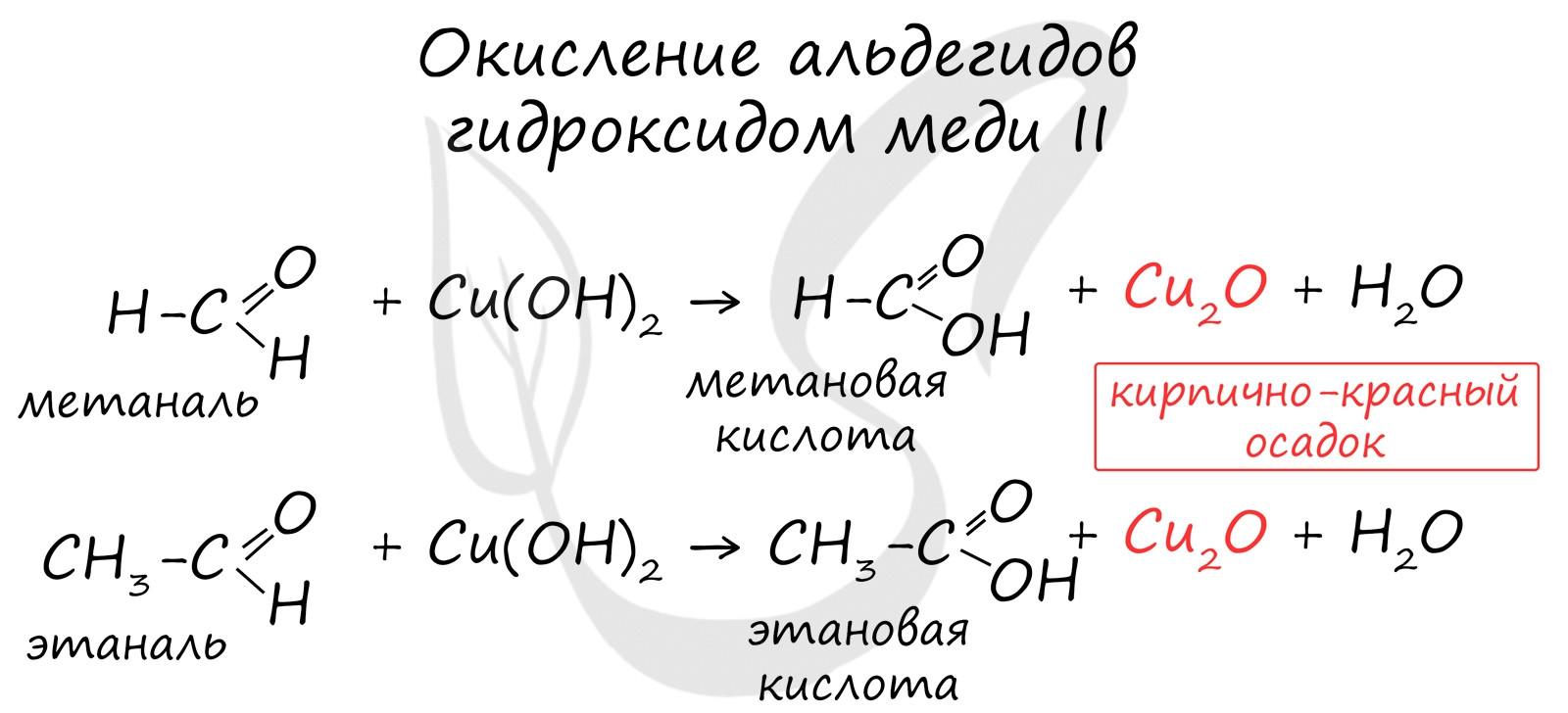
реакция взаимодействия с Cu(OH) 2 , качественная реакиця на альдегиды.
Проведем опыт, взяв 2-3 капли CuSO 4, 2- 3 капли NaOH и формальдегид, подогреем данную смесь. Что можно наблюдать? (осадок кирпично – красного цвета, медь восстанавливается в одноокись меди)
HCHO + 2Cu(OH) 2 2H 2 O + Cu 2 O + HCOOH
Реакция полимеризации и поликонденсации


CH 3 OH + CuO HCHO + Cu + H 2 O

CH 3 —CH(OH)—CH 3 + [O] CH 3 —CO—CH 3 + H 2 O
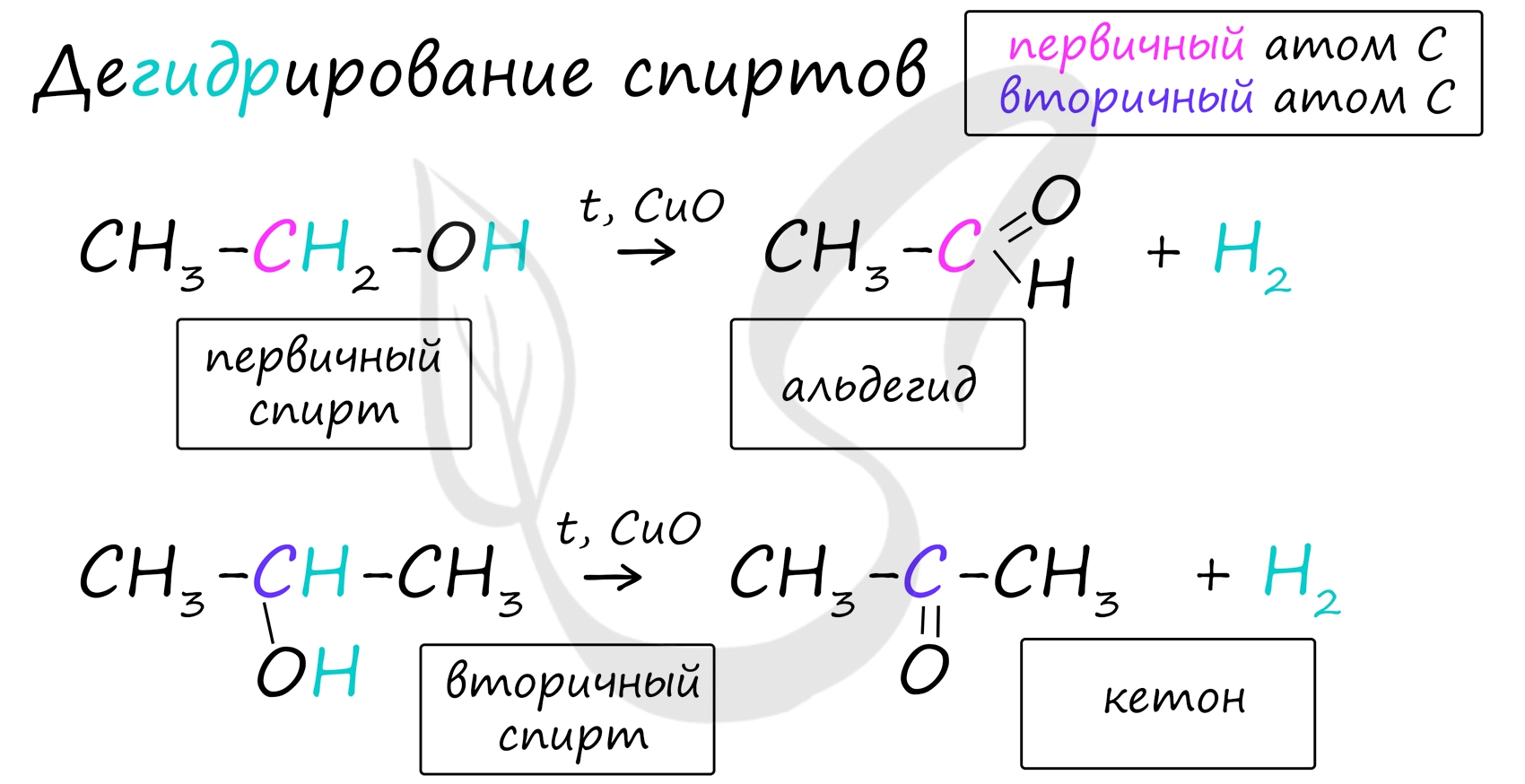
Дегидрирование спиртов (отщепление водорода)

CH 3 CH 2 OH CH 3 CHO + H 2

CH 3 —CH(OH)—CH 3 CH 3 —CO—CH 3 + H 2
реакция Кучерова (гидратация ацителена)

C 2 H 2 + H 2 O CH 3 CHO
CH 3 CHCl 2 + 2NaOH = CH 3 COH + NaCl + H 2 O
На этом наша лекция окончена. А теперь я предлагаю вам выполнить ряд заданий:
Назовите альдегид по международной номенклатуре:

Назовите альдегид по международной номенклатуре:

Назовите альдегид по международной номенклатуре:

№ 2 Какой объем формальдегда необходимо подвергнуть гидрированию для получения 16 г метилового спирта?
№ 3 Напишите структурные формулы следующих соединений:
3 – гидрокси – 4 – метилгексаналь
В.Г. Денисов Химия для учащихся 11 классов и поступающих в вузы. Тренажеры и тесты - Волгоград, 2007
Химия для любознательных 2-е издание – Л.: Химия, 1985

Химические свойства альдегидов
Алгоритм составления названий альдегидов
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
Назовите соединение по алгоритму для углеводородов.
В конце названия допишите суффикс -аль.
Алгоритм составления названий кетонов
1. Пронумеровать самую длинную углеродную цепь, начиная с того конца, где ближе карбонильная группа.
2. Указать положение радикала и его название.
3. Назвать углеводород.
4. Принадлежность к классу кетоны указать суффиксом он .
5. Указать положение функциональной группы
Похожие документы:
Альдегиды и кетоны
. после текста 1 – 7. Химия. Тема: Альдегиды и кетоны. Задание письменно: возможные изомеры для . свойства. Предел последовательности – 2 урока Данные видеоуроки можно посмотреть на . зачёту по социальной сфере. Параграф 20, 21 — читать, конспект. Выполнить .
Календарно тематический план по химии, 10 класс, профильный уровень Класс 10 класс
. , фенолах, альдегидах и кетонах. 1 Урок обобщения и применения знаний Решение расчетных и экспериментальных задач по теме. Знать: . и свойства пиридина, состав пиримидиновых оснований. Конспект урока 9 / 88. Пятичленные азотсодержащие гетероциклические .
Наименований школьной медиатеки
Темы лекций Кол-во аудиторных часов 1
. проработать соответствующие разделы курса по конспекту лекций и учебникам [1] . соединениями (диоксидом углерода, альдегидами, кетона). Реакция Гриньяра с . активная лексика урока. 3. Examinations and vacations. 4. Беседа по теме “Examinations .
Это соединения, содержащие в молекуле КАРБОНИЛЬНУЮ группу >C=O.
АЛЬДЕГИДАМИ называются органические соединения, содержащие карбонильную группу , в которой атом углерода связан с радикалом и одним атомом водорода. Общая формула альдегидов:
Исключение составляет муравьиный альдегид , в котором, как видно, R=H .
Общая формула для предельных альдегидов – С n H 2n O, n > 1
КЕТОНАМИ называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами. Общая формула кетонов:
Общая формула для предельных кетонов – С n H 2n O, n > 3
Номенклатура [соответствующий предельный углеводород + -аль ]
НСНО – метан аль (формальдегид, муравьиный альдегид)
СН 3 -СНО – этан аль (ацетальдегид, уксусный альдегид)
СН 3 -СН 2 -СНО – пропан аль (пропионовый альдегид)
ВИДЫ ИЗОМЕРИИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ.
- межклассовая изомерия с кетонами, начиная с С 3
- межклассовая изомерия с непредельными спиртами и простыми эфирами (с С 3 )
Строение карбонильной группы.
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибри-дизации и образует три σ -связи (одна из них – связь С–О ), которые расположены в одной плоскости под углом 120 о С друг к другу.
π - Связь образована р -электронами атомов углерода и кислорода.
Ввиду большей электроотрицательности атома кислорода по сравнению с атомом углерода, связь С=О сильно поляризована за счет смещения электронной плотности π - связи к атому кислорода, в результате чего на атоме кислорода возникает частичный отрицательный ( δ - ), а на атоме углерода – частичный положительный ( δ + ) заряды:
Физические свойства альдегидов
Формальдегид – газ, с этаналя – летучие жидкости с запахом. Высшие – твердые вещества. Низшие альдегиды хорошо растворимы в воде. Раствор формальдегида в воде называют формалином .
Водородные связи между молекулами не образуются, поэтому t кип. и t плавл. альдегидов ниже, чем у соответствующих спиртов.
ПОЛУЧЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ.
а) при окислении первичных спиртов – образуются альдегиды,
б) при окислении вторичных спиртов – получаются кетоны.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
Окислить первичный спирт до альдегида можно:
а) нагреванием над оксидом меди (II):
СН 3 -СН 2 -СН 2 -ОН + CuO– t CH 3 -CH 2 -C=O + Cu + H 2 O
б) пропусканием смеси паров спирта с кислородом над медной сеткой:
2СН 3 -СН 2 -СН 2 -ОН + O 2 – Cu,t 2CH 3 -CH 2 -C=O + 2H 2 O
При окислении вторичных спиртов образуются кетоны.
2. Дегидрирование спиртов: нагревание над медной сеткой.
СН 3 -СН 2 -СН 2 -ОН – Cu,t CH 3 - CH 2 - C=O + H 2
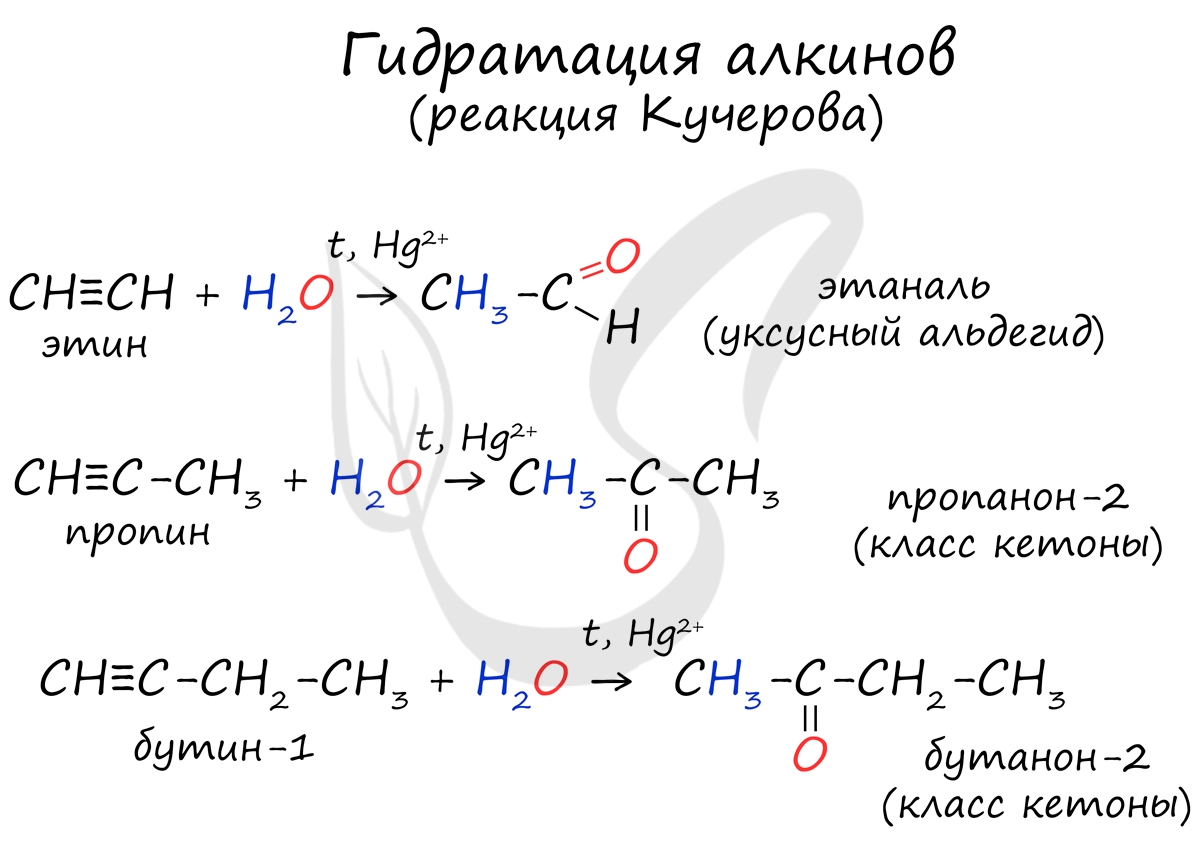
3. Реакция Кучерова – гидратация алкинов.
а) при гидратации ацетилена получается ацетальдегид,
б) при гидратации других алкинов – кетоны.
Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
Кетоны получают при гидратации других гомологов ряда алкинов:
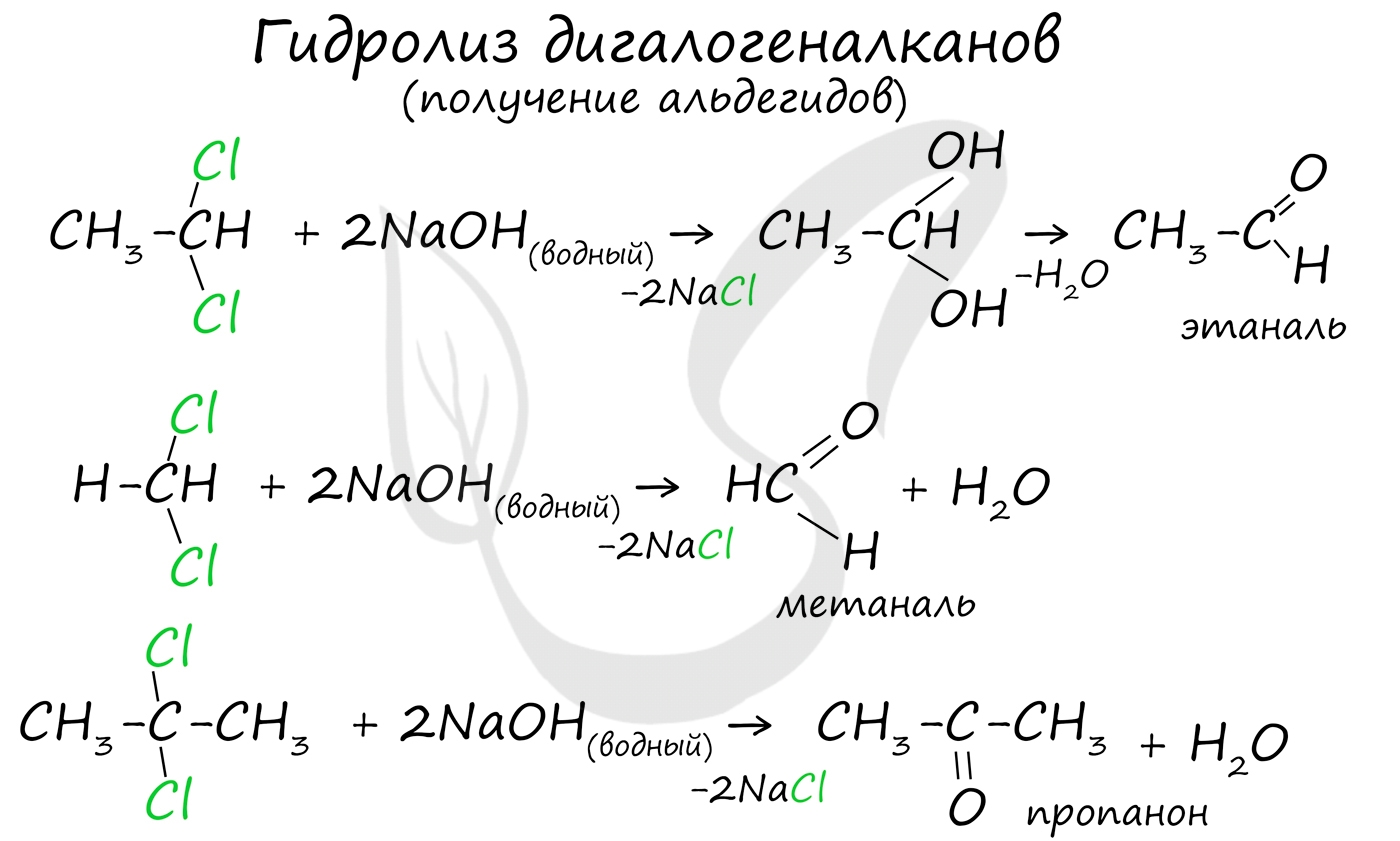
4. Гидролиз дигалогенпроизводных алканов. Под действием щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон
СН 3 –CH 2 - CHCl 2 + 2 KOH [CH 3 -CH 2 -CH-OH]+2KCl
H 2 O + CH 3 - CH 2 - C=O OH
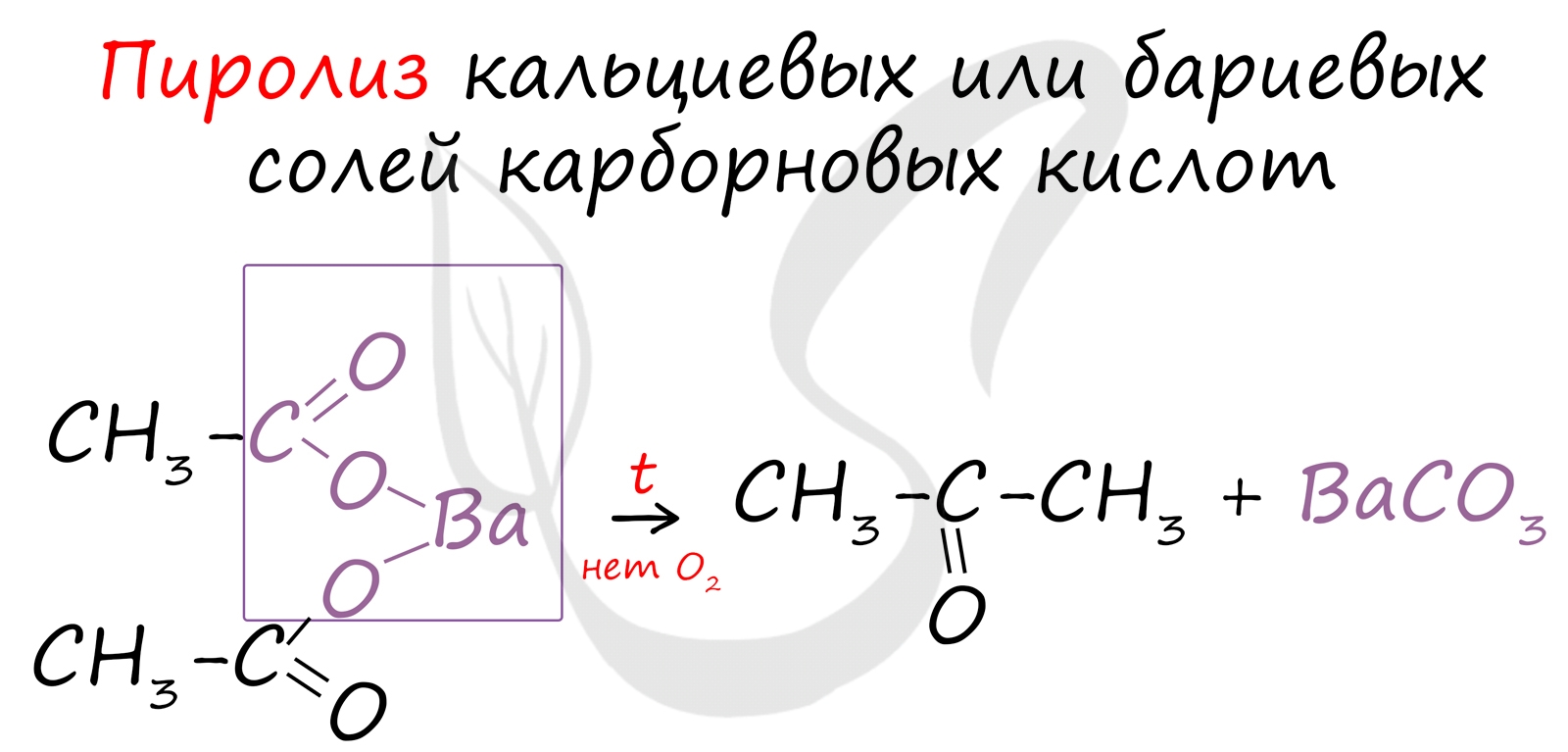
5. Пиролиз кальциевых солей карбоновых кислот – получаются кетоны.
( СН 3 - СОО ) 2 Са –t Ca CO 3 + CH 3 - C - CH 3
6.Окисление алкенов (катализаторы - хлориды Pd и Cu)
7. Кумольный способ получения ацетона (наряду с фенолом).
8. Окисление метана (получение формальдегида)
СН 4 + О 2 –(Аg, 500 0 ) НСНО + Н 2 О
СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ.
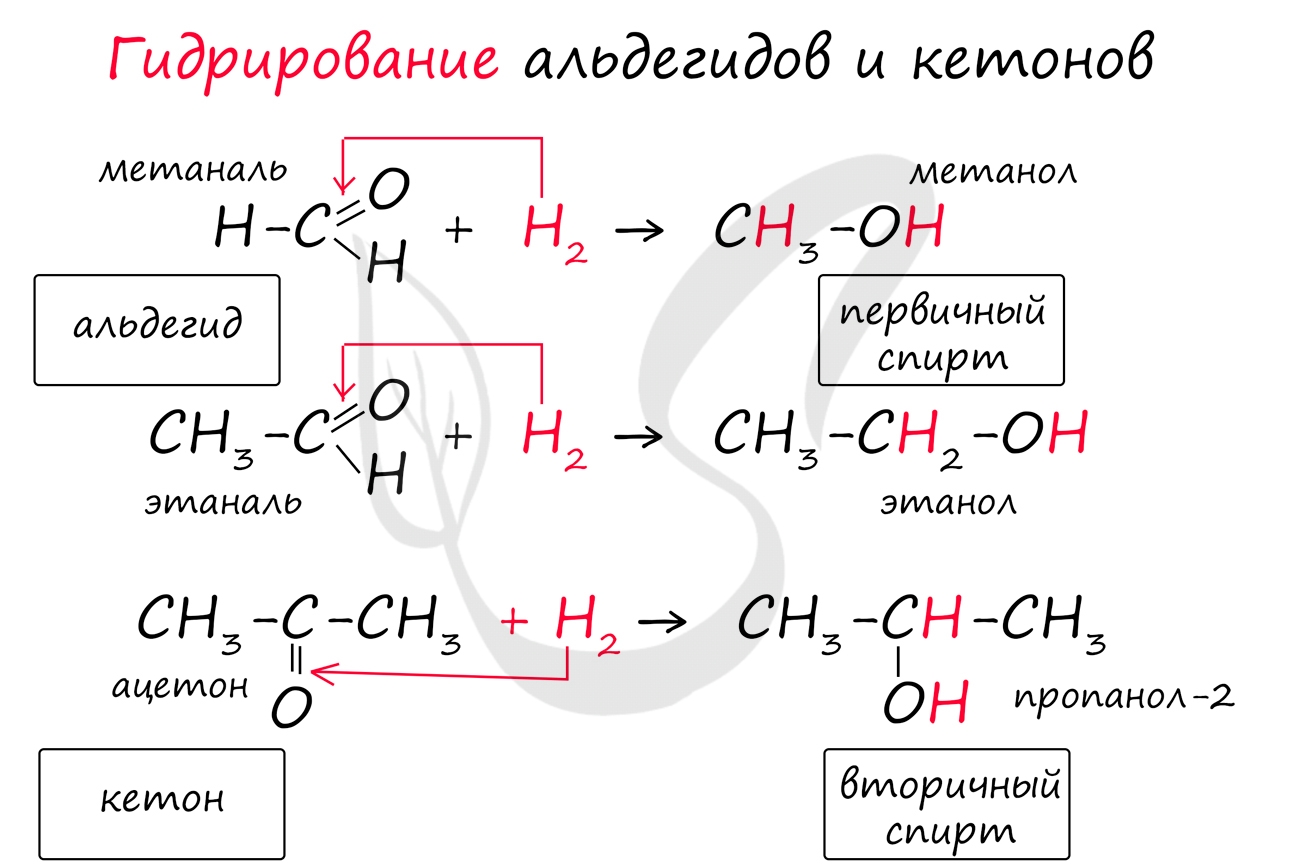
Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора образуют первичные спирты, кетоны - вторичные:
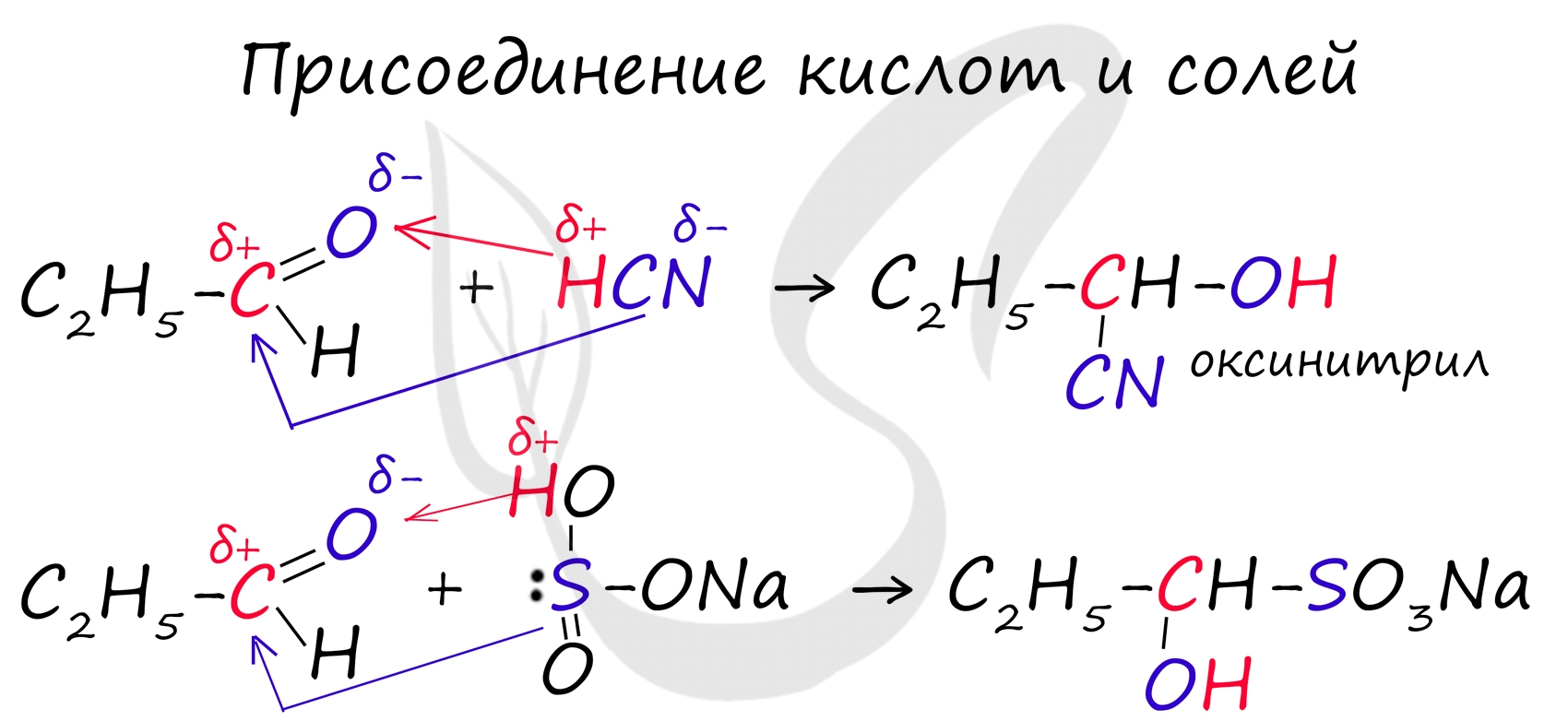
2. Присоединение циановодорода, гидросульфита натрия и спиртов.
1. Присоединение циановодородной (синильной) кислоты HCN:
2. Присоединение спиртов с образованием полуацеталей (в присутствии кислоты или основания как катализатора ):
Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
3.Присоединение гидросульфита натрия дает кристаллические вещества, обычно называемые гидросульфитными производными альдегидов. Это качественная реакция на альдегиды
/
CH 3 –C =О + H SO 3 Na CH 3 –С–SO 3 Na
В реакциях с кислотами эти вещества разрушаются:
/
CH 3 –С–SO 3 Na + НС1 CH 3 –СН=О + NaС1 + SO 2 + Н 2 О
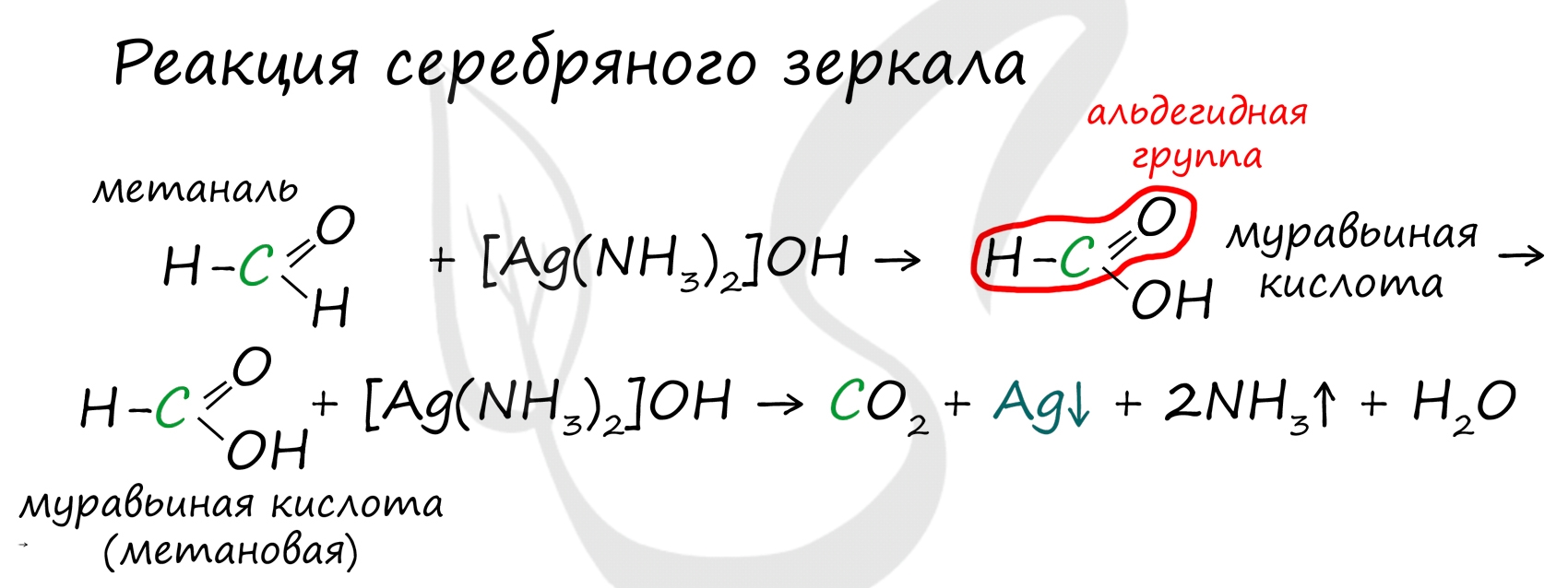
3. Окисление альдегидов. Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием мягких окислителей: оксид серебра (аммиачный раствор) и гидроксид меди (II). Данные реакции являются качественными на альдегидную группу.
Реакция "серебряного зеркала" – окисление аммиачным раствором оксида серебра:
R–CH=O + 2[Ag(NH 3 ) 2 ]OH RCOONH 4 + 2Ag + 3NH 3 + H 2 O
В случае муравьиного альдегида – продуктом является карбонат аммония.
НCH=O + 4[Ag(NH 3 ) 2 ]OH (NH 4 ) 2 СО 3 + 4Ag + 6NH 3 + 2H 2 O
При подкислении реакционной смеси выделяется карбоновая кислота, а в случае муравьиного альдегида – углекислый газ.
Иногда пишут упрощенный вариант реакции:
RCH=O + Ag 2 O -(NH 3 ) RCOОH + 2Ag
Окисление гидроксидом меди (II) в составе комплекса с винной кислотой или с аммиаком (синий цвет) с образованием красно-кирпичного осадка Cu 2 O: RCH=O +2Cu(OH) 2 RCOOH+Cu 2 O+2H 2 O
Окисление КМnО 4 (подкисл.раствор) – до карбоновых кислот
5R–CH=O + 2КМnО 4 + 3Н 2 SO 4 5R–COОН + 2МnSО 4 + К 2 SO 4 + 3Н 2 О
Формальдегид окисляется до СО 2
КЕТОНЫ окисляются с трудом при действии сильных окислителей и нагревании с разрывом С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот меньшей молекулярной массы.
4. Конденсация с фенолами.
Практическое значение имеет реакция формальдегида с фенолом (катализаторы - кислоты или основания):
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол .
CH 3 –CH 2 –C = О + С1 2 –(400 0 ) CH 3 – CH–С=O
6. Йодоформная реакция
В реакцию вступают уксусный альдегид и метилкетоны
Ацетон + 3I 2 + NaOH CH 3 COONa + CHI 3 + H 2 O
nСН 2 =О + H 2 O НОСН 2 -[-ОСН 2 -] n -ОСН 2 ОН
Метаналь (муравьиный альдегид, формальдегид) CH 2 =O
- получение фенолформальдегидных смол;
- синтез лекарственных средств (уротропин);
- дезинфицирующее средство.
- Фиксация биологических объектов
- Протравливание семян
Этаналь (уксусный альдегид, ацетальдегид) СН 3 -СН=О
- производство уксусной кислоты;
- органический синтез.
Ацетон СН 3 -СО-СН 3
- растворитель лаков, красок, ацетатов целлюлозы;
- сырье для синтеза различных органических веществ.
По теме: методические разработки, презентации и конспекты
Лекция по органической химии 11 класс : Теория органического строения. Алканы, циклоал-каны.
Лекционный материал по органической химии: Теория органического строения. Алканы, циклоалканы.

Урок-лекция по органической химии на тему: "Углеводы, их состав и классификация. моносахариды"
Углеводы - полифункциональные органические кислородосодержащие соединения. Дана классификация углеводов по традиционной схеме. Особое внимание уделено особенностям строения моносахаридов и.
Органическая химия класс алкены
Данная разработка поможет учителю на уроке органической химии в 10 классе. Данный материал разработан к учебнику О.С Габриэляна . В разработке престтавлен материал для контроля знаний учащихся.
Органическая химия класс алкены
Данная разработка поможет учителю на уроке органической химии в 10 классе. Данный материал разработан к учебнику О.С Габриэляна . В разработке престтавлен материал для контроля знаний учащихся.

Конспекты лекций по органической химии
Конспекты лекций по органической химии предназначены для организации самостоятельной работы обучающихся при изучении нового материала и его закреплению.

Инструктивная карточка к уроку химии по теме "Химические свойства альдегидов и кетонов"
Инструктивная карточка к уроку химии в 10 классе (профиль) по теме "Химические свойства альдегидов и кетонов".

Альдегиды и кетоны
Ключевые слова конспекта: Альдегиды. Альдегидная группа. Формальдегид. Ацетальдегид. Качественные реакции на альдегиды. Реакции поликонденсации. Карбонильная группа. Кетоны. Ацетон.
Понятие об альдегидах

Современный рынок конструкционных и отделочных материалов необыкновенно богат. Древесно-стружечные плиты, из которых изготовлена мебель, искусно маскируются под натуральное дерево. Искусственный камень, из которого сделаны столешницы кухонной мебели, внешне трудно отличить от натурального камня. Стеновые панели и пластиковая вагонка окрашены во все цвета радуги и легко монтируются. Ламинат или линолеум создают иллюзию настоящей древесины. Ручки кухонной посуды, корпуса розеток и выключателей должны выдерживать высокую температуру или электрическое напряжение, при этом не гореть, не плавиться, отвечать гигиеническим нормам, а потому должны быть изготовлены из веществ, соответствующих установленным требованиям.

Что же общего между такими непохожими предметами быта? При изготовлении многих из них используют полимерные вещества, получаемые на основе органического вещества формальдегида. Формальдегид имеет формулу СН2О, однако чаще всего её записывают в виде НСНО, поскольку она точнее отражает строение молекулы:

Между атомами углерода и кислорода имеется двойная связь. Группу
(или —СНО) называют альдегидной группой. Именно она определяет принадлежность соединения к классу альдегидов.

Гомологический ряд альдегидов
Формальдегид (метаналь) — родоначальник гомологического ряда альдегидов. Это бесцветный ядовитый газ с характерным запахом, хорошо растворимый в воде. Водный раствор формальдегида называют формалином.

Общая формула представителей гомологического ряда альдегидов СnН2nО. Обозначив углеводородный радикал буквой R, общую формулу альдегидов можно записать так:
Формулы и названия первых представителей этого класса органических веществ приведены в таблице 6. Международные названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль.

Способы получения альдегидов

Основной промышленный метод получения формальдегида — уже знакомая вам реакция окисления соответствующего спирта, в данном случае метанола:

Кроме того, возможно получение формальдегида в результате каталитического окисления метана:

Уксусный альдегид (этаналь) в промышленности получают прямым окислением этилена в присутствии катализатора — хлорида палладия(II):
Химические свойства альдегидов
Химические свойства альдегидов определяются в первую очередь наличием в их молекуле альдегидной группы.

Несмотря на наличие в альдегидной функциональной группе двойной связи, альдегиды не относят к непредельным соединениям. В типичные для непредельных соединений реакции присоединения они вступают с трудом. Тем не менее в присутствии катализатора водород способен присоединяться по связи

Формальдегид легко окисляется, образуя при этом карбоновую кислоту. Реакцию окисления формальдегида можно записать упрощённо, обозначив окислитель как [О]:

На реакциях окисления основаны качественные реакции на альдегиды. В роли окислителя можно использовать аммиачный раствор оксида серебра. В упрощённом виде эту реакцию можно выразить уравнением
При осторожном нагревании альдегида с аммиачным раствором оксида серебра на стенках пробирки образуется блестящий налёт металла, поэтому данная реакция получила название реакция серебряного зеркала.

Альдегиды легко окисляются также свежеприготовленным гидроксидом меди(II) в щелочной среде. При этом голубой цвет осадка изменяется на кирпично-красный в результате образования оксида меди(I):
Фенолформальдегидная смола
Наиболее важны с практической точки зрения реакции альдегидов, приводящие к получению высокомолекулярных продуктов (полимеров).
Взаимодействием формальдегида с фенолом синтезируют полимер фенолформальдегидную смолу. Является ли это взаимодействие реакцией полимеризации? Оказывается, нет. В данном случае протекает процесс поликонденсации, в результате которого, в отличие от полимеризации, помимо высокомолекулярного вещества, образуется побочный низкомолекулярный продукт (чаще всего вода). Схема взаимодействия формальдегида с фенолом:


Уравнении реакции:
Если фенолформальдегидной смолой пропитать стружки или опилки и спрессовать при нагревании, получится древесно-стружечная плита. Аналогичным образом склеиванием тонких слоёв древесины (шпона) получают фанеру. Если покрыть древесно-стружечную плиту или фанеру плёнкой с рисунком под дерево или камень, получится материал для изготовления мебели. Изделия из ДСП выделяют в окружающую среду токсичные мономеры фенолформальдегидной смолы — фенол и формальдегид. Даже незначительные концентрации этих веществ могут вызывать головную боль, резь в глазах, раздражение дыхательных путей и т. д. Выделение формальдегида из ДСП контролируется и является важным показателем качества плит.
Если в фенолформальдегидную смолу добавляют различные цветные красители, наполнители, помещают в форму и нагревают, то получают устойчивые к высоким температурам изделия из полимерного материала — фенопласта.
Формальдегид используют для дубления кожи в кожевенном производстве, так как при взаимодействии с белком он вызывает его денатурацию. В результате дубильного действия формалина кожа не подвергается гниению. На этом же свойстве формалина основано его применение для хранения биологических препаратов, дезинфекции и протравливания семян.

Понятие о кетонах

В отличие от молекул альдегидов, молекулы кетонов содержат два углеводородных радикала, связанные с функциональной карбонильной группой . Простейший представитель кетонов — хорошо известный растворитель лаков и красок ацетон, или диметилкетон:


Альдегиды - летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
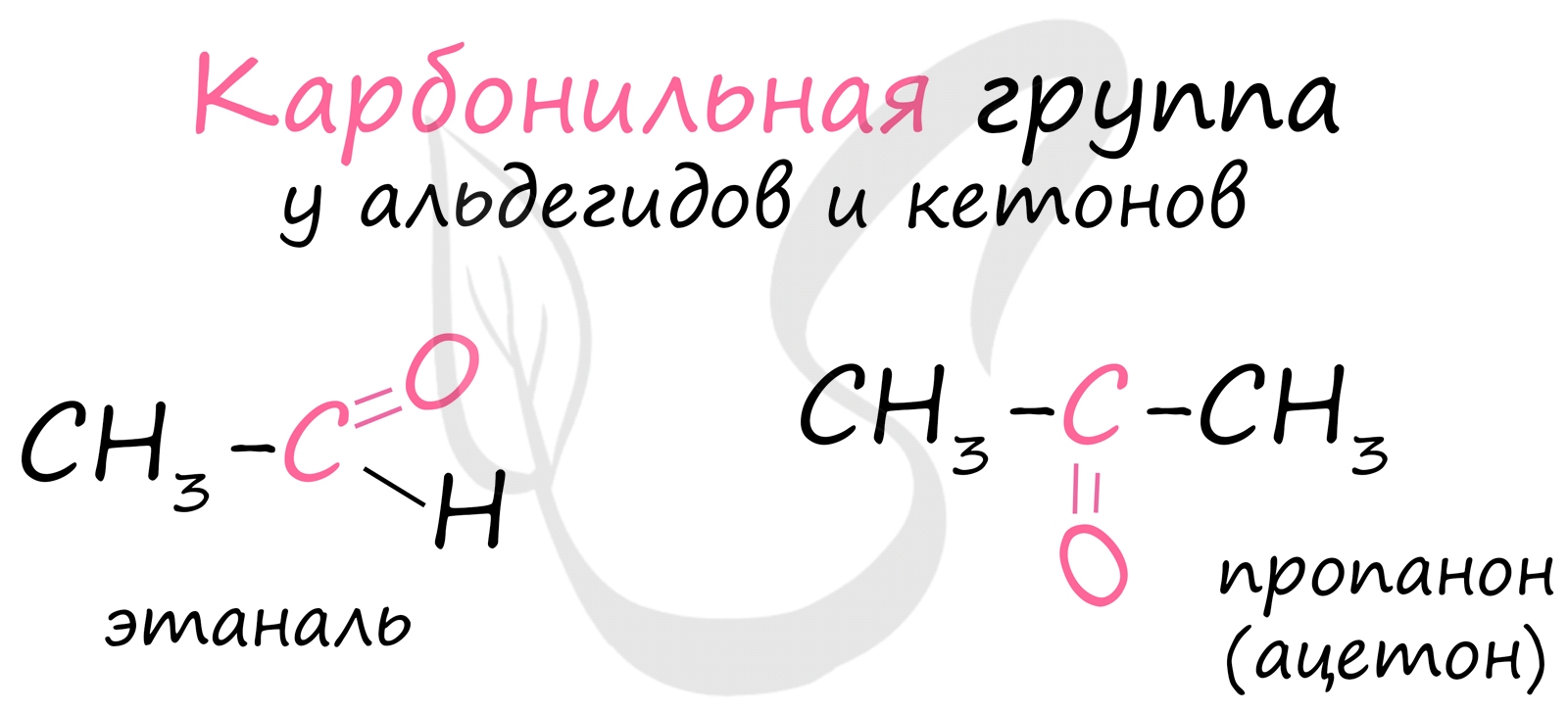
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

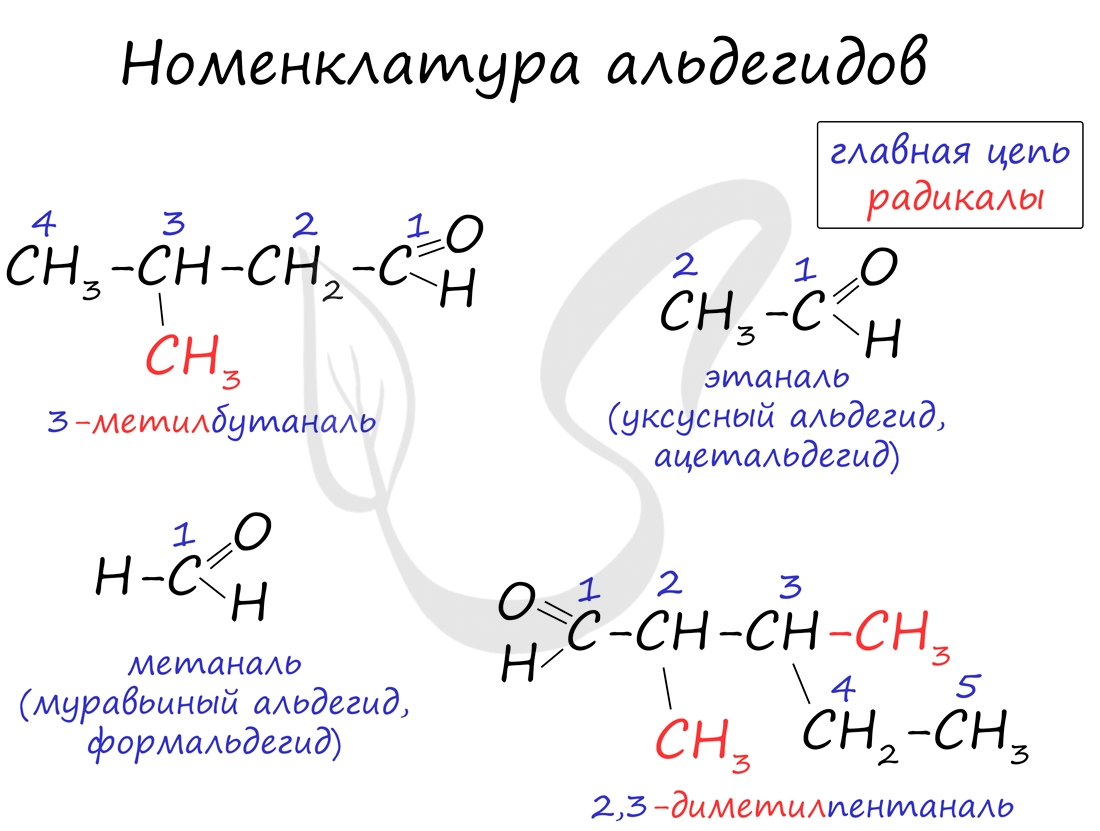
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса "аль" к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот - HO. Например: метаналь - HCHO, этаналь - CH3CHO, пропаналь - C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь - формальдегид, этаналь - ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов - кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов - у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
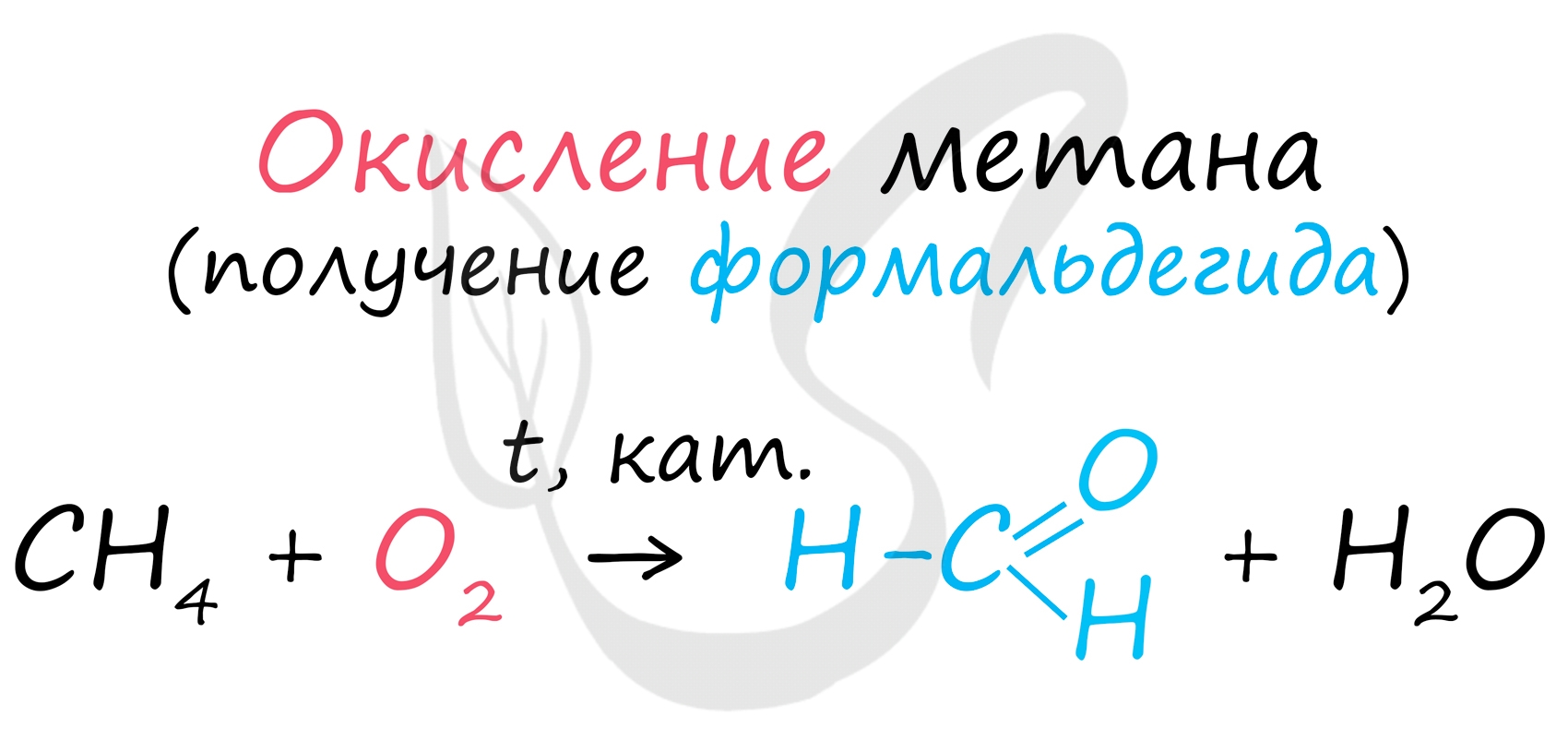
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов - вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом - наличием альдегидной группы у муравьиной кислоты.
Окисление также возможно другим реагентом - гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
- Конспект нод по познавательному развитию в таблице
- Развитие слухового внимания и фонематического восприятия конспект занятия в подготовительной группе
- Живые системы и экосистемы конспект
- Презентация чарушин страшный рассказ 2 класс школа россии презентация и конспект
- Конспект урока элементарные частицы

