Закон сохранения энергии в химии кратко
Обновлено: 07.07.2024
Атом – это наименьшая частица химического элемента, которая несет все его свойства.
Изотопы – это нуклиды с одинаковым зарядом ядра, но разным массовым числом и числом нейтронов
Нейтрон – это незаряженная элементарная частица.
Нуклиды – это различные виды ядер, которые отличаются зарядом или массовым числом.
Протон – это положительно заряженная элементарная частица.
Элементарная частица – это объект, который нельзя разделить на более мелкие составляющие.
Радиоактивный распад – это превращение ядер нуклидов, сопровождающиеся изменением числа протонов или нейтронов в ядре и испусканием элементарных частиц, гамма-квантов или кластеров.
Химический элемент – это вид атомов с определенным зарядом ядра.
Электроны – это отрицательно заряженные элементарные частицы, которые движутся по орбиталям вокруг ядра.
Ядро – это положительно заряженная центральная часть атома.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Одним из основных понятий химии является атом. Атом – это наименьшая частица химического элемента, которая несет все его свойства. Согласно планетарной модели, атом состоит из ядра и электронов. Электроны – это отрицательно заряженные элементарные частицы, которые движутся по орбиталям вокруг ядра. Ядро – это положительно заряженная центральная часть атома. Ядра атомов превращаются друг в друга в ходе ядерных реакций.
Ядро состоит из двух типов элементарных частиц: протонов (Z) и нейтронов (N). Заряд нейтронов равен нулю. Протоны обладают зарядом +1. Общее число нейтронов и протонов в ядре называется массовым числом (А). Оно близко, но не равно по значению к атомной массе элемента, указанной в Периодической таблице. Заряд ядра равен числу протонов и порядковому номеру элемента в Периодической системе.
Вид атомов с определенным зарядом ядра называется химическим элементом. Химический элемент существует в виде простого вещества (металла или неметалла) или соединений с другими элементами. К характеристикам химического элемента относятся: атомный номер, относительная атомная масса, изотопный состав, положение в Периодической системе, строение атома, электроотрицательность, степени окисления, валентность, энергия ионизации, сродство к электрону, распространенность в природе.
Нуклидами называют различные виды ядер, которые отличаются зарядом или массовым числом. Они обозначаются следующим образом: вверху перед символом нуклида пишется массовое число, внизу – порядковый номер элемента. Нуклиды с одинаковым зарядом ядра, но разным массовым числом и числом нейтронов называются изотопами. Изотопы одного элемента обладают одинаковыми химическими свойствами и почти не отличаются по физическим свойствам. Элементы представляют собой совокупность изотопов с разными массовыми числами, поэтому атомные массы многих элементов представлены дробными числами.
Химические реакции подчиняются законам сохранения массы и энергии. Закон сохранения массы веществ впервые сформулировал великий ученый М.В. Ломоносов. Экспериментально его доказал А.Л. Лавуазье. Формулируется закон следующим образом: масса исходных веществ, вступивших в химическую реакцию, равна массе продуктов реакции. В ходе реакции атомы веществ только перегруппировываются.
В двадцатом веке ученые обнаружили, что закон сохранения массы не соблюдается в случае ядерных реакций. После того, как А. Эйнштейн открыл взаимосвязь между массой и энергией, выраженную в его знаменитой формуле E=mc2, стало понятно, что закон сохранения массы лишь частный случай закона сохранения энергии. Закон сохранения энергии гласит: в изолированной системе энергия системы не исчезает и не появляется, а только переходит из одного вида в другой. Для составления ядерных реакций важно помнить, что суммарный заряд ядер и массовое число сохраняются.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на работу с Периодической системой.
Условие задачи: Введите формулу простого вещества, при бета-распаде которого образуется висмут.
Решение: Висмут – элемент с порядковым номером 83. При бета распаде один из нейтронов превращается в протон, таким образом заряд ядра атома увеличивается на единицу. Следовательно, химический элемент, образующий исходное вещество, находится на одну клетку левее висмута. Это свинец.
2.Решение задачи на закон сохранения массы или закон сохранения числа атомов.
Условие задачи: Расставьте коэффициенты в реакции и выберите правильное значение их суммы.
Решение: Составим электронный баланс. Каждый атом алюминия присоединил 3 электрона, а каждый атом серы отдал два электрона. Тогда коэффициенты 2Al + 3S = Al2S3
1. Закон сохранения массы и энергии . Это объединенный закон. В него входят два закона.
Масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Этот закон был открыт М.В. Ломоносовым (1748 г.) и дополнен А.Л.Лавуазье в 1789 г.
В процессе реакции сохраняется масса каждого элемента
Этот закон позволяет составлять уравнения химических реакций и осуществлять расчеты на их основе. Он не является абсолютным. Абсолютным является закон сохранения энергии.
Закон сохранения энергии
Энергия не возникает из ничего и не исчезает, а только переходит из одного вида в другой.
Этот закон – результат работ А. Эйнштейна. Он установил связь между энергией и массой вещества (1905 г.):
Е = mc 2 ,
где с – скорость света в вакууме, равная ~ 300 000 км/с.
Поскольку в результате химической реакции выделяется или поглощается энергия, то, в соответствии с уравнением Эйнштейна, изменяется и масса веществ. Однако это изменение столь мало, что на практике не учитывается (так называемый дефект массы).
Следующие законы справедливы только для соединений с постоянным составом молекул (дальтонидов). Они отличаются от соединений, имеющих переменный состав молекул – бертоллидов.
2. Закон постоянства состава (Ж. Пруст, 1801).
Соотношение между массами химических элементов, входящих в состав данного соединения, есть величина постоянная, не зависящая от способа его получения.
Например, как бы не получали воду – при сгорании водорода (2Н2 + О2 = 2Н2О) или при разложении гидроксида кальция (Са(ОН)2 = СаО + Н2О) – отношение масс атомов водорода и кислорода в реакции равно ~ 1:8.
3. Закон кратных отношений (Дж. Дальтон, 1803).
Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящееся на определенную массу другого, относятся друг к другу как небольшие целые числа.
Этот закон подтвердил атомистическое представление о структуре материи: раз элементы соединяются в кратных отношениях, то химические соединения распадаются на целые атомы. Например, на 1 г азота в его оксидах N2O, NO, N2O3, NO2 и N2O5 приходится 0,57; 1,14; 1,71; 2,28 и 2,85 г кислорода, что соответствует отношению 1:2:3:4:5. Однако в случае соединений переменного состава этот закон неприменим.
4. Закон простых объемных отношений (Ж. Гей-Люссак, 1808).
При равных условиях объем вступающих в реакцию газов относятся друг к другу и к объемам образовавшихся газообразных продуктов как небольшие целые числа.
так, например, в реакции образования аммиака из простых веществ
отношение объемов азота (N), водорода (H) и аммиака (NH3) составляет 1:3:2.
5. Закон Авогадро (1811).
В равных объемах различных газов при одинаковых условиях (р и Т) содержится одинаковое число молекул.
Этот закон вытекает из анализа уравнения состояния идеального газа Клапейрона–Менделеева:
рV = nRT.
Это уравнение можно записать для двух газов:
p1V1 = n1RT1;
p2V2 = n2RT2.
При равенстве р1 = р2, Т1 = Т2 и V1 = V2 будут равны и количества вещества газов: n1 = n2 или, с учетом числа Авогадро:
n1 · NA = n2 · NA,
т.е. будет равно и число молекул газов.
Закон Авогадро имеет следствия :
- Одинаковое число молекул любого газа при одинаковых условиях занимает один и тот же объем.
- Массы газов, взятых в одинаковых объемах при одинаковых условиях (р, Т), относятся друг к другу как их молярные массы:
Это следствие вытекает из равенства количеств веществ этих газов n1 = n2.
Подставляя вместо количества вещества отношения его массы к молярной массе n = m/M получим:
m1/ M1= m2/M2 или m1/m2 = M1/M2.
Второе следствие позволяет вывести уравнение для определения молярной массы неизвестного газа по известной величине относительно плотности этого газа по другому известному газу.
После подстановки в числитель и знаменатель левой части уравнения (1) объемов первого и второго газов, которые равны, получаем:
m1 · V2 /m2 · V1 = M1/M2.
Отношение массы вещества к объему заменяем на плотность (ρ = m/V): ρ1/ ρ2 = M1/M2
и получим уравнение для расчета молекулярной массы первого газа по второму:
M1 = (ρ1/ρ2) M2 = D1/2M2 (2)
Или в общем виде:
где Dг – относительная плотность первого газа по второму.
Если известна плотность данного газа по водороду, то используется уравнение:
Один из фундаментальных и общих законов природы — закон сохранения массы — был открыт М.В.Ломоносовым и Л.Лавуазье независимо друг от друга:
Общая масса веществ, вступающих в химическую реакцию, равна общей массе веществ, образующихся в результате реакции.
Из закона сохранения массы веществ следует важный следствие закона сохранения массы: количество атомов каждого элемента до и после реакции остается постоянным.
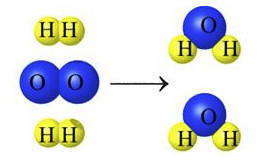
Реакция между Н 2 и О 2 с образованием Н 2 О — подтверждение следствия из закона сохранения массы: количество атомов каждого элемента, которые содержатся в исходных веществах, равно числу атомов этого элемента в продуктах реакции.
Сам Ломоносов считал, что закон сохранения массы веществ является частью более общего закона природы и может быть распространен на другие формы движения материи. Он утверждал, что тело, которое своим толчком возбуждает другое тело к движению, теряет от своего движения столько же, сколько отдает другому. Согласно гипотезе Ломоносова изменения в природе происходят так, что если к чему-то несколько прибавилось, то это отнимется у чего-то другого.
Эта гипотеза была развита только после открытия второй части универсального закона природы — закона сохранения энергии (Майер, 1842 г.):
Энергия не возникает и не исчезает бесследно, а лишь превращается из одной формы в другую в эквивалентных количествах.
Законы сохранения массы и энергии отражают принцип сохранения материи и движения , сущность которого заключается в современном виде формулируется так:
В изолированной системе сумма масс и энергий является постоянной, то есть суммарные массы и энергии веществ, вступающих в реакцию, равны суммарным массам и энергиям продуктов реакции.
Закон сохранения энергии как философский принцип не выводится из более общих постулатов. С физической точки зрения он является следствием однородности времени, то есть тот факт, что законы природы в течение времени не изменяются.
Энергия — это мера движения и взаимодействия различных видов материи. При любых процессах в изолированной системе энергия не возникает и не уничтожается, она может только переходить из одной формы в другую. Например, энергия химического взаимодействия может превращаться в тепловую энергию излучения.
Закон постоянства состава
Сущность закона постоянства состава (Пруст, 1801 г.) заключается в том, что каждое химическое соединение независимо от способа и условий ее добычи имеет определенный массовый состав.
Соотношение между массами элементов, входящих в состав определенной соединения, являются постоянными и не зависят от способа получения этого соединения.
Этот закон не имеет абсолютного обобщенного характера, поскольку в природе существует два типа соединений — с постоянным и с переменным составом.
Соединения, которые имеют постоянный состав и целочисленное атомное соотношение компонентов, называются Дальтониды .
К ним относятся вещества, которые в обычных условиях находятся в газообразном (СО2 , NH3 , NO, HCl) или жидком (Н2О, С6Н6) состоянии или могут быть легко переведены в них, а также кристаллические вещества с молекулярной структурой (I2 , лед).
Соединения переменного состава, в которых стехиометрические соотношения компонентов не соответствуют целым числам, называются бертоллидами .
Бертоллиды не имеют молекулярной структуры. К ним относится подавляющее большинство кристаллических соединений переходных d- и f- элементов: оксиды, гидриды, нитриды, сульфиды, карбиды и другие бинарные соединения. Следует заметить, что на постоянство состава влияет и изотопный состав, например, в обычной воде Н2О и в тяжелой воде D2О массовые доли кислорода различаются.
Итак, состав химических соединений зависит от типа химической связи, агрегатного состояния веществ, изотопного состава и условий их добычи и может быть как постоянным, так и переменным. Поэтому в настоящее формулировки закона постоянства состава внесены некоторые уточнения:
Если химическое соединение имеет молекулярную структуру, то независимо от условий добычи состав ее остается постоянным. Состав химического соединения, не имеющего молекулярной структуры, может изменяться в определенных пределах в зависимости от условий добычи.
Закон объемных соотношений Гей-Люссака
В химических реакциях с участием газов очень часто наблюдается изменение объема реакционной системы. В отличие от постоянства массы веществ, участвующих в реакции и образуются вследствие нее, при взаимодействии газов объем реакционной системы может увеличиваться, уменьшаться или оставаться неизменным. Соотношение между объемами газов устанавливает закон объемных соотношений Гей-Люссака (1808 г.):
Соотношение объемов газов, вступающих в реакцию и образующихся в результате нее, представляет собой соотношение простых чисел, которые являются кратными стехиометрических коэффициентов, стоящих в уравнении реакции перед формулами соответствующих газов.
Этот закон справедлив только в том случае, когда объемы газов измерены при одинаковых условиях.
Из закона Гей-Люссака следует, что стехиометрические коэффициенты в уравнении реакции являются кратными к объемам газов, которые взаимодействуют и образуются.
С помощью закона объемных соотношений можно рассчитать объемы газов или устанавливать состав исходного газа.
Закон Авогадро
Одним из важнейших газовых законов является закон Авогадро:
В равных объемах различных газов при одинаковых условиях содержится одинаковое количество молекул:
N=const, если P,V,T=const, где NN — количество молекул; P, V, T — давление, объем, температура соответственно.
Но поскольку число молекул в реальных образцах вещества очень велико, то была введена универсальная количественная характеристика, которая описывает численный состояние веществ:
Количество вещества ν (или n ) — это физическая величина, определяемая числом частиц — структурных элементов вещества: молекул, атомов, ионов, ионных ассоциатов и тому подобное.
Единицей ее измерения является [ моль ] — одна из основных единиц системы СИ.
Моль — это количество вещества, содержащее столько же структурных элементов вещества, сколько атомов содержится в изотопе углерода-12 массой 12 · 10 -3 кг.
Установлено, что масса одного атома изотопа углерода-12 составляет 19,92 · 10 -27 кг. Тогда число атомов N в 12 · 10 -3 кг равна:
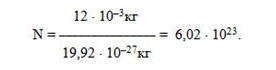
Число, равное 6,02 · 10 23 моль -1 , называется постоянной Авогадро.
Постоянная Авогадро обозначается NA и указывает на число частиц — структурных элементов веществе, количество которой составляет 1 моль и поэтому имеет размерность моль -1 .
Итак, моль любых структурных элементов — это такое количество вещества, которое содержит 6,02 · 10 23 частиц. Например, 1 моль Н2О состоит из 6,02 · 10 23 молекул Н2О и содержит 2 моль (или 2 · 6,02 · 10 23 ) атомов Н и 1 моль (или 6,02 · 10 23 ) атомов В ; 1 моль SO4 2- содержит 6,02 · 10 23 ионов SO4 2- , в том числе 1 моль (6,02 · 10 23 ) атомов S и 4 моль (4 * 6,02 · 10 23 ) атомов О .
Количество вещества связано с числом частиц N и постоянной Авогадро NA зависимостью ν=N/NA.
Масса одного моля вещества называется молярной массой этого вещества, она обозначается через М .
Молярная масса — это физическая величина, определяемая отношением массы вещества к количеству вещества, которое ей отвечает: M=m/ν.
Единицей измерения молярной массы в системе СИ является [кг / моль], но в химии чаще пользуются внесистемной величиной [г / моль], или [г × моль -1 ].
Молярная масса М связана с относительной молекулярной массой Mr и постоянной Авогадро NA зависимостью M=Mr⋅NA⋅1а.в.м.
Например, относительная молекулярная масса оксида углерода равна Mr(CO2)=12+2⋅16=44, а атомная единица массы составляет 1 а.о.м. = 1,66 × 10 -24 г, тогда молярная масса будет М (СО2 ) = 44 × 6,02 · 10 23 · 1,66 · 10 -24 = 44г / моль.
То есть молярная масса численно равна относительной молекулярной массе, но имеет совсем другой физический смысл: Мr характеризует массу одной молекулы, а М — массу одного моля, то есть 6,02 · 10 23 молекул .
Закону Авогадро подлежат все газы независимо от размеров их молекул. Не подлежат ему газы в условиях низких температур и высокого давления, а также вещества в жидком или твердом состоянии. Это объясняется так. Как известно, объем, занимает определенное количество вещества, определяется тремя параметрами: числом составляющих частиц, расстояниями между ними и их размерами. В газах в условиях высоких температур и низкого давления расстояния между молекулами в тысячи раз больше их размеры, поэтому размерами молекул можно пренебречь. В результате объем газа будет оговариваться уже только двумя параметрами: числом молекул и расстояниями между ними. Но при одинаковых условиях (давление и температура) расстояния между молекулами в различных газах одинаковы, поэтому в этом случае равные объемы различных газов содержат одно и то же число молекул.
При низких температурах и под высоким давлением расстояния между молекулами в газах уменьшаются и становятся соизмеримыми с размерами самих молекул, поэтому объем газа зависит от размеров молекул, а газы перестают подлежать закону Авогадро.
Очень часто бывает необходимым знать молярную массу воздуха, которая исчисляется как и молярная масса любой смеси газов с учетом объемной доли φφ каждого газа.
Объемные доли кислорода и азота в воздухе примерно составляют φ(O2)≈0,2 (или 20%), φ(N2)≈0,8 (или 80%). Тогда молярная масса воздуха:
М воздуха =φ(O2)× М (О 2 ) + φ(N2) × М (N2 ) = 0,2 × 32 + 0,8 × 28 = 29г / моль.
1-е следствие закона Авогадро
Один моль любого газа при нормальных условиях (н.у.) занимает объем примерно 22,4 л (0,0224 м 3 ).
Эта величина называется молярным объемом , обозначается V M и измеряется в [л / моль] или [м 3 / моль].
Нормальными условиями считаются: Р = 101325Па (~ 10 5 Па) = 1 атм = 760мм рт.ст., Т = 273,15К или t = 0 0 С.
Молярный объем — это эмпирически установленная величина на основе соотношений:
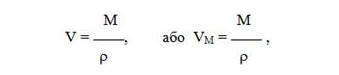
где ρρ — плотность газа, [г / л], или [кг / м 3 ].

Молярный oбьем газов: при н.у. V M = 22,4л / моль
Молярный объем в отличие от молярной массы не является постоянной величиной, а зависит от условий (Р, Т), поэтому VM как понятие употребляют обычно для газов при н.у. Молярный объем связан с другими величинами (объемом V , количеством вещества ν , молярной массой М , плотностью ρ, Числом Авогадро NA и количеством частиц N ) соотношениями:
2-е следствие закона Авогадро
Отношение плотности одного газа в плотности другого газа при одинаковых условиях равна отношению их молярных масс М или относительных молекулярных масс Мr .
Эта величина называется плотностью одного газа по другому и обозначается буквой d или D:
ρ1= ρ2⋅ d2ρ1=ρ2⋅d2 (газа 1), ρ2= ρ1/ d2ρ2=ρ1/d2 (газа 1)
М (газа 1) = d 2 (1) × M (газа 2) M (газа 2) = M (газа 1) / d 2 (газа 1).
Относительная плотность d — это величина безразмерная, она показывает, насколько один газ тяжелее другого.
Основные газовые законы
Состояние газа характеризуется его объемом, давлением и температурой. Между этими величинами экспериментально были установлены следующие законы:
- Закон Бойля-Мариотта (изотермический) сокращенно записывается так:
- при Т = const
- Р 1 · V 1 = Р 2 · V 2 , или Р · V = const;
- Закон Гей-Люссака (Изобарный)
- при Р = const
- V 1 / T 1 = V 2 / T 2 , или V / T = const.
- Закон Шарля (Изохорный)
- при V = const
- Р 1 / T 1 = Р 2 / T 2 , или Р / T = const.
Все три закона можно объединить в один универсальный газовый закон , который описывается уравнением Клапейрона:
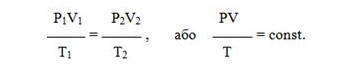
Зависимость для одного моля газа была выведена Менделеевым, поэтому называется уравнением Менделеева-Клапейрона. Оно содержит постоянную величину -универсальную газовую постоянную R.
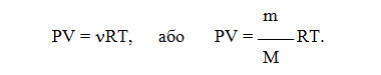
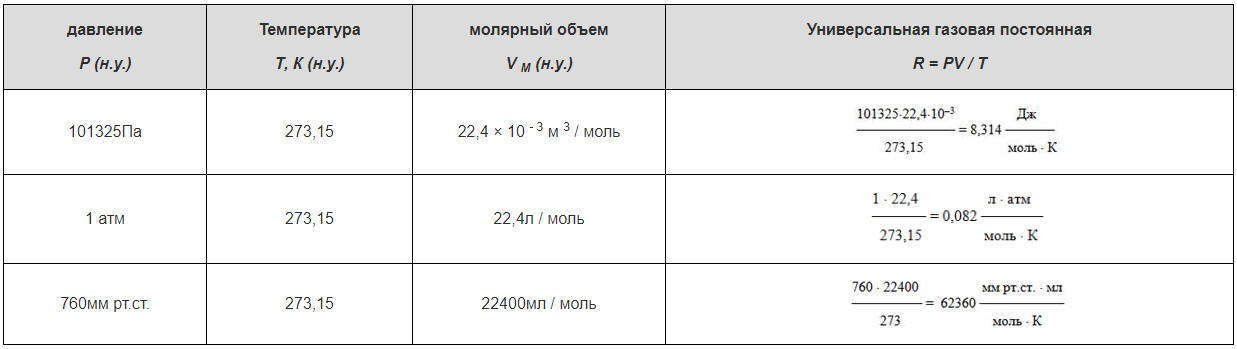
Расчеты значений универсальной газовой постоянной R
Закон эквивалентов
Из закона постоянства состава следует, что элементы сочетаются друг с другом в определенных количественных соотношениях, для характеристики которых было введено понятие эквивалента и эквивалентной массы (слово эквивалентный в переводе означает равноценный ).
Эквивалентом называется условная или реальная частица вещества, которая может присоединять, замещать, отдавать или взаимодействовать иным образом с одним ионом водорода Н + или гидроксила ОН — в кислотно-основных (или ионообменных) реакциях или одному электрону в окислительно-восстановительных реакциях.
Например, эквивалентом азотной (азотной) кислоты реальная частица — молекула HNO3 , содержащей один ион Н + ; эквивалентом ортофосфатной (фосфорной) кислоты — условная частица, соответствует 1/3 молекуле Н3РО4 , в состав которой входят три иона Н + .
Но эквиваленты одного элемента могут быть разными — в зависимости от валентности элемента. Так же сложное соединение может иметь разные эквиваленты, что обусловлено характером ее химического взаимодействия. Например, в реакции нейтрализации ортофосфорная кислота калий гидроксидом
только два атома Н кислоты замещаются атомами К (то есть кислота показывает основность 2). Тогда согласно определению, эквивалентом H3PO4 будет условная частица, которая составляет 1 / 2H3PO4 , поскольку на один атом Н приходится именно половина молекулы H3PO4.
Итак, эквивалент — это фактически один вид молекулы, которая соответствует одному атому Н или иона Н + .
Число, показывающее, какая часть молекулы или иной частицы вещества соответствует эквиваленту, называется фактором эквивалентности fЕ .
Эквивалент и фактор эквивалентности: а) fЕ (HCl) = 1; б) fЕ (CaCl2 ) = 1/2; в) fЕ (AlCl3 ) = 1/3; г) fЕ (CCl4 ) = 1/4; д) fЕ (PCl5 ) = 1/5; е) fЕ (SCl6 ) = 1/6. (Эквиваленты соединений окрашенные темным оттенком):
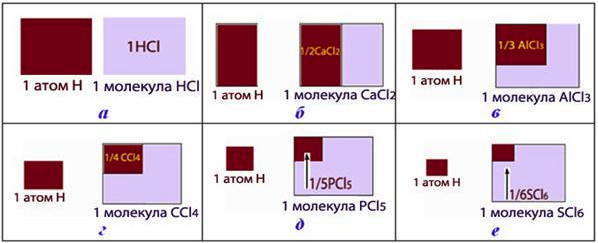
Поскольку эквиваленты элемента и эквиваленты сложного соединения могут быть разными, то как следствие, и фактор эквивалентности тоже будет иметь разные значения, для вычисления которого существуют простые формулы:

Закон сохранения массы и энергии
Великий русский ученый М.В. Ломоносов в 1748 году стал первым, кто осознал, что масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. Он установил закон который гласит, что суммарная масса всех продуктов химического превращения должна точно совпадать с суммарной массой исходных веществ. Помимо суммарной массы веществ, в химических реакциях сохраняется также число атомов каждого сорта независимо от того, в сколь сложных превращениях они участвуют и как переходят из одних молекул в другие.

В химических реакциях должна сохраняться также и энергия. Химически важный вывод из этого закона заключается в том, что поглощение или выделение тепла (теплота реакции) в конкретной химической реакции не зависит от того, каким путем осуществляется реакция — в одну или несколько стадий. Например, тепло, выделяющееся напрямую при сгорании газообразного водорода и графита (одна из форм углерода), должна совпадать с теплом, выделяющимся, когда водород и углерод используются для получения синтетического бензина, а заем этот бензин используется в качестве топлива. Если бы количество тепла, выделяемого в одной из двух описанных выше вариантов реакции, было неодинаковым, можно было бы воспользоваться этим и проводить более эффективную реакцию в одном направлении, а менее эффективную — в обратном. В результате получился бы циклический бестопливный источник тепла, непрерывно дающий даровую энергию. Но это всего лишь мечты о вечном двигателе, создание которого разрушается об незыблемую стену закона сохранения массы и энергии.

Закон сохранения массы: в процессе химической реакции не происходит образования или разрушения атомов.
Закон сохранения энергии: если сумма двух реакций представляет собой новую, третью реакцию, то теплота третьей реакции равна сумме теплот первых двух реакций. Говорят, что тепловые эффекты реакций аддитивны. Более подробно о законе сохранения тепла вы узнаете в конце данной главы, где все станет просто и ясно.
Кстати, в 1756 году Ломоносов экспериментально подтвердил химический закон сохранения массы, путем обжига металлов в запаянных сосудах. Вместо обжига металлов можно в запаянном сосуде сжечь фтор, закон сохранения массы все равно соблюдается:

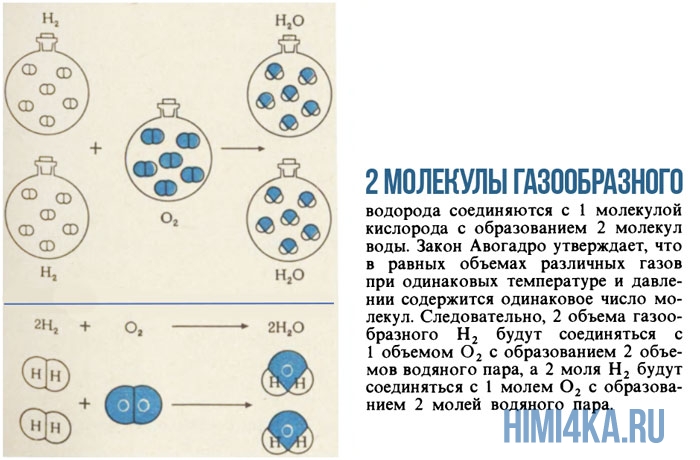
Моль — это просто средство подсчитывать атомы и молекулы порциями по 6,022·10 23 . Если известно, что две молекулы газообразного водорода H2 реагируют с одной молекулой газообразного кислорода O2, с образованием двух молекул воды H2O, то можно предсказать, что 2 моля H2, т.е. 4,032 г, будут реагировать с 1 молем O2, т.е. с 31,999 г, с образованием 2 молей H2O, т.е.36,031 г). Контрольное суммирование 4,032+31,999=36,031 подтверждают, что в этой реакции выполняется химический закон сохранения массы.
Читайте также:

