Угарный газ наименование и характеристика ахов кратко
Обновлено: 02.07.2024
Поражающие факторы АХОВ.К особенностям химического заражения, влияющим на жизнеобеспечение населения, можно отнести следующее:
—опасные концентрации АХОВ могут существовать от нескольких часов до нескольких суток;
—незначительная вероятность поражения людей АХОВ через кожные покровы не требует применения средств защиты кожи при эвакуации населения;
—низкая способность к заражению предметов одежды, мебели, предметов обихода позволяет пользоваться ими после обычного проветривания без специальной обработки;
—чрезвычайная оперативность проведения защитных мероприятий, т.к. пребывание людей в течение нескольких минут в облаке АХОВ может привести к массовым поражениям;
—трудности обнаружения АХОВ, из-за отсутствия надежных технических средств специфической индикации;
—эвакуация на короткий срок не требует строительства новых жилых домов, причем в теплое время года для размещения эвакуируемого населения могут широко применяться палаточные городки;
—дальность эвакуации зависит от масштабов аварии, но, как правило, не превышает 15 км от зоны заражения;
—в большинстве случаев не требуется санитарной обработки эвакуированного населения и дегазации одежды;
— возможность больших санитарных потерь среди населения потребует создания специальных бригад для оказания медицинской помощи пострадавшим;
— заражение водоисточников, продовольствия и пищевого сырья возможно лишь тогда, когда ядовитое вещество будет в жидкой фазе и, в отдельных случаях, в твердом состоянии;
— большинство видов продовольственного сырья и продуктов, хранящихся открыто, после воздействия на них газообразных АХОВ достаточно проверить или подвергнуть кулинарной обработке, чтобы в дальнейшем использовать по назначению.
Последствия химически опасных аварий характеризуются масштабом, степенью опасности и продолжительностью химического заражения.
Масштабхимического зараженияхарактеризуется:
—радиусом и площадью района аварии,
—глубиной и площадью зон распространения первичного и вторичного облака АХОВ,
—глубиной и площадью заражения местности АХОВ с опасными плотностями.
Степень опасности химического заражения характеризуется:
—возможным количеством поражений в зоне аварий и в зонах распространения АХОВ,
Монооксид углерода (лат. Carbon monoxide ; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
- ICSC 0023
- RTECS FG3500000
- ООН 1016
- EC 006-001-00-2
Классификация ООН
- Класс опасности ООН 2,3
- Вторичная опасность по классификации ООН 2,1
Содержание
Строение молекулы
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C≡O:, причём третья связь образована по донорно-акцепторному механизму, где углерод является акцептором электронной пары, а кислород — донором.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ 2 Oσ 2 zπ 4 x, yσ 2 C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум σ—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
Молекула слабо поляризована, электрический момент её диполя μ = 0,04·10 -29 Кл·м (направление дипольного момента O - →C + ). Ионизационный потенциал 14,0 в, силовая константа связи k = 18,6.
История открытия
Монооксид углерода был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем. То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. Моноксид углерода вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
Монооксид углерода в атмосфере Земли
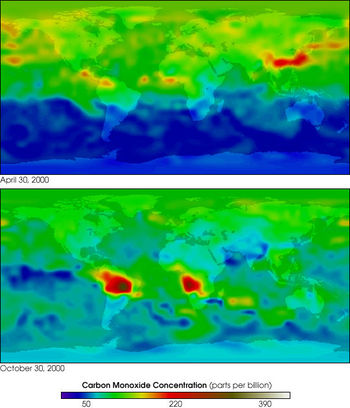
Различают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид углерода образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение монооксида углерода за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % монооксида углерода. В настоящее время в коммунальной сфере этот газ вытеснен гораздо менее токсичным природным газом (низшие представители гомологического ряда алканов — пропан и др.)
Поступление CO от природных и антропогенных источников примерно одинаково.
Монооксид углерода в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года, окисляясь гидроксилом до диоксида углерода.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2. или при восстановлении диоксида углерода раскалённым углём:

Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:

Физиологическое действие, токсичность
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. Признаками отравления служат головная боль, головокружение и потеря сознания. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее, чем кислород (при этом образуется карбоксигемоглобин), таким образом, блокируя процессы транспортировки кислорода и клеточного дыхания. Предельно допустимая концентрация монооксида углерода в воздухе промышленных предприятий составляет 0,02 мг/л. Концентрация более 0,1 % — смертельна. В выхлопе бензинового автомобиля допускается до 1,5-3 %.
Опытами на молодых крысах выяснено, что 0,02-процентная концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении монооксидом углерода: пострадавшего следует вынести на свежий воздух, полезно также кратковременное вдыхание паров нашатырного спирта.
TLV (предельная пороговая концентрация, США): 25 ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³
Защита от монооксида углерода
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
Свойства
| Стандартная энергия Гиббса образования ΔG | −137,14 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 197,54 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 29,11 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 0,838 кДж/моль |
| Энтальпия кипения ΔHкип | 6,04 кДж/моль |
| Критическая температура tкрит | −140,23°C |
| Критическое давление Pкрит | 3,499 МПа |
| Критическая плотность ρкрит | 0,301 г/см 3 |
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
C переходными металлами образует очень летучие, горючие и ядовитые соединения — карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
2K + 2CO → K + O - —C2—O - K +
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
Применение
- Моноксид углерода применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса (en:Clear smoke или en:Tasteless smoke технология). Допустимая концентрация CO равна 200 мг/кг мяса.
См. также
Литература
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Угарный газ" в других словарях:
УГАРНЫЙ ГАЗ — (монооксид углерода, СО), бесцветный, лишенный запаха ядовитый газ, который образуется при неполном сгорании ископаемых топлив; он присутствует, например, в составе угольного газа и выхлопных газов автомобилей. Ядовитое действие угарного газа… … Научно-технический энциклопедический словарь
Угарный газ — оксид углеродa, CO (a. carbon monoxide; н. Kohlenoxyd, Kohlenmonoxyd; ф. oxyde de carbone; и. oxido de carbono), хим. соединение углерода c кислородом из группы оксидов; природный газ без цвета и запаха. Bпервые выделен в лабораторных… … Геологическая энциклопедия
угарный газ — сущ., кол во синонимов: 2 • газ (55) • угар (22) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
УГАРНЫЙ ГАЗ — (монооксид углерода, оксид углерода, СО) продукт неполного окисления углерода и его соединений (в печи, двигателе и др.), чрезвычайно ядовитый газ (вызывает отравление организма угар (см. (1))) без цвета, запаха и вкуса, плохо растворим в воде.… … Большая политехническая энциклопедия
УГАРНЫЙ ГАЗ — УГАРНЫЙ ГАЗ, то же, что углерода оксид … Современная энциклопедия
УГАРНЫЙ ГАЗ — то же, что углерода оксид … Большой Энциклопедический словарь
УГАРНЫЙ ГАЗ — неполный окисел углерода, возникающий в условиях горения при недостатке кислорода воздуха. У. г. не имеет цвета, вкуса и запаха, ядовит; при содержании его в воздухе от 0,02% отравляет организм, а потому во всех цехах, в к рых может возникнуть… … Технический железнодорожный словарь
Угарный газ — см. Оксид углерода … Российская энциклопедия по охране труда
Угарный газ — УГАРНЫЙ ГАЗ, то же, что углерода оксид. … Иллюстрированный энциклопедический словарь
угарный газ — то же, что оксид углерода. * * * УГАРНЫЙ ГАЗ УГАРНЫЙ ГАЗ, то же, что углерода оксид (см. УГЛЕРОДА ОКСИД) … Энциклопедический словарь
Ниже рассматриваются лишь некоторые вещества (аммиак, хлор, хлорпикрин, формальдегид), наиболее широко используемые в национальной экономике. В Республики Карелия функционирует более 300 объектов экономики, располагающих значительными запасами опасных химических веществ. По токсичным свойствам и широкому распространению сжиженные аммиак и хлор являются наиболее опасными АХОВ.
Физико химические свойства. Аммиак – бесцветный газ с резким запахом нашатырного спирта, в 1,7 раза легче воздуха, хорошо растворяется в воде. Растворимость его в воде больше, чем всех других газов: при 20°C в одном объеме воды растворяется 700 объемов аммиака.
Температура кипения сжиженного аммиака – 33,35°С, так что даже зимой аммиак находится в газообразном состоянии. При температуре минус 77,7°С аммиак затвердевает.
При выходе в атмосферу из сжиженного состояния дымит. Облако аммиака распространяется в верхние слои приземного слоя атмосферы. Нестойкое АХОВ.
Поражающее действие в атмосфере и на поверхности объектов сохраняется в течение одного часа.
Пожаро и взрывоопасность. Горючий газ. Горит при наличии постоянного источника огня (при пожаре). При горении выделяет азот и водяной пар. Газообразная смесь аммиака с воздухом (при концентрациях в пределах от 15 до 28 % по объему) взрывоопасна. Температура самовоспламенения 650°С
Действие на организм. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Вызывают при этом обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении охлаждается, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м3. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м3, глаз – 490 мг/м3. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7–14 г/м3 – эритематозный, 21 г/м3 и более – буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м3. Кратковременное воздействие аммиака в концентрации 3,5 г/м3 и более быстро приводит к развитию общетоксических эффектов.
Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м3; максимальная разовая 0,2 мг/м3.
Признаки поражения аммиаком: обильное слезотечение, боль в глазах, потеря зрения, приступообразный кашель; при поражении кожи химический ожог 1 й или 2 й степени.
Аммиак перевозится и часто хранится в сжиженном состоянии под давлением собственных паров (6–18 кгс/см2), а также может храниться в изотермических резервуарах при давлении, близком к атмосферному давлению. При выходе в атмосферу дымит, быстро поглощается влагой.
Поведение в атмосфере. При выбросе паров в воздух очень быстро формируется первичное облако с высокой концентрацией аммиака. Образуется оно очень быстро (в течение 1–3 мин). За это время в атмосферу переходит 18–20 % вещества.
Вторичное облако возникает при испарении аммиака с площади разлива. Характеризуется оно тем, что концентрация его паров на 2–3 порядка ниже, чем в первичном облаке. Однако их продолжительность действия и глубина распространения значительно больше. В таких случаях за внешнюю границу зоны заражения принимают линию, обозначающую среднюю пороговую токсодозу – 15 (мг мин)/л. Продолжительность действия вторичного облака определяется временем испарения разлившегося вещества, которое, в свою очередь, зависит от температуры кипения и летучести вещества, температуры окружающей среды, скорости ветра и характера разлива (свободно или в поддон).
Аммиак почти в 2 раза легче воздуха, а это существенно влияет на глубину его распространения. Так, по сравнению с хлором глубина распространения первичного и вторичного облака, а также площадь зоны заражения будут примерно в 25 раз меньше.Заражает водоёмы при попадании в них.
Хлор – первое отравляющее вещество, применённое в первую мировую войну. Германское командование использовало хлор для газовой атаки 22.04.1915 года. Из 6000 баллонов на фронте 6 км в течение 5 мин было выпущено 120 т хлора, который распространился на глубину 5–8 км. Потери составили 15000 человек. Хлор к настоящему времени утратил значение как ОВ, однако весьма широко используется в различных отраслях производства.
Физико химические свойства. Хлор – зеленовато желтый газ с резким удушающим запахом. Плохо растворяется в воде, хорошо – в некоторых органических растворителях. В практических условиях растворимость хлора в воде незначительна и составляет 3 кг на 1 т воды. При обычном давлении сжижается при температуре – 34°С, образуя маслянистую жидкость желтовато зелёного цвета, затвердевающую при минус 101°С. Твёрдый хлор это бледно жёлтые кристаллы.
Под давлением хлор сжижается уже при обычных температурах. Температура кипения сжиженного хлора –34,1°С, следовательно, даже зимой хлор находится в газообразном состоянии. При испарении образует с водяными парами белый туман. Один килограмм жидкого хлора дает 0,315 м3 газа. Хорошо адсорбируется активным углём. Химически очень активен.
Пожаро и взрывоопасность хлора. Негорюч, но пожароопасен, поддерживает горение многих органических веществ. В смеси с водородом взрывоопасен. При нагревании ёмкости взрывается.
Действие хлора на организм. По физиологическому действию на организм хлор относится к группе веществ удушающего действия. В момент контакта он оказывает сильное раздражающее действие на слизистую оболочку дыхательных путей и глаза. Признаки поражения наступают сразу после воздействия, поэтому хлор является быстродействующим АХОВ. Проникая в глубокие дыхательные пути, хлор разрушает лёгочную ткань, вызывая отёк лёгких.
В зависимости от концентрации (токсодозы) хлора степень тяжести отравления может быть различной.
При воздействии хлора уже в незначительных концентрациях наблюдается покраснение коньюктивы глаз, мягкого нёба и глотки, а также бронхит, лёгкая одышка, охриплость, чувство сдавливания в груди.
Пребывание в атмосфере, содержащей хлор в концентрациях 1,5–2 г/м3, сопровождается появлением болевых ощущений в верхних дыхательных путях, жжением и болью за грудиной (чувство сильного сдавливания в груди), жжением и резью в глазах, слезотечением, мучительным сухим кашлем. Через 2–4 ч появляются признаки отёка лёгких. Увеличивается одышка, учащается пульс, начинается отделение пенистой жёлтоватой или красноватой мокроты.
Воздействие высоких концентраций хлора в течение 10–15 мин может привести к развитию химического ожога лёгких и смерти. При вдыхании хлора в очень высоких концентрациях смерть наступает в течение нескольких минут из за паралича дыхательного центра. Антидота против хлора не существует.
Предельно допустимая концентрация хлора в воздухе рабочей зоны производственного помещения составляет 1 мг/м3, однако человек начинает ощущать хлор в атмосферном воздухе при превышении концентрации 3 мг/м3. Следовательно, если чувствуется резкий удушливый запах хлора, то работать без средств защиты уже опасно. Раздражающее действие возникает при концентрации около 10 мг/м3. Воздействие 100–200 мг/м3 хлора в течение 30–60 минут опасно для жизни. Предельно допустимая концентрация хлора в атмосферном воздухе населённых пунктов равна: среднесуточная 0,03 мг/м3; максимальная разовая 0,1 мг/м3.
Признаки поражения хлором: сильное жжение, резь в глазах; слезотечение; учащённое дыхание; мучительный сухой кашель; сильное возбуждение; страх; в тяжёлых случаях остановка дыхания. При утечке или розливе хлора нельзя прикасаться к пролитому веществу, так как оставшийся в проливе хлор захолаживается до температуры минус 34°С.
Использование. Находит широкое применение для отбеливания тканей и бумажной массы, в производстве пластмасс, каучука, пестицидов, дихлорэтана, в цветной металлургии, а также в коммунально бытовом хозяйстве для обеззараживания воды.
;Хлор хранят и перевозят к местам потребления только в сжиженном состоянии. Наиболее распространённым способом хранения и транспортировки жидкого хлора является хранение под давлением, соответствующим давлению насыщенных паров хлора при температуре окружающей среды. Обычно он хранится в цилиндрических (10–250 м3) и шаровых (600–2000 м3) резервуарах в сжиженном состоянии под давлением собственных паров, величина которого зависит от температуры жидкого хлора. При температуре 25°С оно составляет 8 кгс/см2, а при температуре 60°С – 18 кгс/см2. Сжиженный хлор перевозят в железнодорожных цистернах, контейнерах и баллонах, которые одновременно могут являться временными хранилищами.
Поведение в атмосфере. При разрушении емкости происходит бурное (в зависимости от давления) испарение хлора. Доля мгновенно испарившегося хлора зависит от температуры хранящегося жидкого хлора. Чем выше его температура, тем большая доля хлора практически мгновенно испаряется при аварийном выбросе (20% при 20°С и 30% при 40°С). При этом образуется так называемое первичное облако с концентрациями, значительно превышающими смертельные концентрации. Продолжительность поражающего действия первичного облака хлора на небольших удалениях от места аварии будет составлять от нескольких десятков секунд до нескольких минут.
Вторичное облако, образующееся при испарении хлора с площади розлива, характеризуется концентрацией этого вещества в нем на 2–3 порядка ниже, чем в первичном облаке. Однако продолжительность действия в этом облаке хлора значительно больше и определяется временем испарения разливающейся жидкости. Испарение идет за счет тепла поддона или подстилающей поверхности, а также окружающего воздуха. Время испарения зависит от количества вещества, характера разлива: в поддон или свободно (в обваловку) и от метеорологических условий. Испарение может длиться несколько часов и даже суток.
Газообразный хлор в 2,5 раза тяжелее воздуха, поэтому облако хлора перемещается по направлению ветра близко к земле. Обладает хорошей проникающей способностью в негерметичные сооружения. Может скапливаться в низких участках местности, подвалах домов, колодцах, тоннелях и защитных сооружениях, не оборудованных в противохимическом отношении. За внешнюю границу зоны заражения принимается линия средней пороговой токсодозы, вызывающей начальные симптомы поражения. Она составляет 0,6 (мг.мин)/л.
Физико химические свойства. Хлорпикрин (ХП) – маслянистая жидкость бледно темного цвета, с очень резким раздражающим запахом картофельной ботвы, хорошо испаряющаяся даже зимой. Его пары в 5,7 раза тяжелее воздуха. Плохо растворим в воде, хорошо – в органических растворителях, горючих и смазочных материалах. Хорошо адсорбируется активным углём. Слабо гидролизуется даже при кипячении, не разлагается щелочами, кислотами. Температура кипения – 112,3°С.
Пожаро и взрывоопасность хлорпикрина. Взрывоопасен при нагревании. При нагревании до 400°С разлагается с образованием фосгена.
Действие хлорпикрина на организм человека. Поступает через органы дыхания. Является раздражающим веществом, обладает сильным слезоточивым действием. При концентрации 2 мг/м3 слезотечение начинается через несколько секунд. Непереносимая концентрация его паров составляет 80 мг/м3. В больших концентрациях ХП обладает удушающим действием, вызывая, как фосген, токсический отек легких. Концентрация паров ХП 0,8 г/м3 смертельна при 30 минутной экспозиции, а концентрация 8,0 г/м3 при 3 минутной экспозиции. В капельно жидком состоянии ХП вызывает слабые поражения кожи.
Предельно допустимая концентрация в воздухе рабочей зоны – 0,7 мг/м3. Предельно допустимая концентрация хлорпикрина в атмосферном воздухе населённых пунктов: среднесуточная 0,007 мг/м3; максимальная разовая 0,007 мг/м3.
Признаки поражения хлорпикрином: отсутствие скрытого периода действия (быстрое развитие сильного раздражения слизистой оболочки глаз и органов дыхания); резь, жжение и боль в глазах, слезотечение, першение в горле, кашель, рвота; при попадании на кожу дерматит.
Использование хлорпикрина. Используется главным образом для борьбы с вредителями сельского хозяйства, а также в качестве учебного опасного химического вещества при технической проверке противогазов (для проверки подбора лицевой части и исправности противогаза).
Защита. От паров ХП надежно защищает общевойсковой противогаз, гражданские противогазы типа ГП5 и ГП7, а также промышленный противогаз с коробкой марки А (БКФ). При работе с большим количеством ХП необходимо использовать средства защиты кожи.
Физико химические свойства. Формальдегид – бесцветный газ с резким удушающим запахом, несколько тяжелее воздуха (относительная массовая плотность паров 1,03), хорошо растворяется в воде. Заражает водоёмы. Водный (35–40% й) раствор формальдегида называют формалином (технический продукт содержит до 20% метилового спирта). Температура кипения минус 19,0 °С, температура плавления минус 118°С.
Пожаро и взрывоопасность. Горючий газ. В смеси с воздухом и кислородом взрывоопасен, воспламеняется от огня (пределы воспламенения от 7 до 73% по объему).
Использование формальдегида. Формальдегид используется для получения фенолоформальдегидных смол, изопрена, красителей, взрывчатых веществ, лекарств, а также как дубящее, антисептическое и дезодорирующее средство.
Действие формальдегида на организм человека. По действию – сильное раздражающее, прижигающее вещество (омертвление с длительным заживлением), наркотик. Поражает почки, печень. Пары формальдегида раздражают слизистые оболочки глаз и дыхательных путей. При попадании на кожу вызывает покраснение, образование пузырей.
Признаки поражения характерны для раздражающих веществ. Через несколько часов после воздействия формальдегида развиваются явления поражения глубоких отделов дыхательных путей: резкий кашель, давление в груди, одышка, тошнота рвота, двигательное возбуждение, нарушение сознания, судороги. В более поздний период отмечаются явления гепатита.
Предельно допустимая концентрация в воздухе рабочей зоны 0,5 мг/м3. Защиту органов дыхания обеспечивают фильтрующие общевойсковые и гражданские противогазы, а также промышленные противогазы марки А, М, БКФ.
Ниже рассматриваются лишь некоторые вещества (аммиак, хлор, хлорпикрин, формальдегид), наиболее широко используемые в национальной экономике. В Российской Федерации функционирует более 3600 объектов экономики, располагающих значительными запасами опасных химических веществ. По токсичным свойствам и широкому распространению сжиженные аммиак и хлор являются наиболее опасными АХОВ. Около 60 % химически опасных объектов имеют запасы аммиака и 35 % – хлора.
АММИАК. Химическая формула NH3.
Физико‑химические свойства. Аммиак – бесцветный газ с резким запахом нашатырного спирта, в 1,7 раза легче воздуха, хорошо растворяется в воде. Растворимость его в воде больше, чем всех других газов: при 20°C в одном объеме воды растворяется 700 объемов аммиака.
Температура кипения сжиженного аммиака – 33,35°С, так что даже зимой аммиак находится в газообразном состоянии. При температуре минус 77,7°С аммиак затвердевает.
При выходе в атмосферу из сжиженного состояния дымит. Облако аммиака распространяется в верхние слои приземного слоя атмосферы.
Нестойкое АХОВ. Поражающее действие в атмосфере и на поверхности объектов сохраняется в течение одного часа.
Пожаро и взрывоопасность. Горючий газ. Горит при наличии постоянного источника огня (при пожаре). При горении выделяет азот и водяной пар. Газообразная смесь аммиака с воздухом (при концентрациях в пределах от 15 до 28 % по объему) взрывоопасна. Температура самовоспламенения 650°С
Действие на организм. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Вызывают при этом обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении охлаждается, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м 3 . Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м 3 . Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м 3 , глаз – 490 мг/м 3 . При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7–14 г/м 3 – эритематозный, 21 г/м 3 и более – буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м 3 . Кратковременное воздействие аммиака в концентрации 3,5 г/м 3 и более быстро приводит к развитию общетоксических эффектов. Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м 3 ; максимальная разовая 0,2 мг/м 3 .
Признаки поражения аммиаком: обильное слезотечение, боль в глазах, потеря зрения, приступообразный кашель; при поражении кожи химический ожог 1 й или 2 й степени.
Поведение в атмосфере. При выбросе паров в воздух очень быстро формируется первичное облако с высокой концентрацией аммиака. Образуется оно очень быстро (в течение 1–3 мин). За это время в атмосферу переходит 18–20 % вещества.
Вторичное облако возникает при испарении аммиака с площади разлива. Характеризуется оно тем, что концентрация его паров на 2–3 порядка ниже, чем в первичном облаке. Однако их продолжительность действия и глубина распространения значительно больше. В таких случаях за внешнюю границу зоны заражения принимают линию, обозначающую среднюю пороговую токсодозу – 15 (мг мин)/л. Продолжительность действия вторичного облака определяется временем испарения разлившегося вещества, которое, в свою очередь, зависит от температуры кипения и летучести вещества, температуры окружающей среды, скорости ветра и характера разлива (свободно или в поддон).
Аммиак почти в 2 раза легче воздуха, а это существенно влияет на глубину его распространения. Так, по сравнению с хлором глубина распространения первичного и вторичного облака, а также площадь зоны заражения будут примерно в 25 раз меньше.
Заражает водоёмы при попадании в них.
47. Характеристика основных АХОВ – соляная кислота - воздействие на человека и защита.
Соляная (хлористоводородная) кислота (HCI) — раствор хлористого водорода в воде. Температура кипения — +108,6°С, плотность — 1,18 г/ см3 (при концентрации HCI 35%). Крепкая кислота “дымит” на воздухе из-за образования с парами воды капелек тумана. Давление хлористого водорода над крепкой соляной кислотой с увеличением ее концентрации растет.
Энергично взаимодействует с многими металлами с выходом водорода, с окислами металлов, выделяет свободные кислоты из фосфатов, силикатов, боратов.
Крепость технической соляной кислоты — 27,5—38% по массе. Транспортируют ее в стеклянных бутылях или гуммированых (покрытых слоем резины) металлических емкостях.
Надо помнить, что соляная кислота содержится в желудочном соке (около 0,3%) и способствует перевариванию пищи, убивает различные болезнетворные бактерии. При недостаточной кислотности желудочного сока прописывают для приема внутрь (по 5 — 15 капель 8,3%-й HCI на 1/2 стакана воды до или во время еды).
Применяется в химическом синтезе, для обработки руд, травления металлов.
Мировое производство превышает 10 млн. т в год. Поражение кислотами может произойти при вдыхании паров, при попадании на кожу, слизистые оболочки и через рот.
Пороговая концентрация серной кислоты по восприятию запаха и раздражению слизистых равна 0,6—0,85 мг/м3.
Соляная кислота концентрацией 15 мг/м3 поражает слизистые оболочки верхних дыхательных путей и глаза, концентрация 7 мг/м3 подобным эффектом не обладает.
Защиту органов дыхания от азотной, серной и соляной кислот обеспечивают фильтрующие и изолирующие противогазы, а также универсальные респираторы. Для защиты от этих кислот могут быть использованы промышленные противогазы марки В с аэрозольным фильтром (коробка окрашена в желтый цвет с белой вертикальной полосой), а для азотной кислоты также марки БКФ (защитный), промышленные универсальные респираторы РУ-60М-В. От азотной и соляной кислот защитят гражданские противогазы ГП-5, ГП-7 и детские, а от четырехокиси азота противогаз марки И (серый цвет).
При концентрации выше максимально допустимых должны использоваться только изолирующие противогазы, а для защиты кожи — костюмы из кислотозащитной ткани, защитные прорезиненные костюмы, резиновые сапоги и перчатки, специальные рукавицы для защиты от кислот.
48. Характеристика основных АХОВ – метиловый спирт - воздействие на человека и защита.
СН3ОН – бесцветная жидкость с запахом и вкусом, сходными с С2Н5ОН; сильный кумулятивный яд, обладающий направленным действием на нервную и сосудистую системы, зрительные нервы сетчатку глаз. Может вызвать острые отравления со смертельным исходом при ингаляции, абсорбции через неповрежденную кожу, заглатывании; раздражает слизистые оболочки верхних дыхательных путей, глаз. Смертельная доза метанола для человека при приеме внутрь равна 30 г, но тяжелое отравление, сопровождающееся слепотой, может быть вызвано 5-10 г. Повторное длительное воздействие метанола вызывает головокружения, боли в области сердца и печени, приводит к неврастении, вегето-сосудистой дистонии, недостаточной функции черепных нервов, зрения, обмена липидов и белков, тромбопении, заболеваниям органов желудочно-кишечного тракта, верхних дыхательных путей, дерматитам.
В профессиональных группах, подвергающихся хроническому воздействию метанола, отмечаются мутагенный, гонадотропный и эмбриотоксический эффекты.
Предельно допустимая концентрация метанола в разных средах составляет:
- атмосферный воздух населенных мест: максимальная разовая – 1 мг/м 3 , среднесуточная – 0,5 мг/м 3 , 3 класс опасности, лимитирующий показатель вредности – рефлекторно-резорбтивный.
Метанол входит в состав шеллаков, лаков, жидкостей для смывания красок и промывания ветрового стекла, жидкостей для копировальных машин и топлива для спиртовок. Кроме того, его используют для денатурирования этанола. Метанол обладает несколько меньшим, чем этанол, угнетающим действием на ЦНС. При его метаболизме образуются формальдегид и муравьиная кислота, вызывающая метаболический ацидоз и повреждение сетчатки.
Метанол быстро и полностью всасывается в ЖКТ. Его сывороточная концентрация достигает максимума через 1-2 ч после приема. Он проникает во все жидкости организма. Объем распределения метанола равен 0,7 л/кг, связывание с белками незначительно. Большая часть метанола метаболизируется в печени; до 10% удаляется в неизмененном виде с выдыхаемым воздухом и мочой. При низких сывороточных концентрациях (меньше 9 ммоль/л, то есть 30 мг%) элиминация метанола подчиняется кинетике первого порядка, а Т1/2 составляет около 3 ч. При более высоких концентрациях элиминация подчиняется кинетике нулевого порядка (скорость элиминации - 3 ммоль/л/ч, или 10 мг%/ч), а кажущийся Т1/2 достигает 30 ч. Этанол конкурирует с метанолом за алкогольдегидрогеназу ; при введении этанола Т1/2 метанола увеличивается до 30-60 ч.
Клиническая картина. Симптоматика разнообразна и может развиваться не сразу. Отсутствие проявлений вскоре после приема метанола еще не служит признаком благоприятного исхода. Ранние симптомы обусловлены действием самого метанола, поздние - действием муравьиной кислоты . Сначала обычно появляются тошнота ,рвота , боль в животе , головная боль , головокружение , признаки алкогольного опьянения. Возможно повышение осмотического интервала. Эти проявления сменяются комой , эпилептическими припадками , метаболическим ацидозом с повышенным анионным интервалом, повреждением сетчатки . Зрительные нарушения (нечеткость зрения , пляшущие и мерцающие пятна в глазах , расширение зрачков и утрата их реакции на свет , гиперемия дисков зрительных нервов , отек сетчатки ,слепота ) развиваются спустя 15-19 ч после приема. При быстром начале лечения эти нарушения обратимы. При тяжелом отравлении возможны снижение сократимости миокарда, брадикардия и шок .
Диагностика. Для ранней стадии характерно сочетание картины, напоминающей алкогольное опьянение, с повышенной осмоляльностью плазмы. Диагноз подтверждается измерением сывороточной концентрации метанола (при отравлении она обычно выше 6 ммоль/л, или 20 мг%). На поздней стадии появляетсяметаболический ацидоз
с увеличенным анионным интервалом, в крови выявляется метанол или муравьиная кислота в высокой концентрации.
ЛЕЧЕНИЕ. Срочно проводят мероприятия по удалению отравляющего вещества из ЖКТ. Метод выбора - аспирация желудочного содержимого. Проводят инфузионную терапию, мероприятия по поддержанию дыхания, купируют эпилептические припадки . При ацидозе вводят бикарбонат натрия , иногда в очень больших количествах. Ощелачивание мочи способствует удалению муравьиной кислоты . Показаны тиамин и фолиевая кислота в тех же дозах, что при отравлении этиленгликолем (эти витамины ускоряют метаболизм муравьиной кислоты). Показания к введению этанола :
- наличие клинической симптоматики;
- увеличенный осмотический интервал;
- метаболический ацидоз с увеличенным анионным интервалом;
- сывороточная концентрация метанола выше 6 ммоль/л (20 мг%) при низкой концентрации или в отсутствие этанола в крови.
Дозы этанола такие же, как при отравлении этиленгликолем . Необходимо часто определять сывороточную концентрацию этанола и поддерживать ее на уровне 20-30 ммоль/л (100- 150 мг%). Лечение продолжают, пока сывороточная концентрация метанола не станет ниже 3 ммоль/л (10 мг%) и не исчезнут все клинические проявления.
Гемодиализ ускоряет выведение метанола и муравьиной кислоты. Показания:
- сывороточная концентрация метанола выше 15 ммоль/л (50 мг%);
- повышенная сывороточная концентрация муравьиной кислоты;
- неэффективность других методов лечения.
49. Характеристика основных АХОВ – угарный газ (оксид углерода) - воздействие на человека и защита.
Угарный газ (окись углерода) представляет собой бесцветный газ, образующийся при неполном сгорании углеродосодержащих веществ. В производственных условиях возможно загрязнение атмосферного воздуха небольшими дозами угарного газа, длительное воздействие которого на организм человека приводит к хроническому отравлению Угарный газ, проникая в кровь, вступает в связь с гемоглобином, вытесняя из него кислород. Образующийся карбоксигемоглобин диссоциирует в 3600 раз медленнее, чем оксигемоглобин. Гемоглобин, соединенный с угарным газом, теряет способность переносить кислород. Вследствие этого наступает кислородное голодание тканей, к которому наиболее чувствительна нервная система. Это и определяет клиническую
картину отравления угарным газом. Острое отравление угарным газом может проявляться в легкой, средней и тяжелой степени.
Легкая и средняя степени отравления проявляются головной болью меньшей или большей интенсивности, тошнотой, рвотой, общей слабостью, нарушением сердечной деятельности, обмороками.
Тяжелая степень характеризуется развитием коматозного состояния с нарушением сердечной деятельности и дыхания, непроизвольным мочеиспусканием, исчезновением всех поверхностных и глубоких рефлексов. Может наступить смерть от паралича дыхательного или сердечно-сосудистого центра продолговатого мозга.
Лечение. Первая помощь при остром отравлении угарным газом заключается в том, чтобы немедленно вынести пострадавшего из зоны отравления и применять реанимационные мероприятия для восстановления дыхания и сердечной деятельности: вдыхание карбогена, цититон, лобелин, управляемое аппаратное дыхание, сердечные средства, обменное переливание крови, кальция хлорид. Профилактика производственных отравлений угарным газом требует систематического контроля за его содержанием в рабочих помещениях, организации приточно-вытяжной вентиляции, герметизации производственных процессов, связанных с образованием угарного газа.
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
Обычный способ защиты — использование изолирующего дыхательного аппарата (самоспасатель).
Читайте также:

