Сущность кислотно основного титрования кратко
Обновлено: 04.07.2024
Кислотно-основное титрование – это метод определения кислот, оснований, солей (растворы которых подвержены гидролизу, а также кислых и основных), основанный на реакции взаимодействия между протолитами – кислотой НА и основанием В:
В водных растворах – это реакция нейтрализации:
поэтому метод кислотно-основного титрования называют также методом нейтрализации.
Титрантами метода являются растворы сильных кислот и оснований: HCl, H2SO4, NaOH, КОН. Эти вещества не соответствуют требованиям, предъявляемым к стандартным веществам, поэтому концентрацию титрантов устанавливают стандартизацией их растворов. В качестве первичных стандартов чаще всего используют буру Na2B4O7 ∙ 10 H2O, безводный карбонат натрия Na2CO3, дигидрат щавелевой кислоты Н2С2О4 ∙ 2 Н2О.
Типы кислотно-основного титрования.
Ацидометрическое титрование (ацидометрия) – метод определения сильных и слабых оснований, солей слабых кислот, основных солей и других соединений, обладающих основными свойствами, путем титрования стандартным раствором сильной кислоты.
При титровании сильных оснований протекает реакция
Среда в точке эквивалентности (ТЭ) – нейтральная. При титровании слабых оснований, например, аммиака протекает реакция:
При этом образуются катионы слабого основания, подвергающиеся гидролизу:
поэтому среда в ТЭ – слабокислая, рН − + Н3О + → СН3СООН + H2O.
В точке эквивалентности присутствует слабая кислота – уксусная, вследствие диссоциации которой раствор имеет слабокислую реакцию среды, рН
При титровании солей слабых двухосновных кислот (карбонатов) после присоединения к аниону кислоты одного протона образуется кислый анион слабой кислоты:
Вследствие этого реакция среды в первой ТЭ – слабощелочная, рН > 7. При продолжении титрования кислого аниона слабой двухосновной кислоты во второй ТЭ присутствует эта слабая кислота:
Вследствие частичной диссоциации которой среда во второй ТЭ – слабокислая, рН
При титровании многоосновных кислот реакция среды в разных точках эквивалентности неодинакова. При титровании щелочью сернистой кислоты H2SO3 с последовательными константами кислотной диссоциации, равными К1 = 1,4 ∙ 10 −2 (кислота средней силы) и К2 = 6,2 ∙ 10 −8 (слабая кислота), в первой ТЭ присутствует амфолит НSO3 − :
Амфолит НSO3 − проявляет как кислые свойства:
Основные свойства выражены слабо, так как сернистая кислота – кислота средней силы. В данном случае преобладают кислотные свойства; значение рН в первой ТЭ определяется, как обычно для амфолитов, по формуле
рН = 0,5 ∙ (рК1 + рК2) = 0,5 ∙ (1,85 + 7,20) = 4,53 (рН 2− слабой кислоты НSO3 − :
Этот анион подвергается гидролизу:
поэтому среда во второй ТЭ – щелочная (рН > 7).
При титровании кислых солей образуются средние анионы соответствующей кислоты, свойства которых и определяют значение рН среды в ТЭ. Например, при титровании раствора NaHSO4 щелочью образуется анион сульфата SO4 2− :
Анион сульфата не подвергается гидролизу, поэтому среда в ТЭ – нейтральная.
Соли, содержащие катионы слабых оснований, титруются щелочами с выделением слабого основания. В ТЭ присутствует это основание, поэтому и реакция среды в ТЭ – слабощелочная. Например, при титровании щелочью раствора соли аммония протекает реакция:
При этом образуется слабое основание – аммиак. В ТЭ вследствие взаимодействия аммиака с водой среда слабощелочная (рН > 7):

Титрование это
Титрование является очень популярной процедурой определения относительных концентраций химических эквивалентов в кислотных или основных растворах. И если Вам не приходилось выполнять лабораторные работы по титрованию в школе, то в университете или колледже титровать Вы будете не раз! Итак, переходим к определению:
Титрование — это способ определения концентрации кислоты или основания в растворе, путем измерения объема титранта (основания или кислоты с заданной концентрацией) необходимого для полной нейтрализации имеющегося реагента.
Точка эквивалентности
Поговорим о сущности процесса кислотно-основного титрования. Из необходимого оборудования, грубо говоря, вам понадобится лишь бюретка (стеклянная трубка с краником) и колба. Бывают два случая:
- Когда нужно определить концентрацию основания в колбе путем добавления из бюретки кислоты известной концентрации.
- Наоборот, когда необходимо определить концентрацию кислоты в колбе путем добавления основания известной концентрации.
Рассмотрим титрование в первом случае, когда титруемый раствор — основание, а титрант — кислота. Начинаем к анализируемому образцу основания постепенно добавлять раствор кислоты с заранее определенной концентраций до тех пор, пока число эквивалентов кислоты не будет равно числу эквивалентов основания. Продолжая титровать, в конце концов мы достигнем конечной точки титрования, или, как ее еще называют, точки эквивалентности — момент титрования, когда число эквивалентов титранта и титруемого раствора будут точно равны.
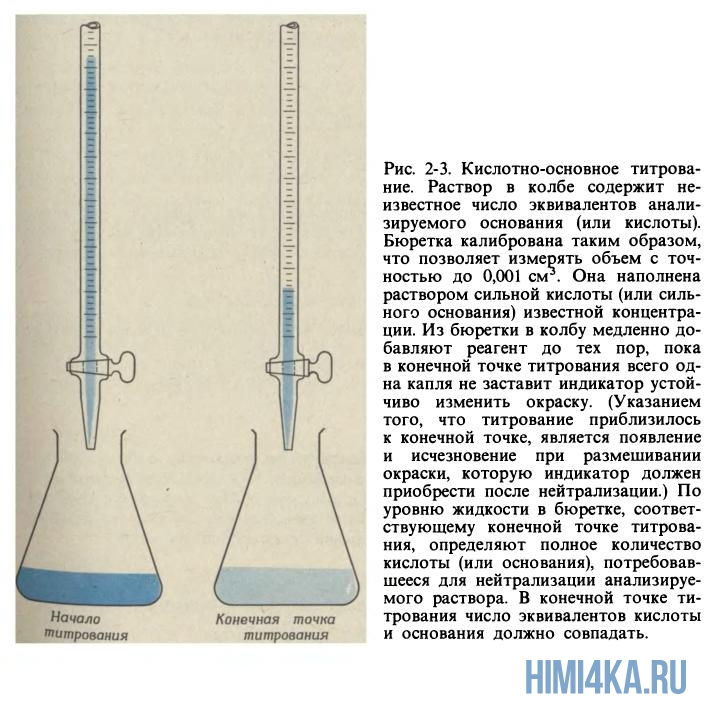
Чтобы понять, достигнута точки эквивалентности или еще нет, обычно используют различные кислотно-основные индикаторы. Для этого перед непосредственным титрованием в колбу с анализируемым раствором добавляют пару капель необходимого индикатора, и в момент достижения точки эквивалентности раствор начинает менять свой цвет.
Зная использованный объем титранта и его концентрацию, можно вычислить число эквивалентов основания в анализируемом образце. Если NA и NB — нормальности растворов кислоты и основания, а VA и VB — их объемы в момент нейтрализации, то:
С теорией покончено, переходим к решению задач на титрование.
Задачи на титрование
Пример 1. Допустим, химичка потребовала, чтобы вы нейтрализовали 25,00 мл раствора кислоты H3PO4. На титрование у вас ушло 30,25 мл раствора NaOH. Вычислите отношение нормальных и молярных концентраций обоих растворов.
Нормальная концентрация NaOH совпадает с молярной, а у H3PO4 нормальность в три раза больше молярной концентрации, поэтому:
Пример 2. Вы израсходовали 10,81 мл 0,1 н раствора HCl на титрование 25,00 мл раствора Ca(OH)2. Какую нормальность и молярность имеет анализируемый раствор? Сколько граммов Ca(OH)2 содержится в растворе?
Первым делом вычислим нормальную концентрацию анализируемого раствора Ca(OH)2:
- NCa(OH)2 = ( VHCl/ VCa(OH)2) × NHCl = ( 10,81 мл / 25,00 мл ) × 0,1 н = 0,0432 н
Молярная концентрация Ca(OH)2 вдвое меньше его нормальной концентрации, так как химический эквивалент Ca(OH)2 равен 2. Поэтому анализируемый раствор имеет молярность 0,0216 М Ca(OH)2. Чтобы ответить на вопрос, сколько граммов Ca(OH)2 содержится в растворе, необходимо найти его количество вещества в растворе, для этого следует множить молярность на объем:
По таблице Менделеева определяем, что молекулярная масса Ca(OH)2 равна 74,1 г/моль, а значит в растворе содержится:
Пример 3. Химик-органик синтезирует новую кислоту. Он растворяет 0,5 г этой кислоты в определенном объеме воды и устанавливает, что для нейтрализации полученного раствора требуется 15,73 мл 0,437 н. раствора NaOH. Чему равен грамм-эквивалент синтезированной им кислоты? Если известно, что эта кислота содержит три ионизуемые группы –COOH, чему равна ее молекулярная масса?
Число эквивалентов основания, понадобившееся для нейтрализации, равно:
Грамм-эквивалент кислоты определяется из соотношения:
Так как грамм-эквивалент кислоты равен 72,8 г, а каждый ее моль высвобождает 3 эквивалента ионов водорода H + , молекулярная масса кислоты должна быть равна 3·72,8 г = 218 г.

Автоматизация методик анализа повышает точность измерения, повторяемость и воспроизводимость результатов. Настроив нужный метод один раз, можно не беспокоиться о влиянии человеческого фактора на результат измерения. Это особенно полезно для предприятий, практикующих вахтовый метод, когда доступ к одной установке имеют несколько сотрудников.
Стандартный комплект для потенциометрического титрования на базе прибора GT-200 (совместная разработка "Mitsubishi Chemical Analytech Co., Ltd." и "Nittoseiko Analytech", Япония) включает:
базовый блок для титрования (автоматический титратор);
бюретку, с помощью которой контролируется объем подаваемого раствора;
магнитную мешалку с контролем перемешивания;
систему электродов для кислотно-основного титрования.
Подходящие электроды для потенциометрического титратора GT-200
Выбор электродов зависит от растворимости аналита в воде.
Для водного титрования рекомендован комплект, состоящий из раздельной пары электродов.
измерительный стеклянный pH-электрод GTPH1B;
электрод сравнения для водных сред GTRE10B.
с узким носиком для небольших емкостей GTPC1C.
Кислотно-основное титрование неводных сред особенно удобно выполнять на автоматическом приборе, поскольку это избавляет лаборанта от контакта с уксусной кислотой, используемой для анализа.
Система для неводного титрования включает:
• измерительный стеклянный pH-электрод GTPH1B;
• электрод сравнения для водных и неводных сред GTRS10B.
Именно такой комплект описан в ГОСТ 11362-96 (определение числа нейтрализации в маслах и нефтепродуктах).
Дополнительно прибор можно оснастить весами с автоматической передачей веса образца в прибор, автоподатчиком GT-200SC на 12/24 образца, принтером и дополнительными разъемами для подключения датчиков другого типа.
Сущность кислотно-основного титрования
Кислотно-основное титрование – это метод объемного титриметрического анализа, основанный на реакции нейтрализации, позволяющий определять концентрации кислот или оснований в водных и неводных средах.
Суть кислотно-основного титрования сводится к передаче протона либо от титранта к аналиту, либо, наоборот, от аналита к титранту. В процессе анализа необходимо точно определить, когда количество добавленного компонента будет ЭКВИВАЛЕНТНО количеству измеряемого компонента. Этот момент называют ТОЧКОЙ ЭКВИВАЛЕНТНОСТИ (ТЭ). В случае КО титрования точка эквивалентности будет достигаться при строго определенном значении pH, поэтому для ее определения используют индикаторы. По мере добавления кислоты/основания, сразу после прохождения ТЭ, в растворе будут появляться/исчезать свободные протоны и индикатор поменяет окрас раствора. Также изменение pH среды можно отслеживать потенциометрически. В этом случае регистрируют скачок потенциала при достижении ТЭ.
При определении содержания кислот в качестве титранта используют растворы KOH, NaOH или Ba(OH)2 известной концентрации. Определение концентрации оснований проводится растворами сильных кислот: HCl или H2SO4.
Перед началом анализа необходимо определить точную концентрацию титранта.
Стандартизацию кислот выполняют с помощью соды (Na2CO3) или буры (Na2B4O7*10H2O).
Щелочи стандартизируют гидрофталатом калия.
Другой способ приготовления титранта с точно известной концентрацией – использовать фиксанал.
При работе с щелочами нельзя допускать их контакта с воздухом, поскольку содержащаяся в нем углекислота легко поглощается титрантом, из-за чего меняется его концентрация. Хранить щелочи в стекле долгое время тоже нельзя, поскольку они с ним взаимодействуют.
Кривые кислотно-основного титрования
Кривая КО титрования строится в координатах: pH раствора – объем добавленного титранта.
На кривой обычно видны две точки перегиба (ТП), между которыми находится точка эквивалентности.
Расстояние ΔpH между точками перегиба называется скачком титрования. Его величина зависит от концентраций реагентов. Чем выше концентрация титранта, тем больше скачок, вызванный сменой кислотности раствора в районе ТЭ. Этот скачок вызывает резкую смену окраса индикатора.
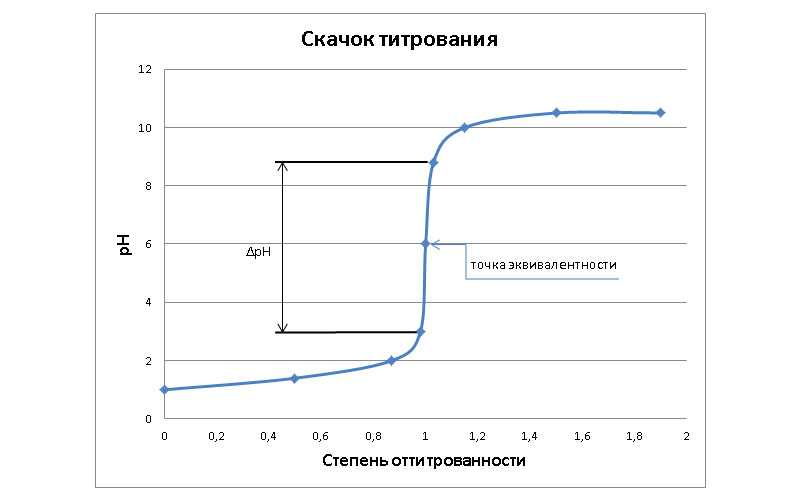
Вид кривых кислотно-основного титрования будет зависеть от природы реагирующей пары: кислота-основание.
Можно рассмотреть следующую классификацию кривых титрования:
сильная кислота – сильное основание
слабая кислота – сильное основание
сильная кислота – слабое основание
слабая кислота – слабое основание
Все они будут отличаться величиной скачка титрования и областью расположения точки эквивалентности.
При титровании многоосновных кислот их диссоциация происходит ступенчато, поэтому на кривой титрования будет несколько точек перегиба. ТП могут попадать в разные диапазоны pH, в таких случаях для их идентификации требуются индикаторы с различным рабочим интервалом.
Смеси кислот (оснований) будут охарактеризованы еще более сложными кривыми. На них возможны наложения точек перегиба, что затрудняет точную идентификацию ТЭ ручным способом анализа.
Индикаторы для кислотно-основного титрования
Все индикаторы работают в определенном интервале pH, который должен попадать, хотя бы частично, в диапазон скачка титрования.
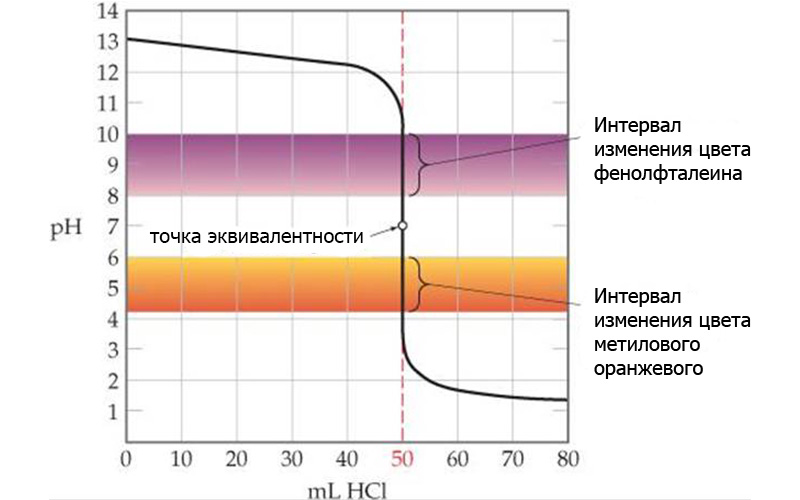
Именно поэтому электрохимические методы анализа являются более универсальными. Потенциометрический титратор построит полную кривую титрования и автоматически рассчитает точку эквивалентности по скачку потенциала.
Применение кислотно-основного титрования
Потенциометрический метод кислотно-основного титрования получил широкое распространение для определения кислотных и щелочных чисел в нефтепродуктах. В Фармакопее также представлены методы неводного КО титрования. В химической промышленности для контроля концентраций кислот и щелочей применяется анализ в водных средах.

Автоматизация методик анализа повышает точность измерения, повторяемость и воспроизводимость результатов. Настроив нужный метод один раз, можно не беспокоиться о влиянии человеческого фактора на результат измерения. Это особенно полезно для предприятий, практикующих вахтовый метод, когда доступ к одной установке имеют несколько сотрудников.
Стандартный комплект для потенциометрического титрования на базе прибора GT-200 (совместная разработка "Mitsubishi Chemical Analytech Co., Ltd." и "Nittoseiko Analytech", Япония) включает:
базовый блок для титрования (автоматический титратор);
бюретку, с помощью которой контролируется объем подаваемого раствора;
магнитную мешалку с контролем перемешивания;
систему электродов для кислотно-основного титрования.
Подходящие электроды для потенциометрического титратора GT-200
Выбор электродов зависит от растворимости аналита в воде.

Для водного титрования рекомендован комплект, состоящий из раздельной пары электродов.
измерительный стеклянный pH-электрод GTPH1B;
электрод сравнения для водных сред GTRE10B.
с узким носиком для небольших емкостей GTPC1C.
Кислотно-основное титрование неводных сред особенно удобно выполнять на автоматическом приборе, поскольку это избавляет лаборанта от контакта с уксусной кислотой, используемой для анализа.
Система для неводного титрования включает:
• измерительный стеклянный pH-электрод GTPH1B;
• электрод сравнения для водных и неводных сред GTRS10B.
Именно такой комплект описан в ГОСТ 11362-96 (определение числа нейтрализации в маслах и нефтепродуктах).
Дополнительно прибор можно оснастить весами с автоматической передачей веса образца в прибор, автоподатчиком GT-200SC на 12/24 образца, принтером и дополнительными разъемами для подключения датчиков другого типа.
Сущность кислотно-основного титрования
Кислотно-основное титрование – это метод объемного титриметрического анализа, основанный на реакции нейтрализации, позволяющий определять концентрации кислот или оснований в водных и неводных средах.
Суть кислотно-основного титрования сводится к передаче протона либо от титранта к аналиту, либо, наоборот, от аналита к титранту. В процессе анализа необходимо точно определить, когда количество добавленного компонента будет ЭКВИВАЛЕНТНО количеству измеряемого компонента. Этот момент называют ТОЧКОЙ ЭКВИВАЛЕНТНОСТИ (ТЭ). В случае КО титрования точка эквивалентности будет достигаться при строго определенном значении pH, поэтому для ее определения используют индикаторы. По мере добавления кислоты/основания, сразу после прохождения ТЭ, в растворе будут появляться/исчезать свободные протоны и индикатор поменяет окрас раствора. Также изменение pH среды можно отслеживать потенциометрически. В этом случае регистрируют скачок потенциала при достижении ТЭ.
При определении содержания кислот в качестве титранта используют растворы KOH, NaOH или Ba(OH)2 известной концентрации. Определение концентрации оснований проводится растворами сильных кислот: HCl или H2SO4.
Перед началом анализа необходимо определить точную концентрацию титранта.
Стандартизацию кислот выполняют с помощью соды (Na2CO3) или буры (Na2B4O7*10H2O).
Щелочи стандартизируют гидрофталатом калия.
Другой способ приготовления титранта с точно известной концентрацией – использовать фиксанал.
При работе с щелочами нельзя допускать их контакта с воздухом, поскольку содержащаяся в нем углекислота легко поглощается титрантом, из-за чего меняется его концентрация. Хранить щелочи в стекле долгое время тоже нельзя, поскольку они с ним взаимодействуют.
Кривые кислотно-основного титрования
Кривая КО титрования строится в координатах: pH раствора – объем добавленного титранта.
На кривой обычно видны две точки перегиба (ТП), между которыми находится точка эквивалентности.
Расстояние ΔpH между точками перегиба называется скачком титрования. Его величина зависит от концентраций реагентов. Чем выше концентрация титранта, тем больше скачок, вызванный сменой кислотности раствора в районе ТЭ. Этот скачок вызывает резкую смену окраса индикатора.

Вид кривых кислотно-основного титрования будет зависеть от природы реагирующей пары: кислота-основание.
Можно рассмотреть следующую классификацию кривых титрования:
сильная кислота – сильное основание
слабая кислота – сильное основание
сильная кислота – слабое основание
слабая кислота – слабое основание
Все они будут отличаться величиной скачка титрования и областью расположения точки эквивалентности.
При титровании многоосновных кислот их диссоциация происходит ступенчато, поэтому на кривой титрования будет несколько точек перегиба. ТП могут попадать в разные диапазоны pH, в таких случаях для их идентификации требуются индикаторы с различным рабочим интервалом.
Смеси кислот (оснований) будут охарактеризованы еще более сложными кривыми. На них возможны наложения точек перегиба, что затрудняет точную идентификацию ТЭ ручным способом анализа.
Индикаторы для кислотно-основного титрования
Все индикаторы работают в определенном интервале pH, который должен попадать, хотя бы частично, в диапазон скачка титрования.

Именно поэтому электрохимические методы анализа являются более универсальными. Потенциометрический титратор построит полную кривую титрования и автоматически рассчитает точку эквивалентности по скачку потенциала.
Применение кислотно-основного титрования
Потенциометрический метод кислотно-основного титрования получил широкое распространение для определения кислотных и щелочных чисел в нефтепродуктах. В Фармакопее также представлены методы неводного КО титрования. В химической промышленности для контроля концентраций кислот и щелочей применяется анализ в водных средах.
Читайте также:

