Современная теория строения атома кратко
Обновлено: 02.07.2024
Современная модель строения атома базируется на четырех положениях:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома (например, радиус атома водорода сост. 0,046 нм, а радиус протона или ядра атома водорода составляет 6,5 . 10 -7 нм).
2. Положительный заряд и почти вся масса атома сосредоточены в ядре атома.
3. Ядра атомов состоят из протонов и нейтронов (общее название нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов (p) и нейтронов (n) соответствует его массовому числу.
4. Вокруг ядра по орбиталям вращаются электроны. Число электронов в невозбужденном (основном) сост. равно заряду ядра (табл. 1).
Различные виды атомов имеют общее название – нуклиды. Нуклиды с одинаковым зарядом, различными массовыми числами и числом нейтронов в ядре называется изотопами. Нуклиды с одинаковыми массовыми числами, но различными зарядами ядра и числа нейтронов в ядре называются изобарами. Нуклиды с одинаковым числом нейтронов, но различным зарядом и массовым числом называется изотонами.
В соответствии с представлениями квантовой механики, электрон обладает двойственной природой, т.е. корпускулярно-волновым дуализмом: с одной стороны электрон – это частица, которая имеет массу, заряд и скорость движения; а с другой стороны электрон проявляет волновые свойства, такие как способность к дифракции, интерференции и особенности движения. Согласно принципу неопределенности В. Гейзенберга невозможно точно определить энергию и положение электрона, поэтому в квантовомеханической модели атома используют вероятностный подход для характеристики положения электрона. Вероятность нахождения электрона в определенной области пространства описывается квадратом волновой функции Ψ 2 (пси), которая характеризует амплитуду волны, как функцию координат электрона. Электрон может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Свойства электронных частиц образующих атомы
| Частицы | Обозна-чение | Масса покоя | Заряд | ||
| г | a. е м. | В единицах массы электрона | Кл | В единицах заряда электрона | |
| Электрон | - 0 e или е | 9,110*10 -28 | 0,000549 | -1,6*10 -19 | -1 |
| Протон | 1 p или р | 1,673*10 -24 | 1,007276 | 1,6*10 -19 | +1 |
| Нейтрон | 1 n или n | 1,675*10 -24 | 1,008665 |
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называется орбиталью.
Орбиталь характеризует вероятность нахождения электрона в определенном пространстве вокруг ядра. Она ограничена в трехмерном пространстве поверхностями той или иной формы. Вероятность нахождения электрона внутри данной области пространства составляет не менее 95 %.
Волновая функция входит в уравнение Шредингера, решение которого позволяет описать поведение электрона в атоме. Точно это уравнение решено для атома H и ионов He + , Li 2+ , H2 + . Оно имеет бесконечно большое число решений, поскольку энергия электрона может принимать бесконечно большое число квантовых значений, однако все решения можно разделить на три серии и ограничиться только теми значениями энергии, которые один электрон может принимать в поле ядра атома водорода (протона). Три серии решения уравнения объединяются значениями связанных между собой квантовых чисел, т.е. положения электрона в атоме описывается четырьмя квантовыми числами.

Современная модель строения атома базируется на четырех положениях:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома (например, радиус атома водорода сост. 0,046 нм, а радиус протона или ядра атома водорода составляет 6,5 . 10 -7 нм).
2. Положительный заряд и почти вся масса атома сосредоточены в ядре атома.
3. Ядра атомов состоят из протонов и нейтронов (общее название нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов (p) и нейтронов (n) соответствует его массовому числу.
4. Вокруг ядра по орбиталям вращаются электроны. Число электронов в невозбужденном (основном) сост. равно заряду ядра (табл. 1).
Различные виды атомов имеют общее название – нуклиды. Нуклиды с одинаковым зарядом, различными массовыми числами и числом нейтронов в ядре называется изотопами. Нуклиды с одинаковыми массовыми числами, но различными зарядами ядра и числа нейтронов в ядре называются изобарами. Нуклиды с одинаковым числом нейтронов, но различным зарядом и массовым числом называется изотонами.
В соответствии с представлениями квантовой механики, электрон обладает двойственной природой, т.е. корпускулярно-волновым дуализмом: с одной стороны электрон – это частица, которая имеет массу, заряд и скорость движения; а с другой стороны электрон проявляет волновые свойства, такие как способность к дифракции, интерференции и особенности движения. Согласно принципу неопределенности В. Гейзенберга невозможно точно определить энергию и положение электрона, поэтому в квантовомеханической модели атома используют вероятностный подход для характеристики положения электрона. Вероятность нахождения электрона в определенной области пространства описывается квадратом волновой функции Ψ 2 (пси), которая характеризует амплитуду волны, как функцию координат электрона. Электрон может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Свойства электронных частиц образующих атомы
| Частицы | Обозна-чение | Масса покоя | Заряд | ||
| г | a. е м. | В единицах массы электрона | Кл | В единицах заряда электрона | |
| Электрон | - 0 e или е | 9,110*10 -28 | 0,000549 | -1,6*10 -19 | -1 |
| Протон | 1 p или р | 1,673*10 -24 | 1,007276 | 1,6*10 -19 | +1 |
| Нейтрон | 1 n или n | 1,675*10 -24 | 1,008665 |
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называется орбиталью.
Орбиталь характеризует вероятность нахождения электрона в определенном пространстве вокруг ядра. Она ограничена в трехмерном пространстве поверхностями той или иной формы. Вероятность нахождения электрона внутри данной области пространства составляет не менее 95 %.
Волновая функция входит в уравнение Шредингера, решение которого позволяет описать поведение электрона в атоме. Точно это уравнение решено для атома H и ионов He + , Li 2+ , H2 + . Оно имеет бесконечно большое число решений, поскольку энергия электрона может принимать бесконечно большое число квантовых значений, однако все решения можно разделить на три серии и ограничиться только теми значениями энергии, которые один электрон может принимать в поле ядра атома водорода (протона). Три серии решения уравнения объединяются значениями связанных между собой квантовых чисел, т.е. положения электрона в атоме описывается четырьмя квантовыми числами.

Сегодня даже дети дошкольного возраста знают, что все вокруг состоит из молекул и атомов. А вот что это такое и из чего они, в свою очередь, состоят — знает далеко не каждый взрослый. В этой статье просто и доступно, поделимся современными знаниями о мельчайших частицах.
Что такое атом — история открытия
Итак, все окружающие нас объекты и мы сами состоим из крошечных частиц, которые называются атомами. В их состав входят еще меньшие частицы: протоны, нейтроны и электроны. Современное строение атома наука открыла сравнительно недавно, до этого его долго считали неделимой частицей.
Мысль о том, что все вокруг состоит из мельчайших, невидимых глазу частиц возникла в Древней Греции и Древней Индии еще до нашей эры. Древнегреческий философ Демокрит был материалистом. Именно он первым ввел в обиход понятие атома (с греческого — atomos — неделимый). Демокрит считал, что невидимые частицы вечны, их бесчисленное множество, они постоянно двигаются, обладают весом, размером и формой.
Последующее развитие теория атомизма получила в Средние века и Новое время в работах французского физика Пьера Гассенди (1592—1655 гг.) и английского ученого Роберта Бойля (1627-1691 гг.).
Развитием атомистической теории и превращением ее в атомно-молекулярное учение занимались также Ломоносов, Лавуазье, Дальтон.
Но теорию Томсона опроверг Эрнест Резерфорд. В 1917 году британским физиком было совершено открытие протона — положительно заряженной элементарной частицы. Открыв протон, Резерфорд предположил и наличие нейтронов — нейтрально заряженных частиц в атоме. Позже их существование экспериментально подтвердил Джеймс Чэдвик. Основываясь на своем открытии, Резерфорд предложил свое описание атомной модели: положительно заряженное ядро и окружающие его электроны.
В начале XX века планетарную модель заменила волновая модель, принятая научным сообществом во всем мире.
Современные представления о строении атома были бы невозможны без открытия элементарных частиц и явления радиоактивности. Огромный вклад в науку, помимо вышеназванных ученых, внесли Эрвин Шредингер, Макс Планк, Вольфганг Паули.
Атомная структура — современные знания

На чем базируется, из скольки главных частиц состоит
Основу современных представлений теории атомизма составляют следующие положения:
- Атом состоит из ядра и окружающей его электронной оболочки.
- Электронная оболочка представляет собой движущиеся вокруг ядра электроны.
- Ядро всегда положительно заряжено — оно состоит из протонов, обозначающихся символом — p и нейтронов — n. Заряд ядра всегда равен сумме протонов в нем.
- Атом электронейтрален, так как число отрицательных частиц — электронов (е–) равняется числу положительных частиц — протонов (p+).
- Его электронейтральность может нарушаться, при условии, что он отдает или присоединяет электроны, при этом он становится положительно или отрицательно заряженным ионом соответственно.
- Электроны располагаются вокруг ядра в трехмерном пространстве. Они находятся в специальных областях, которые называют орбиталями. Каждая из этих областей характеризуется формой, размером и ориентацией внутри атома, каждой из орбиталей присваивается буквенно-цифровое обозначение.
Свойства, масса и размер
Массовое число — это сумма нейтронов и протонов в ядре атома.
Размеры атомов крайне малы. Самым маленьким по размеру считается атом Гелия, его радиус составляет 32 пикометра. Атом цезия является самым большим, его радиус равен 225 пикометров. Пико = \(10^\) . А радиус ядра в 10 000 раз меньше радиуса атома.
Электронно-графическая формула
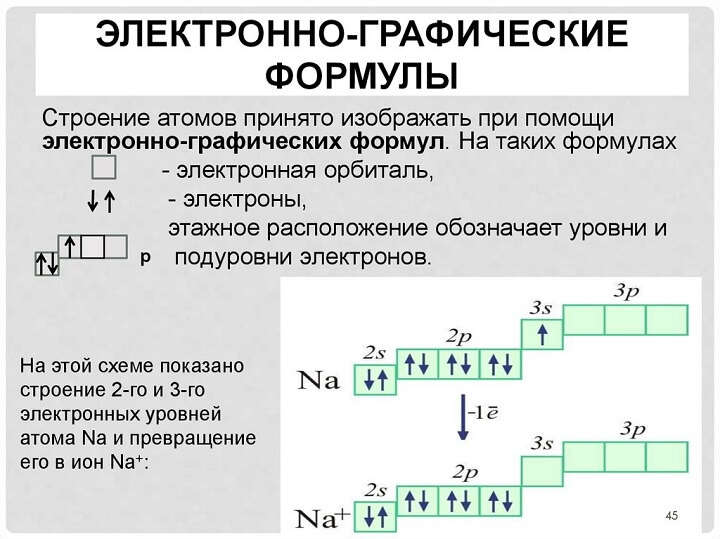
Периодическая система и строение атома, какая взаимосвязь
В таблице Менделеева указывается относительная атомная масса химических элементов.
Количество протонов в ядре соответствует порядковому номеру химического элемента в известной таблице Менделеева. Заряд ядра — это главная характеристика атома, которая влияет на распределение вещества в таблице Менделеева.
Количество нейтронов в таблице не указывается, их можно рассчитать, вычтя из массы атома порядковый номер химического вещества (число его протонов).
Почему ядро не распадается
Науке известно 4 основных вида взаимодействия между телами и частицами:
- слабое;
- сильное;
- электромагнитное;
- гравитационное.
Внутри атома, в его ядре, между протонами и нейтронами существует сильное взаимодействие, которое не позволяет ядру с легкостью распадаться. В середине XX века человечество обнаружило, что при расщеплении ядер происходит высвобождение огромной энергии, что послужило толчком для развития атомной промышленности и ядерного оружия.
Атомистическая теория — не самая сложная тема, которая есть в физике и химии. Если столкнулись с заданиями посложнее и не понимаете, с чего начать, ищите помощи у специалистов Феникс.Хелп!

Современные представления о строении атома
Элемент ЕГЭ: 1.1 Современные представления о строении атома. 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояние атомов.
Современные представления о строении атома

Атом – химически неделимая электронейтральная частица, которая состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Атомы не имеют заряда (нейтральны). Если атом присоединяет один или несколько электронов, он приобретает отрицательный заряд и превращается в анион. Если атом теряет один или несколько электронов, он приобретает положительный заряд и превращается в катион. Заряд иона указывают арабской цифрой и знаком после символа атома.
Состав ядра: А = Z + N, где А — массовое число; Z — протонное число (число протонов); N — число нейтронов.
Элементарные частицы
Порядковый номер элемента в периодической системе:
- Заряд ядра атома
- Число протонов в ядре атома
- Число электронов в атоме

Нуклиды – разновидности атомов с фиксированным массовым числом А, числом протонов Z и нейтронов N в ядре.

Основные положения квантовой теории строения атома:
- Дискретность энергии электрона
- Двойственная (корпускулярно-волновая) природа электрона
- Невозможность определения траектории электрона (принцип неопределенности)
Относительная атомная масса элемента (Ar)
Физическая величина, показывающая, во сколько раз средняя масса атомов данного элемента больше 1/12 части массы изотопа углерода 12 С.

Атомные орбитали
Орбиталь — пространство вокруг ядра, в котором нахождение электрона наиболее вероятно (вероятность более 90%)

Порядок заполнения орбиталей в основном состоянии
1) Принцип наименьшей энергии. Электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.


2) Принцип Паули. На каждой орбитали могут находиться не более двух электронов, причём спины их противоположны.
Спин электрона — свойство электрона, характеризующее его способность взаимодействовать с магнитным полем. Может принимать два значения (положительное и отрицательное).

Последовательность заполнения орбиталей электронами в основном состоянии:
Энергетические уровни и подуровни

Элементы, у которых идет заполнение s-подуровня, называют s-элементами.
Элементы, у которых заполняется р-подуровень, называют р-элементами.
Элементы, у которых заполняется d-подуровень, называют d-элементами.
Элементы, у которых заполняется f-подуровень, называют f-элементами.
Распределение электронов в атоме по энергетическим уровням (электронным слоям) и подуровням
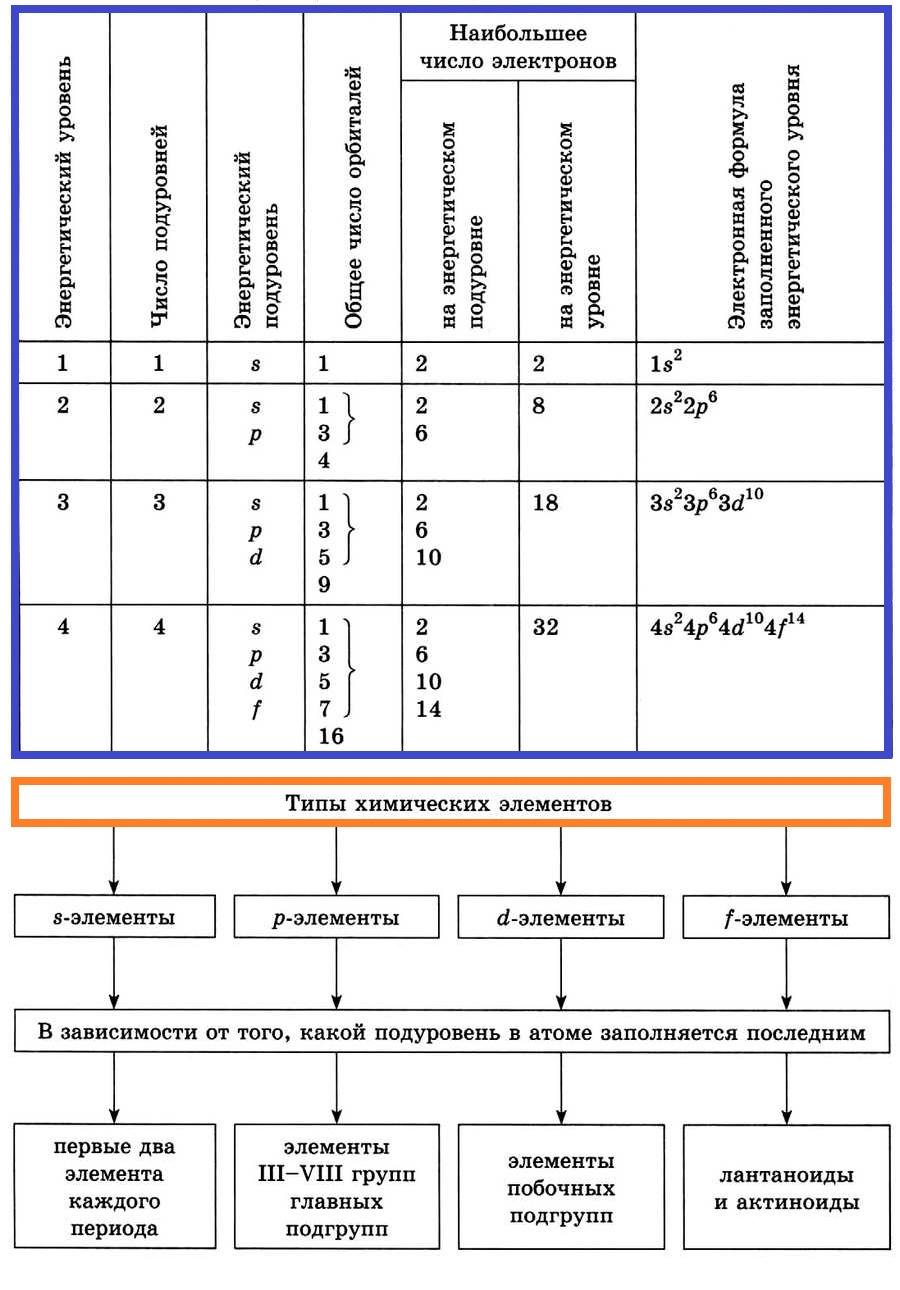
Электроны, относящиеся к последнему энергетическому уровню, называют внешними (валентными) электронами.
Строение электронных оболочек атомов первых четырёх периодов
Распределение электронов по орбиталям атома называют электронной конфигурацией атома, или электронной формулой.
Строение элементов первого периода

Строение элементов второго периода

Строение элементов третьего периода

Строение элементов четвёртого периода

Основное и возбуждённое состояние атомов
Наиболее устойчивое состояние атома, в котором энергия его электронной оболочки минимальна, называется основным состоянием атома. Любые другие состояния атома называют возбужденными состояниями.

Для возможности перехода атома в возбуждённое состояние необходимо выполнение одновременно двух условий:
- наличие спаренных электронов;
- наличие вакантных орбиталей.


Все тела окружающие нас, несмотря на их разнообразие, состоят из мельчайших частиц — атомов, состоящих, в свою очередь, из еще меньших частиц — протонов, нейтронов и электронов . Это стало известно относительно недавно, атом долгое время считался неделимой частицей, т.е простейшей (см историю развития представлений об атоме ).
В основе современной теории строения атома лежат следующие основные положения:
- Атом состоит из ядра и электронной оболочки
- Электронная оболочка – совокупность движущихся вокруг ядра электронов
- Ядра атомов заряжены положительно, они состоят из протонов p и нейтронов n (вместе носят название нуклоны).Заряд ядра равен сумме протонов (обозначены красным цветом на рисунке).
- Атом в целом электронейтрален, число электронов е– равно числу протонов p+ , равно порядковому номеру элемента в таблице Менделеева. Именно заряд ядра является основной характеристикой атома и определяет его положение в таблице Менделеева. Хими́ческийэлеме́нт — совокупность атомов с одинаковым зарядом ядра.

Например, водород, первый элемент таблицы, имеет самое простое строение – его ядро представляет собой одни протон, а электронная оболочка состоит из одного электрона. Атом бора имеет порядковый номер 5, это значит, что заряд ядра атома бора =+5, ядро содержит 5 протонов, электронная оболочка содержит 5 электронов.

- Если атом присоединяет или отдает электроны (несущие отрицательный заряд) то его электронейтральность нарушается, он превращается в отрицательно или положительно заряженный ион соответственно.
При образовании положительно заряженного иона количество электронов уменьшается (на величину заряда данного иона), а при образовании отрицательно заряженного иона количество электронов увеличивается (на величину заряда данного иона).
Э 0 -ne — = Э n+
Э 0 +ne — = Э n-
В атомах имеются небольшие тяжелые ядра, в состав которых входят протоны и нейтроны и в которых сосредоточена почти вся масса атома. Большая часть атома заполнена электронами и представляет собой почти пустое пространство.
Помимо заряда ядра, ещё одной важной характеристикой атома является его масса или массовое число. Вся масса атома сосредоточена в маленьком ядре, массой электронов пренебрегают, тк масса электрона почти в 2000 раз меньше массы протона. Массовое число равно сумме числа протонов и нейтронов в ядре. Например, у кислорода, массовое число = 16, тк его ядро содержит 8 протонов (красные кружочки) и 8 нейтронов (белые кружочки).
В таблице Менделеева приведена относительная атомная масса — среднее арифметическое масс изотопов с учетом их % содержания в земной коре.
Количество нейтронов не указывается в таблице, поэтому чтобы рассчитать число нейтронов, нужно из массы атома (указывается в задании) вычесть порядковый номер (число протонов).
В химических реакциях состав ядер атомов не изменяется (искл. ядерные реакции – не рассматриваются в данном курсе, область изучения физики), изменяться может только состав электронной оболочки (количество электронов). Поэтому нам важно знать, каким образом располагаются электроны в атоме, т.е строение электронных оболочек атомов.
Электроны расположены в трехмерном пространстве вокруг ядра атома. Внутри этого пространства имеются области, в которых могут располагаться электроны. Эти области называются орбиталями . Каждая орбиталь характеризуется размером, формой и ориентацией внутри атома, и каждой присвоено буквенно-цифровое обозначение.
Хотя в атоме имеется большое число орбиталей, в обычных условиях только сравнительно малая их часть занята электронами. Ниже приводится список общепринятых обозначений первых (т. е. ближайших к ядру) восемнадцати орбиталей. Цифра (номер) характеризует размер или средний диаметр орбитали, а буква — форму орбитали. s-Орбиталь представляет собой сферу, центр которой совпадает с центром (ядром) атома, а три р-орбитали напоминают объемные восьмерки, оси которых перпендикулярны друг другу. Таким образом, 1s-орбиталь — сферическая и наименьшая по размерам; 2s-орбиталь — также сферическая, но большего размера; 2р-орбитали имеют форму восьмерок и по размеру сопоставимы с 2s-орбиталью. d-Орбитали имеют более сложную форму.
Орбитали группируются в соответствии с их размерами и эти группы называются слоями или оболочками или энергетическими уровнями . В первой электронной оболочке имеется лишь одна орбиталь — 1s. На второй оболочке их уже четыре, а на третьей — девять. Каждая орбиталь может быть свободной (пустой) или занятой одним или двумя электронами. Заметим, что в каждой оболочке (кроме первой) существует три р-орбитали и пять d-орбиталей (во всех оболочках, кроме двух первых). Поскольку на каждой орбитали может находиться по 2 электрона, группу р-орбиталей могут занимать не более 6 электронов, а группу д-орбиталей — 10 электронов.

Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц - кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.

Схема строения атома
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие "моль". 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
Размеры атомов чрезвычайно малы. Так, самый маленький атом – это атом Гелия, его радиус – 32 пикометра. Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?

Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами - 126) элементов, не считая изотопов. Но так было далеко не всегда.


Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.

Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Читайте также:

