Системы секреции бактерий кратко
Обновлено: 02.07.2024
Для того, чтобы клетка размножалась и росла, ей необходимы различные питательные вещества, которые должны попасть в клетку извне. И существует 4 основных пути транспорта веществ в клетку:
Пассивная диффузия осуществляется без затраты энергии, движущей силой её является градиент концентрации по обе стороны от бактериальной клетки. Важным условием для такой диффузии является относительно небольшая молекулярная масса транспортируемых молекул.
Облегчённая диффузия – процесс, также не зависящий от энергии, однако в данном случае имеются специальные интегральные белки, которые субстрат переносят в клетку.
Активный транспорт – энергозависимый вид транспорта, осуществляемый с помощью белков – пермеаз. Таким образом в клетку могут накачиваться сахара, аминокислоты. Фосфотрансферазный путь – это один из видов активного транспорта, таким способом в клетку могут попадать некоторые сахара (глюкоза, фруктоза), которые связываются с белком-переносчиком, находящимся в фосфорилированном состоянии, а высвобождаются эти сахара с внутренней стороны с присоединённым фосфатом и далее вступают в различные метаболические пути.
Системы секреции бактериальных клеток.
Клетки не только поглощают вещества извне, но и выделяют в окружающую среду продукты своей жизнедеятельности, токсины, компоненты клеточной стенки и т.д.
Для выделения различных веществ существуют 5 систем секреции.
I тип секреции – это вариант секреции, не зависимый от sec-белков. Во внутренней мембране расположена АТФ-зависимая кассета, которая перемещает секретируемое вещество в периплазму. В периплазме имеет каналообразующий белок, по которому вещество достигает наружной мембраны, где имеется пора, посредством которой вещество выделяется наружу.
В основном по I типу секреции из клетки выделяются пороформирующие токсины – гемолизины.
II тип секреции – это более сложный, чем предыдущий, вариант секреции. Во внутренней мембране расположен sec -белок, который узнаёт N-концевую последовательность секретируемого субстрата, и с использованием энергии АТФ вещество попадает в периплазму. В периплазме под действием пептидаз N-концевая последовательность удаляется, белок связывается с шаперонами, а после через пору в наружной мембране попадает наружу.
Таким способом секретируются холерный токсин, нейраминидаза, а у P. aeruginosa – эластаза, фосфолипаза С.
IV тип секреции аналогичен II типу секреции в плане функционирования, однако таким способом очень часто секретируются молекулы ДНК, передаваемые от одной клетки другой (при конъюгации), а также крупномолекулярные факторы патогенности.
V тип секреции похож на два предыдущих (ранее его отдельно не выделяли и причисляли к IV типу секреции). Во внутренней мембране также расположен sec-белок (это низкомолекулярное семейство белков до 30 аминокислот). Он также узнаёт N-концевую последовательность (в случае же I типа секреции узнаётся C-концевая последовательность секретируемого вещества), и белок с использованием энергии АТФ оказывается в периплазме. Там отсутствуют пептидазы, но C-концевая последовательность формирует β-цилиндрическую структуру, через которую выходит фрагмент субстрата, и N-концевая последовательность удаляется уже за пределами клетки, при этом вещество переходит в активное состояние. Таким способом транспортируется IgA-протеаза у N. gonorrhoeae.
III тип секреции занимает особое место в медицинской микробиологии. Эта система иначе называется TTCC-система, она представляет собой молекулярный шприц, посредством которого бактерии могут инъецировать эффекторные молекулы непосредственно в клетки эукариот. Кроме того, посредством этой системы выделяются многие компоненты для построения жгутиков.
Белковый обмен у бактерий, методы изучения. Углеводный обмен у бактерий, методы изучения.
Белковый обмен.
Для бактериальной клетки важно построение определённых структур, для этого нужен белок. Часть белков выполняют иную роль: это ферменты, токсины и т.д.
С одной стороны, в бактериальных клетках идёт синтез белковых молекул из аминокислот, с другой, сами бактериальные клетки могут вызвать распад (биодеградацию) белковых молекул.
В бактериальные клетки могут непосредственно поступать аминокислоты путём активного транспорта (см. выше), а в некоторых случаях бактерии выделяют экзоферменты, которые расщепляют белки и пептоны, и более маленькие фрагменты (трипептиды, дипептиды, отдельные аминокислоты) поступают в бактериальную клетку.
В некоторых случаях все необходимые питательные вещества для бактерий, в том числе аминокислоты, могут синтезироваться из одного исходного субстрата (чаще всего глюкозы). Такие микроорганизмы мы будем называтьпрототрофами. Если же для полноценного роста им необходимо поступление веществ извне (аминокислоты, сахара, спирты, витамины), то данные микроорганизмы назовём ауксотрофами.
Построение аминокислот из прочих углеродных скелетов возможно при использовании промежуточных продуктов фруктозодифосфатного, пентозофосфатного путей, цикла Кребса и т.д. Это малонат, оксалоацетат, пируват и другие. Введение аминогруппы осуществляется путём амминирования или переамминирования, при этом нитраты и нитриты предварительно переводятся в аммиак.
Синтез белка происходит на рибосомах, и состоит из 3 этапов:
Инициация заключается в объединении большой и малой субъединиц с участием мет-РНК. При элонгации рибосома движется по матричной РНК, одновременно наращивается цепь белка, а терминация заключается в остановке синтеза белка, поскольку был достигнут кодон-терминатор, которому нет своего антикодона и аминокислоты.
Итак, мы сказали, что бактерии осуществляют биодеградацию белков, причём в зависимости от условий этот процесс называется по-разному:
- гниение (в анаэробных условиях);
- тление (в аэробных условиях)
Способность бактерий расщеплять белки называют протеолитической активностью. Способность бактерий расщеплять пептоны называют пептолитической активностью.
Протеолитические свойства оценивают при посеве на желатин и лакмусовое молоко, а пептолитические свойства изучаются при посеве на мясопептонный бульон (МПБ), при этом образуются индол и сероводород.
Углеводный обмен.
Углеводный обмен, как белковый, носит двоякий характер: с одной стороны, это синтез сложных углеводов из более простых фрагментов, с другой – распад сахаров с извлечением энергии.
Если углеводы расщепляются при участии кислорода, то это называют дыханием, а если без участия кислорода (в анаэробных условиях), то брожением.
- образование кислоты без газа (индикатор меняет свой цвет, но поплавок не всплывает);
- образование кислоты и газа (индикатор меняет свой цвет, происходит всплытие поплавка).
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.005)
• Транспорт белков через цитоплазматическую мембрану у грамотрицательных и грамположительных бактерий происходит с участием белковых систем Sec и Tat
• Грамотрицательные бактерии также способны транспортировать белки через наружную мембрану
• Для секреции вирулентных факторов патогенные микроорганизмы обладают специальной секреторной системой
Для жизнедеятельности всех клеток необходим безошибочный таргетинг макромолекул. У прокариотов порядка 20% белков транспортируются через цитоплазматическую мембрану. Для всех клеток транспорт белков через биологические мембраны связан с одной и той же проблемой: каким образом можно транспортировать относительно гидрофильную молекулу (белок) через относительно гидрофобную область (мембрану).
Неудивительно, что как про-, так и эукариоты выработали аналогичные системы транспорта белков через мембрану. Обычно аппарат транспорта белков состоит из интегрального мембранного белка или белкового комплекса, образующего канал, через который проходят субстраты. Для протекания этого процесса необходима энергия. Переместившиеся белки связываются с мембраной или выходят во внеклеточное пространство.
Как показано на рисунке ниже, система Sec состоит из нескольких интегральных мембранных белков, SecY, SecE, SecG и АТФазы, расположенной на периферии мембраны, которая обозначается SecA и обеспечивает энергией процесс транслокации. Для поддержания секретируемого комплекса в несобранном и способном к секреции состоянии для некоторых субстратов Sec у грамотрицательных бактерий необходим цитоплазматический шаперон, SecB.
У грамположительных микроорганизмов гомолог SecB не обнаружен. Все белки, траспортируемые с участием системы Sec, на N-концевом участке содержат сигнальную последовательность, которая направляет их в цитоплазматическую мембрану. Обычно она представлена гидрофобными остатками амиинокислот, однако включает короткий гидрофильный участок, который содержит один или несколько положительно заряженных остатков.
Сигнальные последовательности у грамотрицательных и грамположительных бактерий практически одинаковы, хотя у грамположительных они длиннее, и ближе к N-терминальному участку обогащены положительно заряженными остатками аминокислот. Белки, которые транспортируются с участием системы Sec, могут встраиваться в мембрану, высвобождаться в периплазму, или секретироваться во внеклеточную среду.
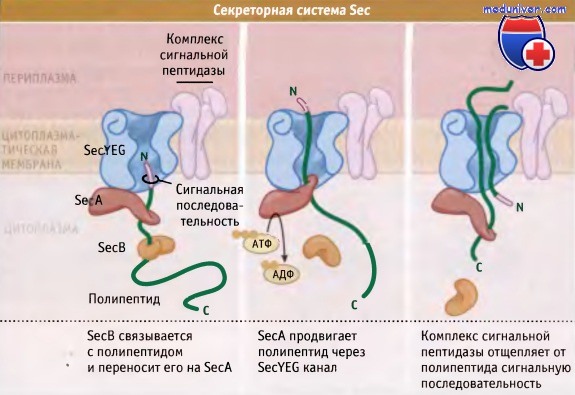
Белки общего секреторного пути, или системы Sec,
перемещают новосинтезированные белки через плазматическую мембрану.
Наряду с системой Sec, у бактерий сохранилась еще одна общая секреторная система, Tat. В отличие от Sec, эта система использует протонный градиент для транспорта к клеточной поверхности молекул белков, обладающих нативной структурой, или даже их олигомеров. Система Tat не использует энергию гидролиза АТФ для секреции и не секретирует белковые молекулы, не обладающие нативной структурой. Фактически эта система не использует такие белки в качестве субстратов.
Например, белок PhoA обычно секретируется с участием системы Sec, однако, если в его N-терминальную область включить сигнальную последовательность, специфичную для системы Tat, он становится для нее субстратом. Впрочем, PhoA является субстратом только для Tat, если до секреции в периплазму белок образовал в цитоплазме правильную нативную структуру. Считается поэтому, что прежде чем система Tat узнает субстраты, они должны приобрести правильную нативную структуру.
Белки, входящие в комплекс Tat, включают TatA, В, С и Е. TatABC составляют мембранный комплекс, в то время как TatE является функциональным гомологом TatA. Предполагается, что TatA образует канал, a TatBC комплекс, который связывается с сигнальным пептидом субстрата. Сигальные пептиды, специфичные по отношению к системе Tat, напоминают сигнальные пептиды Sec, однако обладают дополнительными особенностями.
Наиболее характерной их чертой является наличие консервативной последовательности, Ser-Arg-Arg-X-Phe-Leu-Lys, локализованной сразу же после N-терминального участка. Два аргининовых остатка и дали системе название. Почти каждый субстрат Tat содержит два остатка аргинина, хотя некоторые могут содержать только один остаток
Наряду с общими, у прокариот существуют другие многочисленные системы секреции белков через цитоплазматическую мембрану или, как в случае грамотрицательных микроорганизмов, через цитоплазматическую и наружную мембраны. На рис. 16.26 представлены пять основных групп этих секреторных систем, существующих у грамотрицателных бактерий. Многие из них представляют собой комплексы, состоящие из нескольких субъединиц.
Секреторные системы типа I представляют собой комплекс транспортных белков, связывающий АТФ (АВС) и широко распространенный у бактерий (в клетках эукариот также существует много АВС-переносчиков).Типичная система секреции, принадлежащая к типу I, состоит из двухдоменного белка, локализованного в цитоплазматической мембране. Один из доменов взаимодействует с мембраной, а другой содержит один или два белка, связывающих АТФ.
У грамотрицательных микроорганизмов в состав секреторных систем типа I входит белок наружной мембраны, который транспортирует через нее субстраты. В составе большинства комплексов типа I присутствует дополнительный белок, связанный с цитоплазматической мембраной, который, вероятно, обеспечивает специфичность транспорта. Субстраты системы типа I могут быть самые разные, однако наиболее известны порообразующие токсины и ферменты деградации, секретируемые патогенными бактериями.
У грамотрицательных бактерий секреторная система, относящаяся к типу II (также называемая главное терминальное ответвление GSP), транспортирует через внешнюю мембрану много Sec-зависимых субстратов. Основной характерной чертой главного терминального ответвления является наличие во внешней мембране интегрального белка, который называется секретин. Секретины представляют собой стабильные мультимеры (состоящие из 10-14 субъединиц), которые образуют во внешней мембране канал транслокации.
Система секреции, относящаяся к типу III, исследована очень подробно, поскольку она участвует во взаимодействии патогенных бактерий с организмом хозяина. Субстраты этой системы транспортируются из цитоплазмы бактерий непосредственно в цитоплазму клетки организма хозяина. Таким путем переносятся многие вирулентные факторы, представляющие собой молекулы, которые позволяют патогенным бактериям инфицировать организм и расти в нем. Предполагают, что белки, секретируемые с участием этой системы, в периплазме не образуют промежуточных продуктов.
Системы секреции белков, относящиеся к типу IV, гомологичны системам переноса ДНК. Вначале белковые субстраты этой системы секретируются через цитоплазматическую мембрану посредством системы Sec. Так же как и при функционировании системы III, белки в этом случае секретируются прямо в цитоплазму эукариотической клетки хозяина. Такие системы секреции типа IV, как, например, система переноса Т-ДНК у Agrobacterium tumefaciens, могут переносить в клетки хозяина как белки, так и ДНК. Хотя системы секреции этого типа обнаружены во многих грамотрицательных бактериях, пока для них известны лишь несколько субстатов.
Одним из этих субстратов является коклюшный токсин, который секретируется бактериями Bordetella pertussis с участием системы типа IV. В отличие от переноса Т-ДНК в Agrobacterium, который происходит прямо из цитоплазмы клеток бактерий в цитоплазму клеток хозяина, этот токсин секретируется в два этапа. Токсин проходит через цитоплазматическую мембрану при участии системы Sec, а затем вступает во взаимодействие с системой переноса типа IV и проходит через внешнюю мембрану.
В системах транспорта типа V белок обеспечивает свою собственную секрецию через наружную мембрану. Такие белки называются аутопереносчиками. Вначале они транспортируются в периплазму посредством системы Sec. Например, патогенные бактерии Neisseria используют систему аутопереносчика для секреции протеазы, которая позволяет им избежать атаки иммунной системы организма хозяина. После попадания в периплазму С-концевой участок молекулы белка включается в наружную мембрану и функционирует как переносчик N-концевого участка.
После того как последний достиг клеточной поверхности, он отщепляется от С-концевого участка. Затем протеазный домен отщепляется от поверхности клетки бактерии, а С-концевой остается в составе наружной мембраны. Аутопереносчики, близкие по свойствам к протеазе Neisseria, обнаружены у многих грамотрицательных бактерий.
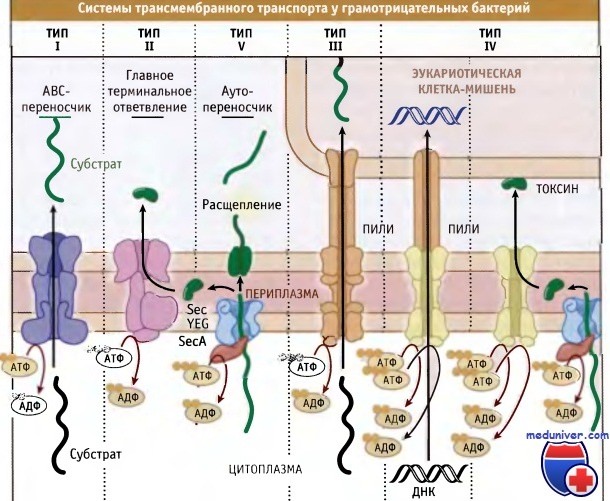
Основные типы систем трансмембранного транспорта у грамотрицательных бактерий.
Некоторые секреторные системы представляют собой белковые комплексы,
пронизывающие внутреннюю мембрану, периплазму и наружную мембрану.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Бактериа́льные систе́мы секре́ции (англ. Bacterial secretion systems ) — белковые комплексы, расположенные в клеточной мембране бактерий и служащие для секреции различных белков. В частности, их используют патогенные бактерии для выделения факторов вирулентности [en] . На основании состава, структуры и действия системы секреции делят на несколько типов. Наиболее фундаментальные различия наблюдаются между системами секреции грамположительных и грамотрицательных бактерий. Существует по меньшей мере шесть типов систем секреции, специфичных для грамотрицательных бактерий, четыре типа систем секреции уникальны для грамположительных бактерий, а два типа систем секреции имеются у обеих групп бактерий [1] .
Бактерии синтезируют и секретируют во внешнюю среду различные продукты своей жизнедеятельности, в том числе белки, главным образом ферменты и токсины, с помощью которых они оптимизируют свое существование. Например, благодаря секреции ферментов они расщепляют сложные органические соединения и делают их более доступными для питания. Для патогенных бактерий секреция ферментов и токсинов служит мощным средством, благодаря которому они только и могут обеспечивать свое существование и размножение в организме животного и подавлять его защитные механизмы. Секреция белков бактериями осуществляется с помощью различных систем и механизмов. При этом следует различать секрецию белков в периплазматическое пространство через ЦМ и секрецию белков непосредственно в культуральную среду (экскрецию, или экспорт белков). У грамотрицательных бактерий большинство белков секретируется в периплазматическое пространство в виде белков-предшественников, содержащих в своей структуре особый сигнальный (лидерный) пептид из 15 – 40 аминокислотных остатков. Именно он обеспечивает перенос белка-предшественника через ЦМ, после чего и отрезается от него с помощью сигнальной (лидерной) пептидазы.
Существует несколько моделей, объясняющих механизм, посредством которого лидерный пептид обеспечивает секрецию белка-предшественника через ЦМ в периплазматическое пространство.
Модель прямого транспорта предполагает прямое вхождение лидерного пептида в липидный бислой мембраны с использованием свободной энергии мембраноассоциированных рибосом.
Сигнальная гипотеза предполагает, что в результате взаимодействия лидерного пептида непосредственно с особым рецептором мембраны образуется внутримембранный канал, через который и осуществляется секреция.
Существуют и другие, более сложные, модели механизма переноса секретируемого белка через ЦМ. Возможно, что применительно к разным белкам и у разных групп бактерий действуют различные механизмы. Детальнее всего механизмы секреции изучены у E. coli. У нее обнаружены два пути секреции: sec-зависимый и относительно sec-независимый. Для обеспечения секреции белков в случае sec-зависимого механизма требуется участие продуктов ряда sec-генов: secA, secY, secB, secD, secE и secF. Источниками энергии для переноса белков служат гидролиз АТФ и градиент концентрации протонов. Для осуществления посттранслокационного процессинга (англ. processing – обработка) белка после его перемещения (транслокации) достаточно, вероятно, активности только сигнальных пептидаз. У E. coli их обнаружено две: сигнальная пептидаза I (м. м. 36 кД, кодируется геном lepB) и сигнальная пептидаза II (м. м. 18 кД, кодируется геном lepA).
Большой интерес представляет так называемая система секреции 3-го типа (ССТ3). Она осуществляет секрецию эффекторных белков из цитоплазмы клетки через ЦМ и наружную мембрану непосредственно в клетки растения и животного, с которыми бактерия контактирует. ССТ3 обнаружена у бактерий родов Shigella, Salmonella, Yersinia и других и играет у них роль одного из факторов патогенности. Непосредственно в культуральную среду грамотрицательные бактерии экскретируют только некоторые белки, при этом в каждом случае используются различные механизмы, которые также еще недостаточно изучены. Например, бактериоцины, кодируемые различными плазмидами, не содержат в своей структуре сигнальных пептидов. Для их секреции через ЦМ и наружную мембрану требуется специальный вспомогательный белок – рилизинг-белок. Система транспорта гемолизина HlyA, кодируемого генами Hly-плазмиды, состоит как минимум из двух вспомогательных белков HlyB и HlyD, которые образуют канал для непосредственного выхода гемолизина (важного фактора патогенности E. coli) из цитоплазмы во внешнюю среду.


Многоклеточная жизнь одноклеточных
В естественной среде обитания жизнь микробных клеток протекает в сообществах, которые могут отличаться по плотности популяций: от планктонных форм и небольших конгломератов в водных средах до колоний, биопленок и матов на твердых поверхностях. Еще одна особенность микробных сообществ, как и всего мира микробов, — большое генетическое и метаболическое разнообразие составляющих их видов.
Тем не менее удалось установить, что часть химических взаимодействий имеет определенную специфичность. Так, их можно разделить на антагонистические и коммуникативные. Антагонистические — это, например, секреция антибиотических веществ, подавляющих размножение конкурентных видов. При коммуникативных взаимодействиях секретируемые вещества вызывают модуляцию метаболизма участников, после чего меняются их свойства и/или поведение.
Первыми привлекли внимание исследователей антагонистические отношения между микроорганизмами. Еще Луи Пастер отметил, что это явление, возможно, удастся использовать для борьбы с болезнетворными бактериями. Действительно, были обнаружены и получены для медицинских целей продуцируемые бактериями и грибами антибиотики. Установлено, что некоторые бактерии синтезируют бактериоцины — (поли)пептиды, обладающие антибактериальной активностью с узким спектром действия. Известны так называемые полипептидные киллер-токсины — их выделяют дрожжевые формы некоторых грибов. Несмотря на грозное название, эти вещества специфически поражают только чувствительные клетки того же вида или близкого рода грибов. Противогрибковой активностью обладают также и некоторые секретируемые дрожжевыми грибами гликолипиды.
О существовании коммуникативных межклеточных взаимодействий в мире микробов стало известно сравнительно недавно.
. И было это так


Рис. 2. Микрофотографии пекарских (винных) дрожжей Saccharomyces cerevisiae в световом (а–г) и в электронном (д) микроскопе. В популяции имеются диплоидные и гаплоидные клетки. Диплоидные делятся почкованием (а, б). Гаплоидные клетки (в) бывают двух типов а и α. Спариваются только клетки разных типов, а перед этим приобретают характерную форму — становятся похожими на матрешек (такие клетки называются шму; фото г). Спаривание происходит при слиянии шму (д). Слившиеся клетки образуют зиготу, которая может развиваться как диплоидная клетка или пройти мейоз и дать начало гаплоидным клеткам
Первые указания на то, что бактериальные клетки специфически воздействуют друг на друга химическими факторами, были получены в 1960-х годах. Стало известно, что стрептококки и бациллы выделяют в среду, в которой их культивируют, соединения пептидной природы, обеспечивающие переход клеток в состояние компетентности для генетической трансформации (такие клетки готовы поглощать ДНК из среды, чтобы приобрести новые, возможно, полезные гены). Позднее некоторые из них были выделены и химически охарактеризованы.



Рис. 4. Люминесцирующие бактерии Photobacterium (Vibrio) fischeri и Beneckea (Vibrio) harveyi — симбионты гавайского короткохвостого кальмара Euprymba scolopes (вверху). В чистой культуре (внизу) они заметно люминесцируют только при достижении определенной концентрации клеток

С тех пор интерес к проблеме межклеточной коммуникации у микроорганизмов, в особенности к quorum sensing, стремительно растет. Исследования развиваются как вширь — увеличивается список микроорганизмов, у которых выявлены коммуникативные отношения, так и вглубь — изучаются их молекулярные механизмы.
Однако результаты практически всех работ по изучению коммуникативных отношений у микробов получены in vitro, на изолированных культурах. Поэтому со временем возникли два вопроса: в какой мере эти реакции проявляются в природных условиях и какие из них следует считать сигнальными?
Сигнализация или не сигнализация
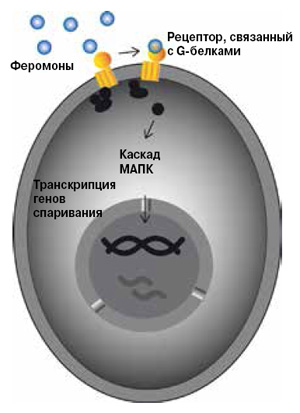
Спаривание у дрожжей
Это явление лучше всего изучено у аскомицетных дрожжей Saccharomyces cerevisiae и Schizosaccharomyces pombe прежде всего потому, что оба вида давно и успешно служат моделями клеток высших эукариот. Спаривание у дрожжей сопровождается мейозом: клетки из диплоидных превращаются в гаплоидные, а при слиянии их восстанавливается диплоидность. Очевидно, в этом и состоит биологическая целесообразность полового процесса у дрожжей — он обеспечивает комбинационную изменчивость вида. Хотя дрожжи S. cerevisiae и S. pombe сравнительно давно разошлись в ходе эволюции и заметно различаются по всем основным биологическим свойствам, принципиальная схема механизмов, обеспечивающих спаривание, у них имеет много общего (рис. 5 и 6).
Гаплоидные клетки противоположного типа спаривания (МАТа и МАТα у S. cerevisiae, Р и М у S. pombe) секретируют сигнальные пептидные молекулы — феромоны (факторы а и α у S. cerevisiae, Р и М у S. pombe), которые взаимодействуют с рецепторами на поверхности партнеров. Это активирует связанные с рецепторами G-белки, которые, в свою очередь, способствуют активации фермента митоген-активируемой протеинкиназы (МАПК). С этого момента начинается внутриклеточная передача сигнала: протеинкиназа фосфорилирует белки-мессенджеры — присоединяет к ним фосфатные группы. Они становятся факторами транскрипции, то есть белками, которые регулируют активность других генов, в данном случае многочисленных генов спаривания. В результате клеточный цикл останавливается, индуцируется образование шму, клетки-партнеры сливаются, затем сливаются их ядра, формируется диплоидная зигота. После этого у S. cerevisiae образуются либо диплоидные клетки в результате митоза, либо (в условиях голодания по азоту) гаплоидные споры за счет мейоза. У S. pombe мейотическое деление зиготы приводит к образованию гаплоидных спор.


Рис. 6. Схема спаривания гаплоидных клеток дрожжей Saccharomyces cerevisiae и Schizosaccharomyces pombe. (По: Open Biology, 2013,3,130008. DOI:10.1098/rsob.130008)
Молекулярные детали этого сложнейшего механизма уже сравнительно хорошо изучены. Познакомиться с ними, а также с нерешенными вопросами можно в научном обзоре, ссылка на который дана в подписи к рис. 6.
Quorum sensing
Межклеточная сигнализация по механизму quorum sensing к настоящему времени описана у многих видов бактерий и некоторых дрожжевых форм грибов. Есть данные, указывающие на то, что она существует у архей.
Биологическая целесообразность quorum sensing в большинстве случаев предположительно заключается в следующем. Учитывая энергетические затраты, микроорганизмам имеет смысл включать некоторые направления метаболизма только тогда, когда результат может быть достигнут при условии коллективных однонаправленных действий группы клеток. Установлено, что к таким физиологическим реакциям относятся генетическая трансформация у стрептококков, энтерококков и бацилл, биолюминесценция у люминесцирующих вибрионов, спорогенез у бацилл, образование биопленок и биосинтез антибиотиков у бактерий, образование плодовых тел и спорогенез у миксококков, экспрессия факторов вирулентности у бактерий и дрожжевых форм грибов. Всем этим не стоит заниматься в одиночку: результат окупит затраты энергии только в том случае, если много клеток будут делать то же самое. Свечение небольшого количества вибрионов в тканях кальмара слишком слабо, чтобы его заметили, концентрация антибиотика в среде слишком низкая, чтобы подавить размножение конкурента, если антибиотик выделяет мало клеток, и т. п.
Для принятия решения — запускать или не запускать такие энергоемкие процессы — клетки зондируют окружающую среду, синтезируя и выпуская туда сигнальные молекулы. В разных системах их называют автоиндукторами либо феромонами. Когда их концентрация достигает определенного уровня — что возможно либо при увеличении концентрации клеток, либо при наличии некоего диффузионного барьера (например, когда бактерии заключены в эндосомах клеток хозяина), либо и того и другого, — вся популяция клеток воспринимает это как сигнал для специфических изменений экспрессии генов.
У бактерий существует два наиболее распространенных типа сигнальных молекул quorum sensing. У грамотрицательных видов (а) их чаще называют автоиндукторами, и они представляют собой различные N-ацилпроизводные гомосеринлактона (АГЛ), которые синтезируются синтазой LuxI-типа. АГЛ способны проникать через цитоплазматические мембраны, поэтому синтезированные внутри клеток молекулы выходят в среду, накапливаются и возвращаются по градиенту концентрации в клетки. Там они связываются с цитоплазматическими белками LuxR-типа — регуляторами транскрипции quorum sensing генов, обеспечивающих синтез автоиндукторов и молекулярных компонентов для физиологического ответа.


Особую роль в изучении quorum sensing сыграли обнаружение и характеристика трех систем quorum sensing у морских люминесцирующих грамотрицательных бактерий Vibrio harveyi (в). Здесь все оказалось необычно. Во-первых, удивителен сам факт существования в клетках одного вида сразу трех систем quorum sensing, которые могут функционировать одновременно и контролировать работу генов, ответственных не только за биолюминесценцию, но и за другие процессы: секрецию III типа, синтез металлопротеаз и сидерофоров. Во-вторых, молекулярная организация одной из систем представляет собой своего рода комбинацию систем грамположительных и грамотрицательных бактерий. Автоиндуктор в ней — АГЛ (N-(3-гидроксибутаноил)гомосеринлактон) синтезируемый ферментом LuxM, а его первичный сенсор — рецептор с киназной активностью LuxN. Его называют автоиндуктором первого типа, АИ-1. В-третьих, автоиндуктор другой системы (CAI-1), 3-гидрокситридекан-4-он, а также компоненты его синтеза и рецепции (не показан на рисунке) обнаружились у патогенного для человека Vibrio cholerae и некоторых морских бактерий. Но главный герой в этой истории — система с автоиндуктором второго типа (АИ-2), S-2-метил-2,3,3,4-тетрагидрокситетрагидрофуранборатом. Это продукт синтеза с участием фермента LuxS, а рецептором для него служит LuxPQ, бинарный компонент с киназной активностью. Ген LuxS и АИ-2 не видоспецифичны — они найдены у многих бактерий, и есть гипотеза, что они используются для межвидового общения.
Заключение
Читайте также:

