Роль фосфора в природе кратко
Обновлено: 30.06.2024

Фосфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus ) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л . В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3 (F,Cl,OH), фосфорит (Сa3(PO4)2) и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Получение
- 4 Физические свойства
- 4.1 Белый фосфор
- 4.2 Жёлтый фосфор
- 4.3 Красный фосфор
- 4.4 Чёрный фосфор
- 4.5 Металлический фосфор
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие с водой
- 5.3 Взаимодействие со щелочами
- 5.4 Восстановительные свойства
- 7.1 Элементарный фосфор
- 7.2 Соединения фосфора в сельском хозяйстве
- 7.3 Соединения фосфора в промышленности
- 7.4 Фосфатные связующие
- 8.1 Токсикология элементарного фосфора
- 8.2 Токсикология соединений фосфора
История
![фосфор]()
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Аморфную аллотропную модификацию фосфора — красный фосфор Pn — выделил, нагревая белый фосфор без доступа воздуха, А. Шрёттер в середине XIX в.
Происхождение названия
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
Физические свойства
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все существующие аллотропные модификации фосфора пока (2016 г.) до конца не изучены. Традиционно различают четыре его модификации: зеленовато-белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
![фосфор]()
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
![фосфор]()
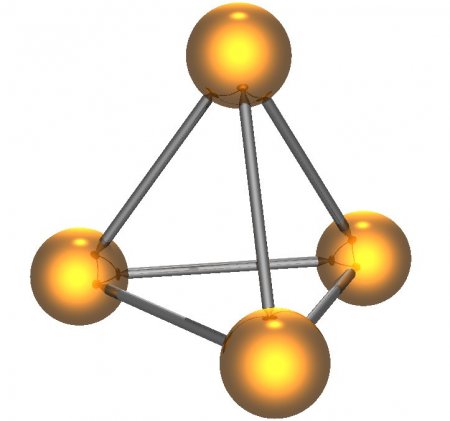
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Так как фосфор реагирует с водой лишь при температуре свыше 500 °C, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твёрдое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
![фосфор]()
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅10 9 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8⋅10 6 Па.
Металлический фосфор
При 8,3⋅10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25⋅10 11 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
4P + 5O2 → 2P2O5 (с избытком кислорода) 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — PH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Реакция взаимодействия красного фосфора и воды с образованием ортофосфорной кислоты и водорода. Реакция протекает при температуре 700—900 °C. Катализатором могут выступать: платина, медь, титан, цирконий.
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Изотопы
Известно более 20 изотопов фосфора (с массовым числом от 24 до 47). Природный изотоп 31 P стабилен. Из радиоактивных изотопов наиболее долгоживущие: 30 P (T1/2 = 2,5 мин), 32 P (T1/2 = 14,26 сут) и 33 P (T1/2 = 25,34 сут)..
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
![черный фосфор]()
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Ca3(PO4)2·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приёме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Продукт Содержание, мг/100 г Очищенное конопляное семя 1650 Семена тыквы (ядра) 1233 Семена подсолнечника (ядра) поджаренные 1158 Семена мака 870 Горчичный порошок 828 Кунжут (очищенный) 774 Семена дыни (ядра) 755 Какао-порошок 734 Твёрдый пармезан 694 Семена подсолнечника (ядра) сушёные 660 Сафлора семена (ядра) 644 Семена льна 642 Семена лотоса 626 Сыр швейцарский нежирный 605 Кешью сырые 593 Орехи пили 575 Амарантовая крупа 557 Сыр гауда 546 Овёс 523 Грецкий орех чёрный 513 Печень говяжья тушёная 497 Фисташки сырые 490 Миндаль 481 Киноа 457 Люпин, семена 440 Карп 415 Фасоль 407 Арахис 397 Сыр рокфор 392 Мука из цельного зерна 357 Печень куриная 297 Вырезка свиная 286 Желтоперый тунец 278 Сгущённое молоко 253 Яйцо 198 Говядина 188 Курица 178 Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать поражённые участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15-100 мг/кг) и чрезвычайно высокой ( Опасность для здоровья
![]()
Соединения фосфора – обязательная составляющая растительных и животных организмов. В растениях фосфор накапливается в семенах и плодах; в организме человека и животных - в скелете, мышечной и нервной тканях.
В среднем тело человека содержит около 1,5 кг фосфора, из которых 1,4 кг приходится на кости, 130г содержится в мышцах и 12г – в нервной ткани.
У взрослого человека около 86% фосфора находится в минеральной части костей и зубов. Оставшийся фосфор распределяется в мышцах, органах, жидкостях, скелетной ткани, но особенно много её в тканях нервных клеток и мозга.
1. Обеспечение нормального роста костной и зубной тканей, а также последующее поддержание их целостности в течение всей жизни человека.
2. Обеспечение постоянного состава нуклеиновых кислот (ДНК, РНК, молекул хранящие и передающие наследственную информацию, отвечающие за нормальное деление и рост клеток)
3. В составе ферментов Р принимает участие в жировом обмене, синтезе и распаде гликогена и крахмала
4. В составе фосфорной кислоты учувствует в мышлении, движении, дыхании , нормализует белковый и углеводный обмен
5. Обеспечивает энергией все процессы жизнедеятельности в составе АТФ
6. Вместе с белками и жирными кислотами фосфор образует высокоактивные соединения – например, лецитин, необходимый для формирования клеточных и мозговых оболочек. Известно, что лецитин в огромных количествах расходуется организмом при нагрузках, не только физических, но и психоэмоциональных, поэтому без достаточного количества фосфора, необходимого для его синтеза, наши клетки останутся незащищёнными.
7. Соединения фосфора участвуют в поддержании кислотно-щелочного равновесия в организме, так как входят в состав крови и других жидкостей; благодаря фосфору, могут образовываться активные формы витаминов, так как он запускает необходимые для этого ферментные реакции.
8. В соединении с азотом, жирными кислотами и глицерином образует фосфолипиды, которые участвуют во всех физиологических процессах в организме.
9. Подкисляет мочу и снижает вероятность образования камней в почках.Суточной нормой фосфора для взрослого человека считают 1600 мг, потребность у беременных - 3000 мг, а у кормящих матерей 3800 мг в сутки (у детей она выше, чем у взрослых).
Дневная норма фосфора для взрослого человека содержится в 130,0 г сыра, 12 яичных желтках, в 6 столовых ложках тыквенных семечек, 500,0 г мяса или рыбы, 400,0 г овсяных хлопьев. Принятый с пищей фосфор попадает в кости уже через 4 -6 ч.
Продукты, содержащие фосфор
- Бобовые (горох, фасоль)
- Кукуруза;
- Дрожжи;
- Сыр;
- Отруби;
- Молоко (цельное и сгущенное)
- Молочные продукты;
- Желток яйца;
- Рыба;
- Сухофрукты;
- Чеснок;
- Орехи;
- Семечки тыквы;
- Семечки подсолнечника;
- Мясо;
- Домашняя птица.
Потребность в фосфоре повышается при физических нагрузках и недостатке белка, чрезмерном употреблении сахара, приёме некоторых гормональных препаратов.
Признаки нехватки фосфора
- - потеря аппетита
- - слабость, усталость
- - нарушение чувствительности в конечностях
- - боль в костях
- - онемение и ощущение покалывания
- - недомогание
- - тревога и чувство страха
У маленьких детей недостаток фосфора может возникнуть при искусственном вскармливании – это чревато развитием рахита .
При дисбалансе фосфора также могут проявляться всплески интеллектуальной активности, на смену которым приходит нервное истощение. Такие люди могут активно реагировать на окружающее, а затем впадать в апатию и депрессию.
Кроме слабости и утомляемости, недостаток фосфора может выражаться снижением внимания и аппетита, болями в мышцах и костях, частыми инфекциями и простудами, нарушениями работы печени, серьёзными сбоями в обмене веществ, кровоизлияниями, патологическими изменениями в сердце, остеопорозом и резким снижением иммунитета.
Без фосфора не усваивается ниацин – витамин В3, необходимый для работы сердца и почек, обменных процессов, дыхания клеток и обеспечения их энергией, передачи нервных импульсов.При отравлении фосфором нарушается работа всей пищеварительной системы, печени, почек, сердца, появляются геморрагии – мелкие кровоизлияния, в том числе и на сетчатке глаз.
![фосфор]()
Каждый человек знаком с 15 элементом таблицы Менделеева – фосфором, ведь каждый в своей жизни хотя бы раз пользовался спичками, имеющими фосфор в своем составе. Более того, все люди содержат фосфор в своем организме, не в чистом виде, разумеется, а в виде химических соединений, но тем не менее. Особенно много фосфора находится в наших костях и зубах, чей химический состав почти полностью совпадает с формулой минерала фосфорита Ca3(PO4)2.Также фосфорсодержащие белки находятся в наших мышцах, нервах и мозговой ткани, именно поэтому фосфор особенно полезен для мозга. О физических и химических свойствах этого важного химического элемента, о его применении и влиянии на человека читайте далее.
История открытия
В 1669 гамбургский купец и по совместительству алхимик Хенниг Брандт в очередной раз пытался осуществить мечту всех средневековых алхимиков – найти легендарный философский камень, якобы превращающий все металлы в золото и дарующий бессмертие. Увы, философский камень и в этот раз найти не удалось, но, тем не менее, Хеннигу посчастливилось сделать другое не менее важное открытие в химии. На этот раз в качестве эксперимента немецкий алхимик решил выпаривать воду из… человеческой мочи. В результате череды сложных химических манипуляций над собственной мочой в реторте у алхимика образовалось неведомое до того светящееся вещество – фосфор.
![открытие фосфора]()
Впрочем, Хенинг Брандт был не первым, кто добыл фосфор опытным путем. Еще до него, в XII веке это удалось сделать арабскому алхимику Алхиду Бехилу, все также благодаря химическим манипуляциям с мочой и глиной, но его открытие затерялось, и именно повторное открытие фосфора немецким алхимиком принесло широкую популярность этому химическому элементу.
Первое время после открытия фосфор вызывал лишь любопытство своим свечением и только в конце XIX века ученые поняли, что фосфор также является чрезвычайно важным полезным микроэлементом для жизнедеятельности человеческого организма.
Физические свойства
Как и азот, фосфор способен образовывать двухатомные молекулы Р2.. Однако подобные молекулы фосфора могут быть устойчивыми лишь при очень высокой температуре – около 1000 С. В обычных же условиях атомы фосфора соединяются в молекулы других составов. Например, белый фосфор состоит из четырехатомных молекул Р4. Между собой атомы белого фосфора соединены в виде простейшего многогранника тетраэдра.
Так схематически выглядит строение молекулы белого фосфора, состоящей из четырех атомов.
Сам белый фосфор являет собой практически бесцветное твердокристаллическое вещество, моментально окисляемое кислородом воздуха, при этом во время окисления фосфора идет дым, а в воздухе появляется явный чесночный запах. Своим внешним видом белый фосфор похож на воск, такой же мягкий и легкоплавкий, при этом светится в темноте и является чрезвычайно опасным, так как очень ядовит и огнеопасен.
Помимо белого фосфора физики также различают красный фосфор, черный фосфор, желтый фосфор и металлический фосфор, каждый из них имеет свои особенные физические свойства.
Так если белый фосфор нагревать до температуры 300 С без доступа воздуха и в присутствии катализаторов (ими может быть йод или натрий), то он превратится в красный фосфор. В отличие от белого фосфора его красный собрат не светится в темноте и не является ядовитым и опасным, к слову именно его используют при производстве спичек.
![спички]()
Красный фосфор это аморфное вещество, состоящее из полимерных молекул Px, он нерастворим в воде и других органических растворителях, а при нагревании без доступа воздуха не возгорается.
Если белый фосфор поместить под очень большое давление (в сотни атмосфер) то из него получится черный фосфор, который своими свойствами напоминает металл: он блестит и проводит электрический ток. Если еще больше увеличить давление, то черный фосфор превратится в металлический, его кристаллическая решетка будет такой же плотной как у металлов. Металлический фосфор очень хорошо проводит электрический ток.
![виды фосфора]()
Так выглядят разные виды фосфора.
Хотя фосфор и является одним из самых распространенных химических элементов на нашей планете, в чистом виде в природных условиях его не бывает, добыть чистый фосфор возможно лишь в химической лаборатории. Однако фосфор входит в состав многих важных химических и биологических соединений: фосфолипидов, фосфидов (соединения фосфора и металлов), фосфинов (соединений водорода с фосфором), фосфорной кислоты и так далее.
Химические свойства
Как мы писали выше, фосфор занимает 15 место в периодической таблице Менделеева и входит в одну группу с азотом, мышьяком и сурьмой. Хотя на валентном уровне он и имеет целых 5 электронов, однако 5 связей образуются довольно редко.
![Фосфор]()
Фосфор – очень химически активный элемент, особенно белый фосфор. Как следствие он может вступать в самые разнообразные химические реакции, выступая как в качестве окислителя (с элементами, расположенными ниже и левее в таблице Менделеева), так и восстановителя (с элементами, расположенными выше и правее в таблице Менделеева).
При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
При взаимодействии фосфора с серой образуются сульфиды:
При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Применение
Научившись добывать фосфор в чистом виде человек нашел ему самое разнообразное применение, причем не только созидательное, но порой и очень разрушительное. Так еще во время первой мировой войны немецкими химиками был использован желтый фосфор в качестве начинки зажигательных боеприпасов и отравляющих газов.
![Газовая атака]()
Впоследствии применение таких газов на поле боя было запрещено Женевской конвенцией. Увы, такая наша глупая человеческая природа – использовать научные открытия в разрушительных целях, как впрочем, и открытие энергии расщепления атома было применено для создания атомной бомбы, и лишь потом для атомной энергетики.
Но вернемся к фосфору, в мирных целях этот химический элемент активно используется в сельском хозяйстве для создания эффективных удобрений для растений. Фосфор входит в состав некоторых лекарственных препаратов, к примеру, в антибиотик фосфомицин, в состав моющих средств, наконец, из безопасного красного фосфора делают спички.
Фосфор имеет свое применение и в металлургии, в качестве сверхпрочных и антикоррозийных покрытий (черный и металлический фосфор). А многие фосфиды (соединения фосфора и металлов) обладают отличными полупроводниковыми свойствами и активно задействуются в микроэлектронике.
Получения
Для получения белого фосфора в чистом виде химики прокалывают природные фосфаты вместе с коксом и песком в электрической печи. Впрочем, вместо фосфатов можно использовать и другие неорганические соединения фосфора, например, метафосфорную кислоту. Красный и черный фосфор получают уже из белого фосфора путем разных манипуляций над последним (нагревание, увеличение давления).
![Получение фосфора]()
Действие фосфора, его функции и роль в организме человека
Теперь давайте ответим на вопрос, какая роль фосфора в организме человека. А она очень большая, так как фосфор принимает участие во всех обменных процессах, происходящих в нашем организме. Основная масса фосфора находится в костях и зубах. Совместно с кальцием фосфор формирует правильную структуру костной ткани, и если пропорция содержания кальция и фосфора будет нарушена, то кости могут стать хрупкими, увеличится риск переломов.
Помимо костей и зубов фосфор имеет влияние и на самое главное – мыслительное деятельность человека, ведь он содержится в нашей мозговой ткани и нервах. От фосфора зависит работа нервной системы, с его помощью осуществляется метаболизм липидов и протеинов, биосинтез всех необходимых органических веществ. Наконец фосфор входит в состав ДНК и РНК, участвует в ферментивных процессах, поддерживающих кислотно-щелочной баланс в организме.
Фосфор для ребенка
Особенно необходим фосфор для растущего детского организма, ведь у ребенка идет активное формирование костей скелета, развиваются клетки головного мозга. Поэтому очень важно чтобы малыш получал фосфор в необходимых количествах и при этом регулярно, ведь значительная его часть вымывается из организма с мочой.
Поэтому важно знать, какие продукты содержат фосфор.
Продукты, содержащие фосфор
К счастью фосфор содержится во многих доступных продуктах питания: орехах, морепродуктах (особенно в рыбе), в сыре, капусте, моркови, чесноке, куриных яйцах (особенно в желтке). Особенно много фосфора имеется в яблоках, грецких орехах, говяжьей печени, гречке и икре рыб семейства осетровых.
![Продукты, содержащие фосфор]()
Теперь вы знаете, какие продукты могут увеличить содержание фосфора в вашем организме и организме ваших детей.
Суточная норма
Суточная норма фосфора для взрослого человека составляет 1200-1600 мг. Также стоит учесть, что для людей занимающихся интенсивными физическими нагрузками, а также для беременных и кормящих матерей суточная норма фосфора выше и составляет приблизительно 3000-3800 мг.
Детям требуется от 300 до 1800 мг фосфора каждый день, в зависимости от их возраста.
Недостаток (дефицит) фосфора в организме
Недостаток или дефицит фосфора в человеческом организме может быть обусловлен разными причинами:
- приемом некоторых лекарств, которые понижают кислотность,
- диетами с пониженным содержанием белков,
- алкогольными или наркотическими зависимостями,
- эндокринными заболеваниями,
- заболеваниями почек.
Симптомами недостатка фосфора является общее недомогание, слабость, апатичность, депрессия, физическое и умственное истощение. Если у вас проявляются эти симптомы, то лучше чем скорее обратится к врачу, чтобы он прописал вам правильное лечение.
Избыток фосфора в организме и симптомы отравления им
Избыток фосфора в человеческом организме может быть столь же вредным, как и его недостаток. Обычно причиной избытка фосфора является злоупотребление человеком мясной пищей. Когда фосфора становится слишком много, нарушается его пропорция содержания с кальцием. Кальция становится меньше чем нужно, его вытесняет фосфор, от чего кости человека становятся более хрупкими, может возникнуть остеопороз (снижение плотности костей, повышение их хрупкости).
Также переизбыток фосфора может привести к возникновению проблем с зубами, нарушению работы нервной системы, почек и щитовидных желез. Чтобы предотвратить все это важно вести здоровый образ жизни, правильно питаться (не одним лишь хлебом и мясом, а обязательно фруктами, овощами), избегать вредных привычек.
![]()
Фосфор – один из трех главных химических элементов питания растений. По своей важности он занимает второе место после азота. Принадлежит к числу достаточно распространенных элементов. В свободном состоянии в природе не встречается. Является действующим веществом простых и сложных фосфорных удобрений. Применяется под все сельскохозяйственные культуры в виде основного внесения, припосевного внесения и подкормки.
![Фосфор]()
Содержание:
В 1680 году независимо от Бранда фосфор был получен и известным ученым Робертом Бойлем. Его опыт тоже оказался не уникальным, и также был основан на нагревании мочи. И лишь в 1774 году Карл Шееле предложил добывать этот элемент из другого органического источника – рогов и костей животных. В настоящее время фосфор получают преимущественно из природных минералов. [7]
![Фосфор - Фосфор]()
Фосфор
![Фосфор - Фосфор]()
1 - красный; 2 – черный
Физические и химические свойства
Фосфор (Phosphorus), P – химический элемент главной подгруппы V группы периодической химической системы Менделеева. Атомный номер – 15, атомная масса – 30,97. В настоящее время известно несколько радиоактивных изотопов фосфора, из которых 32 Р применяется в физиолого-биохимических и агрохимических исследованиях.
Фосфор характеризуется в целом как неметалл. Элемент образует несколько аллотропических видоизменений.
Белый фосфор
- Плотность – 1,83 г/см 3 ,
- Температура плавления – +44,1 °C,
- Температура кипения – +257 °C.
В чистом виде прозрачен и бесцветен, продажный продукт желтоватого цвета. На холоде хрупкое вещество. При температуре выше +15 °C становится мягким. На воздухе быстро окисляется с характерным свечением, особенно заметным в темноте. Даже при слабом нагревании (достаточно простого трения) белый фосфор сгорает, выделяя большое количество теплоты. Также характерно явление самовоспламенения на воздухе по причине выделения большого количества теплоты при окислении. В воде нерастворим, растворяется в сероуглероде. Благодаря сравнительно невысокой прочности связей между молекулами кристаллической решетки, белый фосфор обладает высокой химической активностью. Данное вещество – сильный яд, принятия даже малой дозы которого достаточно для смертельного исхода.
Красный фосфор
образуется при долгом нагревании белого фосфора без доступа воздуха при температуре 250 – 300 °C. Имеет красно-фиолетовый цвет. Данное вещество может образоваться и под действием света. Для него характерно медленное окисление на воздухе, отсутствие свечения в темноте, температура горения – +260 °C, нерастворимость в сероуглероде. Красный фосфор не ядовит. Плотность – 2,0 – 2,4 г/см 3 . При сильном нагревании вещество испаряется, не плавясь (сублимируется). Охлаждение полученных паров приводит к образованию белого фосфора.
Черный фосфор
получают из белого при нагревании до +200 – 220 °C под высоким давлением. По внешнему виду он схож с графитом, на ощупь жирный. Плотность – 2,7 г/см 3 . Имеет свойства полупроводника. [4]
![Фосфор - Фосфорит]()
Фосфорит
![Фосфор - Фосфорит]()
Фосфорит – осадочная порода, источник фосфора.
Содержание в природе
Природные соединения фосфора
По причине легкой окисляемости чистый фосфор в природе не встречается. Соединения фосфора составляют по отношению к весу земного шара только 0,000015 %. В земной коре масса соединений фосфора составляет 0,75 %. [3]
Ортофосфат кальция
Ca3(PO4)2.Самое важное соединение фосфора в природе. Образует большие залежи в виде фосфорита. Богатейшее месторождение находится в Южном Казахстане, в горах Каратау.
Апатит
В состав, кроме ортофосфата кальция Ca3(PO4)2, входят соединения кальция с фтором (CaF2) или хлором (CaCl2).
Фосфор также входит в состав белков растительного и животного происхождения. [4]
Формы фосфора в почве
Запасы фосфора в почве во многом влияют на обеспеченность растений этим элементом. Все формы фосфора в почве и возможные вариации их воздействия отражаются в следующей цепочке:
Валовый → органический → минеральные соединения Р2О5 → потенциально доступный Р2О5 → непосредственно доступный Р2О5
Валовый фосфор
состоит из органических и минеральных соединений. Общее его содержание зависит от гранулометрического состава почвы, ее окультуренности, особенностей материнской породы, генезиса.
Содержание фосфора в верхних горизонтах почвы, как правило, выше, чем в нижележащих. Данное соотношение не зависит от типа почвы и гранулометрического состава. Обычно это связано с деятельностью человека и биологическими факторами, [1] в частности, с накоплением фосфора в зоне отмирания главной массы корней. Вниз по профилю почвы наблюдается уменьшение содержания фосфора. Большая его часть присутствует в почве в минеральной форме. [5]
Органические фосфаты
находятся преимущественно в составе гумуса. Часть органического фосфора присутствует в составе фитина, фосфатидов, нуклеиновых кислот и прочих органических соединений почвы. Некоторая его часть находится в плазме микроорганизмов. Масса сухого вещества микробов в гумусе достигает 1 %, в окультуренных длительным внесением навоза дерново-подзолистых почвах вес органических веществ микробов составляет 2–3 % от массы гумуса. После отмирания микробов фосфор превращается в доступный для растительности. При разложении органических фосфорсодержащих веществ водорастворимый фосфор не накапливается в почве, а сразу связывается в результате физико-химического и биологического поглощения. [5]
Минеральные фосфаты
присутствуют в почве в качестве солей кальция, алюминия или железа. Таким образом, их состав определяется катионным составом в поглощенном комплексе почвы. При этом, кальциевые соли фосфорной кислоты являются более растворимыми, а соли алюминия и железа менее растворимы и менее доступны растениям. Длительное применение удобрений способствует изменению состава фосфорных соединений. [5]
Органические и минеральные соединения фосфора находятся в состоянии постоянного взаимопревращения. Соотношения данных форм определяется направленностью почвообразования. [1]
Содержание фосфора в различных типах почв
Различные почвы содержат неодинаковое количество фосфора – от 0,1 % Р2О5 в бедных песчаных до 0,20 % в мощных высоко гумусных почвах.
Почвы северной лесостепи
европейской части России отличаются меньшим содержанием фосфора, чем почвы южной зоны. Характерно, что к северу и югу от наиболее мощных черноземов относительное количество содержания органических фосфатов в почве уменьшается, а минеральных – возрастает.
Дерново-подзолистые, глеевато-легкосуглинистые и среднесуглинистые почвы
Дерново-подзолистые легкосуглинистые, развивающиеся на моренном суглинке
Дерново-подзолистые
Дерново-подзолистые песчаные
Дерново-подзолистые почвы
в общем характеризуются преобладанием минеральных фосфатов над органическими. Содержание органического фосфора в данных почвах варьирует от 16 до 48 % от общего, в тяжелых почвах выше, чем в легких.
Содержание фосфора в слое 0–20 см, согласно данным: [5]
Читайте также: