Первый закон термодинамики кратко презентация
Обновлено: 02.07.2024
Презентация на тему: " I закон термодинамики." — Транскрипт:
1 I закон термодинамики
2 Закон сохранения энергии Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую.
3 Способы изменения внутренней энергии Теплопередача ТеплопроводностьКонвекцияИзлучение Механическая работа (деформация) Изменение формы: сгибание подковы Изменение объема: вспыхивание ваты при сжатии воздуха Трение: опыт Джоуля
4 I закон термодинамики внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: Δ U = A внешн + Q 5 Если при нагревании газ расширяется и при этом совершает работу A, то первый закон термодинамики можно сформулировать по-другому: Q = Δ U + A I Количество теплоты, переданное газу, равно сумме изменения его внутренней энергии и работы, совершенной газом. Так как работа газа и работа внешних сил вследствие 3-го закона Ньютона равны по модулю и имеют противоположный знак: A внешн = –A I
6 I закон термодинамики и изопроцессы НАЗВАНИЕ ПРОЦЕССА ГРАФИК ΔUΔUAIAI Q УРАВНЕНИЕ I ЗАКОНА ТД ИЗОТЕРМ. РАСШИРЕНИЕ 0АI>0АI>0Q>0Q>0Q = А I ИЗОБАРИЧ. РАСШИРЕНИЕ ΔU>0АI>0АI>0Q>0Q>0Q = А I + ΔU ИЗОХОРНОЕ НАГРЕВАНИЕ ΔU>0А I =0Q>0Q>0Q = ΔU V р1 2 V р 12 V р 1 2
7 I закон термодинамики и изопроцессы НАЗВАНИЕ ПРОЦЕССА ГРАФИК ΔUΔUAIAI Q УРАВНЕНИЕ I ЗАКОНА ТД ИЗОТЕРМ. СЖАТИЕ 0АI
8 Адиабатный процесс – это модель термодинамического процесса, происходящего в системе без теплообмена с окружающей средой. Линия на термодинамической диаграмме состояний системы, изображающая равновесный (обратимый) адиабатический процесс, называется адиабатой. р V V 1 V 2 р0р1р2р0р1р2
9 I закон термодинамики и изопроцессы НАЗВАНИЕ ПРОЦЕССА ГРАФИК ΔUΔUAIAI Q УРАВНЕНИЕ I ЗАКОНА ТД АДИАБАТНОЕ РАСШИРЕНИЕ ΔU0АI>0Q=0ΔU = -А I ΔU = А АДИАБАТНОЕ СЖАТИЕ ΔU>0АI
Из первого закона термодинамики
следует, что создание вечного
двигателя невозможно. Если
к системе не поступает энергия, то
работа над внешними телами может
быть совершена только за счёт
уменьшения внутренней энергии.
После того как внутренняя энергия
системы окажется равна нолю,
двигатель перестанет работать.
Внутренняя энергия системы тел изменяется
при совершении работы против внешних сил
и при передаче теплоты другим телам.
Идеальный газ
При изотермическом
процессе температура
газа не изменяется, значит,
не меняется внутренняя
энергия идеального газа.
Согласно первому закону
термодинамики, всё
переданное газу количество
теплоты идёт на совершение
работы газа против внешних
сил.
При изобарном процессе согласно первому закону термодинамики,
передаваемое газу количество теплоты идёт на изменение его внутренней
энергии и на совершение им работы при постоянном давлении.
При адиабатном процессе по первому закону термодинамики
изменение внутренней энергии происходит только
за счёт совершения работы.
Если внешние тела совершают
над газом положительную
работу, его внутренняя энергия
увеличивается, температура газа
повышается.
Если внешние тела совершают
над газом положительную
работу, его внутренняя энергия
увеличивается, температура газа
повышается.
И наоборот, если сам газ
совершает положительную
работу над внешними телами,
то его внутренняя энергия
уменьшается и газ охлаждается.
После наступления теплового
равновесия, по первому закону
термодинамики, увеличение
внутренней энергии ложки
в стакане будет равно количеству
теплоты, отданному водой.
В изолированной системе суммарная внутренняя энергия
не меняется. А, значит, и сумма количеств теплоты, полученных
и отданных телами изолированной системы, равна нолю.
Внутренняя энергия идеального газа
не изменяется только при изотермическом
процессе. При изохорном она изменяется
за счёт теплообмена, а при изобарном
процессе внутренняя энергия газа
изменяется как за счёт теплопередачи,
так и за счёт совершения работы.
В теплоизолированной системе
происходит адиабатный процесс.


0, ΔU Система совершает механическую работу только за счет уменьшения своей внутренней энергии. " width="640"
Первый закон термодинамики для адиабатного процесса: Q=0
𝚫 U = -Аʹ
адиабатное расширение А' 0, ΔU
Система совершает механическую работу только за счет уменьшения своей внутренней энергии.
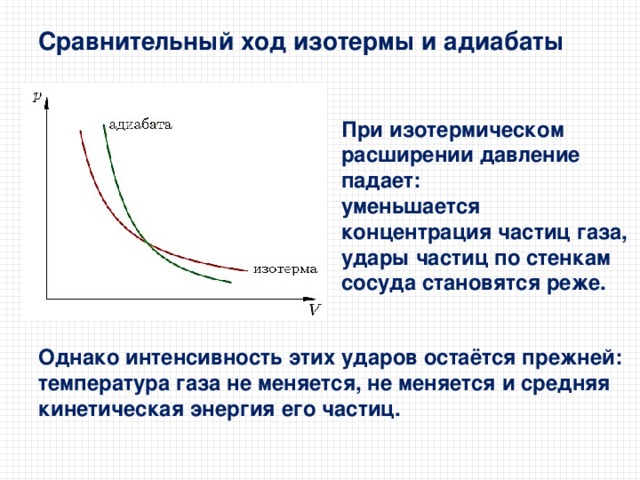
Сравнительный ход изотермы и адиабаты
При изотермическом расширении давление падает:
уменьшается концентрация частиц газа, удары частиц по стенкам сосуда становятся реже.
Однако интенсивность этих ударов остаётся прежней: температура газа не меняется, не меняется и средняя кинетическая энергия его частиц.
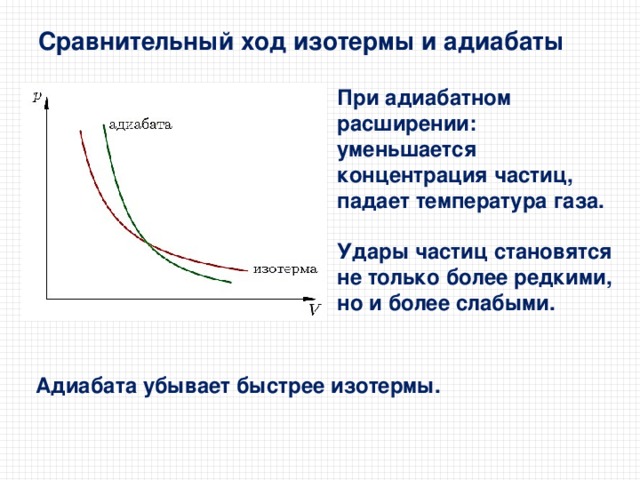
Сравнительный ход изотермы и адиабаты
При адиабатном расширении:
уменьшается концентрация частиц,
падает температура газа.
Удары частиц становятся не только более редкими, но и более слабыми.
Адиабата убывает быстрее изотермы.

Одним из главных процессов, приводящих к образованию облака, является процесс адиабатного расширения воздуха при его подъеме над поверхностью земли.
Нагретый воздух поднимается вверх и расширяется, так как атмосферное давление падает с увеличением высоты. Это расширение сопровождается значительным охлаждением. В результате водяные пары конденсируются и образуются облака.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:

Первый закон термодинамики Автор: Федорова Н.Н., МБОУ СОШ № 9

Работа в термодинамике Работа ΔA, совершаемая газом, определяется давлением газа и изменением его объема: ΔA = pΔV. А- работа, совершаемая над газом, А΄- работа, совершаемая газом


Закон сохранения энергии Энергия в природе не возникает из ничего и не исчезает : количество энергии неизменно, она только переходит из одной формы в другую. Открыт в середине 19 века нем. врачом Р.Майером, анг. Дж.Джоулем и нем. физиком Г. Гельмгольцом

Первый закон термодинамики Закон сохранения и превращения энергии к тепловым процессам. Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе

Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами: Q = ΔU + A.

Из первого закона термодинамики вытекает невозможность создания вечного двигателя.

Адиабатный процесс Процесс, протекающий в системе , которая не обменивается теплом с окружающей средой Q=0

Нагревание воздуха при быстром сжатии нашло применение в дизельных двигателях

Уравнение теплового баланса Если система изолирована, теплообмен с окружающей средой отсутствует, то

Применение 1 закона термодинамики к изопроцессам

Применение 1 закона термодинамики к изопроцессам

Применение 1 закона термодинамики к изопроцессам

1. Газ, изобарно расширяясь, совершает работу 0,2 кДж при давлении 2*105 Па. Определите первоначальный объем газа, если его конечный объем равен 2,5*10-3 м3.

2. В стальном баллоне находится гелий массой 0,5 кг при температуре 10º С. Как изменится внутренняя энергия гелия, если его температура повысится до 30º С?

3. В калориметр с теплоемкостью 63 Дж/К было налито 250 г масла при 12 ºС. После опускания в масло медного тела массой 500 г при температуре 100 ºС установилась общая температура 33 º С. Какова удельная теплоемкость масла.

4. Какую работу совершает идеальный газ в количестве 2 кмоль при его изобарном нагревании на 5 º С.

5. В цилиндр заключен кислород массой 1,6 кг при температуре 17º С и давлении 4*105 Па. До какой температуры нужно изобарно нагреть кислород, чтобы работа по расширению была равна 4*104Дж

6. Воздух, занимающий при давлении 200 кПа, объем которого 200 л, изобарно нагрели до температуры 500 К. Масса воздуха 0,58 кг. Определите работу воздуха. Молярная масса воздуха 0,029 кг/моль.

7. Газ занимал объем 0,01 м3 и находился под давлением 0,1 МПа при температуре 300 К. Затем газ был нагрет без изменения объема до температуры 320 К, а после этого нагрет при постоянном давлении до температуры 350 К. Найдите работу газа при переходе из начального состояния в конечное.







Второй закон термодинамики
Краткое описание документа:
Презентация составлена для учащихся 10 класса по термодинамике. Есть материал по следующим разделам: первый закон термодинамики, применение первого закона к изопроцессам, второй закон термодинамики. Приведены тексты задач на первый закон термодинамики.Подходит к изучению физики на базовом уровне по любому учебнику.
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 29 человек из 18 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Дистанционные курсы для педагогов
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 612 231 материал в базе
Материал подходит для УМК
§ 78. Первый закон термодинамики
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 22.03.2020 1117
- PPTX 2.2 мбайт
- 95 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Федорова Наталия Николаевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
Новые курсы: преподавание блогинга и архитектуры, подготовка аспирантов и другие
Время чтения: 16 минут
ГИА для школьников, находящихся за рубежом, может стать дистанционным
Время чтения: 1 минута
Время чтения: 2 минуты
Онлайн-тренинг: нейрогимнастика для успешной учёбы и комфортной жизни
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Читайте также:

