Область применения цинка кратко
Обновлено: 02.07.2024
В цинк Это переходный металл, который принадлежит к группе 12 Периодической таблицы и представлен химическим символом Zn. Это элемент номер 24 в изобилии в земной коре, находящийся в минералах серы, таких как сфалерит, или карбонатах, таких как смитсонит.
Это очень известный металл в массовой культуре; например, цинковые крыши и добавки для регулирования мужских гормонов. Он содержится во многих продуктах питания и является важным элементом бесчисленных метаболических процессов. Его умеренное потребление дает несколько преимуществ по сравнению с негативными последствиями его избытка в организме.
Цинк был известен задолго до того, как стал серебристым гальванизировать сталь и другие металлы. Латунь, представляющая собой сплав меди и цинка различного состава, на протяжении тысячелетий была частью исторических объектов. Сегодня его золотой цвет часто встречается на некоторых музыкальных инструментах.
Аналогичным образом, это металл, из которого изготавливаются щелочные батареи, поскольку его понижающая мощность и легкость отвода электронов делают его хорошим вариантом в качестве анодного материала. Его основное применение - гальванизация стали, покрытие ее слоем цинка, который окисляется или жертвуется, чтобы предотвратить последующую коррозию находящегося под ним железа.
В производных соединениях он почти всегда имеет степень окисления или состояние +2. Поэтому ион Zn считается 2+ окружен молекулярной или ионной средой. Хотя Zn 2+ Это кислота Льюиса, которая может вызывать проблемы внутри клеток, координируется с другими молекулами, положительно взаимодействует с ферментами и ДНК.
История
Античность
С цинком манипулировали тысячи лет; Но незаметно, поскольку древние цивилизации, включая персов, римлян, трансильванцев и греков, уже делали предметы, монеты и медное оружие.
Поэтому латунь - один из старейших известных сплавов. Они приготовили его из минерального каламина, Zn4да2ИЛИ7(ОЙ)2ЧАС2Или которые шлифуют и нагревают в присутствии ваты и меди.
Во время процесса небольшое количество металлического цинка, которое могло образоваться, улетучилось в виде пара, что на долгие годы отсрочило его идентификацию как химический элемент. Со временем содержание цинка в латуни и других сплавах увеличилось, и они стали более сероватыми.
В четырнадцатом веке в Индии уже успели произвести металлический цинк, который они назвали Jasada и они продавали его в то время в Китае.
Изоляция
Хотя Индия уже производила металлический цинк с 1300-х годов, это произошло благодаря методу, при котором каламин использовался с шерстью; следовательно, это не был металлический образец значительной чистоты. Уильям Чэмпион усовершенствовал этот метод в 1738 году, Великобритания, используя вертикальную ретортную печь.
Позже были разработаны процессы, которые, наконец, стали независимыми от каламина, с использованием вместо него оксида цинка; Другими словами, очень похож на нынешний пирометаллургический процесс. Печи также улучшились, давая возможность производить все большее количество цинка.
До тех пор еще не было приложений, которые требовали бы огромного количества цинка; но это изменилось с участием Луиджи Гальвани и Алессандро Вольта, которые уступили место концепции гальванизации. Вольта также разработал так называемый гальванический элемент, и вскоре цинк стал частью конструкции сухих элементов.
Физические и химические свойства
Внешность
Это сероватый металл, обычно доступный в виде гранул или порошка. Физически он слабый, поэтому не лучший выбор для приложений, где он должен поддерживать тяжелые объекты.
Точно так же он хрупкий, хотя при нагревании выше 100 ºC становится ковким и пластичным; до 250 ºC, температура, при которой он становится хрупким и снова может распыляться.
Молярная масса
Атомный номер (Z)
Температура плавления
419,53 ° С. Эта низкая температура плавления указывает на его слабую металлическую связь. В расплавленном состоянии он похож на жидкий алюминий.
Точка кипения
температура самовоспламенения
Плотность
-7,14 г / мл при комнатной температуре
-6,57 г / мл при температуре плавления, то есть только при плавлении или плавлении
Теплота плавления
Теплота испарения
Молярная теплоемкость
25,470 Дж / (моль К)
Электроотрицательность
1,65 по шкале Полинга
Энергии ионизации
-Первый: 906,4 кДж / моль (Zn + газообразный)
-Второй: 1733,3 кДж / моль (Zn 2+ газообразный)
-Третий: 3833 кДж / моль (Zn 3+ газообразный)
Атомное радио
Эмпирический 134 вечера
Ковалентный радиус
Твердость по Моосу
2.5. Это значение значительно ниже твердости других переходных металлов, а именно вольфрама.
Магнитный заказ
Теплопроводность
Удельное электрическое сопротивление
59 нОм при 20 ° C
Растворимость
Он нерастворим в воде, пока его защищает оксидный слой. Как только он удаляется под действием кислоты или основания, цинк вступает в реакцию с водой с образованием водного комплекса Zn (OH2)6 2+ , причем Zn находится 2+ в центре октаэдра, ограниченного молекулами воды.
Разложение
Когда он горит, он может выделять в воздух токсичные частицы ZnO. При этом наблюдается зеленоватое пламя и тлеющий свет.
Химические реакции
Цинк - химически активный металл. При комнатной температуре он может быть покрыт не только оксидным слоем, но и основным карбонатом Zn.5(ОЙ)6(CO3)2, или даже сера, ZnS. Когда этот слой различного состава разрушается под действием кислоты, металл реагирует:
Химическое уравнение, соответствующее его реакции с серной кислотой и:
С соляной кислотой. В обоих случаях, хотя это не написано, водный комплекс Zn (OH2)6 2+ ; кроме случаев, когда среда является основной, поскольку она осаждается в виде гидроксида цинка, Zn (OH)2:
Zn 2+ (водн.) + 2ОН – (ас) → Zn (ОН)2(s)
Это белый аморфный амфотерный гидроксид, способный продолжать реагировать с большим количеством ионов ОН. – :
Zn (OH)4 2- цинкат-анион. Фактически, когда цинк вступает в реакцию с таким сильным основанием, как концентрированный NaOH, комплекс цинкат натрия, Na2[Zn (OH4]:
Точно так же цинк может реагировать с неметаллическими элементами, такими как галогены в газообразном состоянии или сера:
Zn (s) + S (s) → ZnS (s) (верхнее изображение)
Изотопы
Цинк существует в природе в виде пяти изотопов: 64 Zn (49,2%), 66 Zn (27,7%), 68 Zn (18,5%), 67 Zn (4%) и 70 Zn (0,62%). Остальные синтетические и радиоактивные.
Структура и электронная конфигурация
Атомы цинка кристаллизуются в компактную, но искаженную гексагональную структуру (ГПУ), продукт их металлической связи. Валентные электроны, которые управляют такими взаимодействиями, в соответствии с электронной конфигурацией принадлежат 3d- и 4s-орбиталям:
Обе орбитали полностью заполнены электронами, поэтому их перекрытие не очень эффективно, даже когда ядра цинка оказывают на них силу притяжения.
Следовательно, атомы Zn не очень связаны, что отражается в их низкой температуре плавления (419,53 ºC) по сравнению с другими переходными металлами. Фактически, это характеристика металлов 12 группы (наряду с ртутью и кадмием), поэтому они иногда задаются вопросом, действительно ли их следует считать элементами блока d.
Числа окисления
Цинк не может потерять свои двенадцать валентных электронов или иметь степень окисления или состояние +12, если предположить, что существует катион Zn. 12+ . Вместо этого он теряет только два своих электрона; особенно те из 4s орбитали, которые ведут себя аналогично щелочноземельным металлам (г-н Бекамбара).
Когда это происходит, говорят, что цинк участвует в соединении со степенью окисления или состоянием +2; то есть, если предположить существование катиона Zn 2+ . Например, в оксиде ZnO цинк имеет эту степень окисления (Zn 2+ ИЛИ 2- ). То же самое относится и ко многим другим соединениям, поскольку приходит к выводу, что существует только Zn (II).
Однако есть также Zn (I) или Zn + , который потерял только один из электронов с 4s-орбитали. Другая возможная степень окисления цинка - 0 (Zn 0 ), где его нейтральные атомы взаимодействуют с газообразными или органическими молекулами. Поэтому его можно представить как Zn 2+ , Zn + или Zn 0 .
Как это получается
Сырье
Цинк находится на двадцать четвертом месте среди самых распространенных элементов земной коры. Обычно он содержится в минералах серы, распространенных по всей планете.
Чтобы получить металл в чистом виде, сначала необходимо собрать породы, расположенные в подземных туннелях, и сконцентрировать минералы, богатые цинком, которые представляют собой истинное сырье.
К этим минералам относятся: сфалерит или вюрцит (ZnS), цинкит (ZnO), виллемит (Zn2да4), смитсонит (ZnCO3) и ганите (ZnAl2ИЛИ4). Сфалерит, безусловно, является основным источником цинка.
Кальцинирование
После того, как минерал был сконцентрирован после процесса флотации и очистки горных пород, его необходимо прокалить, чтобы превратить сульфиды в соответствующие им. На этом этапе минерал просто нагревается в присутствии кислорода, что приводит к следующей химической реакции:
2 ZnS + 3 O2(г) → 2 ZnO (т) + 2 SO2(грамм)
SO2 также реагирует с кислородом с образованием SO3, соединение, предназначенное для синтеза серной кислоты.
После получения ZnO его можно подвергнуть пирометаллургическому процессу или электролизу, конечным результатом которого является образование металлического цинка.
Пирометаллургический процесс
ZnO восстанавливается с использованием угля (минерального или коксующегося) или оксида углерода:
2 ZnO (тв) + C (тв) → 2 Zn (г) + CO2(грамм)
ZnO (т) + CO (г) → Zn (г) + CO2(грамм)
Сложность, с которой сталкивается этот процесс, заключается в образовании газообразного цинка из-за его низкой температуры кипения, которая преодолевается высокими температурами печи. Поэтому пары цинка необходимо перегонять и отделять от других газов, а их кристаллы конденсируются на расплавленном свинце.
Электролитический процесс
Из двух способов его получения это наиболее широко используемый во всем мире. ZnO реагирует с разбавленной серной кислотой, выщелачивая ионы цинка в виде его сульфатной соли:
Наконец, этот раствор подвергается электролизу с образованием металлического цинка:
Риски
В подразделе химических реакций было упомянуто, что газообразный водород является одним из основных продуктов реакции цинка с водой. Вот почему в металлическом состоянии он должен храниться надлежащим образом и вне досягаемости кислот, щелочей, воды, серы или любых источников тепла; в противном случае существует опасность возгорания.
Чем более мелко разделен цинк, тем выше риск возгорания или даже взрыва.
В противном случае, пока температура не приближается к 500 ºC, его твердая или гранулированная форма не представляет никакой опасности. Если он покрыт слоем оксида, с ним можно обращаться голыми руками, так как он не вступает в реакцию с их влажностью; однако, как и любое твердое вещество, он раздражает глаза и дыхательные пути.
Хотя цинк необходим для здоровья, его превышение может вызвать следующие симптомы или побочные эффекты:
- Тошнота, рвота, несварение желудка, головные боли и желудок или диарея.
- Он вытесняет медь и железо во время его всасывания в кишечнике, что проявляется в усилении слабости в конечностях.
Приложения
- Металл
Сплавы
Возможно, цинк - один из металлов, наряду с медью, который образует самые популярные сплавы: латунь и гальваническое железо. Медь неоднократно наблюдалась во время выступления музыкального оркестра, поскольку золотое сияние инструментов частично связано с упомянутым сплавом меди и цинка.
Металлический цинк не находит широкого применения, хотя в свернутом виде он служит анодом для сухих элементов, а в виде порошка он предназначен в качестве восстановителя. Когда слой этого металла наносят электроосаждением на другой, первый защищает последний от коррозии, будучи более подверженным окислению; то есть цинк окисляется раньше железа.
Существует также алюмоцинк, алюминиево-цинковый сплав, используемый в гражданском строительстве.
Восстановитель
Цинк является хорошим восстановителем, поэтому он теряет свои электроны, чтобы их могли получить другие вещества; особенно катион металла. В форме порошка его восстанавливающее действие даже быстрее, чем у твердых гранул.
Он используется в процессах получения металлов из минералов; такие как родий, серебро, кадмий, золото и медь.
Аналогичным образом, его восстанавливающее действие используется для уменьшения количества органических веществ, которые могут быть задействованы в нефтяной промышленности, таких как бензол и бензин, или в фармацевтической промышленности. С другой стороны, цинковая пыль также находит применение в щелочных батареях из диоксида цинка и марганца.
Разное
Цинковая пыль, учитывая ее реакционную способность и более энергичное горение, находит применение в качестве добавки в спичечных головках, во взрывчатых веществах и фейерверках (они придают белые вспышки и зеленоватое пламя).
- Соединения
Сульфид
Сульфид цинка имеет свойство быть фосфоресцирующим и люминесцентным, поэтому его используют в производстве светящихся красок.
Окись
Белый цвет его оксида, а также его полу- и фотопроводимость используются в качестве пигмента для керамики и бумаги. Кроме того, он присутствует в тальке, косметике, каучуках, пластмассах, тканях, лекарствах, чернилах и эмалях.
Пищевая добавка
Нашему организму нужен цинк для выполнения многих жизненно важных функций. Чтобы получить его, его добавляют в некоторые пищевые добавки в виде оксида, глюконата или ацетата. Он также присутствует в кремах для снятия ожогов и раздражений кожи, а также в шампунях.
Некоторые известные или ассоциированные преимущества приема цинка:
- Улучшает иммунную систему.
- Хорошее противовоспалительное средство.
- Уменьшает раздражающие симптомы простуды.
- Он предотвращает повреждение клеток сетчатки, поэтому рекомендуется для зрения.
- Он помогает регулировать уровень тестостерона, а также связан с фертильностью мужчин, качеством их спермы и развитием мышечной ткани.
- Регулирует взаимодействие между нейронами мозга, поэтому это связано с улучшением памяти и обучения.
-А также он эффективен при лечении диареи.
Эти добавки цинка коммерчески доступны в виде капсул, таблеток или сиропов.
Биологическая роль
Карбоангидраза и карбоксипептидаза
Считается, что цинк входит в состав 10% всех ферментов в организме человека, примерно 300 ферментов. Среди них можно отметить карбоангидразу и карбоксипептидазу.
Карбоангидраза, цинк-зависимый фермент, действует на тканевом уровне, катализируя реакцию углекислого газа с водой с образованием бикарбоната. Когда бикарбонат достигает легких, фермент меняет реакцию, и образуется углекислый газ, который выводится наружу во время выдоха.
Карбоксипептидаза - это экзопептидаза, которая переваривает белки с высвобождением аминокислот. Цинк обеспечивает положительный заряд, который облегчает взаимодействие фермента с перевариваемым белком.
В функционировании простаты
Цинк присутствует в разных органах человеческого тела, но наибольшая его концентрация находится в простате и в сперме. Цинк отвечает за правильное функционирование простаты и развитие мужских репродуктивных органов.
Цинковые пальцы
Цинк участвует в метаболизме РНК и ДНК. Цинковые пальцы (Zn-пальцы) состоят из атомов цинка, которые служат связующими мостами между белками, которые вместе участвуют в различных функциях.
Цинковые пальцы полезны при чтении, письме и транскрипции ДНК. Кроме того, существуют гормоны, которые используют их в функциях, связанных с гомеостазом роста по всему телу.
В регуляции глутамата
Глутамат является основным возбуждающим нейротрансмиттером в коре головного мозга и стволе мозга. Цинк накапливается в глутаминергических пресинаптических везикулах, участвуя в регуляции высвобождения глутамата нейротрансмиттера и в возбудимости нейронов.
Имеются данные о том, что чрезмерное высвобождение глутамата нейромедиатора может иметь нейротоксическое действие. Поэтому существуют механизмы, регулирующие его высвобождение. Таким образом, гомеостаз цинка играет важную роль в функциональной регуляции нервной системы.

Цинк — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Эссенциальный (незаменимый) микроэлемент тканей человека. По количественному соотношению в организме занимает второе, после железа, место. Ему принадлежит ключевая роль в регенерации поврежденных тканей, так как без цинка нарушается синтез нуклеиновых кислот и белка.
Смотрите так же:
СТРУКТУРА
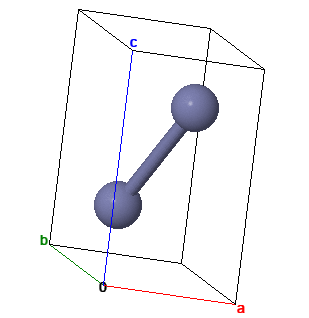
Кристаллы цинка имеют гексагональную упаковку атомов. Но в отличие от плотнейшей гексагональной упаковки сферических атомов решетки цинка вытянуты в одном направлении. Каждый атом окружен шестью другими атомами, лежащими в одной плоскости или слое. Расстояние между центрами соседних атомов в этом плоском слое а равно 0,26649 нм. Внешняя электронная конфигурация атома 3d 10 4s 2 . Не полиморфен.
СВОЙСТВА
ЗАПАСЫ И ДОБЫЧА

Среднее содержание цинка в земной коре — 8,3·10 -3 %, в основных извержённых породах его несколько больше (1,3·10 -2 %), чем в кислых (6·10 -3 %). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Цинк добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60% Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах.
ПРОИСХОЖДЕНИЕ
ПРИМЕНЕНИЕ
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.

Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Цинк – это металл, стоящий в таблице Менделеева, под номером 30 и имеет обозначение Zn. Плавится при температуре 419 °С градусов, если же температура кипения 913 °С – начинает превращаться в пар. При температурном обычном режиме, состояние хрупкое, а при ста градусах начинает гнуться.
Цвет цинка сине-белый. При воздействии кислорода появляется окисление, а также покрытие карбоната, предохраняющего металл от дальнейшей реакции окисления. Появление на цинке гидроокиси обозначает то, что вода на химический элемент не действует.
Цинк — химический элемент, имеет свои отличительные свойства, преимущества и недостатки. Он широко применяется в повседневной жизни человека, в фармацевтике и металлургии.

Особенности цинка
Металл является необходимым и широко применяемым практически во всех отраслях повседневной жизни человека.
Это переходной металл, имеет степень окисления +2, радиоактивный изотоп, период полураспада 244 дня.

Водный арсенат кадмия, цинка и меди
В чистом виде элемент не добывается. Содержится в рудах и минералах: клейофане, марматите, вюртците, цинките. Обязательно присутствует в сплаве с алюминием, медью, оловом, никелем.
Химические, физические свойства и характеристики цинка
Цинк – металл, обладает рядом свойств и характеристик, отличающих его от иных элементов периодической таблицы.
К физическим свойствам цинка относится его состояние. Основным фактором выступает температурный режим. Если при комнатной температуре это хрупкий материал, плотность цинка 7130 кг/м 3 (˃ плотности стали), который практически не гнётся, то при повышении он легко изгибается и прокатывается в листах на заводах. Если взять более высокий температурный режим – материал приобретает жидкое состояние, а если еще поднять температуру на 400-450 °С градусов, тогда он просто испарится. В этом уникальность – менять своё состояние. Если же подействовать кислотами и щелочами, он может рассыпаться, взорваться, расплавиться.

Цинк в жидком состоянии
Формула цинка Zn – zincum. Атомная масса цинка 65.382 а.е.м.
Электронная формула: ядро атома металла содержит 30 протон, 35 нейтрон. В атоме 4 энергетических уровня – 30 электронов. (рис. строение атома цинка)1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 .
Кристаллическая решётка цинка – шестиугольная кристаллическая система с плотно прижатыми атомами. Данные решётки: A=2.66У, С=4.94.
Структура и состав цинка
По применению среди всех элементов периодической таблицы металл стоит на 23 месте. В природе элемент выступает в виде сульфида с примесями свинца Pb, кадмия Cd, железа Fe, меди Cu, серебра Ag.

В зависимости от того, какое количество примесей, металл имеет маркировку.
Производство цинка
Как было сказано выше, чистого вида данного элемента в природе нет. Он добывается из иных пород, таких как руда – кадмий, галлий, минералы – сфалерит.
Металл получают на заводе. Каждый завод имеет свои отличительные особенности производства, поэтому оборудование для получения чистого материала различно. Оно может быть таким:
- Роторы, расположенные вертикально, электролитные.
- Специальные печи с достаточно высокой температурой для обжига, а также специальные электропечи.
- Транспортёры и ванны для электролиза.
В зависимости от принимаемого метода добычи металла, задействовано соответствующее оборудование.
Получение чистого цинка
Как упоминалось выше – в природе чистого вида нет. В основном добыча производится из руд, в которых он идет с различными элементами.
Для получения чистого материала задействован специальный флотационный процесс с избирательностью (селективностью). После проведения процесса руда распадается на элементы: цинк, свинец, медь и так далее.
Добытый таким методом чистый металл обжигается в специальной печи. Там при определенных температурах сульфидное состояние материала переходит в оксидное. При обжиге выделяется газ с содержанием серы, направляемый для получения серной кислоты.

Есть 2 способа получения металла:
- Пирометаллургический – идет процесс обжигания, после — полученная масса восстанавливается с помощью чёрного угля и кокса. Конечным процессом является отстаивание.
- Электролитический – добытая масса обрабатывается серной кислотой. Полученный раствор подвергают электролизу, при этом металл оседает, его плавят в печах.
Выплавка цинка в печи
Температура плавления цинка в печи 419-480 °С градусов. Если же температурный режим превышен, тогда материал начинает испаряться. При данной температуре допускается примесь железа 0.05%.
При процентной ставке 0.2 железа, лист невозможно будет прокатать.
Применяются различные способы выплавки чистого металла, вплоть до получения цинковых паров, которые направляются в специальные резервуары и там вещество опадает вниз.
Применение металла
Свойства цинка позволяют его применение во многих сферах. В процентном соотношении:
- Цинкование – до 60%.
- Медицина – 10%.
- Различные сплавы, содержащие данный металл 10%.
- Выпуск шин 10%.
- Производство красок – 10%.

А также применение цинка необходимо для восстановления таких металлов, как золото, серебро, платина.
Цинк в металлургии
Металлургическая промышленность задействует данный элемент периодической таблицы как основной для достижения определенных целей. Выплавка чугуна, стали является главной во всей металлургии страны. Но, данные металлы подвержены негативному влиянию окружающей среды. Без определенной обработки идет быстрое окисление металлов, что приводит к их порче. Наилучшей защитой служит оцинкование.
Нанесение защитной плёнки на чугун и сталь является лучшим средством от коррозии. На оцинкование уходит около 40% всего производства чистого материала.
Способы оцинкования
Металлургические заводы отличительны не только своим оборудованием, но и применяемыми методами производства. Это зависит от ценовой политики, и месторасположения (природных ресурсов, используемых для металлургической промышленности). Есть несколько методов оцинкования, которые рассматриваются ниже.
Горячий способ оцинкования
Данный способ заключается в обмакивании металлической детали в жидком растворе. Происходит это так:
- Деталь или изделие обезжиривается, очищается, промывается и сушится.
- Далее, цинк расплавляется до жидкого состояния при температуре до 480 °С.
- В жидкий раствор опускается подготовленное изделие. При этом оно хорошо смачивается в растворе и образуется покрытие толщиной до 450 мкм. Это является 100% защитой от воздействия внешних факторов на изделие (влага, прямые солнечные лучи, вода с химическими примесями).

Горячее цинкование металлоконструкций
Но, данный метод имеет ряд недостатков:
- Цинковая пленка на изделии получается неравномерного слоя.
- Нельзя использовать данный метод для деталей, отвечающих точным стандартам по ГОСТу. Где каждый миллиметр считается браком.
- После горячего оцинкования, не каждая деталь останется прочной и износостойкой, поскольку после прохождения высокой температуры появляется хрупкость.
А также данный метод не подходит для изделий, покрытых лакокрасочными материалами.
Холодное оцинкование
Этот метод носит 2 названия: гальванический и электролитический. Методика покрытия изделия защитой от коррозии такова:

Благодаря этому методу защитой покрываются детали с точным допуском, изделия, покрытые лакокрасочными материалами. Повышается стойкость к внешним факторам, приводящим к коррозии.
Недостатки данного метода: тонкий защитный слой – до 35 мкм. Это приводит к меньшей защите и небольшим срокам защиты.
Термодиффузионный способ
Данный метод делает покрытие, которое является электродом с положительной полярностью, в то время как металл изделия (сталь) становится отрицательной полярности. Появляется электрохимический защитный слой.
Метод применим только в случае, если детали произведены из углеродистой стали, чугуна, стали с примесями. Цинк используется таким образом:
- При температуре от 290 °С до 450 °С в порошковой среде, поверхность детали насыщается Zn. Здесь маркировка стали, а также тип изделия имеют значение – выбирается соответствующая температура.
- Толщина защитного слоя достигает 110 мкм.
- В закрытый резервуар помещается изделие из стали, чугуна.
- Добавляется туда специальная смесь.
- Последним шагом является специальная обработка изделия от появления белых высолов от солёной воды.

В основном данным методом пользуются в случае, если требуется покрыть детали, имеющие сложную форму: резьбу, мелкие штрихи. Образование равномерного защитного слоя является важным, поскольку данные детали претерпевают множественное воздействие внешней агрессивной среды (постоянная влага).
Данный метод дает самый большой процент защиты изделия от коррозии. Оцинкованное напыление является износостойким и практически нестираемым, что очень важно для деталей, которые время о времени крутятся и разбираются.
Иные сферы применения цинка
Помимо оцинкования, металл применяется и в других сферах промышленности.
- Цинковые листы. Для производства листа выполняется прокатка, в которой важна пластичность. Это зависит от температурного режима. Температура в 25 °С дает пластичность только в одной плоскости, что создает определенные свойства металла. Тут главное для чего изготавливается лист. Чем выше температура, тем тоньше получается металл. В зависимости от этого идет маркировка изделия Ц1, Ц2, Ц3. После этого из листов создаются различные изделия для автомобилей, профиля для строительства и ремонта, для полиграфии и так далее.
- Цинковые сплавы. Для улучшенных свойств металлических изделий, добавляется цинк. Данные сплавы создаются при высоких температурах в специальных печах. Чаще всего производятся сплавы из меди, алюминия. Данные сплавы применяются для производства подшипников, различных втулок, которые применимы в машиностроении, судостроении и авиации.
В домашнем обиходе оцинкованное ведро, корыто, листы на крыше – это норма. Применяется цинк, а не хром или никель. И дело не только в том, что оцинкование дешевле, чем покрытие другими материалами. Это наиболее надёжный и продолжительный по службе эксплуатации защитный материал нежели, хром или другие применяемые материалы.
В итоге – цинк наиболее распространенный металл, применяемый широко в металлургии. В машиностроении, строительстве, медицине – материал применим не только как защита от коррозии, но и для увеличения прочности, продолжительного срока эксплуатации. В частных домах оцинкованные листы защищают крышу от осадков, в зданиях выравниваются стены и потолки гипсокартонными листами на основе оцинкованных профилей.
Практически у каждой хозяйки в доме есть оцинкованное ведро, корыто, которым она пользуется длительное время.
Цинк относится к металлам древности, дата и место открытия которых теряются в столетиях. По одним источникам, первые упоминания о нем археологи находили в индийских манускриптах, относящихся к V веку до н.э., по другим, в Египте в I веке до нашей эры.

Цинк применяется в медицине, как противовоспалительное и антисептическое средство. Сплавы с цинком находят и промышленное применение: в машиностроении, для производства цинковых белил, в качестве антикоррозийных покрытий для стали, в изготовлении аккумуляторов и батареек.
Цинк в промышленности
Технология производства цинка

В природе металл встречается в виде сульфида с примесями меди, железа и кадмия. В чистом виде цинк не добывают. Он присутствует в составе сульфидных руд и минеральных пород: сфалерите, вюртците, цинките. Также содержится в литейных сплавах с алюминием, медью (латунью), никелем.
Цинк выплавляют на заводе. Для производства металлического цинка используют пирометаллургический и гидрометаллургический процессы. Сульфидные руды перерабатывают, в результате чего они распадаются на отдельные элементы: цинк и другие составные части. Полученный цинковый концентрат подвергают обжигу.
Характеристики цинка: физические и химические свойства

Цвет цинка — сине-белый.
Температура плавления — 419°С.
Температура кипения (переходит в состояние пара) — 913 °С.
В спокойном состоянии — хрупкий металл (плотность цинка 7130 кг/м 3 ).
Пластичность появляется при 100°С.
Атомная масса цинка — 65.382 а.е.м.
Цинк образует кислородные соединения, оксидируется и образует пленку.
Цинк не вступает в реакцию с щелочами и кислотами.
Такие свойства делают цинк уникальным металлом. При разных температурах он меняет свое состояние.
Области применения цинка

Основными производственными сферами использования цинка являются:
- Получение сплавов с добавлением цинка;
- Производство оцинкованной стали;
- Цинк является основным легирующим элементом для латуни;
- Производство химикатов.

Также металл находит широкое применение в прочих производствах:
- Данный металл используется для извлечения золота и серебра.
- При помощи цинка производят энергоемкие воздушные и автомобильные аккумуляторы.
- Цинк является важным элементов при создании аккумуляторов и батареек.
- Селенид цинка участвует в производстве оптических стекол.
- Используется в качестве антикоррозийного материала.
- Сульфиды и окиси цинка применяются для создания гибких экранов, деталей автомобилей и оружия.
- Металл применяется для производства цинковых матриц в сфере полиграфической печати.
- Сульфид цинка обнаруживает лучи радиации.
- В состав многих красящих смесей для ремонта входит цинк, в особенности в белила и белую краску.
- При производстве бытовых оцинкованных изделий: ведра, тазы, посуда.
Цинк в медицине
Биологическая роль и функции цинка в организме
Согласно исследованиям ученых, в организме взрослого человека цинк содержится в размере:
- у женщин — 1,5 грамма
- у мужчин — 2,5-3 грамма
Процентное соотношение цинка в организме:
- в коже — 20%
- в костно-мышечной системе — 60%

Основная функция элемента для человеческого организма — это формирование карбоангидраза в эритроцитах для поддержания кислотно-щелочного равновесия. Этот белок обеспечивает преобразование углекислого газа и обратное его перемещение в легкие для последующего выдоха. Цинк, будучи частью 400 пищеварительных ферментов, влияет на полноценное усвоение микроэлементов из пищи.
Помимо основного свойства, цинк выполняет следующие функции:
Продукты питания, богатые цинком
Цинк из пищи и витаминов всасывается в верхней части кишечника посредством белковых соединений из желудочного сока. Этот микроэлемент обязательно должен быть в рационе мужчин, беременных, кормящих женщин и детей в период их активного роста.
ТОП-10 продуктов питания по содержанию цинка в мкг на 100 грамм:
| 1. | Зародыши пшеницы | 17.000 |
| 2. | Семена кунжута | 7.800 |
| 3. | Овсянка | 6.200 |
| 4. | Яичный желток | 5.600 |
| 5. | Говяжья печень | 5.000 |
| 6. | Арахис | 4.800 |
| 7. | Горох лущеный | 2.440 |
| 8. | Мясо кролика | 2.300 |
| 9. | Цельнозерновой пшеничный хлеб | 2.130 |
| 10. | Гречневая крупа | 2.000 |
Суточная норма потребления цинка
При правильном питании гипоцинкоз (недостаток цинка) человеку не опасен. Лишь при возникновении проблем с всасыванием солей цинка из кишечника и выведением его из организма, могут возникать нарушения обменного характера.

Недостаток цинка часто встречается у детей в период активного роста и у младенцев на грудном вскармливании. В молоке, к сожалению, малое количество необходимого для развития элемента.
У больных сахарным диабетом наблюдается повышенное выделение цинка с мочой и, соответственно, более низкое его содержание в организме.
Для повышения уровня цинка в организме рекомендуется не только добавлять в рацион продукты, богатые этим элементом, но и принимать цинкосодержащие препараты.

Рекомендуемые суточные дозы цинка в зависимости от пола и возраста:
Цинк — незаменимый питательный элемент, обладающий антиоксидантными и противовоспалительными свойствами, участвующий во множестве биологических процессов человеческого организма.

Цинк — хрупкий голубовато-белый металл. В природе без примесей не встречается. В 1738 году Уильям Чемпион добыл чистые пары цинка с помощью конденсации. В периодической системе Менделеева находится под номером 30 и обозначается символом Zn.
Свойства цинка
Химические свойства цинка
Цинк — активный металл. При комнатной температуре тускнеет и покрывается слоем оксида цинка.
- Вступает в реакцию со многими неметаллами: фосфором, серой, кислородом.
- При повышении температуры взаимодействует с водой и сероводородом, выделяя водород.
- При сплавлении с щелочами образует цинкаты — соли цинковой кислоты.
- Реагирует с серной кислотой, образуя различные вещества в зависимости от концентрации кислоты.
- При сильном нагревании вступает в реакции со многими газами: газообразным хлором, фтором, йодом.
- Не реагирует с азотом, углеродом и водородом.
Физические свойства цинка
Цинк — твердый металл, но становится пластичным при 100–150 °C. При температуре выше 210 °С может деформироваться. Температура плавления — очень низкая для металлов. Несмотря на это, цинк имеет хорошую электропроводность.
- Плотность — 7,133 г/см³.
- Теплопроводность — 116 Вт/(м·К).
- Температура плавления цинка — 419,6 °C.
- Температура кипения — 906,2 °C.
- Удельная теплота испарения — 114,8 кДж/моль.
- Удельная теплота плавления — 7,28 кДж/моль.
- Удельная магнитная восприимчивость — 0,175·10-6.
- Предел прочности при растяжении — 200–250 Мн/м 2 .
Подробный химический состав цинка различных марок указан в таблице ниже.
| Обозначение марок | Цинк, не менее | Примесь, не более | |||||||
| свинец | кадмий | железо | медь | олово | мышьяк | алюминий | всего | ||
| ЦВ00 | 99,997 | 0,00001 | 0,002 | 0,00001 | 0,00001 | 0,00001 | 0,0005 | 0,00001 | 0,003 |
| ЦВ0 | 99,995 | 0,003 | 0,002 | 0,002 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,005 |
| ЦВ | 99,99 | 0,005* | 0,002 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,01 |
| Ц0А | 99,98 | 0,01 | 0,003 | 0,003 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,02 |
| Ц0 | 99,975 | 0,013 | 0,004 | 0,005 | 0,001 | 0,001 | 0,0005 | 0,005 | 0,025 |
| Ц1 | 99,95 | 0,02 | 0,01 | 0,01 | 0,002 | 0,001 | 0,0005 | 0,005 | 0,05 |
| Ц2 | 98,7 | 1,0 | 0,2 | 0,05 | 0,005 | 0,002 | 0,01 | 0,010** | 1,3 |
| Ц3 | 97,5 | 2,0 | 0,2 | 0,1 | 0,05 | 0,005 | 0,01 | - | 2,5 |
| * В цинке, применяемом для производства сплава марки ЦАМ4-1о, массовая доля свинца должна быть не более 0,004%. ** В цинке, применяемом для проката, массовая доля алюминия должна быть не более 0,005%. | |||||||||
Содержание примесей в цинке зависит от способа производства и качества сырья.
В России основной процент цинка получают гидрометаллургическим способом — металл восстанавливают из солей в растворах. Такой способ позволяет получить наиболее чистый металл. Но часть цинка обрабатывают при высоких температурах. Такой метод называют пирометаллургическим.
Свинец — особая примесь в цинке, так как основная его часть оседает из-за нерастворимых анодов, содержащихся в металле. Катодный цинк, помимо всех указанных примесей, состоит из хлора и фтора.
Как примеси изменяют свойства цинка
Производители ограничивают содержание кадмия, олова и свинца в литейных сплавах цинка, чтобы подавить межкристаллитную коррозию.
Олово — вредная примесь. Металл не растворяется и выделяется из расплава — способствует ломкости цинковых отливок. Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Железо повышает твердость цинка, но снижает его прочность. Вместе с тем оно усложняет процесс заполнения форм при литье.
Медь увеличивает твердость цинка, но уменьшает его пластичность и стойкость при коррозии. Содержание меди также мешает рекристаллизации цинка.
Наиболее вредная примесь — мышьяк. Даже при небольшом ее количестве металл становится хрупким и менее пластичным.
Чтобы избежать растрескивания кромок при горячей прокатке цинка, содержание сурьмы не должна быть выше 0,01%. В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
Сплавы цинка
Сплавы на цинковой основе с добавлением меди, магния и алюминия имеют низкую температуру плавления и обладают хорошей текучестью. Они легко поддаются обработке, свариванию и паянию.
Латунь
Различают латуни двухкомпонентные и многокомпонентные.
Двухкомпонентная латунь — сплав цинка с высоким содержанием меди. Существует желтая латунь с медью в количестве 67%, золотистая медь или томпак — 75%, и зеленая — 60%. Такие сплавы могут деформироваться при температуре 300 °C.
Многокомпонентные латуни, помимо 2-х основных металлов, состоят из других добавок: никеля, железа, свинца или марганца. Каждый из элементов влияет на свойства сплава.
ЦАМ — семейство цинковых сплавов. В их состав входят магний, алюминий и медь. Такие сплавы цинка используются в литейном производстве. В них содержится алюминий в количестве 4%.
Основная область применения сплавов ЦАМ — литье цинка под давлением. Сплавы этого семейства обладают низкой температурой плавления и хорошими литейными свойствами. Их высокопрочность позволяет производить прочные и сложные детали.
Вирениум
Сплав состоит из цинка (24,5%), меди (70%), никеля (5,5%).
Производств цинка
Добыча металла
Цинк как самородный металл в природе не встречается. Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия. Руды обогащаются селективной флотацией и получаются цинковые концентраты (50–60% Zn).

Концентраты цинка обжигают в печах. Сульфид цинка переводится в оксид ZnO. При этом выделяется сернистый газ SO2, который используется в производстве серной кислоты.
Получение металла
Существуют два способа получения чистого цинка из оксида ZnO.
Самый древний метод — дистилляционный. Обожженный концентрированный состав подвергают термообработке, чтобы придать ему зернистость и газопроницаемость.
Затем концентрат восстанавливают коксом или углем при температуре 1200–1300 °C. В процессе образуются пары металла, которые конденсируют и разливают в изложницы. Жидкий металл отстаивают от железа и свинца при температуре 500 °C. Так достигается цинк чистотой 98,7%.
Иногда используется сложная и дорогая обработка цинка ректификацией — разделением смесей за счет обмена теплом между паром и жидкостью. Такая чистка позволяет получить металл чистотой 99,995% и извлечь кадмий.
Второй метод производства цинка — электролитический. Обожженный концентрат обрабатывается серной кислотой. Готовый сульфатный раствор очищается от примесей, после чего подвергается электролизу в свинцовых ваннах. Цинк дает осадок на алюминиевых катодах. Полученный металл удаляют с ванн и плавят в индукционных печах. После этого получается электролитный цинк чистотой 99,95%.
Литье металла
Горячий цинк — жидкий и текучий металл. Благодаря таким свойствам он легко заполняется в литейные формы.
Примеси влияют на величину натяжения поверхности цинка. Технологические свойства металла можно улучшить, добавив небольшое количество лития, магния, олова, кальция, свинца или висмута.

Чем выше температура перегрева цинка, тем лучше он заполняет формы. При литье металла в чугунные изложницы его объем уменьшается на 1,6%. Это затрудняет получение крупных и длинных цинковых отливок.
Применение цинка
Для защиты металлов от коррозии
Чистый цинк используется для защиты металлов от коррозии. Основу покрывают тонкой пленкой. Этот процесс называется металлизацией.
В автомобильной отрасли
Сплавы на цинковой основе используют для оформления декора автомобильного салона, в производстве ручек дверей, замков, зеркал и корпусов стеклоочистителей.
В автомобильные покрышки добавляют окись цинка, которая повышает качество резины.
В батарейках, аккумуляторах и других химических источниках тока цинк используется как материал для отрицательного электрода. В производстве электромобилей применяются цинк-воздушные аккумуляторы, которые обладают высокой удельной энергоемкостью.
В производстве ювелирных украшений
Ювелиры добавляют цинк в сплавы на основе золота. В итоге они легко поддаются ковке и становятся пластичными — прочно соединяют мелкие детали изделия между собой.
Металл также осветляет ювелирные изделия, поэтому его часто используют в изготовлении белого золота.
В медицине
Окись цинка применяется в медицине как антисептическое средство. Окись добавляют в мази и другие составы для заживления ран.
Благодаря своим свойствам, цинк широко применяется в различных областях промышленности. Металл пользуется спросом из-за относительно низкой цены и хороших физических свойств.
Читайте также:

