Методика решения расчетных задач в школьном курсе химии
Обновлено: 05.07.2024
В методике обучения химии разработаны различные способы решения расчетных задач. Среди них выделяют следующие:
· физический способ (решение задач с использованием формул математической зависимости);
· решение задач с использованием пропорций;
· алгебраический способ (решение задач путем составления и решения алгебраических уравнений и неравенств);
3.1. Физический способ
При выборе данного способа решения расчетных задач по химии следует опираться на знания школьников полученные при изучении физики и математики. На уроках физики учащиеся решают задачи с использованием формул математической зависимости величин. При этом они подбирают нужные формулы, решают сначала задачи в общем виде, а затем подставляют числовые значения [3]. В этот блок входят многочисленные типы задач, требующие при решении применения известных формул:
1. , отсюда N = NA • n
2. , отсюда m = n • M и .
3. , отсюда V = Vm • n и .
4. , отсюда m = ρ • V и .
6. w (в-ва)= , отсюда m (в-ва)= m (р-ра)• w (в-ва) и m (р-ра)= .
7. c (р.в.)= , отсюда n = V (р-ра) • c (в-ва) и V (р-ра) = .
8. φ(газа В)= , отсюда V ( B ) = φ( B ) • V (смеси) и V (смеси) = .
Решение химических задач физическим способом включает следующие этапы: а) подбор формулы для искомой величины; б) преобразование формулы в общем виде; в) подстановка в формулу числовых значений и нахождение ответа.
Пример 1. Какую массу имеет аммиак, занимающий объем 5,6 дм 3 (при н.у.)?
1. Подбираем формулу для нахождения массы m = n • M . В ней неизвестно химическое количество вещества.
2. Подбираем формулу для нахождения химического количеств газа, исходя из условия задачи: n = .
3. Определяем общую искомую формулу для нахождения массы газа: m = • M .
4. Подставляем общую формулу числовые значения и находим массу аммиака.
М r ( NH 3 ) = Ar ( N ) + 3 Ar ( H ) = 14 + 3 · 1 = 17; М( NH 3 ) = 17 г/моль.
m ( NH 3 ) = • 17 г/моль = 4,25 г;
Ответ : аммиак объемом 5,6 дм 3 (при н.у.) имеет массу 4.25 г.
3.2. Решение задач с использованием пропорций
Составление пропорций при решении расчетных задач по химии наиболее часто используется в школьной практике. Этот способ многие учителя считают наиболее понятным учащимся. Однако применение его ограничено, поскольку составление пропорций при решении отдельных типов задач не всегда оправдано. Наиболее рационально применять пропорции при проведении расчетов по химическим уравнениям.
Решение расчетных задач по химии с использованием пропорций включает этапы: а) установление пропорциональной зависимости; б) составление пропорции; в) решение пропорции и нахождение ответа [3].
Пример 2. Какую массу фосфора нужно сжечь для получения оксида фосфора( V ) массой 7,1 г?
1. Составляем уравнение реакции и устанавливаем стехиометрические отношения между известной и искомой величиной:
n 4 моль 2 моль
M 31 г/моль 142 г/моль
2. Составляем пропорцию, рассуждая: при сжигании фосфора массой 124 г образуется оксид фосфора( V ) массой 284 г, а при сжигании фосфора массой x г получается оксид фосфора( V ) массой 7,1 г:
3. Решаем пропорцию: х = = 3,1 г
Ответ : для получения оксида фосфора( V ) массой 7,1 г необходимо сжечь фосфор массой 3,1 г.
Рассмотрим решение предыдущей задачи (пример 2) этим способом.
Ход рассуждений: оксид фосфора( V ) массой 142 г содержит химическое количество вещества 1 моль. Следовательно, оксид фосфора( V ) массой 1 г содержит химическое количество вещества моль, а P 2 O 5 массой 7,1 г – в 7,1 раза больше, т.е. моль = 0,05 моль оксида фосфора( V ).
Согласно уравнению реакции при получении оксида фосфора( V ) химическим количеством 4 моль сгорает фосфор химическим количеством 2 моль, а при образовании 0,05 моль оксида фосфора( V ) сгорает 0,1 моль фосфора.
1 моль фосфора имеет массу 31 г, а 0,1 моль фосфора – в 0,1 раза больше, т.е. 31 г · 0,1 = 3,1 г
3.4. Способ подбора
Способом подбора, как правило, решаются химические задачи на расчеты , связанные с нахождением неизвестного элемента или вещества. Рассмотрим этот способ на конкретном примере.
Пример 3. Металл, массой 16 г, взаимодействуя с молекулярным кислородом объемом 4,48 дм 3 (н.у.), образует оксид. Определите, какой это металл.
1. Составляем уравнение реакции получения оксида, приняв за х валентность металла в оксиде.
2. Находим химическое количество прореагировавшего кислорода:
n ( O 2 ) = = = 0,2 моль.
3. Определяем по уравнению реакции химическое количество прореагировавшего металла:
= ; n (Ме) = = моль = моль.
4. Находим молярную массу металла и подбором определяем, какой это металл:
Методика обучения определяется как педагогическая наука, исследующая закономерности определенному учебному предмету. Соответственно, методика обучения учащихся решению задач по химии может представлять частную методику, исследующую закономерности обучения решению задач.
Овладение методикой обучения школьников решать задачи — одно из сложных профессиональных умений учителя химии. Решение химических задач — важная сторона овладения знаниями основ науки химии. Включение задач в учебный процесс позволяет реализовать следующие дидактические принципы обучения:
- обеспечение самостоятельности и активности учащихся;
- достижение прочности знаний и умений;
- осуществление связи обучения с жизнью;
- реализация политехнического обучения химии, профессиональной ориентации.
Выпускник средней школы должен уметь решать следующие типы расчетных задач:
- вычисление относительных молекулярных масс веществ по химическим формулам;
- вычисление по химическим уравнениям массы или количества вещества по известным массе или количеству одного из вступающих или получающихся в реакции веществ;
- расчеты по термохимическим уравнениям;
- вычисление массовой доли и массы вещества в растворе;
- вычисление по химическим уравнениям объемов газов по известному количеству одного из вступающих в реакцию веществ или получающихся в результате реакции;
- расчеты объемных отношений газов по химическим уравнениям;
- вычисление относительной плотности газов;
- расчеты по химическим уравнениям, если одно из исходных веществ взято в избытке;
- определение массовой или объемной доли практического выхода продукта реакции по сравнению с теоретически возможным;
- вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего примеси;
- нахождение молекулярной формулы вещества, находящегося в газообразном состоянии.
Все указанные типы расчетных задач условно можно сгруппировать следующим образом:
- Задачи, для решения которых используют расчеты по химическим формулам (1,7).
- Задачи, для решения которых используют расчеты по химическим уравнениям (2, 3, 5, 6, 8, 9, 10).
- Задачи на растворы (4).
- Задачи на выведение химических формул (11).
- Задачи на химические (кинетические и другие) закономерности также используются в школьном обучении химии.
При решении расчетных задач по химии в первую очередь происходит формирование учебно-познавательных компетенций:
- самостоятельная познавательная деятельность, включающая элементы логической, методологической, общеучебной деятельности;
- креативные навыки по отношению к изучаемым объектам: добывание знаний непосредственно из окружающей действительности, владением приемами учебно-познавательных проблем, действий в нестандартных ситуациях;
- химическая функциональная грамотность.
Требования образовательного стандарта к уровню подготовки учащихся в области решения расчетных задач
Основное общее образование
Среднее (полное) общее образование
Умение вычислять:
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни
- массовую долю химического элемента по формуле соединения;
- массовую долю химического элемента по формуле соединения;
- количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции.
- выполнение расчетов, необходимых при приготовлении растворов заданной концентрации, используемых в быту и на производстве.
- расчет количеств (масс, объемов) веществ, образующихся в результате протекания химической реакции.
Особенности решения расчетных задач по химии
При решении расчетных задач применяют обычно линейные по структуре алгоритмические предписания.
Общий алгоритм решения расчетной задачи:
- Прочитайте текст задачи.
- Запишите кратко условие и требование задачи с помощью общепринятых условных обозначений.
- Составьте химические формулы (или уравнение) в соответствии с содержанием задачи и ее требованием.
- Составьте рациональный план решения задачи.
- Продумайте, какие дополнительные данные можно извлечь из химических формул (или уравнения) для реализации требований задачи.
- Произведите все необходимые в данной задаче действия с заданной математической точностью.
- Запишите полученный ответ.
В методике преподавания можно выделить три основных этапа формирования умений решения расчетных задач:
Первый этап — формирование общих понятий данного типа химических задач: отличительные признаки данного типа задач, обязательный набор условий для данного типа — узнавания типа задачи;
— формирование общих принципов решения расчетных задач разных типов: определение конкретного алгоритма на основании общих принципов решения.
Второй этап — практический — нарешивание расчетных задач по разнообразию способов, рациональности, нарастанию уровня сложности решения. Завершается этот этап обязательно решением комбинированных задач.
Третий этап — составление условий задач — позволяет лучше осмыслить, взглянуть изнутри на решение задачи, поставить себя на позицию автора задачи.
В решении любой расчетной задачи можно выделить два аспекта: химический и математический. Основу для расчетов дают химические формулы и уравнения. Поэтому для решения любой химической задачи необходимо владеть химической грамотностью, т.е. знание строения и свойств веществ и алгоритмом решения (математическая грамотность).
Все типы химических задач имеют единство — три характеристики вещества: масса (m), объем (V), количество вещества — моли (v или n):

Взаимосвязь осуществляется посредством молярного объема, молярной массы и плотности. Это составляет фундамент стереохимических расчетов.
Расчётные задачи по химии учащиеся решают с начала VIII класса и до конца обучения в школе. Решение задач позволяет:
- расширять кругозор учащихся;
- развивать умение логически мыслить;
- воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
- устанавливать связь химии с другими науками: физикой, математикой, биологией, экологией и др.;
- способствует политехнической подготовке учащихся, готовиться к успешной аттестации по предмету (в том числе и в форме ЕГЭ).
Решая задачи, учащиеся более глубоко усваивают учебный материал, учатся применять приобретённые теоретические знания на практике.
При обучении учащихся решению расчетных химических задач следует помнить, что решение задач — это средство, способствующее более глубокому пониманию и усвоению химических понятий и в первую очередь количественных.
Обычно у учащихся при решении расчетных химических задач возникают затруднения особого порядка, связанные именно со спецификой химической науки.
Подбирать задачи нужно так, чтобы возникала необходимость использовать эту единицу. И лишь тогда, когда в сознании учащихся утвердится, что количественные отношения веществ всегда выражаются в молях, можно учить переходным формулам, показать взаимосвязь массы и количества вещества, объема и количества вещества.
Схема взаимосвязи физических величин
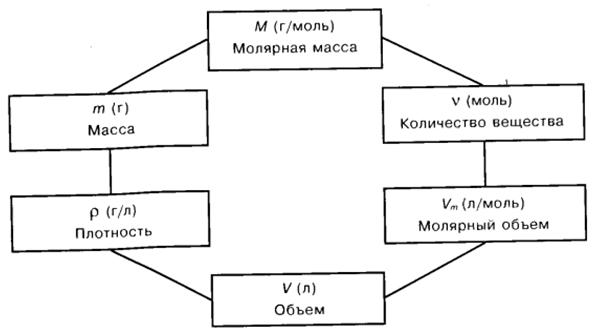
Очень важно правильно объяснить, что такое молярная масса М и что такое молярный объем Vm, показать их размерность и объяснить, как с их помощью осуществляется переход от массы и объема к количеству вещества и обратно. Нужно рассказать о постоянной Авогадро NА. Учащиеся должны всеми формулами пользоваться сознательно. Общие формулы всегда абстрактны, выражают обобщенные подходы к решению, а в каждой задаче они конкретизируются, Полезно довести до сведения учащихся схему, отражающую систему количественных понятий, связи между ними и переходные формулы, выражающие связи между этими понятиями.

Один из аспектов изучения химии – это формирование умения решать задачи. Решение задач необходимо не только в учебе, но и в научно-производственной деятельности.
Актуальность
Один из аспектов изучения химии – это умение решать задачи. Решение задач необходимо не только в учебе, но и в научно-производственной деятельности. Химические процессы являются основой многих производств,
где требуются детальные расчеты материального баланса: расход сырья и энергии, количество получаемой продукции, производственные потери и т.п. Знания взаимопревращений веществ и владение приемами расчета химических процессов очень важны для их реализации в лабораториях и на производстве. Поэтому при изучении химии большое внимание уделяется решению задач, они способствуют улучшению знаний и развитию логического мышления. Решение химических задач при помощи математических методов поможет ученикам лучше усвоить многие темы по таким предметам, как алгебра и химия.
Изучить какими математическими методами можно решать расчетные химические задачи.
Ознакомиться с литературой по решению химических задач
Найти наиболее рациональные математические методы решения химических задач
Решить наиболее распространённые расчетные задачи по химии с помощью найденных методов
Категории химических задач
Все химические задачи можно условно разделить на две категории: качественные и расчетные.
Качественные задачи направлены на обнаружение, идентификацию и определение составных частей (атомов, ионов, радикалов, молекул, функциональных групп) анализируемого объекта, определение последовательности соединения и взаимного расположения отдельных составных частей в веществе, определение изменения природы и концентрации составных частей объекта во времени. Обычно такие задачи не связаны с математическими расчетами.
Для решения же расчетных задач нужно знать основные химические свойства соединений и уметь применять основные понятия и законы химии, подобрать наиболее рациональные методы вычислений, используя математический аппарат (системы уравнений с несколькими неизвестными, неравенства, степенные и логарифмические функции).
Расчетные задачи в свою очередь делятся еще на две категории:
Задачи, связанные с использованием формул веществ;
Расчеты по уравнениям реакций.
Среди задач первой категории можно выделить несколько типов:
Вычисление массы вещества по его количеству и обратный расчет.
Определение массовой доли элемента в веществе по его молекулярной массе и наоборот.
Расчет объемов и объемных долей газов с использованием газовых законов (Авогадро, Бойля – Мариотта, Гей-Люссака, Менделеева – Клапейрона).
Вывод формул соединений по количественному составу.
Задачи второй категории, как правило, основаны на применении закона сохранения массы вещества. Эти задачи также подразделяются на несколько типов:
Задачи на вычисление количеств, масс и объемов исходных веществ по количеству, массе и объему продуктов реакции и обратные расчеты.
Расчет количеств, масс и объемов продуктов реакции, если один из реагентов взят в избытке.
Вычисления количеств, масс и объемов продуктов реакции, если один из реагентов содержит примеси.
Задачи на определение выхода продукта реакции от теоретически возможного.
Вычисления по уравнениям реакций, протекающих в растворах и требующих учета концентрации реагентов.

В пособии рассматривается методика обучения студентов педагогических институтов решению основных типов расчетных химических задач, содержание которых ориентировано на школьную программу по химии; даются рекомендации по решению задач повышенной сложности, что может быть использовано при подготовке студентов к ведению курсов углубленного изучения химии, факультативов, внеклассной работы.
Читайте также:

