Метод электронно ионного баланса кратко
Обновлено: 02.07.2024
Для составления уравнений окислительно-восстановительных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
Метод электронного баланса является более простым и учитывает изменение степени окисления элементов в реакциях. Ионно-электронный метод учитывает характер химической связи в молекуле и наличие тех ионов, которые в действительности существуют в растворе, например, MnO4 – , SO4 2- , Cr2O7 2- . При реакциях окисления-восстановления электроны не берутся откуда-то со стороны, а только переходят от одних атомов или ионов к другим, поэтому число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. При составлении уравнений окислительно-восстановительных реакций для того, чтобы правильно написать продукты реакции, необходимо знать свойства реагирующих веществ.
8.3.1.Метод электронного баланса.
Подбор коэффициентов в реакции методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель
Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5.
Следовательно, молекулярное уравнение реакции имеет следующий вид:
2) Определить величину и знак степени окисления элементов до реакции и после реакции.

3) Составить электронный баланс

4) Подставить найденные коэффициенты в уравнение реакции.
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
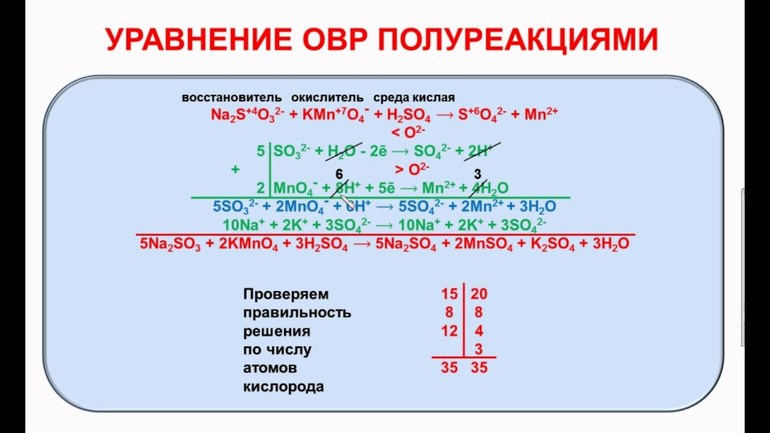
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции.
Составляем уравнения электронного баланса

Подставляем найденные коэффициенты в уравнение реакции. Подсчитываем количество групп в правой части уравнения (15+2+1=18), добавляем в левую часть равенства недостающие -группы в виде коэффициента при H2SO4. уравниваем число атомов водорода в правой и левой части равенства.
Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства.
8.3.2. Ионно-электронный метод.
При составлении электронно-ионных уравнений следует исходить не из изменения степени окисления элементов в реагирующих веществах, а нужно учитывать действительно существующие ионы в водном растворе с точки зрения теории электролитической диссоциации. Например, если реакция происходит с участием перманганата калия, то в реакции окислителем будут ионы MnO4 – , а не ионы Mn 7+ , так как перманганат калия в водном растворе диссоциирует KMnO4↔K + +MnO4 – . При этом вещества неионного характера и недиссоциирующие изображаются в электронных уравнениях в виде молекул: NH3, CO, NO2, SiO2, P.
В окислительно-восстановительных реакциях могут получаться различные продукты реакции в зависимости от характера среды – кислой, щелочной, нейтральной. Для таких реакций в молекулярной схеме необходимо указывать окислитель, восстановитель и вещество, характеризующее реакцию среды (кислоту, щелочь, воду). В этом случае в ионном уравнении необходимо руководствоваться правилами стяжения, указывать ионы, характеризующие реакцию среды: H + , OH – , H2O. Правила стяжения сводятся к следующему:
1. В кислой среде избыток ионов O +2 образует с ионами H + молекулы воды:
2. В нейтральной или щелочной среде избыток ионов O 2- образует с молекулами воды гидроксид – ионы:
3. В щелочной среде недостаток ионов O 2– компенсируется двумя ионами OH – , одновременно образуется одна молекула воды:
| Реакция среды | Избыток ионов О 2– | Недостаток ионов О 2– |
| окислитель | восстановитель | |
| Кислая | Н + Н2О | Н2O 2Н + |
| изб. O 2– + 2H + = Н2О | Н2О 2Н + + O 2– | |
| Нейтральная | H2O OH – | Н2O 2Н + |
| изб. О 2– + Н2О 2OН – | Н2О 2Н + + О 2– | |
| Щелочная | Н2O ОН – | 2OН – Н2О |
| изб. О 2– + Н2O 2OН – | 2OН – Н2О + О 2– |
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Эта первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnО – 4 (он имеет малиновую окраску) в ион Mn 2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой
Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO – 4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO – 4 + 8H + +5e – = Mn 2+ +4H2О
Это вторая полуреакция – процесс восстановления окислителя – иона MnO – 4.
Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так:

Сократив на 10 Н + , окончательно получим
Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы:
Пример 2. Реакция среды кислая

1. Составить схему реакции
Из опытных данных знаем, что окислителем является КМnO4. Ион MnO4 – восстанавливается в кислой среде до Мn 2+ (фиолетово-малиновая окраска иона MnO4 – становится бесцветной, переходя в Мn 2+ – ион), следовательно, ион SO3 2 – будет являться восстановителем, переходя в ион SO4 2- .
2. Составить электронно-ионные уравнения
а) для окислителя
Из ионной схемы видно, что, ион MnO4 – – превращается в ион Мn 2+ , при этом освобождаются ионы О 2- , которые по правилу стяжения в кислой среде связываются ионами Н + , образуя молекулы Н2O.
б) для восстановителя
Из ионной схемы видно, что ион SO3 2- превращается в ион SO4 2- . Для этого превращения необходимо добавить ион О 2- , который берется из молекулы H2O (реакция протекает в водной среде), при этом освобождаются два иона Н+.
3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова.
MnO4 – + 8H + + 5ē = Mn 2+ + 4H2O
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:

5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты:
6. Сократить в левой и правой части уравнения 10 Н + и 5Н2O. Получается ионное уравнение:
7. По ионному уравнению составить молекулярное уравнение реакции:
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
Окислителем в данной реакции является молекула брома, следовательно, восстановителем будет являться метахромит калия, а именно ион СrO2 – .
2. Составить электронно-ионное уравнение
а) для окислителя
б) для восстановителя
Из ионной схемы видно, что ион CrO2 – превращается в ион СгО4 2– . Каждый недостающий ион О 2– берется по правилу стяжения из двух гидроксильных ионов (среда щелочная ОН – ), при этом одновременно образуется одна молекула воды.
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.

4. Написать суммарное уравнение, учитывая найденные коэффициенты:
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левой части уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
2. Составить электронно-ионное уравнение
а) для окислителя
В нейтральной среде избыток ионов кислорода стягивается с молекулами воды, образуя гидроксид-ионы.
б) для восстановителя
Из ионной схемы видно, что ион SО3 2- превращается в ион SO4 2- , для этого необходимо добавить один ион О 2- , который берется из молекулы Н2O (реакция протекает в водной среде). При этом освобождаются два иона Н + .
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.

4.Написать электронно-ионное уравнение, учитывая найденные коэффициенты:
Сокращаем левую и правую часть равенства на 6Н20. Получаем окончательное ионное уравнение.
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левей части уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в соединениях NН3, HNO2, HNO3, H2S, Н2SO3, Н2SО4, MnO2 и КМnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Пример 6. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и Н2SО3; в) Н2SО3 и НС1O4?
а) Степень окисления в Н2S n(S) = -2; в HI n(I) = -1. Так как и сера и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в H2S n(S) = -2 (низшая), в H2SO3 n(S) = +4 (промежуточная).
Следовательно, взаимодействие этих веществ возможно, причем, Н2SО3 является окислителем;
Пример 7. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:


Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
Пример 8. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительная функция принадлежит сере (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p-элемента VIA-группы равна -2. Цинк как металл IIВ-группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
Составляем уравнение реакции:

Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы H2SO4 идут на связывание четырех ионов Zn 2+ .
Одним из способов решения химических уравнений является метод полуреакций. Ведь большинство процессов идут со сменой степеней окисления, что вызывает затруднения при расстановке коэффициентов перед любой новой формулой. Потому и был расписан рассматриваемый метод, который связывают с электронно-ионным и электронным балансом при перераспределении зарядов.

Сущность методики
Ее описывают как электронно-ионный баланс, заключающийся в распределении множителей коэффициентного типа. Основой метода полуреакций в нейтральной или щелочной среде является обмен отрицательно заряженных частиц, происходящий между анионами и катионами с различными значениями водородного показателя.

В реакциях, которые происходят с участием окислительных и восстановительных электролитов, имеются ионы с минусовым или положительным зарядом. Уравнения молекулярно-ионного типа, основой которых является метод полуреакций, наглядным образом покажет суть каждого процесса при помощи уравнивания и подбора необходимых коэффициентов.
Формирование баланса по определенному алгоритму происходит с применением электролитов сильного звена в виде ионных частиц и недиссоциированных молекул в виде слабых соединений. В уравнениях нужно указать частицы, в которых меняются степени окисления. Чтобы определить растворяющую среду, необходимо определить щелочные, кислые и нейтральные условия.
В ОВР метод полуреакций используется с той целью, чтобы расписать по отдельности выражения для восстановительных и окислительных процессов. Итоговым результатом химического разложения станет их суммирование калькулятором или обычным методом.
Исполнение алгоритма
В методе полуреакций примеры с решением имеют свои особенности решения. Основным способом является следование стандартному алгоритму. Сюда включают такие стадии:

Таким образом, метод полуреакций фактически сводится к написанию молекулярного уравнения путем следования заданному алгоритму. Он используется наравне с составлением баланса электронного вида, но может использоваться чаще за счет простоты.
Окислители и восстановители
Не менее важно для правильной записи уравнений как в традиционной, так и онлайн-форме, подобрать окислители и восстановители. От этого зависит, сколько нужно добавлять или вычитать электронов и ионов, а также сложность итоговых выражений.
К окислителям относят такие частицы, которые несут в себе отрицательно заряженные электроны. Они могут восстанавливаться и легко восполняют электронный недостаток. Сильными окисляющими реагентами считаются:
- Группы галогенов.
- Различные кислоты и калии.
- Золото и серебро с содержанием ионов.
- Оксиды марганца и свинца с валентностью 4.
- Соединения кислорода с содержанием газа.
Восстановители при участии в химических процессах передают отрицательный заряд. Окислительное действие претерпевают при расщеплении электронов. Подобными свойствами обладают различные органические и неорганические вещества:
- Ряд металлов и соединения серы, включая сероводород.
- Сульфаты железа, а также хрома и марганца.
- Азотсодержащие реагенты.
- Углерод природный плюс его оксид с валентностью 2.
- Молекулы водорода.
Также к указанной группе можно отнести кислоты с содержанием галогена и фосфористую кислоту. Роль восстановителей обычно играют ионные, атомарные частицы, а также молекулы.
Достоинства полуреакций
Для написания схемы окислительно-восстановительных реакций с учетом разных потенциалов полуреакции используют чаще по сравнению со способом электродного баланса. Преимущества такого метода состоят в следующем:

- Решать написанные уравнения, будь то обычные химические или гидролиз, легче за счет рассмотрения реальных ионов и соединений внутри раствора.
- Несмотря на отсутствие информации о получающихся веществах, их можно определить на последних стадиях.
- За счет такого метода можно узнать количество участвующих в полуреакциях электронов, а также изменения в коэффициентах водородного показателя раствора.
Кроме того, с помощью упрощенных ионных уравнений можно изучить особенности прохождения процессов и структуру созданных веществ. Также не всегда бывает необходима информация о степени окисления, поскольку ее можно установить в ходе работы с уравнениями и при необходимости уравнивать.
Нейтральная среда

Применяется метод полуреакций в нейтральной среде в тех случаях, когда происходит гидролиз солей при образовании слабокислого или слабощелочного раствора. Запись осуществляется в двух вариантах в соответствии с установленными таблицами веществ.
Первый метод позволяет не учитывать гидролиз солей. Среда считается нейтральной, слева приписывается молекулярная вода. Тогда одну полуреакцию нужно подбирать до установления щелочного состояния, а вторую до кислотного варианта.
А вот следующий способ является оптимальным для тех процессов, где можно примерно устанавливать значение водородного показателя. В этом случае реакции для электронно-ионного метода стоит рассматривать либо щелочи, либо в кислоте.
Примером нейтрального раствора может служить воссоединение сероводорода с дихроматом натрия в воде. Получается осадок серы, натрия и трехвалентного гидроксида хрома. Это считается типичной реакцией нейтрального раствора.
В конце реакции происходит образование голубого осадка из гидроксида хрома и желтой серы. Процесс идет в растворе щелочи с натриевым гидроксидом. При этом степень окисления серы изменяется на 0, заряд хрома уменьшается с 6 до 3.
Вышеописанная методика может включать в себя семь или более этапов в зависимости от сложности уравнений и требуемого результата. Его преимуществами считаются относительная простота и отсутствие необходимости в дополнительной информации по имеющимся элементам в уравнении. Правильное следование алгоритму и учет всех имеющихся факторов, включая валентность и степень заряда каждого химического элемента из таблицы Менделеева, позволит грамотно составить молекулярное выражение и отыскать все необходимые данные для созданных новых веществ.
Сегодня мы научимся расставлять коэффициенты в окислительно-восстановительных реакциях (сокращенно ОВР) методом электронно-ионного баланса.
Задание обычно звучит так:
Подберите коэффициенты к уравнениям окислительно-восстановительной реакции, используя метод электронно-ионного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления.
Для примера разберем следующую ОВР:
Для нашей реакции:
Сl2 0 + K2 1+ + S 2- + K 1+ + OH 1- → K 1+ + Cl 1- + K2 1+ + SO4 2- + H2O
Сокращаем те ионы, которые повторяются и слева, и справа и получаем уравнение реакции в ионно-молекулярном виде:
Сl2 0 + S 2- + OH 1- → Cl 1- + SO4 2- + H2O
Определим среду нашей ОВР. Ионы OH- в левой части реакции говорят нам, что среда щелочная. Это хуже, чем кислотная, но мы справимся ☺
Расставим степени окисления над каждым атомом. Принцип очень простой: степень окисления кислорода (почти) всегда 2-; водорода – 1+; степень окисления металлов равна порядковому номеру группы в таблице Менделеева, где живет этот металл. Степени окисления оставшихся атомов вычисляем, вычитая из степени окисления всего иона степени окисления известных атомов.
Сl2 0 + S 2- + O 2- H 1+ → Cl 1- + S 6+ O4 2- + H2O 2-
Видно, что в ОВР изменяются степени окисления хлора (было 0, стало 1-) и серы (было 2-, стало 6+).
Степень окисления хлора уменьшилась, т.е. он забрал себе лишние электроны. Степень окисления серы увеличилась, т.е. она электроны отдала. Ион, отдавший ионы, называется восстановителем; получивший электроны – окислителем.
Теперь записываем две полуреакции для серы и для хлора:
Cl2 0 → Cl 1- - окислитель, полуреакция восстановления
S 2- → SO4 2- - восстановитель, полуреакция окисления
После десятка-другого ОВР все описанное выше делается в уме за несколько секунд.
Теперь начинаем работать с выделенными полуреакциями.
Шаг первый: уравниваем количество атомов главного элемента (хлора).
Шаг второй: уравниваем количество атомов кислорода. У нас кислорода нет, едем дальше.
Шаг третий: уравниваем количество атомов водорода. Водорода тоже нет, едем дальше.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд 0, справа 2 заряда по -1, достаточно очевидно, что нужно добавить 2 электрона слева. Что мы и делаем:
Cl2 0 + 2е → 2Cl 1-
Одна полуреакция готова. Принимаемся за вторую.
Шаг первый: уравниваем количество атомов главного элемента (серы). У нас они уже равны, едем дальше.
Поскольку среда щелочная, шаг второй и шаг третий объединяем: нужно уравнять количества атомов кислорода и водорода, причем делать это нужно, добавляя слева ионы OH-, а справа молекулы воды. Я это делаю обычно перебором. В нашем случае справа нужно добавить 8 ионов OH - , а слева – 4 молекулы воды.
Все атомы уравнялись.
Шаг четвертый: уравниваем заряды с помощью электронов. В нашем случае слева заряд -10, справа -2, вычитаем слева 8 электронов:
S 2- + 8OH - - 8e → SO4 2- + 4H2O
Теперь выписываем наши уравненные полуреакции рядом. Хлор забирает 2 электрона, сера отдает 8 электронов, значит, чтобы все сошлось, необходимо умножить полуреакцию хлора на 4.
А если делать на автомате, то записываем количество электронов, сокращаем (если сокращается) и меняем местами. На получившееся число умножаем полуреакцию и собираем обратно в молекулярно-ионную запись.
Cl2 0 + 2е → 2Cl - 2→1→4
S 2- + 8OH - - 8e → SO4 2- + 4H2O 8→4→1
4Сl2 0 + S 2- + 8OH - → 8Cl - + SO4 2- + 4H2O
Проверяем, все ли сходится: хлора – по 8 атомов с каждой стороны, серы – по 1, водорода – по 8, кислорода – по 8.
С теми же коэффициентами переписываем полную ОВР.
Для закрепления рассмотрим еще одну реакцию, на этот раз с кислой средой. Не буду расписывать так же подробно, только ключевые моменты.
Наметанным глазом сразу видно: степени окисления меняются у алюминия и у хрома. Выписываем полуреакции и уравниваем их.
Шаг первый: уравниваем количество атомов главного элемента – выполнено.
Шаг второй: уравниваем количество атомов кислорода – выполнено.
Шаг третий: уравниваем количество атомов водорода – выполнено.
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд 0, справа +3, нужно вычесть слева 3 электрона. Алюминий электроны отдает, значит, он в реакции восстановитель, а его полуреакция является полуреакцией окисления.
Шаг первый: уравниваем количество атомов главного элемента.
Шаг второй: уравниваем количество атомов кислорода с помощью воды.
Шаг третий: уравниваем количество атомов водорода c помощью ионов H + , потому что среда кислая. О том, что она кислая, нам говорит наличие кислоты в левой части реакции (если бы мы записали ионно-молекулярную форму реакции, слева остались бы ионы H + )
Шаг четвертый: уравниваем заряды с помощью электронов. Слева заряд +12, справа 2 раза по +3, нужно добавить слева 6 электрона. Хром электроны забирает, значит, он в реакции окислитель, а его полуреакция является полуреакцией восстановления.
Выписываем полуреакции рядом и производим манипуляции с электронами:
Al 0 – 3e → Al 3+ 3→1→2
Собираем две полуреакции в ионно-молекулярную реакцию, домножив, соответственно, на полученные числа.
Cr2O7 2- + 2Al 0 + 14H + → 2Cr 3+ + 2Al 3+ + 7H2O
Восстанавливаем полную реакцию, расставляя найденные коэффициенты:
Кислород сошелся, значит, все верно.
Любую ОВР можно уравнять описанным методом. Бывают, конечно, более сложные варианты, но смысл всегда один и тот же.
На уроках химии в школе мы вводим основные понятия теории ОВР (степень окисления, окислитель, восстановитель, процессы окисления и восстановления) и учим школьников уравнивать окислительно-восстановительные реакции методом электронного баланса. Этот метод позволяет расставить коэффициенты в реакции, реагенты и продукты которой известны.

Методом электронно-ионного баланса
можно составить уравнение ОВР, а не только
расставить коэффициенты
Сдавая вступительный экзамен по химии в институт, абитуриент сталкивается с заданиями, в которых нужно не только уравнять, но и составить уравнение окислительно-восстановительной реакции, а это, не владея методом электронно-ионного баланса, сделать очень трудно. В качестве примера приведем одно из заданий части С ЕГЭ по химии 2007 года.
Ученику дается право выбора, и это задание действительно можно выполнить, владея только электронным балансом и хорошо понимая основные положения теории ОВР. Но с помощью электронно-ионного баланса данное задание выполняется гораздо проще и, что немаловажно, быстрее.
Таким образом, становится совершенно очевидным, что для обеспечения своим ученикам непрерывного образования мы должны познакомить их (на занятиях элективных курсов, в рамках факультатива или предметного кружка) с методом электронно-ионного баланса.
При использовании метода электронно-ионного баланса следует иметь в виду, что в водных растворах связывание избыточного кислорода у окислителя и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается протонами с образованием молекул воды, а в нейтральных и щелочных – молекулами воды с образованием гидроксид-ионов. Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде – за счет гидроксид-ионов с образованием молекул воды.
Кроме того, при записи полуреакций, в отличие от метода электронного баланса, записывают только те частицы, которые существуют в растворах на самом деле, – для сильных электролитов учитывают диссоциацию и записывают реально существующий ион, а слабые электролиты записывают в полуреакциях в виде молекул. Например, используя метод электронного баланса, мы в случае восстановления перманганата калия в кислой среде запишем:
При использовании метода электронно-ионного баланса данная полуреакция будет иметь вид:
Рассмотрим алгоритм составления ОВР с использованием метода электронно-ионного баланса на примере вышеупомянутой реакции из заданий ЕГЭ.
1. Записываем реагенты ОВР, определяем окислитель, восстановитель и среду раствора:

2. Записываем полуреакцию с участием окислителя, рассуждая следующим образом: перманганат калия является сильным электролитом (растворимая соль), поэтому в растворе восстановлению будет подвергаться перманганат-ион. В кислой среде перманганат-ион восстанавливается до катиона Mn 2+ . Уравниваем полуреакцию с помощью протонов и молекул воды (см. схемы полуреакций в кислой среде). Суммируем заряды ионов в полуреакции (до и после) и по разнице сумм находим число принятых или отданных в полуреакции электронов:

(процесс восстановления, участвует окислитель)

(процесс окисления, участвует восстановитель)
4. Составляем электронно-ионный баланс: находим наименьшее общее кратное между числом принятых и отданных в полуреакциях электронов (10); разделив наименьшее общее кратное на число электронов в каждой полуреакции, получаем коэффициенты к полуреакциям:

5. Суммируем полуреакции с учетом коэффициентов, при этом получаем ионное уравнение окислительно-восстановительной реакции:

6. Если есть необходимость, взаимно уничтожаем одинаковые частицы в левой и в правой части ионного уравнения (в данном случае такой необходимости нет).
Таким образом, метод электронно-ионного баланса позволяет не только уравнивать, но и одновременно составлять окислительно-восстановительную реакцию. Надо отметить, что в курсе органической химии метод электронно-ионного баланса находит столь же широкое применение.
Читайте также:

