Классы неорганических соединений кратко и понятно презентация
Обновлено: 30.06.2024
Презентация на тему: " Основные классы неорганических веществ Обобщающий урок." — Транскрипт:
1 Основные классы неорганических веществ Обобщающий урок
2 Цель урока: Обобщить знания об основных классах неорганических соединений; Обобщить знания об основных классах неорганических соединений; Повторить классификацию, строение, физические и химические свойства кислот, оксидов, оснований и солей; Повторить классификацию, строение, физические и химические свойства кислот, оксидов, оснований и солей; Подготовиться к контрольной работе. Подготовиться к контрольной работе.
3 сложные вещества оксиды основания кислоты соли
4 Оксиды – сложные вещества, состоящие их двух химических элементов, один из которых кислород со степенью окисления - 2. Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HCl = H + + Cl - Основаниями называются электролиты, которые при диссоциации образуют катионы металла и анионы гидроксогрупп ОН -. NaOH = Na + + OH - Средними солями называются электролиты, которые при диссоциации образуют катионы металла и анионы кислотных остатков. K 3 PO 4 = 3K + + PO 4 3-
5 оксиды несолеобразующие солеобразующие основные амфотерные кислотные
6 Химические свойства оксидов 1. Основные Оксиды, которым соответствуют основания 2. Кислотные Оксиды, которым соответствуют кислоты 3. Амфотерные В зависимости от условий проявляют кислотные или основные свойства Химические свойства 1. Взаимодействие с водой Образуют основания Na 2 O + H 2 O = 2 NaOH Образуют кислоты CO 2 + H 2 O = H 2 CO 3 Не взаимодействуют 2. Взаимодействие с кислотами Образуется соль и вода FeO + H 2 SO 4 = FeSO 4 + H 2 O Не взаимодействуют Образуется соль и вода ZnO + 2HCl = ZnCl 2 + H 2 O 3. Взаимодействие с основаниями Не взаимодействуют Образуется соль и вода SO NaOH = Na 2 SO 4 + H 2 O Образуется соль и вода Al 2 O NaOH=2NaAlO+H 2 O 4. Взаимодействие основных и кислотных оксидов образуется соль CaO + CO 2 = CaCO 3
7 Получение оксидов Соединение простого вещества с кислородом (горение) Соединение простого вещества с кислородом (горение) C + O 2 = CO 2 ; 4 Li + O 2 = 2 Li 2 O Горение сложных веществ Горение сложных веществ 2H 2 S + 3O 2 = 2H 2 O + 2SO 2 Разложение при нагревании кислородных соединений: карбонатов, нитратов, гидроксидов Разложение при нагревании кислородных соединений: карбонатов, нитратов, гидроксидов CaCO 3 = CaO + CO 2 ; 2Cu(NO 3 ) 2 = CuO + 4NO 2 +O 2 2 Fe(OH) 3 = Fe 2 O H 2 O
8 Кислоты Одноосновные HCl; HNO 3 Двухосновные H 2 SO 4 ; H 2 CO 3 ; H 2 S Tрехосновные H 3 PO 4 Кислородсодержащие HNO 3 ; H 2 SO 3 ; H 3 PO 4 Бескислородные HCl ; H 2 S
9 Физические свойства кислот Агрегатное состояние – жидкие, твердые; Агрегатное состояние – жидкие, твердые; Многие хорошо растворимы в воде; Многие хорошо растворимы в воде; Растворы кислот имеют кислый вкус; Растворы кислот имеют кислый вкус; Разъедают растительные и животные ткани; Разъедают растительные и животные ткани; Окрашивают синий лакмус в красный цвет. Окрашивают синий лакмус в красный цвет. Основные кислоты H 2 SO 4 _ серная H 3 PO 4 фосфорная HCl соляная H 2 CO 3 угольная HNO 3 азотная H 2 SO 3 сернистая
10 Химические свойства кислот 1. Кислота + металл = соль + водород ( металл расположен до водорода в ряду напряжений металлов ) 2HCl + Zn = ZnCl 2 + H 2 2H + + Zn = Zn 2+ + H 2 2. Кислота + оксид металла = соль + вода CuO + H 2 SO 4 = CuSO 4 + H 2 O CuO + 2H + = Cu 2+ + H 2 O 3. Кислота + основание = соль + вода 2HNO 3 + Fe(OH) 2 = Fe(NO 3 ) 2 + 2H 2 O 2H + + Fe(OH) 2 = Fe 2+ +2H 2 O 4. Кислота + соль = новая кислота + новая соль 2HNO 3 + CaCO 3 = Ca(NO 3 ) 2 + H 2 O+CO 2 2H + + CaCO 3 = Ca 2+ + H 2 O+CO 2
11 Получение кислот Взаимодействие оксида неметалла с водой Взаимодействие оксида неметалла с водой CO 2 + H 2 O = H 2 CO 3 Взаимодействие соли с кислотой Na 2 SiO 4 + H 2 SO 4 = Na 2 SO 4 + H 2 SiO 4 Соединение водорода с неметаллом с последующим растворением в воде H 2 + Br 2 = 2 HBr
12 Химические свойства оснований Растворимые (щелочи) Нерастворимые Амфотерные 1. Взаимодействие с кислотами KOH + HCl = KCl + H 2 O OH - + H + = H 2 O Al(OH) 3 + 3HCl= AlCl 3 +3 H 2 O Al(OH) H + = Al H 2 O 2. Взаимодействие с кислотными оксидами 2NaOH + SiO 2 = Na 2 SiO 4 +H 2 O 2. Взаимодействие с основаниями (в водных растворах) Al(OH) 3 + NaOH = Na[Al(OH) 4 ] 3. Взаимодействие с растворами солей 2KOH + CuSO 4 = Cu(OH) 2 + K 2 SO 4
13 Соли Средние Na 2 SO 4 Кислые NaHSO 4 Двойные KAl(SO 4 ) 2 Смешанные CaCl(OCl) Комплексные K 4 [F(CN) 6 ] Основные Mg(OH)Cl
14 Химические свойства средних солей С металлами С металлами CuSO 4 + Fe = Cu + FeSO 4 Cu 2+ + Fe 0 = Fe 2+ + Cu 0 Cu 2+ + Fe 0 = Fe 2+ + Cu 0 Со щелочами Со щелочами 2KOH + CuSO 4 = Cu(OH) + K 2 SO 4 2OH - + Cu 2+ = Cu(OH) 2 С кислотами С кислотами 2HNO 3 + Fe(OH) 2 = Fe(NO 3 ) 2 + 2H 2 O 2H + + Fe(OH) 2 = Fe 2+ +2H 2 O С солями С солями Ca(NO 3 ) 2 + Na 2 CO 3 = CaCO NaNO 3 Ca 2+ +CO 3 2+ = CaCO 3
15 Генетическая связь между классами неорганических соединений МЕТАЛЛ ОСНОВНЫЙ ОКСИД ОСНОВАНИЕ СОЛЬ НЕМЕТАЛЛ КИСЛОТНЫЙ ОКСИД КИСЛОТА
Даны вещества: Na 2 O, H 3 PO 4 , KNO3, Ca(OH) 2 , AlCl 3 , MgO, Fe(OH) 3 , HF, H 2 O, Ba(OH) 2 , Ag 2 O, H 2 SO 4 , NaOH, H 2 SiO 3 , CaCO 3 , Fe(NO 3 ) 3 ,Mg 3 (PO 4 ) 2 .Распределите их по классам Оксиды Кислоты Основания Соли
Проверь себя! Оксиды Кислоты Основания Соли Na 2 O MgO H 2 O Ag 2 O H 3 PO 4 HF H 2 SO 4 H 2 SiO 3 Ca(OH) 2 Fe(OH) 3 Ba(OH) 2 NaOH KNO 3 AlCl 3 CaCO 3 Fe(NO 3 ) 3 Mg 3 (PO 4 ) 2
Химические свойства неорганических веществ
Закончите уравнения реакции: Са O + H 2 O SO 3 + H 2 O CaO + SO 3 MgO +HCl CO 2 + NaOH
Правильные ответы Са O + H 2 O Ca(OH) 2 SO 3 + H 2 O H 2 SO 4 CaO + SO 3 CaSO 4 MgO +2HCl MgCl 2 + H 2 O CO 2 +2 NaOH Na 2 CO 3 + H 2 O
Закончите уравнения осуществимых реакций: H 2 SO 4 + Ba(OH) 2 HNO 3 + Fe 2 O 3 HCl + AgNO 3 H 3 PO 4 +Ca HCL + Cu H 2 CO 3
Проверьте себя H 2 SO 4 + Ba(OH) 2 BaSO 4 + 2H 2 O 6 HNO 3 + Fe 2 O 3 2 Fe(NO 3 ) 3 + H 2 O HCl + AgNO 3 AgCl + HNO 3 2H 3 PO 4 +3Ca Ca 3 (PO 4 ) 2 +3H 2 HCl + Cu H 2 CO 3 H 2 O + CO 2
Допишите уравнения химических реакций Ba(OH) 2 + HNO 3 KOH + P 2 O 5 NaOH + FeCl 2 Cu(OH) 2 +2HCl Fe(OH) 3
Химические свойства оснований Ba(OH) 2 + 2HNO 3 Ba(NO) 2 + 2H 2 O 6KOH + P 2 O 5 2 K 3 PO 4 + 3H 2 O 2NaOH + FeCl 2 Fe(OH) 2 + 2NaCl Cu(OH) 2 +2HCL CuCl 2 +2H 2 O 2Fe(OH) 3 Fe 2 O 3 + 3H 2 O
Химические свойства солей CuSO 4 + KOH H 2 SO 4 + BaCl 2 CaCl 2 + Na 2 CO 3 CaCO 3 CuSO 4 + Fe
Проверь себя CuSO 4 + 2KOH Cu(OH) 2 + K 2 SO 4 H 2 SO 4 + BaCl 2 BaSO 4 + 2HCl CaCl 2 + Na 2 CO 3 CaCO 3 + 2NaCL CaCO 3 CaO + CO 2 CuSO 4 + Fe FeSO 4 + Cu
ТЕСТ 1 ) Из предложенного перечня выберите основной оксид а) K 2 O б) SO 3 в) CO 2 2) В результате взаимодействия с водой Na 2 O образуется а) основание б) кислота в) соль 3) Какая из веществ в быту называется поваренной солью а) Na 2 CO 3 б) NaNO 3 в) NaCl г) Na 3 PO 4 4) Какой металл не реагирует с соляной кислотой а) Mg б) Ag в) Fe 5) Что из перечисленного подходит гидроксиду натрия а) щелочь б) двухосновная в) нерастворима в воде 6) Вещества какой пары могут реагировать между собой а) С O 2 + HCl б) CaO + HCl в) CaO + NaOH
Спасибо за работу!
По теме: методические разработки, презентации и конспекты
Конспект урока на тему " Классы неорганических соединений . Кислоты " 8 класс
" Генетическая связь между классами неорганических соединений " 8 класс.
Урок изучения нового материала. Цель урока:сформировать знания о генетической связи и генетическом ряде, научиться составлять генетические ряды металлов и неметаллов.

Контрольная работа "Основные классы неорганических соединений" (8 класс)
Данная контрольная работа содержит 30 вариантов. В каждом варианте 4 задания. Задания разных вариантов имеют одинаковые формулировки, но различные выходные данные.

Важнейшие классы неорганических соединений. Генетическая связь между классами неорганических соединений.
Цели:1)Обобщить и систематизировать знания учащихся о составе, номенклатуре важнейших классов неорганических соединений, химических свойствах, генетической связи ; совершенствовать навыки состав.

"Основные классы неорганических соединений. генетическая связь неорганических соединений"
Заключительный урок обобщения по химии в 8 классе.

План-конспект урока химии в 11 классе "Обобщение по теме "Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений."
Цель урока: обобщение, систематизация и углубление знаний по основным классам неорганических соединений, генетической связи между ними; подготовка учащихся к контрольной работе. Нетрадиционная форма у.

Презентация к лекции по химии по теме: "Основные классы неорганических соединений"предназначена для студентов 1 курса, обучающихся по техническим специальностям.

Обучающая: Повторить, обобщить и углубить знания и умения студентов о классификации неорганических веществ, о химических свойствах, получении, номенклатуре оксидов, кислот, оснований и солей.
•развивать умения анализировать и делать выводы;
•способствовать пробуждению интереса к изучаемой дисциплине;
•находить главную мысль в тексте;
•аргументировать свои ответы .
•формирование научно-материалистического мировоззрения;
• воспитание трудолюбия, усидчивости, умения вести диалог.

Основные классы неорганических соединений.
Преподаватель ГБПОУ ВО ВАТ имени В.П.Чкалова

ЦЕЛИ И ЗАДАЧИ ЗАНЯТИЯ:
Обучающая: Повторить, обобщить и углубить знания и умения студентов о классификации неорганических веществ, о химических свойствах, получении, номенклатуре оксидов, кислот, оснований и солей.
Развивающая:
- развивать умения анализировать и делать выводы;
- способствовать пробуждению интереса к изучаемой дисциплине;
- находить главную мысль в тексте;
- аргументировать свои ответы .
Воспитывающая :
- формирование научно-материалистического мировоззрения;
- воспитание трудолюбия, усидчивости, умения вести диалог.
Кузнецова Екатерина Владимировна

- Классификация сложных неорганических веществ.
- Оксиды: состав, названия, классификация, свойства.
- Кислоты: состав, названия, классификация, свойства.
- Основания: состав, названия, классификация, свойства.
- Соли: состав, названия, классификация, свойства.
- Генетическая связь между классами неорганических веществ.
Кузнецова Екатерина Владимировна
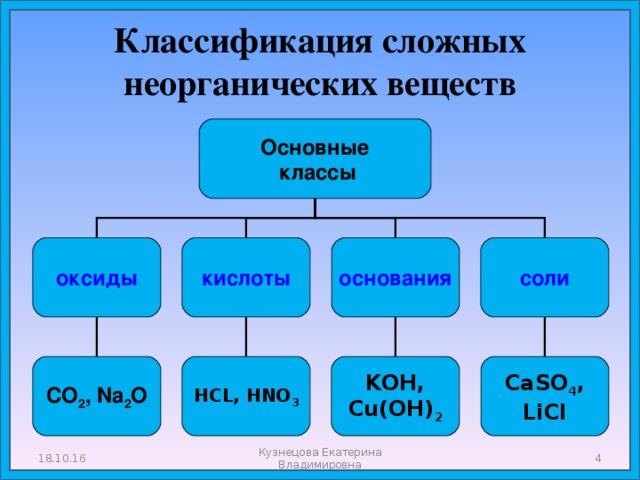
Классификация сложных неорганических веществ
HCL, HNO 3
СО 2 , Na 2 O
Cu(OH) 2
CaSO 4 ,
Кузнецова Екатерина Владимировна

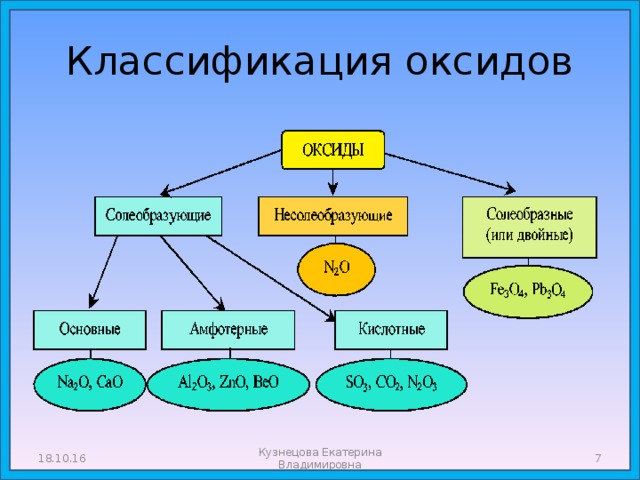
Оксиды: состав, названия, классификация, свойства.
- Оксиды - сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2 .
Кузнецова Екатерина Владимировна

оксид углерода ( II )
оксид азота ( II )
оксид железа (III )
оксид марганца (VII )
Кузнецова Екатерина Владимировна
Кузнецова Екатерина Владимировна
![Химические свойства оксидов О сновные - реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1 .Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H 2 O=Ca(OH) 2 2 .Все - с кислотами МgO+2HCl=MgCl 2 +H 2 O 3.С кислотными оксидами CaO+CO 2 =CaCO 3 4.С амфотерными оксидами Li 2 O+Al 2 O 3 =2LiAlO 2 Амфотерные (ZnO, Al 2 O 3 ,Cr 2 O 3 , MnO 2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl 2 +H 2 O ZnO+2NaOH+H 2 O=Na 2 [Zn(OH) 4 ] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO 2 ZnO+SiO 2 =ZnSiO 3 Кислотные -реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO 3 +H 2 O=H 2 SO 4 2.Со щелочами NaOH+SiO 2 =Na 2 SiO 3 +H 2 O 3.С основными оксидами SiO 2 +CaO=CaSiO 3 4.С амфотерными оксидами Al 2 O 3 +3SO3=Al 2 (SO 4 ) 3 18.10.16 Кузнецова Екатерина Владимировна](https://fhd.multiurok.ru/4/e/3/4e3a64e84a66e14dfba0eec46a127212d3880e30/img7.jpg)
Химические свойства оксидов
О сновные - реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1 .Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H 2 O=Ca(OH) 2 2 .Все - с кислотами МgO+2HCl=MgCl 2 +H 2 O 3.С кислотными оксидами CaO+CO 2 =CaCO 3 4.С амфотерными оксидами Li 2 O+Al 2 O 3 =2LiAlO 2
Амфотерные (ZnO, Al 2 O 3 ,Cr 2 O 3 , MnO 2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl 2 +H 2 O
ZnO+2NaOH+H 2 O=Na 2 [Zn(OH) 4 ] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO 2 ZnO+SiO 2 =ZnSiO 3
Кислотные -реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO 3 +H 2 O=H 2 SO 4 2.Со щелочами NaOH+SiO 2 =Na 2 SiO 3 +H 2 O 3.С основными оксидами SiO 2 +CaO=CaSiO 3 4.С амфотерными оксидами Al 2 O 3 +3SO3=Al 2 (SO 4 ) 3
Кузнецова Екатерина Владимировна

ПОЛУЧЕНИЕ ОКСИДОВ.
2H 2 S+3O 2 =2H 2 O+2SO 2
Cu (OH) 2 =CuO+H 2 0
нагреванием кислородсодержащих кислот
нагреванием высших оксидов
Окисление низших оксидов
H 2 SO 3 =H 2 O+SO 2
4CrO 3 =Cr 2 O 3 +3O 2
4FeO+O 2 =2Fe 2 O 3
Вытеснение летучего оксида менее летучим
Na 2 CO 3 +SiO 2 =Na 2 SiO 3 +CO 2
Кузнецова Екатерина Владимировна

- Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных заместиться на атом металла, и кислотного остатка.
- Число атомов водорода определяет основность кислот.
- Общая формула: Нх(Ас)
Кузнецова Екатерина Владимировна
Классификация по наличию кислорода в кислотном остатке
HCl, HBr, HI, H 2 S
Cl - - хлорид H 2 S-сероводородная,
H 2 SO 4 , HNO 3 , H 2 CO 3 , H 3 PO 4 и другие .
Кузнецова Екатерина Владимировна

КЛАССИФИКАЦИЯ КИСЛОТ ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДА В МОЛЕКУЛЕ
ОДНООСНОВНЫЕ ТРЕХОСНОВНЫЕ
ДВУХОСНОВНЫЕ H 3 PO 4
H 2 SO 4 , H 2 CO 3
Кузнецова Екатерина Владимировна

Кузнецова Екатерина Владимировна

SO 3 +H 2 O=H 2 SO 4 P 2 O 5 +3H 2 O=2H 3 PO 4
3.Cоль+менее летучая кислота
P+5HNO 3 +2H 2 O=3H 3 PO 4 +5NO
NaNO 3 +H 2 SO 4 =HNO 3 +NaHSO 4
2.Cоль+менее летучая кислота
NaCl+H 2 SO 4 =2HCl +NaHSO 4
Кузнецова Екатерина Владимировна

Физические свойства кислот
Жидкости H 2 SO 4 HClO 4 и др.
Твердые H 3 PO 4 H 2 SiO 3 и др.
Газообразные HCl H 2 S и др.
Кузнецова Екатерина Владимировна

1.Изменяют окраску индикаторов
2.Взаимодействие с металлами, стоящими до водорода
H 2 SO 4 +Ca=CaSO 4 +H 2
2HCl+Ca=CaCl 2 +H 2
3.Взаимодействие с основными оксидами
H 2 SO 4 +CaO=CaSO 4 +H 2 O
2HCl+CaO=CaCl 2 +H 2 O
4.Взаимодействие с основаниями
H 2 SO 4 +Ca(OH) 2 =CaSO 4 +2H 2 O
2HCl+Ca(OH) 2 =CaCl 2 +2H 2 O
Кузнецова Екатерина Владимировна

5.Взаимодействие с амфотерными оксидами
H 2 SO 4 +ZnO=ZnSO 4 +H 2 O
2HCl+ZnO=ZnCl 2 +H 2 O
6.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество
H 2 SO 4 +BaCl 2 =BaSO 4 +2HCl
2HCl+Na 2 CO 3 =2NaCl+H 2 O+CO 2
Слабые кислоты легко разлагаются H 2 SiO 3 =H 2 O+SiO 2
Кузнецова Екатерина Владимировна

- Основания - сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами - ОН.
- Общая формула: Ме(ОН) х
Кузнецова Екатерина Владимировна

- Физические свойства: твердые кристаллические вещества.
- В воде растворимые называются - щелочи: LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH) 2 , Sr(OH) 2 ,Ba(OH) 2 ,
- Другие - малорастворимы.
Кузнецова Екатерина владимировна

2Na+H 2 O=2NaOH+H 2 Ba+2H 2 O=Ba(OH) 2 +H 2
солей щелочных металлов
Li 2 O+H 2 O=2LiOH CaO+H 2 O=Ca(OH) 2
2NaCl+2H 2 O=2NaOH+Cl 2 +H 2
CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
Кузнецова Екатерина владимировна

Действие индикаторов
Кузнецова Екатерина Владимировна

1.Взаимодействие с кислотами
Cu(OH) 2 +2HCl=CuCl 2 +2H 2 O
2.Взаимодействие с кислотными оксидами
2KOH+CO 2 =K 2 CO 3 +H 2 O
3.Взаимодействие с амфотерными оксидами
2KOH+ZnO=K 2 ZnO 2 +H 2 O
4.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание

№ слайда 1
Свойства основных классов неорганических соединений ВеществаКлассы веществКислотыКлассификация кислотХимические свойства кислотОснованияКлассификация основанийСвойства основанийРазложение нерастворимых основанийСолиРазнообразие солейСвойства солейОксидыСолеобразующие оксидыТипичные реакции основных оксидовТипичные реакции кислотных оксидов
№ слайда 2
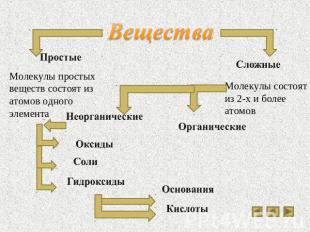
Вещества Простые Молекулы простых веществ состоят из атомов одного элемента Сложные Молекулы состоят из 2-х и более атомов Неорганические Оксиды Соли Гидроксиды Органические Основания Кислоты
№ слайда 3
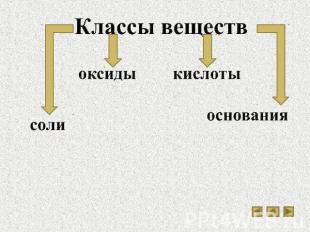
Классы веществ соли оксиды кислоты основания

№ слайда 4
Оксиды Несолеобразующие - такие оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей. это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления -2. Солеобразующие - такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
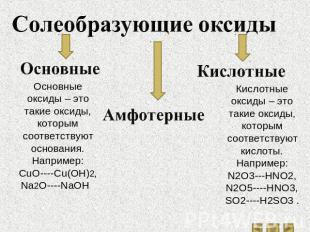
№ слайда 5
Солеобразующие оксиды Основные Основные оксиды – это такие оксиды, которым соответствуют основания.Например:CuO----Cu(OH)2,Na2O----NaOH . Амфотерные Кислотные Кислотные оксиды – это такие оксиды, которым соответствуют кислоты.Например:N2O3---HNO2,N2O5----HNO3,SO2----H2SO3 .

№ слайда 6
Основные оксиды взаимодействуют: Основный оксид + кислота соль + вода.(реакция обмена)CuO + 2HNO3 = Cu(NO3)2 + H2OОсновный оксид + кислотный оксид соль.(реакция соединения)CaO + N2O5 = Ca(NO3)2Основный оксид + вода щелочь.(реакция соединения)K2O + H2O = 2KOH

№ слайда 7
Кислотные оксиды взаимодействуют: Кислотный оксид + основание соль + вода.(реакция обмена)SO2 + 2NaOH = Na2SO3 + H2OКислотный оксид + основный оксид соль.(реакция соединения)K2O + SO3 = K2SO4Кислотный оксид + вода кислота.(реакция соединения)SO3 + H2O = H2SO4

№ слайда 8
Кислоты Этот класс соединений широко распространен в природе. В желудке человека содержится сильная бескислородная одноосновная соляная кислота. В природе наблюдается многообразие органических кислот . Молочная кислота содержится в кисломолочных продуктах (а), образуется при квашении капусты (б)

№ слайда 9
Кислоты – это сложные вещества, которые состоят из атомов водорода и кислотного остатка.

№ слайда 10
Химические свойствакислот Кислота + основание соль + вода. (реакция обмена)HСl + NaOH = NaCl + H2OКислота + оксид металла соль + вода. (реакция обмена)CuO + H2SO4 = CuSO4 + H2OКислота + соль новая кислота + новая соль. (реакция обмена)H2SO4 + BaCl2 = BaSO4 + 2HCl

№ слайда 11
Кислота + металл соль + водород. (реакция замещения) 1)Металл должен находиться в ряду стандартных электронных потенциалов до водорода. Например, Zn + 2НСl = ZnCl2 + Н2 2)Должна получиться растворимая соль.Pb + H2SO4 = PbSO4 + H2 3) Третья реакция характерна для растворов кислот, поэтому нерастворимые кислоты например кремниевая, не вступают в реакции с металлами.4) Концентрированный раствор H2SO4, раствор НNO3 любой концентрации взаимодействуют с металлами иначе.Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O. Взаимодействие кон. НNO3 с медью сопровождается образованием бурого газа – оксида азота (IV)

№ слайда 12
Основания – это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими гидросогруппами (ОН)

№ слайда 13
Основания Водные растворы щелочей, мылкие на ощупь, разъедают кожу, ткань, изменяют окраску индикаторов. Нерастворимые основания этими свойствами не обладают. Нерастворимые гидроксиды: а - гидроксид меди (II); б - гидроксид магния; в - гидроксид никеля (II); г - гидроксид железа (III); д - гидроксид кобальта (II)

№ слайда 14
Свойства оснований Типичные реакции оснований Основание + оксид неметалла соль + вода. ( реакция обмена)2KOH + SO2 = K2SO3 + H2OЩелочь + соль новое основание + новая соль. (реакция обмена)2KOH + CuSO4 = Cu(OH)2 + K2SO4
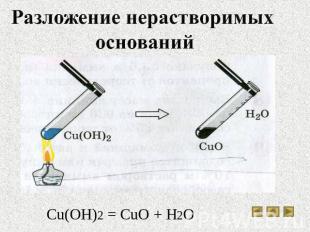
№ слайда 15
Разложение нерастворимых оснований Cu(OH)2 = CuO + H2O

№ слайда 16
Соли Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков.

№ слайда 17
Разнообразие солей Соли имеют самые различные цвета: а - медный купорос;б - дихромат калия; в - желтая кровяная соль; г - перманганат калия; д - хлорид натрия; е - нитрат никеля (II) Раковины состоят из карбоната кальция Малахит
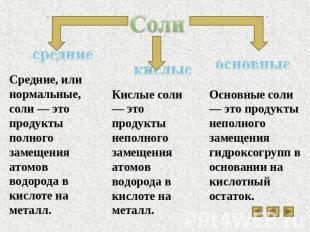
№ слайда 18
Соли средние Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл. кислые Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл. основные Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.

№ слайда 19
Свойства солей Соль 1 + соль 2 соль 3 + соль 4.(реакция обмена: в реакцию вступают две соли, в результате ее получаются две другие соли)Ca(NO3)2 + Na2CO3 = CaCO3 + 2NaNO3Соль + металл другая соль + другой металл.(реакция замещения)CuSO4 + Fe = FeSO4 + Cu
В презентации применяется технологический приём "закладка". Интерактивные подсказки активизируют мыслительную активность учащихся и способствуют формированию прочных знаний.



Рекомендации:





В презентации применяется технологический приём "закладка". Интерактивные подсказки активизируют мыслительную активность учащихся и способствуют формированию прочных знаний.
Читайте также:

