Катион это в химии определение кратко
Обновлено: 04.07.2024
Атом, при взаимодействии с другими атомами, может отдать один или несколько электронов другому атому или, наоборот, присоединить один или несколько чужих электронов. В результате электрически нейтральный атом становится положительно или отрицательно заряженной частицей — ионом.
Ион — это положительно или отрицательно электрически заряженная частица, образовавшаяся в результате потери атомом или присоединения к нему одного или нескольких электронов.
Если атом теряет один электрон, то образуется положительно заряженный ион с зарядом +1, а если присоединяет электрон, то заряд иона будет равен -1. В случае потери атомом или присоединения к нему двух электронов образуются ионы с зарядами +2 или -2 соответственно и т. д.
Заряд иона записывается рядом с символом химического элемента в верхнем правом углу.
Пример. H 1+ , Ca 2+ , O 2- .
Знаки + и - , в записи заряда иона, ставятся после числа, которое показывает количество потерянных или присоединённых электронов. Число 1 обычно опускается, поэтому, если ион имеет заряд +1 или -1, то в верхнем правом углу ставят только плюс или минус.
Пример. H + , Cl - .
В зависимости от заряда иона (положительного или отрицательного), ионы делятся на катионы и анионы. Катионы — это положительно заряженные ионы. Анионы — это отрицательно заряженные ионы.
Катионы и анионы, то есть противоположно заряженные ионы, притягиваются друг к другу.
В предыдущей части мы ввели несколько новых понятий, таких как:
Ионная связь - химическая связь, образованная за счёт электростатических сил взаимного притяжения между катионами металлов и анионами неметаллов (в этой работе наша задача ответить на вопрос о том, что такое катионы и анионы)
Попробуем сделать отсюда несколько выводов: почему связь между металлами и неметаллами называется ионной? Наверное, потому что непосредственное отношение к делу имеют некие частицы, которые мы будем называть ионами ? Конечно.
Посмотрите, на рисунке выше атом в ходе отдачи либо принятия электрона(ов ) становится ионом . Хм. Мы знаем, что атом - электронейтральная частица. Что же это получается, что в ходе отдачи либо принятия электронов атом приобретает заряд? Верно!
Попробуем в этом разобраться. Атом электронейтрален прежде всего по той причине, что число отрицательно заряженных частиц в атоме, то есть электронов , чей заряд мы условно принимаем равным -1, равно числу положительно заряженных частиц, то есть протонов , чей заряд мы условно принимаем равным +1 , и суммарный заряд атома оказывается равен нулю (об этом здесь ). Если же атом отдаёт или принимает электроны, то баланс нарушается, и электроотрицательных частиц в атоме, электронов , становится либо меньше, чем протонов , либо больше, в результате чего суммарный заряд частицы вещества окажется отличным от нуля! То есть, в качестве итога мы будем иметь дело уже не с атомом, а с ионом.
С этого момента мы будем работать по следующей простой схеме:
1) Число электронов равно числу протонов - атом .
2) Число электронов меньше, чем число протонов - положительный ион .
3) Число электронов больше, чем число протонов - отрицательный ион .
Почему так? Дело в том, что атом, отдавая электроны, оказывается в ситуации, когда число протонов в ядре начинает преобладать над числом электронов, то есть, суммарный положительный заряд атома начинает превышать суммарный отрицательный заряд атома, что означает, что атом стал положительным ионом. И наоборот.
Замыкаем сюжетную линию.
Если, во-первых, атомы металлов , проявляя металлические свойства , отдают электроны , а мы знаем, что атомы, отдавая электроны, становятся положительными ионами , если, во-вторых, атомы неметаллов , проявляя неметаллические свойства , принимают электроны , а мы знаем, что атомы, принимая электроны, становятся отрицательными ионами , то понятие об ионной связи , как об электростатических силах удерживающих между собой катионы металлов и анионы неметаллов, открывается для нас в новом свете:
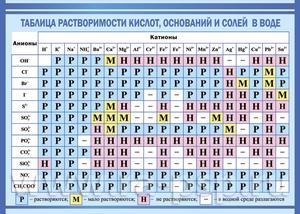
В волшебном мире химии возможно любое превращение. Например, можно получить безопасное вещество, которым часто пользуются в быту, из нескольких опасных. Подобное взаимодействие элементов, в результате которого получается однородная система, в которой все вещества, вступающие в реакцию, распадаются на молекулы, атомы и ионы, называется растворимость. Для того чтобы разобраться с механизмом взаимодействия веществ, стоит обратить внимание на таблицу растворимости.
Показатели растворимости в воде
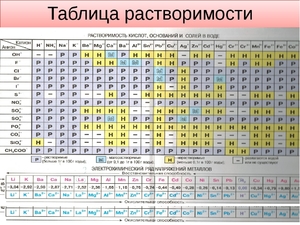
Таблица, в которой показана степень растворимости, является одним из пособий для изучения химии. Те, кто постигают науку, не всегда могут запомнить, как определённые вещества растворяются, поэтому под рукой всегда следует иметь таблицу.
Она помогает при решении химических уравнений, где участвуют ионные реакции. Если результатом будет получение нерастворимого вещества, то реакция возможна. Существует несколько вариантов:
- Вещество хорошо растворяется;
- Малорастворимо;
- Практически не растворяется;
- Нерастворимо;
- Гидрализуется и не существует в контакте с водой;
- Не существует.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Электролиты
Это растворы или сплавы, проводящие электрический ток. Электропроводность их объясняется мобильностью ионов. Электролиты можно поделить на 2 группы:
- Сильные. Растворяются полностью, независимо от степени концентрации раствора.
- Слабые. Диссоциация проходит частично, зависит от концентрации. Уменьшается при большой концентрации.
Теория электролитической растворимости
Во время растворения электролиты диссоциируют на имеющие разный заряд ионы: положительные и отрицательные. При воздействии тока положительные ионы направляются в сторону катода, тогда как отрицательные в сторону анода. Катод – положительный заряд, анод – отрицательный. В итоге происходит движение ионов.
Одновременно с диссоциацией проходит противоположный процесс – соединение ионов в молекулы. Кислоты – это такие электролиты, при распаде которых образуется катион – ион водорода. Основания – анионы – это гидроксид ионы. Щелочи – это основания, которые растворяются в воде. Электролиты, которые способны образовывать и катионы и анионы, называются амфотерными.
Это такая частица, в которой больше протонов или электронов, он будет называться анион или катион, в зависимости от того, чего больше: протонов или электронов. В качестве самостоятельных частиц они встречаются во многих агрегатных состояниях: газах, жидкостях, кристаллах и в плазме. Понятие и название ввёл в обиход Майкл Фарадей в 1834 году. Он изучал воздействие электричества на растворы кислот, щелочей и солей.
Простые ионы несут на себе ядро и электроны. Ядро составляет почти всю атомную массу и состоит из протонов и нейтронов. Количество протонов совпадает с порядковым номером атома в периодической системе и зарядом ядра. Ион не имеет определённых границ из-за волнового движения электронов, поэтому невозможно измерить их размеры.
Отрыв электрона от атома требует, в свою очередь, затрат энергии. Она называется энергия ионизации. Когда присоединяется электрон, происходит выделение энергии.
Катионы
Это частицы, носящие положительный заряд. Могут иметь разную величину заряда, например: Са2+ — двузарядный катион, Na+ — однозарядный катион. Мигрируют к отрицательному катоду в электрическом поле.
Анионы
Это элементы, имеющие отрицательный заряд. А также обладает различным количеством величины зарядов, например, CL- — однозарядный ион, SO42- — двухзарядный ион. Такие элементы входят в состав веществ, обладающих ионной кристаллической решёткой, в поваренной соли и многих органических соединениях.
- Натрий. Щелочной металл. Отдав один электрон, находящийся на внешнем энергетическом уровне, атом превратится в положительный катион.
- Хлор. Атом этого элемента принимает на последний энергетический уровень один электрон, он превратится в отрицательный хлорид анион.
- Поваренная соль. Атом натрия отдаёт электрон хлору, вследствие этого в кристаллической решётке катион натрия окружён шестью анионами хлора и наоборот. В результате такой реакции образуется катион натрия и анион хлора. Благодаря взаимному притяжению формируется хлорид натрия. Между ними образуется прочная ионная связь. Соли — это кристаллические соединения с ионной связью.
- Кислотный остаток. Это отрицательно заряженный ион, находящийся в сложном неорганическом соединении. Он встречается в формулах кислот и солей, стоит обычно после катиона. Практически для всех таких остатков есть своя кислота, например, SO4 – от серной кислоты. Кислот некоторых остатков не существует, и их записывают формально, но они образуют соли: фосфит ион.
Химия – наука, где возможно творить практически любые чудеса. Катион вы можете узнать по ссылке.

- Катио́н — положительно заряженный ион. Характеризуется величиной положительного электрического заряда: например, NH4+ — однозарядный катион аммония, Ca2+ — двухзарядный катион кальция. В электрическом поле, катионы притягиваются к отрицательному электроду — катоду.
катио́н
1. хим. физ. ион с положительным электрическим зарядом ◆ При электролизе катионы движутся в сторону катода. ◆ Многозарядный катион.
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать Карту слов. Я отлично умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова теоретизирование (существительное):
Ассоциации к слову «катион»
Синонимы к слову «катион»
Предложения со словом «катион»
- Использование катиона металла в качестве организующего центра открыло широкие возможности в синтезе катенаноподобных молекул.
Сочетаемость слова «катион»
Алкоголяты (алкоксиды) — соединения общей формулы R—OM, где R — алкил (или замещённый алкил), а M — катион металла либо другой катион. Формально — продукты замещения иона водорода гидроксильной группы спиртов другим катионом.
Галогеноводоро́ды — общее название соединений, образованных из водорода и галогенов (элементов подгруппы фтора).
Ено́лы (также алкенолы) — α-гидроксиалкены, соединения общей формулы R1R2C=CR3OH. Енолы находятся в таутомерном равновесии с соответствующим карбонильным соединением — альдегидом или кетоном.
Читайте также:

