Какова роль коррозии в жизни человеческого общества и зачем ее изучать кратко
Обновлено: 02.07.2024
сформировать эмоциональное отношение учащихся к данному явлению.
I. Организационный момент.
Тема, которую мы будем рассматривать– коррозия металлов. Мы должны выяснить, что такое коррозия металлов? Какие виды коррозии бывают? Как протекает этот процесс? Какова роль коррозии в жизни человеческого общества и зачем ее изучать? Какие способы защиты от нее существуют? Какое влияние может оказать коррозия на здоровье человека?
II. Объяснение нового материала.
Коррозия металлов наносит большой экономический вред. Приводит к уменьшению надежности работы оборудования, к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции. Коррозия так же приводит к загрязнению продукции, и к снижению ее качества.
Проблема защиты металлов от коррозии, знакомые человечеству с древних времён по сей день остается чрезвычайно актуальной. Ежегодные потери из-за коррозии составляет от 20 до 30 млн. тон металла. Прямой экономический ущерб от неё исчисляется сотнями миллиардов долларов в год. В связи с этим исследование механизма коррозии и разработка методов защиты от неё имеют большое значение.
Коррозии подвергаются различные металлы и сплавы, но наиболее часто приходится сталкиваться с коррозией самого распространенного металла - железа и его различных сплавов. Поэтому мы решили рассмотреть коррозию железа подробнее.
Учащиеся формируют и записывают тему, цель и гипотезу исследования.
Тема урока : Коррозия железа.
Цель урока. Исследовать, какие условия способствуют, а какие препятствуют коррозии железа.
Если поместить железо в щелочную среду, то скорость коррозии уменьшится.
Учитель предлагает составить план проведения исследования.
1. Изучить сущность коррозии, её виды и способы защиты от коррозии.
2. Иследовать зависимость скорости коррозии от присутствия кислорода.
3. Иследовать влияние электролитов на процесс коррозии.
4. Исследовать влияние ингибиторов на процесс коррозии.
Учащиеся работают по учебнику.
"Понятие о коррозии. Химическая и электрохимическая коррозия"
1. Понятие о коррозии.
Коррозия - это разрушение металла под действием внешней среды.
Коррозия - это окислительно-восстановительный процесс, при котором атомы металлов переходят в ионы (идет процесс окисления)
В роли окислителя, как правило, выступают
2. Виды коррозии.
Коррозия от латинского :. - разъедать.
По механизму протекания разрушений различают 2 типа коррозии: химическую и электрохимическую.
Химическая коррозия - это разрушение металлов в результате взаимодействия их с сухими газами или жидкостями, не проводящими электрический ток (в газах, нефти), при высоких температурах, когда невозможна конденсация водяного пара. Ей подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин, аппаратура химической отрасли промышленности.
При химической коррозии электроны переходят от металла к окислителю непосредственно.
Электрохимическая коррозия - это разрушение металлов при контакте двух металлов в воде или среде электролита. Электрохимическая коррозия распространена значительно шире, чем химическая. Ей подвергаются подводные части судов в морской и пресной воде, паровые котлы, металлические сооружения и конструкции под водой и в атмосфере, проложенные в грунте трубопроводы и др.
При электрохимической коррозии окислительно- восстановительная реакция разбивается на полу реакции окисления и восстановления и электроны переходят по металлу от восстановителя к окислителю, наряду с химическим процессом идет электрический -перенос электрона, то есть возникает электрический ток.
Коррозия железа, находящегося в контакте с медью и раствором слабой кислоты.
Этот вид коррозии приносит большой вред!
3. Условия, способствующие электрохимической коррозии:
а ) положение металлов в ряду напряжений, чем дальше расположены металлы друг от друга в ряду, тем быстрее происходит коррозия;
б) чистота металла (с примесями металлы быстрее подвергаются коррозии);
в) неровность поверхности металла, трещины;
г) блуждающие токи;
д) грунтовые воды;
е) среда электролита (наличие раствора сильного электролита, например, морская вода, усиливает коррозию );
ж) повышение температуры тоже способствует коррозии;
з) одним из важнейших факторов влияющих на электрохимическую коррозию, является действие микроорганизмов.
По данным зарубежных исследований, на счет микроорганизмов может быть отнесено до 75% всех потерь от коррозии, а в нефтедобывающей промышленности даже 80%. Процесс коррозии, идущий под действием бактерий и грибов, называют биокоррозией.
При использование металлических материалов очень важен вопрос о скорости их коррозии, от чего зависит скорость коррозии? Эксперимент поможет нам в этом разобраться.
1. Эксперимент №1. Роль кислорода в процессе коррозии железа.
пробирка 1-ж. гвоздь + вода наполовину
пробирка 2-ж. гвоздь + полностью
пробирка 3-ж. гвоздь + вода + масло
Учащиеся обсуждают результат эксперимента №1.
Больше ржавчины образуется в пробирке 1- железо соприкасается и с водой и с кислородом. В пробирке 2 ржавчины меньше т. к железо соприкасается только с водой. В пробирке 3 гвоздь почти не проржавел, кислород не смог пройти через слой масла, а без кислорода коррозия не развивается.
2. Эксперимент №2. Влияние электролитов на процесс коррозии железа.
стакан 1-ж. гвоздь +вода
стакан 2-ж. гвоздь +раствор NaCl
стакан 3-ж. гвоздь +медь+раствор NaCl
стакан 4-ж. гвоздь +алюминий +раствор NaCl
Учащиеся обсуждают результаты эксперимента. В стакане 1- мало ржавчины, в чистой воде коррозия идет медленно т. к вода слабый электролит. В данном случае мы наблюдаем химическую коррозию. В стакане 2 ржавчины больше, следовательно хлорид ионы увеличивают скорость коррозии. В стакане 3-скорость коррозии очень велика, образовалась много ржавчины. Следовательно , хлорид натрий -это сильно -коррозионная среда для железа, особенно в случае контакта с менее активным металлом -медью. В стакане 4тоже наблюдаем коррозию, но не железа, а алюминия, т. к железо в контакте с более активным металлом в сильно коррозионной среде - NaCl не корродирует до тех пор пока не прокорродирует весь алюминий. В стаканах 3и4 -электрохимическая коррозия.
3. Эксперимент №3. Влияние ингибиторов на процесс коррозии.
пробирка1-ж. гвоздь +раствор NaOH+р-р NaCL
пробирка 2-ж. гвоздь +раствор Na3Po4 + р-р NaCL
пробирка 3-ж. гвоздь +раствор Na2C4O4+ р-р NaCL
Учащиеся обсуждают результаты эксперимента №3.
В пробирках 1-3 железный гвоздь опущен в раствор хлорида натрия, к которому добавили гидроксид натрия, фосфат натрия, хромат натрия. Коррозия железа в данном случае отсутствует. Следовательно, эти вещества замедляют коррозию, являются ингибиторами. По результатам экспериментов 1-3 учащиеся формулируют выводы :
1. Коррозия железа резко усиливается в присутствии кислорода.
2. Коррозия усиливается, если железо соприкасается с более активным металлом.
3. Скорость коррозии зависит от состава омывающей металл среды, хлорид ионы усиливают коррозию железа.
4. Коррозия железа ослабляется в присутствии гидроксид-фосфат, хромат -ионов.
Способы защиты металлов от коррозии.
1. Применение защитных покрытий.
а) Металлические изделия покрывают лаками, красками, эмалями, стекло кристаллические покрытия.
б) металлические изделия покрывают другие металлами. В качестве металлов для покрытия применяют металлы, образующие на своей поверхности защитные пленки. К таким металлам относятся хром, никель цинк, олово и другие.
2. Приготовление сплавов стойких к коррозии части машин, инструменты и предметы быта изготовляют из нержавеющей стали и других сплавов, стойких к коррозии. В сплав вводят хром, никель, кремлей, кобальт, алюминий.
3. Электрохимические методы защиты.
а) применение заклепок изготовленных из более активных металлов.
б) Прикрепление пластинок из более активного металла для защиты основного металлического изделия. Например в паре Zn-Fe (оцинкованное железо)защищено железо, в паре Sn-Cu защищена медь и т. д.
К днищам кораблей прикрепляют протекторы -слитки более активного металла, чем обшивка днища корабля-это протекторная защита с помощью цинка (анодная защита) Катодная защита - защита менее активным металлом (лужёное железо)Особые требования - не допускать разрушении целостности покрытия.
4. Нейтрализация тока, возникающего при коррозии, постоянным током, пропускаемым в противоположным направлении. Так обычно защищают трубы нефтепровода, газопровода. Ни в коем случае нельзя перепутать полюсы тока, ошибки должны быть исключены.
5. Добавление ингибиторов. Использование замедлителей коррозии (органические, неорганические вещества)
Теперь мы можем понять широко используемые на практике способы предупреждения и борьбы с коррозией. Однако они полностью не защищают металлы от разрушения, поэтому учёные заняты поиском новых, более перспективных способов защиты. Коррозия металлов осуществляется в соответствие с законами природы, и поэтому её нельзя полностью устранить, её можно лишь замедлить.
III.Закрепление изученного материала.
Перечислите способы борьбы с коррозией?
На стальной крышке поставлена медная заклепка. Что разрушится раньше – крышка или заклепка? Почему?
4) Почему луженный (покрытый оловом) железный бак на месте повреждения защитного слоя быстро разрушается?
5) Почему на оцинкованном баке на месте царапины цинк разрушается, а железо не ржавеет?
IV. Подведение итога урока
Итак, на сегодняшнем уроке мы с вами изучили один из важнейших вопросов химической промышленности – коррозию металлов. Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить, на что и направлена современная химическая наука.
V. Домашнее задание: § 10 №1-5 с.51 по учебнику О.С.Габриелян.
1.Что на уроке показалось интересным? 2.Что вызвало затруднения? 3.Что вы узнали нового?
Полезно? Поделись с другими:
Если Вы являетесь автором этой работы и хотите отредактировать, либо удалить ее с сайта - свяжитесь, пожалуйста, с нами.
Посмотрите также:
Учебно-методические пособия и материалы для учителей, 2015-2022
Все материалы взяты из открытых источников сети Интернет. Все права принадлежат авторам материалов.
По вопросам работы сайта обращайтесь на почту [email protected]
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Тема: Коррозия металлов . Виды коррозии.
Провела: учитель химии Насенова Г.Р.
Цели урока : Рассмотреть коррозию металлов и их виды.
1. Сформировать понятие о коррозии металлов, рассмотреть классификацию коррозионных процессов, способы защиты металлов от коррозии.
2.Рассмотреть влияние коррозии на здоровье человека.
3.Рассмотреть экологические проблемы, связанные с коррозией металлов.
Оборудование : заранее подготовленные образцы:
учащимся – Р-р HCl, 2 пробирки CFe, Fe + C ₄
учителю - H ₂ SO ₄ + Fe (уротропин, сухое горючее)
пробирка № 1 – раствор хлорида натрия + ж. гвоздь
пробирка № 2 - раствор хлорида натрия + ж. гвоздь обвитый медной пров.
пробирка № 3 - раствор хлорида натрия + ж. гвоздь + цинк
пробирка № 4 – вода + ж. гвоздь
компьютер, экран, проектор
Тип урока : изучение нового материала.
Ход урока .
1. Вступительное слово учителя.
Тема, которую мы будем рассматривать, - коррозия металлов.
Мы должны выяснить, что такое коррозия металлов?
Какие виды коррозии бывают?
Как протекает этот процесс?
Какова роль коррозии в жизни человеческого общества и зачем её изучать? Какие способы защиты от неё существуют?
1.По механизму процесса
По характеру разрушения металла различают коррозию сплошную и местную .
Сплошная коррозия распределяется равномерно по всей поверхности металла или сплава (например, процесс ржавления сплавов железа на воздухе или их взаимодействие с сильными кислотами).
При местной коррозии её очаги распределяются неравномерно – в виде коррозионных пятен или точек, что особенно опасно для промышленной
Электрохимическая
По характеру разрушения металла различают коррозию сплошную и местную .
Сплошная коррозия распределяется равномерно по всей поверхности металла или сплава (например, процесс ржавления сплавов железа на воздухе или их взаимодействие с сильными кислотами).
При местной коррозии её очаги распределяются неравномерно – в виде коррозионных пятен или точек, что особенно опасно для промышленной химической аппаратуры.
Химическая коррозия металлов – это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды.
Наиболее распространённым видом химической коррозии является газовая коррозия, проистекающая в сухих газах при полном отсутствии влаги. Газообразное вещество окружающей среды реагирует с металлом на поверхности металлического изделия и образует с ним соединения. 2Fe + 3Cl ₂ → 2FeCl ₃
Электрохимическая коррозия – это разрушение металлов, которое сопровождается возникновением электрического тока. Это такая коррозия, в результате которой наряду с химическими процессами (отдача электронов атомами коррозируемого металла – процесс окисления) протекают электрические (перенос электронов от одного участка изделия к другому).
Давайте рассмотрим химическую коррозию металлов на воздухе.
Как протекает этот процесс?
Вспомним, что представляет собой воздух?
Ученик: - Это смесь газов, которая имеет состав по объёму:
Азот 78,095%
Кислород 20,939%
Диоксид углерода 0,031%
Благородные газы 0, 935 %, а остальные примеси
Учитель: Железо под воздействием O ₂ , H ₂ O и ионов водорода постепенно окисляется. Этот процесс является окислительно-восстановительным, где
металл является восстановителем. Коррозия железа может быть описана упрощённым уравнением
4Fe + 3O ₂ + 6H ₂ O = 4Fe(OH) ₃
Fe º - 3e = Fe³⁺
Oº ₂ + 4e = 2O²¯
Fe(OH) ₃ и является ржавчиной.
Проведём такой опыт
Опыт № 1.
Взяли две пробирки, налили в них воду. В одной из них воду прокипятили. Поместили в обе пробирки по очищенному железному гвоздю. Закрыли колбы пробками. Гдй пойдёт процесс коррозии быстрее?
Ученик: Признаки реакции появились быстрее в пробирке с некипячёной водой.
Учитель: В этом опыте мы выяснили роль кислорода воздуха в коррозии железа. Давайте сделаем вывод: кислород является одним из агрессивных её факторов.
Учитель: Если кислород является одним из агрессивных её факторов, тогда почему вода в алюминиевом чайнике при нагревании кипит, но не действует на металл, и чайник служит довольно долгое время?
Ученик: алюминий – очень активный металл и теоретически с водой должен был бы взаимодействовать в соответствии с уравнением
2Al + 3H ₂ O = Al ₂ O ₃ + 3H ₂
Однако его поверхность покрывается плотной плёнкой оксида AlO, которая защищает металл от воздействия воды и кислорода.
Учитель: значит окисная плёнка защищает металл от воздействия воды и кислорода.
Особенно разнообразные процессы химической коррозии встречаются в среде кислот, щелочей, солей, а также в расплавах солей и других веществ.
Большие неприятности связаны с хлоридом натрия (в некоторых странах используют отход производства – хлорид кальция), разбрасываемым в зимнее время на дорогах и тротуарах для удаления снега и льда. В присутствии солей они плавятся, и образующиеся растворы стекают в канализационные трубопроводы. Соли и особенно хлориды являются активаторами коррозии и приводят к ускоренному разрушению металлов, в частности транспортных средств и подземных коммуникаций.
^ Основополагающим звеном для понимания электрохимических процееов является ряд напряжения металлов. Металлы можно расположить в ряд, который начинается с химически активных и заканчивается наименее активными благородными металлами.
РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ
Li, Rb, K, Ba, Sr, Ca, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe? Cd, Tl, Co, Tl, Co, Ni,Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.
Рассмотрим влияние различных электролитов на процесс коррозии металлов.
В пробирку № 1 – раствор хлорида натрия + ж. гвоздь
В пробирку № 2 - раствор хлорида натрия + ж. гвоздь обвитый медной пров.
В пробирку № 3 - раствор хлорида натрия + ж. гвоздь + цинк
В пробирку № 4 – вода + ж. гвоздь
Приложение
Результаты опытов 1 и 2. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с медью, а в другом – нет. И там и здесь произошла коррозия, и появился бурый осадок ржавчины. Но в опыте 1 ржавчины получилось мало, а в опыте 2 – много. Результаты опытов 1 и 3 в обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с цинком, а в другом – нет. Наблюдается сильная коррозия, но в опыте 2 осадок бурого цвета – ржавчина, а в опыте 3 осадок белого цвета – это гидроксид цинка. Следовательно, в опыте 3 коррозировало не железо, а цинк. Таким образом, железо практически не коррозирует, если оно соприкасается с цинком. Сравним результаты опытов 1 и 4.
Ученик: Добавка к воде хлорида натрия усилила коррозию металла.
Учитель: Мы убедились, что коррозия – это универсальное явление не только для железа, но и для всех металлов. Рассмотрим работу гальванического элемента.
Сущность работы гальванического элемента.
Сначала наполним химический стакан вместимостью 250 мл до середины 10%-ным раствором серной кислоты и погрузим в неё не слишком маленькие куски цинка и меди. К обоим электродам приклепаем медную проволоку, концы которой не должны касаться раствора.
Пока концы проволоки не соединены друг с другом, мы будем наблюдать растворение цинка, которое сопровождается выделением водорода. Цинк, как следует из ряда напряжения, активнее водорода, поэтому металл может вытеснять водород из ионного состояния. На обоих металлах образуется двойной электрический слой. Разность потенциалов между электродами проще всего обнаружить с помощью вольтмера. Непосредственно после включения прибора в цель стрелка укажет примерно 1В, но затем напряжение быстро упадёт.
Рассмотрим процессы в медно-цинковом элементе несколько подробнее. На катоде цинк переходит в раствор по следующему уравнению: Zn = Zn ²⁺ + 2e
На медном аноде разряжаются ионы водорода серной кислоты. Они
присоединяют электроны, поступающие по проволоке от цинкового катода, и в результате образуются пузырьки водорода: 2H ⁺ + 2e = H ₂
Через короткий промежуток времени медь покроется тончайшим слоем
пузырьков водорода. При этом медный электрод превратится в водородный, а разность потенциалов уменьшится. Этот процесс называют поляризацией электрода. На практике применяют гальванические цепи, электроды которых не поляризуются, или цепи, поляризацию которых можно устранить, добавив
Учитель: А теперь поговорим о способах защиты металлов от коррозии.
Способы защиты от коррозии.
1.легирование металлов, т.е. получение сплавов. Например, в настоящее время создано большое число нержавеющих сталей путём присадок к железу никеля, хрома, кобальта и др. Такие стали, действительно, не покрываются ржавчиной.
производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции. Коррозия также приводит к загрязнению продукции, а
начит, и к снижению её качества. Один из американских миллионеров, не жалея денег, решил построить самую шикарную яхту. Её днище было
обшито дорогим металлом (сплав 70% никеля и 30% меди), а киль, форштевень и раму руля изготовили из стали. В морской воде в подводной части яхты образовался гальванический элемент с катодом из металла, а анодом из стали. Он настолько энергично работал, что яхта ещё до завершения отделочных работ вышла из строя, ни разу не побывав в море. Иногда зубные коронки, изготовленные из различных металлов (золота и
Как называются вещества, замедляющие коррозию?
Введение каких элементов в сталь повышает её коррозионную стойкость?
К стальному днищу машины была предложена протекторная защита. Какой металл этого лучше применить: Zn, Cu или Ni?
Почему многие детали быстрее корродируют вблизи предприятий?
Лист железа, покрытый цинком, и лист железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии железо в обоих случаях?
Тема урока: Коррозия металлов и сплавов. Меры по предупреждению коррозии. Задачи урока: 1.Образовательная: Сформировать понятие о коррозии металлов, рассмотреть классификацию коррозионных процессов, способы защиты металлов от коррозии. 2.Развивающая: Формировать умение делать выводы, анализировать, обобщать. 3.Воспитательная: Рассмотреть влияние коррозии на здоровье человека и экологические проблемы, связанные с коррозией металлов.
Способы защиты от коррозии
Закрепление знаний, умений и навыков
Оборудование: заранее подготовленные (за 4-5дней) образцы - пробирка №1 - раствор хлорида натрия +ж.гвоздь пробирка №2 - раствор хлорида натрия +ж.гвоздь обвитый медной пров. пробирка №3- раствор хлорида натрия +ж.гвоздь +цинк пробирка №4- вода + ж.гвоздь компьютер, экран, проектор
Тип урока: изучение нового материала.
Самостоятельная работа(по вариантам)
Fe2O3 + СО→ CuO + Н2 →
МnО2 + Аl → CuO + H2SO4 → CuSO4 + Fe → CuO + CO-> CuSO4 + Zn -> СuСl2 + 2NaOH->
FeСl2 + 2NaOH → FeCl2 + Zn →
И так, что же такое коррозия металлов? Коррозией металлов называют самопроизвольный процесс разрушения металлов и изделий из них под воздействием окружающей среды. Коррозию можно классифицировать:
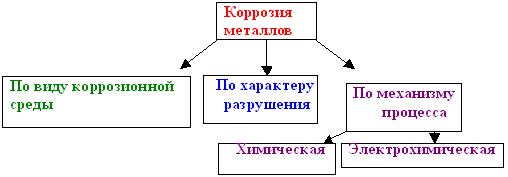
По характеру разрушения металла различают коррозию сплошную и местную. Сплошная коррозия распределяется равномерно по всей поверхности металла или сплава (например, процесс ржавления сплавов железа на воздухе или их взаимодействие с сильными кислотами). При местной коррозии ее очаги распределяются неравномерно - в виде коррозионных пятен или точек, что особенно опасно для промышленной химической аппаратуры.
Химическая коррозия металлов - это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды. Наиболее распространенным видом химической коррозии является газовая коррозия, проистекающая в сухих газах при полном отсутствии влаги. Газообразное вещество окружающей среды реагирует с металлом на поверхности металлического изделия и образует с ним соединения.
Электрохимическая коррозия - это разрушение металлов, которое сопровождается возникновением электрического тока. Это такая коррозия, в результате которой наряду с химическими процессами (отдача электронов атомами коррозируемого металла - процесс окисления) протекают электрические (перенос электронов от одного участка изделия к другому).
Давайте рассмотрим химическую коррозию металлов на воздухе. Как протекает этот процесс? Вспомним, что представляет собой воздух? - Это смесь газов, которая имеет состав по объему: Азот 78,095% Кислород 20,939% Диоксид углерода 0,031% Благородные газы 0,935% , а остальное примеси
Учитель: Железо под воздействием O2 , H2О и ионов водорода постепенно окисляется. Этот процесс является окислительно-восстановительным, где металл является восстановителем. Коррозия железа может быть описана упрощенным уравнением 4Fe + 3O2 + 6H2О = 4 Fe(OH) 3 Fe 0 -3е= Fe 3+ O 0 2+4 е=2O 2- Fe(OH) 3 и является ржавчиной.
Проведем такой опыт
Опыт № 1. Взяли две пробирки, налили в них воду. В одной из них воду прокипятили. Поместили в обе пробирки по очищенному железному гвоздю. Закрыли колбы пробками. Где пойдет процесс коррозии быстрее? Признаки реакции появились быстрее в пробирке с некипяченой водой. В этом опыте мы выяснили роль кислорода воздуха в коррозии железа. Давайте сделаем вывод: Вывод: кислород является одним из агрессивных ее факторов.
Представьте себе такую установку: колба, в которую помещены железные опилки, закрыта пробкой с газоотводной трубкой, конец которой опущен в стакан с подкрашенной водой, вода поднимается по трубке. Как объясните это явление?
Если кислород является одним из агрессивных ее факторов, тогда почему вода в алюминиевом чайнике при нагревании кипит, но не действует на металл, и чайник служит довольно долгое время? Алюминий - очень активный металл и теоретически с водой должен был бы взаимодействовать в соответствии с уравнением 2Al + 3H2О = Al2O3 + 3H2
Однако его поверхность покрывается плотной пленкой оксида Al2O3, которая защищает металл от воздействия воды и кислорода.
Это значит окисная пленка защищает металл от воздействия воды и кислорода.
Особенно разнообразные процессы химической коррозии встречаются в среде кислот, щелочей, солей, а также в расплавах солей и других веществ
Большие неприятности связаны с хлоридом натрия (в некоторых странах используют отход производства - хлорид кальция), разбрасываемым в зимнее время на дорогах и тротуарах для удаления снега и льда. В присутствии солей они плавятся, и образующиеся растворы стекают в канализационные трубопроводы. Соли и особенно хлориды являются активаторами коррозии и приводят к ускоренному разрушению металлов, в частности транспортных средств и подземных коммуникаций.
Основополагающим звеном для понимания электрохимических процессов является ряд напряжения металлов. Металлы можно расположить в ряд, который начинается с химически активных и заканчивается наименее активными благородными металлами:
РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ
Li, Rb, К, Ва, Sr, Са, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe, Cd, Tl, Co, Ni, Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.
Рассмотрим влияние различных электролитов на процесс коррозии металлов.
В пробирку №1 - раствор хлорида натрия +ж.гвоздь В пробирку №2 - раствор хлорида натрия +ж.гвоздь обвитый медной пров. В пробирку №3- раствор хлорида натрия +ж.гвоздь +цинк В пробирку №4- вода + ж.гвоздь
Результаты опытов 1 и 2. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с медью, а в другом - нет. И там и здесь произошла коррозия, и появился бурый осадок ржавчины. Но в опыте 1 ржавчины получилось мало, а в опыте 2 - много. Результаты опытов 1 и 3 в обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с цинком, а в другом - нет. Наблюдается сильная коррозия, но в опыте 2 осадок бурого цвета - ржавчина, а в опыте 3 осадок белого цвета - это гидроксид цинка. Следовательно, в опыте 3 коррозировало не железо, а цинк. Таким образом, железо практически не коррозирует, если оно соприкасается с цинком. Сравним результаты опытов 1 и 4. Добавка к воде хлорида натрия усилила коррозию металла. Мы убедились, что коррозия - это универсальное явление не только для железа, но и для всех металлов. Рассмотрим работу гальванического элемента.
Сущность работы гальванического элемента
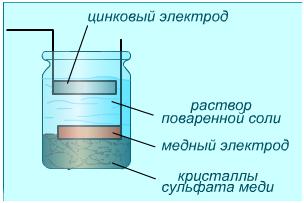
Сначала наполним химический стакан вместимостью 250 мл до середины 10%-ным раствором серной кислоты и погрузим в нее не слишком маленькие куски цинка и меди. К обоим электродам приклепаем медную проволоку, концы которой не должны касаться раствора.
Пока концы проволоки не соединены друг с другом, мы будем наблюдать растворение цинка, которое сопровождается выделением водорода. Цинк, как следует из ряда напряжения, активнее водорода, поэтому металл может вытеснять водород из ионного состояния. На обоих металлах образуется двойной электрический слой. Разность потенциалов между электродами проще всего обнаружить с помощью вольтметра. Непосредственно после включения прибора в цепь стрелка укажет примерно 1 В, но затем напряжение быстро упадет.
Рассмотрим процессы в медно-цинковом элементе несколько подробнее. На катоде цинк переходит в раствор по следующему уравнению: Zn = Zn 2+ + 2е -
На медном аноде разряжаются ионы водорода серной кислоты. Они присоединяют электроны, поступающие по проволоке от цинкового катода, и в результате образуются пузырьки водорода: 2Н + + 2е - = Н2
Через короткий промежуток времени медь покроется тончайшим слоем пузырьков водорода. При этом медный электрод превратится в водородный, а разность потенциалов уменьшится. Этот процесс называют поляризацией электрода. На практике применяют гальванические цепи, электроды которых не поляризуются, или цепи, поляризацию которых можно устранить, добавив деполяризаторы.
3.2. Способы защиты от коррозии
1. легирование металлов, т.е. получение сплавов. Например, в настоящее время создано большое число нержавеющих сталей путем присадок к железу никеля, хрома, кобальта и др. Такие стали, действительно, не покрываются ржавчиной
3. введение ингибиторов (замедлителей коррозии) Проведение эксперимента. В пробирку на 1/5 объема налили разбавленную серную кислоту, затем поместили в нее железные стружки. Довели до кипения. Наблюдали выделение пузырьков газа водорода. Затем в эту же пробирку добавили ингибитор уротропин (1 измельченную таблетку). Уротропин можно заменить тиомочевиной или сухим горючим. Реакция с кислотой прекратилась.
3.3 Влияние коррозии на организм человека и роль коррозии в жизни человеческого общества Коррозия металлов наносит большой экономический вред. Коррозия приводит к уменьшению надежности работы оборудования: аппаратов высокого давления, паровых котлов, металлических контейнеров для токсичных и радиоактивных веществ. Коррозия приводит к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции. Коррозия также приводит к загрязнению продукции, а значит, и к снижению ее качества. Иногда зубные коронки, изготовленные из различных металлов (золота и стали) и близко расположенные друг к другу, доставляют их носителям неприятнейшие болевые ощущения. Поскольку слюна является электролитом, эти коронки образуют гальванический элемент. Электрический ток протекает по десне и вызывает зубную боль.
Способность металлов пассивироваться широко используют для их защиты от коррозии. Например, известно, что хранение лезвий безопасных бритв в растворах солей хромовых кислот позволяет дольше сохранять их острыми. Так как под действием влажного воздуха железо, особенно на острие лезвия, окисляется и покрывается рыхлым слоем ржавчины.
Требуется скрепить железные детали. Какими заклепками следует пользоваться медными или цинковыми, чтобы замедлить коррозию железа? Ответ обоснуйте.
Как называются вещества, замедляющие коррозию?
Введение каких элементов в сталь повышает ее коррозионную стойкость?
К стальному днищу машины была предложена протекторная защита. Какой металл для этого лучше применить: Zn, Cu или Ni?

Бесплатное участие. Свидетельство СМИ сразу.
До 500 000 руб. ежемесячно и 10 документов.
Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"

Разработка урока "Коррозия металлов"


Бесплатный просмотр. Свидетельства участникам
для аттестации за минуту.
Читайте также:
- Паспорт безопасности музыкальной школы образец
- Особенности социализации детей дошкольного возраста кратко
- Основные задачи философии кратко
- Сравните функции двух зон корня всасывающей и проводящей укажите их особенности 6 класс ответ кратко
- Волк и семеро козлят театрализация сценарий в доу в формате новых технологий

