Каков механизм работы ферментов кратко
Обновлено: 05.07.2024
Ферменты (энзимы) — это белковые вещества, играющие очень важную роль в различных биохимических процессах в организме. Они необходимы для переваривания пищевых продуктов, стимуляции деятельности головного мозга, процессов энергообеспечения клеток, восстановления органов и тканей. Наиболее важной функцией ферментов является ускорение и запуск биохимических реакций в организме, многие, если не большинство, из которых, идут только в присутствии соответствующих энзимов. Функция каждого из ферментов уникальна, т.е. каждый фермент активизирует только один биохимический процесс. В связи с этим в организме существует огромное количество энзимов.
В зависимости от того, какие виды реакций организма катализируют ферменты, они выполняют различные функции. Чаще всего их подразделяют на две основные группы: пищеварительные и метаболические.
Пищеварительные ферменты выделяются в желудочно-кишечном тракте, разрушают питательные вещества, способствуя их абсорбции в системный кровоток. Различают три основные категории таких ферментов: амилаза, протеазы, липаза. Амилаза расщепляет углеводы и находятся в слюне, панкреатическом секрете и в содержимом кишечника. Различные виды амилазы расщепляют различные сахара. Протеазы, находящиеся в желудочном соке, панкреатическом секрете и в содержимом кишечника, помогают переваривать белки. Липаза, находящаяся в желудочном соке и панкреатическом секрете, расщепляет жиры.
Метаболические ферменты катализируют биохимические процессы внутри клеток. Каждый орган или ткань организма имеет свою сеть ферментов.
Некоторые виды пищевых продуктов содержат ферменты. К сожалению, ферменты очень чувствительны к высокой температуре и легко разрушаются при нагревании. Для того, чтобы организм получил дополнительное количество ферментов, следует или есть продукты, содержащие их, в сыром виде или принимать биологически активные пищевые добавки с такими ферментами.
Ферментами богаты продукты растительного происхождения: авокадо, папайя, ананасы, бананы, манго, ростки.
Большинство формул биологически активных пищевых добавок содержит различные пищеварительные ферменты и получены из продуктов животного или грибкового происхождения.
Протеолитическими ферментами являются пепсин, трипсин, реннин, панкреатин и хи-мотрипсин. Помимо улучшения пищеварения, эти ферменты оказывают противовоспалительное действие. Панкреатин используют при ферментной недостаточности поджелудочной железы, муковисцидозе, нарушениях пищеварения, пищевой аллергии, аутоиммунных заболеваниях, вирусных инфекциях и спортивных травмах.
Обычно пищеварительные ферменты принимают после еды, но если вы едите продукты, прошедшие технологическую обработку или измельченные, то во время еды.
Все препараты и БАД, содержащие ферменты, следует хранить в прохладном месте. Таблетки и жидкости в холодильнике, порошок и капсулы — в сухом прохладном месте.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
Метаболизм является основой всей жизнедеятельности организмов, а обмен веществ неотделим от катализа ферментов. Ферменты — это каталитически активные организмы, продуцируемые живыми клетками. По сути, подавляющее большинство ферментов — это белки, некоторые — РНК, то есть рибонуклеиновая кислота, носитель генетической информации.
Белки с ферментативной активностью подразделяются на простые белки и связывающие белки. Простые белковые ферменты состоят из аминокислот и не содержат других веществ (таких как пепсин). Белковые ферменты состоят из простых белков и кофакторов, таких как лактатдегидрогеназа, трансаминаза и так далее. Простая белковая часть, из которой состоит фермент, называется ферментным белком или основным ферментом, а простетическая часть называется коферментами. Связывающий фермент обычно представляет собой комбинацию первичного фермента и кофермента и становится целым ферментом, который функционирует как фермент.
Роль ферментов в организме
В организме содержится множество ферментов, которые контролируют многие метаболические процессы: метаболизм, питание и преобразование биоэнергии. Большинство реакций, тесно связанных с жизненными процессами, являются реакциями, катализируемыми ферментами.
Роль ферментов в катализе
Самая важная роль фермента — катализ. Он позволяет упорядоченно осуществлять сложный метаболизм веществ в клетках, адаптируя метаболизм веществ к нормальным физиологическим функциям. Если дефицит или активность фермента ослаблены из-за генетических дефектов или по другим причинам, каталитическая реакция фермента может быть ненормальной, что приведет к нарушению метаболизма вещества или даже к заболеванию.
Каталитический механизм фермента в основном включает кислотно-основной катализ и ковалентный катализ. Кислотно-основной катализ относится к каталитическому действию переноса протона для ускорения реакции. Ковалентный катализ означает, что субстрат или часть субстрата образует ковалентную связь с катализатором и затем переносится на второй субстрат. Многие реакции переноса группы, катализируемые ферментами, осуществляются путем ковалентного катализа.
В организме человека имеется большое количество ферментов, которые сложны по структуре и разнообразны. Например, когда люди жуют рис и приготовленные на пару булочки, то чем дольше они жуют, тем слаще вкус. Это обьясняется следующим образом: крахмал в рисе гидролизуется до мальтозы под действием амилазы слюны, секретируемой ротовой полостью.
Следовательно, люди, которые больше жуют во время еды, могут хорошо смешивать пищу и слюну, что полезно для пищеварения. Кроме того, белок, который человеческое тело принимает из пищи, должен быть гидролизован до аминокислот с помощью различных протеолитических ферментов в пищевой промышленности, таких как пепсин, а затем конкретные аминокислоты выбираются другими ферментами для восстановления необходимых белков в определенном порядке. Здесь происходит множество сложных химических реакций.
Как ферменты снижают энергию активации реакции?
Каталитический механизм фермента заключается в снижении энергии активации реакции. Химическая реакция может быть проведена, потому что часть молекул субстрата была активирована, чтобы стать активированными молекулами, и чем больше активированных молекул, тем выше скорость реакции. Комплекс фермент-субстрат реагирует с образованием продукта, высвобождая фермент, который связывается с другой молекулой субстрата и увеличивает скорость химической реакции за счет уменьшения активации реакции.
Ферменты могут ускорить химическую реакцию, но не могут изменить точку равновесия химической реакции. Это означает, что фермент способствует прямой реакции и обратной реакции в той же пропорции, поэтому роль фермента заключается в сокращении времени, необходимого для достижения равновесия.
Механизм действия ферментов. Работа ферментов.
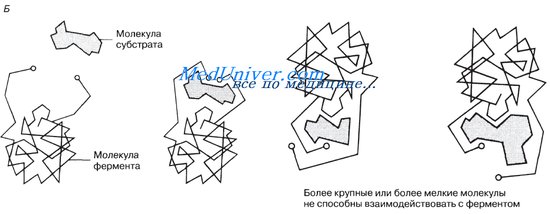
Ферменты обладают очень высокой специфичностью. Фишер (Fischer) в 1890 г. высказал предположение, что эта специфичность обусловливается особой формой молекулы фермента, точно соответствующей форме молекулы субстрата (или субстратов).
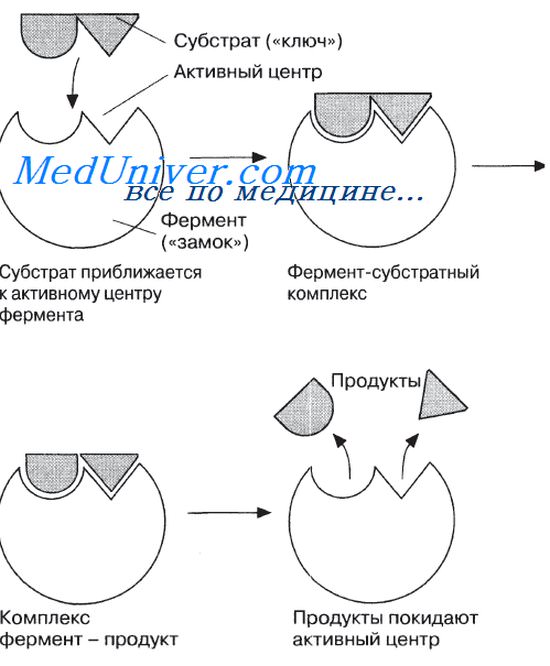
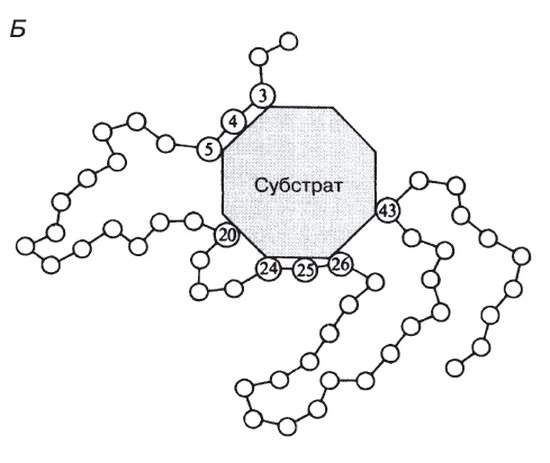
Молекулы большей части ферментов во много раз крупнее, чем молекулы тех субстратов, которые атакует данный фермент. Активный же центр фермента составляет лишь очень небольшую часть его молекулы, обычно от 3 до 12 аминокислотных остатков. Роль остальных аминокислот, составляющих основную массу фермента, заключается в том, чтобы обеспечить его молекуле правильную глобулярную форму, которая, как мы увидим далее, очень важна для наиболее эффективной работы активного центра фермента.
Образовавшиеся продукты по форме уже не соответствуют активному центру фермента. Они отделяются от него (поступают в окружающую среду), после чего освободившийся активный центр может принимать новые молекулы субстрата.
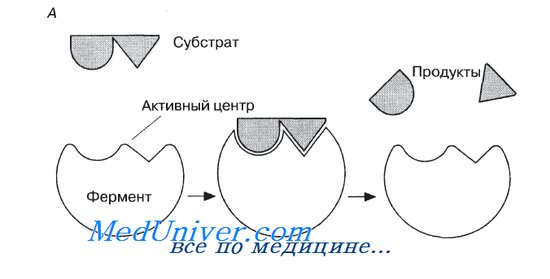
Подходящей аналогией в этом случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму. По мере выяснения отдельных деталей механизма различных реакций в эту гипотезу вносятся уточнения.
Представление о том, как работает фермент, можно получить с помощью рентгеноструктурного анализа и компьютерного моделирования. Рисунок иллюстрирует это на примере фермента лизоцима.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Ферменты – это особый вид протеинов, которым природой отведена роль катализаторов разных химических процессов.
Этот термин постоянно на слуху, правда, далеко не все понимают, что такое фермент или энзим, какие функции выполняет это вещество, а также чем отличаются ферменты от энзимов и отличаются ли вообще. Все это сейчас и узнаем.
История открытия
Структура: цепь из тысяч аминокислот

Все ферменты являются белками, но не все белки – ферменты. Как и другие протеины, энзимы состоят из аминокислот. И что интересно, на создание каждого фермента уходит от ста до миллиона аминокислот, нанизанных, словно жемчуг на нить. Но эта нить не бывает ровной – обычно изогнута в сотни раз. Таким образом, создается трехмерная уникальная для каждого фермента структура. Меж тем, молекула энзима – сравнительно крупное образование, и лишь небольшая часть его структуры, так называемый активный центр, участвует в биохимических реакциях.
Биохимические свойства
Хотя при участии ферментов в природе происходит огромное количество реакций, но все они могут быть разделены на 6 категорий. Соответственно, каждая из этих шести реакций протекает под влиянием определенного типа ферментов.
Реакции при участии энзимов:
Ферменты, участвующие в этих реакциях, называются оксидоредуктазами. В качестве примера можно вспомнить как, алкогольдегидрогеназы преобразуют первичные спирты в альдегид.
Ферменты, благодаря которым происходят эти реакции, называются трансферазами. Они обладают умением перемещать функциональные группы от одной молекулы к другой. Так происходит, например, когда аланинаминотрансферазы перемещают альфа-аминогруппы между аланином и аспартатом. Также трансферазы перемещают фосфатные группы между АТФ и другими соединениями, а из остатков глюкозы создают дисахариды.

Гидролазы, участвующие в реакции, умеют разрывать одинарные связи, добавляя элементы воды.
Этот вид реакций негидролитическим путем происходит при участии лиазы.
Во многих химических реакциях положение функциональной группы изменяется в пределах молекулы, но сама молекула состоит из того же количества и типов атомов, что были до начала реакции. Иными словами, субстрат и продукт реакции являются изомерами. Такого типа трансформации возможны под влиянием ферментов изомеразы.
- Образование одинарной связи с устранением элемента воды.
Гидролазы разрушают связь, добавляя в молекулу элементы воды. Лиазы осуществляют обратную реакцию, удаляя водную часть из функциональных групп. Таким образом, создают простую связь.
Как работают в организме
Ферменты ускоряют практически все химические реакции, происходящие в клетках. Они имеют жизненно важное значение для человека, облегчают пищеварение и ускоряют метаболизм.
Гипер- и гипоактивность
Бывают случаи, когда энзимы выполняют свои функции с неправильной интенсивностью. Чрезмерная активность вызывает чрезмерное формирование продукта реакции и дефицит субстрата. В результате – ухудшение самочувствия и серьезные болезни. Причиной гиперактивности энзима может быть как генетическое нарушение, так и избыток витаминов или микроэлементов, используемых в реакции.
Гипоактивность ферментов может даже стать причиной смерти, когда, например, энзимы не выводят из организма токсины либо возникает дефицит АТФ. Причиной такого состояния также могут быть мутированные гены или, наоборот, гиповитаминоз и дефицит других питательных веществ. Кроме того, пониженная температура тела аналогично замедляет функционирование энзимов.
Катализатор и не только

Сегодня можно часто услышать о пользе ферментов. Но что такое эти вещества, от которых зависит работоспособность нашего организма?
Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Ферменты в качестве катализаторов ускоряют процессы метаболизма и другие реакции.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтобы снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Факторы, определяющие активность энзимов
Поскольку энзим способен ускорять реакции во много раз, его активность определяется так называемым числом оборотов. Этот термин обозначает количество молекул субстрата (реагирующего вещества), которую способна трансформировать 1 молекула фермента за 1 минуту. Однако существует ряд факторов, определяющих скорость реакции:

Увеличение концентрации субстрата ведет к ускорению реакции. Чем больше молекул действующего вещества, тем быстрее протекает реакция, поскольку задействовано больше активных центров. Однако ускорения возможно только до тех пор, пока не задействуются все молекулы фермента. После этого, даже повышение концентрации субстрата не приведет к ускорению реакции.
Обычно повышение температуры ведет к ускорению реакций. Это правило работает для большинства ферментативных реакций, но только до тех пор, пока температура не поднимется выше 40 градусов по Цельсию. После этой отметки скорость реакции, наоборот, начинает резко снижаться. Если температура опустится ниже критической отметки, скорость ферментативных реакций повысится снова. Если температура продолжает расти, ковалентные связи рушатся, а каталитическая активность фермента теряется навсегда.
На скорость ферментативных реакций также влияет показатель рН. Для каждого фермента существует свой оптимальный уровень кислотности, при котором реакция проходит наиболее адекватно. Изменение уровня рН сказывается на активности фермента, а значит, и скорости реакции. Если изменения слишком велики, субстрат теряет способность связываться с активным ядром, а энзим больше не может катализировать реакцию. С восстановлением необходимого уровня рН, активность фермента также восстанавливается.
Ферменты для пищеварения
Ферменты, присутствующие в человеческом организме, можно разделить на 2 группы:
За что отвечают пищеварительные – понятно из названия. Но и здесь срабатывает принцип селективности: определенный тип ферментов влияет только на один вид пищи. Поэтому для улучшения пищеварения можно прибегнуть к маленькой хитрости. Если организм плохо переваривает что-то из еды, значит надо дополнить рацион продуктом, содержащим фермент, который способен расщепить трудно перевариваемую пищу.
Пищевые ферменты – катализаторы, которые расщепляют продукты питания до состояния, в котором организм способен поглощать из них полезные вещества. Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость
На этом этапе на пищу воздействует альфа-амилаза. Она расщепляет углеводы, крахмалы и глюкозу, которые содержатся в картофеле, фруктах, овощах и других продуктах питания.
Желудок
Здесь пепсин расщепляет белки до состояния пептидов, а желатиназа – желатин и коллаген, содержащиеся в мясе.
Поджелудочная железа
- трипсин – отвечает за расщепление белков;
- альфа-химотрипсин – помогает усвоению протеинов;
- эластазы – расщепляют некоторые виды белков;
- нуклеазы – помогают расщеплять нуклеиновые кислоты;
- стеапсин – способствует усвоению жирной пищи;
- амилаза – отвечает за усвоение крахмалов;
- липаза – расщепляет жиры (липиды), содержащиеся в молочных продуктах, орехах, маслах и мясе.
Тонкая кишка
Толстый кишечник

Здесь функции ферментов выполняют:
- кишечная палочка – отвечает за переваривание лактозы;
- лактобактерии – влияют на лактозу и некоторые другие углеводы.
Кроме названных энзимов, существуют еще:
- диастаза – переваривает растительный крахмал;
- инвертаза – расщепляет сахарозу (столовый сахар);
- глюкоамилаза – превращает крахмал в глюкозу;
- альфа-галактозидаза – способствует перевариванию бобов, семян, соевых продуктов, корневых овощей и листовых;
- бромелайн – фермент, полученный из ананасов, способствует расщеплению разных видов белков, эффективен при разных уровнях кислотности среды, обладает противовоспалительными свойствами;
- папаин – фермент, выделенный из сырой папайи, способствует расщеплению мелких и крупных протеинов, эффективен в широком диапазоне субстратов и кислотности.
- целлюлаза – расщепляет целлюлозу, растительные волокна (в человеческом организме не обнаружена);
- эндопротеаза – расщепляет пептидные связи;
- экстракт бычьей желчи – энзим животного происхождения, стимулирует моторику кишечника;
- панкреатин – фермент животного происхождения, ускоряет переваривание жиров и белков;
- панкрелипаза – животный фермент, способствует усвоению белков, углеводов и липидов;
- пектиназа – расщепляет полисахариды, содержащиеся во фруктах;
- фитаза – способствует усвоению фитиновой кислоты, кальция, цинка, меди, марганца и других минералов;
- ксиланаза – расщепляет глюкозу из зерновых.
Катализаторы в продуктах
Ферменты имеют решающее значение для здоровья, поскольку помогают организму расщеплять пищевые компоненты до состояния, пригодного для использования питательных веществ. Кишечник и поджелудочная железа производят широкий спектр ферментов. Но кроме этого, многие из полезных веществ, способствующих пищеварению, содержатся также и в некоторых продуктах.
Например, абрикосы содержат в себе смесь полезных энзимов, в том числе инвертазу, которая отвечает за расщепление глюкозы и способствует быстрому высвобождению энергии.
Натуральным источником липазы (способствует более быстрому перевариванию липидов) может послужить авокадо. В организме это вещество производит поджелудочная железа. Но дабы облегчить жизнь этому органу, можно побаловать себя, например, салатом с авокадо – вкусно и полезно.
Кроме того, что банан, пожалуй, самый известный источник калия, он также поставляет в организм амилазу и мальтазу. Амилаза содержится также в хлебе, картофеле, крупах. Мальтаза способствует расщеплению мальтозы, так называемого солодового сахара, который в обилии представлен в пиве и кукурузном сиропе.
Другой экзотический фрукт – ананас содержит в себе целый набор энзимов, в том числе и бромелайн. А он, согласно некоторым исследованиям, еще и обладает противораковыми и противовоспалительными свойствами.
Экстремофилы и промышленность
Экстремофилы – это вещества, способны сохранять жизнедеятельность в экстремальных условиях.
Живые организмы, а также ферменты, позволяющие им функционировать, были найдены в гейзерах, где температура близка к точке кипения, и глубоко во льдах, а также в условиях крайней солености (Долина Смерти в США). Кроме того, ученые находили энзимы, для которых уровень рН, как оказалось, также не принципиальное требование для эффективной работы. Исследователи с особым интересом изучают ферменты-экстремофилы, как вещества, которые могут быть широко использованы в промышленности. Хотя и сегодня энзимы уже нашли свое применение в индустрии как биологически и экологически чистые вещества. К применению энзимов прибегают в пищевой промышленности, косметологии, производстве бытовой химии.
- Коровкин Б. Ф. – Ферменты в жизни человека / Б. Ф. Коровкин. – М.: Медицина, 2016 г. – 770 c.
Специальность: инфекционист, гастроэнтеролог, пульмонолог .
Общий стаж: 35 лет .
Образование: 1975-1982, 1ММИ, сан-гиг, высшая квалификация, врач-инфекционист .
Читайте также:

