Характеристики атомного ядра кратко
Обновлено: 05.07.2024
Предложенная Э. Резерфордом в \(1911\) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более \(99,96\) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов . Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
К элементарным частицам относятся также электроны (\(e\)), которые образуют электронную оболочку атома.
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 1 1840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд \(+1\). Заряд электрона — отрицательный и по величине равен заряду протона: \(–\)\(1\).

где mе — масса электрона, а.е.м. — атомная единица массы. Значение массы протона приведено в энергетических единицах как принято в ядерной физике.
Протон имеет спин s = 1/2 и собственный магнитный момент


где mя — ядерный магнетон (единица, в которой измеряют магнитные моменты нуклонов):
Ядерный магнетон в 1836 раз меньше магнетона Бора, т. е. собственный магнитный момент протона в 660 раз меньше магнитного момента электрона.

Нейтрон (n). Его электрический заряд равен нулю, а масса близка к массе протона:
что на 0,14% или 2,5 mе больше массы протона.
Атомная единица массы равна 1/12 массы нейтрального атома 12 С, т. е. 1 а.е.м. = 1,66·10 -24 г или 931,50 МэВ.
Спин нейтрона s = 1/2 и, несмотря на отсутствие электрического заряда, нейтрон имеет магнитный момент
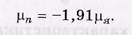
В свободном состоянии нейтрон нестабилен и самопроизвольно распадается, превращаясь в протон и испуская электрон и еще одну частицу, нейтрино (v):
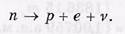
Период полураспада (время, за которое распадается половина первоначального количества нейтронов) равно примерно 12 мин.
Характеристики атомного ядра. Основными величинами, характеризующими атомное ядро, являются зарядовое Z и массовое А числа. Число Z равно количеству протонов в ядре и определяет его электрический заряд Ze. Его также называют атомным номером. Массовое число А определяет число нуклонов в ядре. Число нейтронов в ядре
Символически эти характеристики ядра обозначают так:
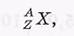
где под X имеется в виду химический символ элемента, которому принадлежит данное ядро, например, Н,Hе,U и т. д.
Конкретные атомы с данным числом протонов и нейтронов в ядре принято называть нуклидами. Нуклиды с одинаковым числом протонов (т. е. принадлежащие одному химическому элементу) называют изотопами.
Атомы изотопов обладают практически очень близкими физико-химическими свойствами. Это связано с тем, что на строение электронной оболочки атома ядро влияет в основном только своим электрическим полем. У изотопов эти поля одинаковы, за исключением некоторых случаев. Сильнее всего это различие у трех нуклидов:Н,Н и H, ядра которых также существенно отличаются друг от друга. Поэтому этим трем нуклидам присвоены разные названия — соответственно обычный водород, дейтерий и тритий, а ядра дейтерия и трития — дейтрон (d) и тритон (t).
У разных атомов число изотопов различно, среди них имеются стабильные и радиоактивные.
Размеры ядер. У атомного ядра (как и у всякой квантовой системы) нет четко определенной границы. В экспериментах по рассеянию электронов и нуклонов на ядрах установлено, что в каждом ядре имеется внутренняя область, в которой плотность ρ ядерного вещества практически постоянна, и
поверхностный слой, где эта плотность падает до нуля. Типичное распределение концентрации нуклонов в зависимости от расстояния до центра
ядра, т. е. п(г) показано на рисунке
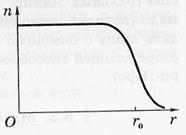
где rо — радиус ядра — расстояние от центра ядра, на котором концентрация нуклонов падает в два раза.
В первом приближении ядро можно считать сферическим радиуса
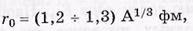
где 1 фм = 10 -13 см. Из этой формулы вытекает важный вывод: масса ядра, определяемая массовым числом А, пропорциональна его объему V, поскольку V ~ г~ А. Следовательно, плотность вещества во всех ядрах примерно одинакова и, как показывает расчет, равна ρ 2·1014 г/см 3 .
Масса и энергия связи ядра
Масса ядра не является аддитивной величиной: она не равна сумме масс образующих ядро нуклонов. Причиной является сильное взаимодействие нуклонов в ядре. Из-за этого взаимодействия для полного разделения ядра на отдельные свободные нуклоны необходимо произвести минимальную работу, которая и определяет энергию связи ядра Есв. Наоборот, при образовании ядра из свободных нуклонов эта энергия выделяется (в виде, например, электромагнитного излучения).
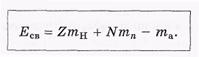
Для упрощения расчетов вводят понятие дефект массы как разность между массой (в а.е.м.) и массовым числом А ядра или нуклона: = m-А.

где N = А-Z. Соответственно и в таблицах приводят не массы нуклидов, а их дефекты масс.
Удельная энергия связи. Так называют энергию связи, приходящуюся в среднем на один нуклон, т.е. Есв/А. Эта величина характеризует меру прочности ядра: чем больше Есв/А, тем ядро прочнее.
Энергия связи электронов в атомах порядка 10 эВ, что пренебрежимо мало с величиной удельной энергии связи ядра.
Удельная энергии связи Есв/А зависит от массового числа А. График соответствующей зависимости показан на рисунке.
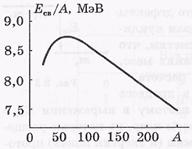
Удельная энергия связи ядер почти не зависит от
массового числа А и равна примерно 8 МэВ. Приближенная независимость удельной энергии связи от А означает, что ядерные силы обладают свойством насыщения. Оно заключается в том, что каждый нуклон взаимо-действует только с ограниченным числом соседних нуклонов.
Отсюда также следует, что ядерные силы являются короткодействующими с радиусом порядка среднего расстояния между нуклонами в ядре (~10 -13 см).
Наиболее прочными являются ядра с массовыми числами А~ 50÷60, т. е. элементов от Сг до Zn.
Состав ядра. Экспериментально установлено, что атомное ядро состоит из протонов и нейтронов. Эти частицы называют нуклонами.
Протон (р) обладает положительным зарядом е и массой

где mе — масса электрона, а.е.м. — атомная единица массы. Значение массы протона приведено в энергетических единицах как принято в ядерной физике.
Протон имеет спин s = 1/2 и собственный магнитный момент


где mя — ядерный магнетон (единица, в которой измеряют магнитные моменты нуклонов):
Ядерный магнетон в 1836 раз меньше магнетона Бора, т. е. собственный магнитный момент протона в 660 раз меньше магнитного момента электрона.

Нейтрон (n). Его электрический заряд равен нулю, а масса близка к массе протона:
что на 0,14% или 2,5 mе больше массы протона.
Атомная единица массы равна 1/12 массы нейтрального атома 12 С, т. е. 1 а.е.м. = 1,66·10 -24 г или 931,50 МэВ.
Спин нейтрона s = 1/2 и, несмотря на отсутствие электрического заряда, нейтрон имеет магнитный момент
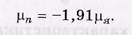
В свободном состоянии нейтрон нестабилен и самопроизвольно распадается, превращаясь в протон и испуская электрон и еще одну частицу, нейтрино (v):
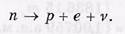
Период полураспада (время, за которое распадается половина первоначального количества нейтронов) равно примерно 12 мин.
Характеристики атомного ядра. Основными величинами, характеризующими атомное ядро, являются зарядовое Z и массовое А числа. Число Z равно количеству протонов в ядре и определяет его электрический заряд Ze. Его также называют атомным номером. Массовое число А определяет число нуклонов в ядре. Число нейтронов в ядре
Символически эти характеристики ядра обозначают так:
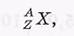
где под X имеется в виду химический символ элемента, которому принадлежит данное ядро, например, Н,Hе,U и т. д.
Конкретные атомы с данным числом протонов и нейтронов в ядре принято называть нуклидами. Нуклиды с одинаковым числом протонов (т. е. принадлежащие одному химическому элементу) называют изотопами.
Атомы изотопов обладают практически очень близкими физико-химическими свойствами. Это связано с тем, что на строение электронной оболочки атома ядро влияет в основном только своим электрическим полем. У изотопов эти поля одинаковы, за исключением некоторых случаев. Сильнее всего это различие у трех нуклидов:Н,Н и H, ядра которых также существенно отличаются друг от друга. Поэтому этим трем нуклидам присвоены разные названия — соответственно обычный водород, дейтерий и тритий, а ядра дейтерия и трития — дейтрон (d) и тритон (t).
У разных атомов число изотопов различно, среди них имеются стабильные и радиоактивные.
Размеры ядер. У атомного ядра (как и у всякой квантовой системы) нет четко определенной границы. В экспериментах по рассеянию электронов и нуклонов на ядрах установлено, что в каждом ядре имеется внутренняя область, в которой плотность ρ ядерного вещества практически постоянна, и
поверхностный слой, где эта плотность падает до нуля. Типичное распределение концентрации нуклонов в зависимости от расстояния до центра
ядра, т. е. п(г) показано на рисунке

где rо — радиус ядра — расстояние от центра ядра, на котором концентрация нуклонов падает в два раза.
В первом приближении ядро можно считать сферическим радиуса
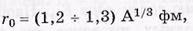
где 1 фм = 10 -13 см. Из этой формулы вытекает важный вывод: масса ядра, определяемая массовым числом А, пропорциональна его объему V, поскольку V ~ г~ А. Следовательно, плотность вещества во всех ядрах примерно одинакова и, как показывает расчет, равна ρ 2·1014 г/см 3 .
Масса и энергия связи ядра
Масса ядра не является аддитивной величиной: она не равна сумме масс образующих ядро нуклонов. Причиной является сильное взаимодействие нуклонов в ядре. Из-за этого взаимодействия для полного разделения ядра на отдельные свободные нуклоны необходимо произвести минимальную работу, которая и определяет энергию связи ядра Есв. Наоборот, при образовании ядра из свободных нуклонов эта энергия выделяется (в виде, например, электромагнитного излучения).
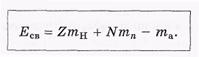
Для упрощения расчетов вводят понятие дефект массы как разность между массой (в а.е.м.) и массовым числом А ядра или нуклона: = m-А.
где N = А-Z. Соответственно и в таблицах приводят не массы нуклидов, а их дефекты масс.
Удельная энергия связи. Так называют энергию связи, приходящуюся в среднем на один нуклон, т.е. Есв/А. Эта величина характеризует меру прочности ядра: чем больше Есв/А, тем ядро прочнее.
Энергия связи электронов в атомах порядка 10 эВ, что пренебрежимо мало с величиной удельной энергии связи ядра.
Удельная энергии связи Есв/А зависит от массового числа А. График соответствующей зависимости показан на рисунке.

Удельная энергия связи ядер почти не зависит от
массового числа А и равна примерно 8 МэВ. Приближенная независимость удельной энергии связи от А означает, что ядерные силы обладают свойством насыщения. Оно заключается в том, что каждый нуклон взаимо-действует только с ограниченным числом соседних нуклонов.
Отсюда также следует, что ядерные силы являются короткодействующими с радиусом порядка среднего расстояния между нуклонами в ядре (~10 -13 см).
Наиболее прочными являются ядра с массовыми числами А~ 50÷60, т. е. элементов от Сг до Zn.
Основными характеристиками атомных ядер являются электрический заряд, масса, спин, энергия связи и так далее.
Заряд ядра
Ядро каждого из атомов обладает положительным зарядом. В качестве носителя положительного заряда выступает протон. По той причине, что заряд протона численно эквивалентен заряду электрона e , можно записать, что заряд ядра элемента равен + Z e ( Z выражает собой целое число, которое указывает на порядковый номер химического элемента в периодической системе химических элементов Д. И. Менделеева). Значение Z также характеризует число протонов, входящих в состав ядра и количество электронов в атоме. Именно из-за этого его определяют как атомный номер ядра. Электрический заряд представляет собой одну из основных характеристик атомного ядра, от которой зависят оптические, химические и иные свойства атомов.
Масса ядра
Существует также другая значимая характеристика ядра, а именно масса. Массу атомов и ядер принято выражать в атомных единицах массы (а.е.м.), в качестве атомной единицы массы выступает 1 12 массы нуклида углерода C 6 12 :
где N A = 6 , 022 · 10 23 м о л ь - 1 обозначает число Авогадро.
Кроме того, есть другой способ выражения атомной массы: исходя из соотношения Эйнштейна E = m c 2 , ее выражают в единицах энергии. По той причине, что масса протона m p = 1 . 00728 а . е . м . = 938 , 28 М э В , масса нейтрона m n = 1 . 00866 а . е . м . = 939 , 57 М э В , а масса электрона m e = 5 , 49 ⋅ 10 - 4 а . е . м . = 0 , 511 М э В ,
Из приведенных выше значений видно, что масса электрона несущественно мала, если сравнивать ее с массой ядра, поэтому масса ядра практически эквивалентна массе всего атома и отлична от целых чисел.
Масса ядра, которая выражается в а . е . м . и округляется до целого числа носит название массового числа и обозначается с помощью буквы A . Она характеризует количество нуклонов, находящихся в составе ядра.
Количество нейтронов в ядре эквивалентно N = A − Z . В качестве обозначения ядер используют символ X Z A , в котором X определяется как химический символ этого элемента.
Атомные ядра, обладающие одинаковым числом протонов, однако при этом отличающимися друг от друга массовыми числами, носят название изотопов.
В некоторых элементах количество стабильных и нестабильных изотопов достигает десятков, в качестве примера, уран обладает 14 изотопами: от U 92 227 до U 92 240 . Большая часть химических элементов, которые существуют в природе, являются смесью нескольких изотопов. Как раз наличие изотопов объясняет следующее явление: некоторые природные элементы обладают массой, которая является отличной от целых чисел. В качестве примера рассмотрим природный хлор, который состоит из 75 % C 17 35 l и 24 % C 17 37 l , а его атомная масса эквивалентна 35 , 5 а . е . м . В большей части атомов, исключая водород, изотопы обладают практически равными физическими и химическими свойствами. Однако, за своими, исключительно ядерными свойствами, изотопы значительно отличаются друг от друга. Какие-то из них могут представлять собой стабильные изотопы, а другие – радиоактивные.
Ядра с эквивалентными массовыми числами, но отличающимися значениями Z носят название изобар, в качестве примера, A 18 40 r , C 20 40 a .
Ядра с одинаковым числом нейтронов определяют как изотоны.
Размер атомного ядра
Принимая форму атомного ядра приблизительно сферической, мы имеем возможность ввести понятие его радиуса R . Обратим внимание на то, что в некоторых ядрах есть небольшое отклонение от симметрии в распределении электрического заряда. Более того, атомные ядра представляют собой не статические, а динамические системы, и понятие радиуса ядра нельзя представлять как радиус шара. Именно из-за этого факта, в качестве размеров атомного ядра нужно принимать ту область, в которой проявляются ядерные силы. В процессе создания количественной теории рассеивания α -частиц Э. Резерфорд исходил из тех предположений, что атомное ядро и α - частица взаимодействуют по закону Кулона, Другими словами из того, что электрическое поле вокруг ядра обладает сферической симметрией.
Это работает в отношении α - частиц, обладающих достаточно малым значением энергии E . При этом частица не имеет возможности преодолеть кулоновский потенциальный барьер и в последствии не достигает области, в которой наблюдается действие ядерных сил. Одновременно с повышением энергии частицы до некоторого граничного значения E г р , α -частица достигает данной границы. В таком случае в рассеянии α -частиц возникает некоторое отклонение от формулы Резерфорда.
Опытным путем было определено, что радиус R ядра является зависимым от числа нуклонов, которые входят в состав ядра.
Размеры ядер определяют экспериментальным путем по рассеянию протонов, быстрых нейтронов или же электронов высоких энергий. Существует также целый список иных косвенных способов получения значений размеров ядер. Они основываются:
- на связи времени жизни α - радиоактивных ядер с энергией выпущенных ими α - частиц;
- на оптических свойствах, носящих название мезоатомов, в которых один из электронов временно захвачен мюоном;
- на сравнении энергий связи парных зеркальных атомов.
Энергия связи. Дефект масс ядер
Величину ∆ m , что определяет разницу масс между массой нуклонов, которые формируют ядро, и массой ядра, называют дефектом массы ядра.
Важные сведения о свойствах ядра могут быть получены даже при отсутствии знаний о подробностях взаимодействия между нуклонами ядра, на основании закона сохранения энергии и закона пропорциональности массы и энергии. Поскольку в результате каждого изменения массы ∆ m происходит соответствующее изменение энергии ∆ E ( ∆ E = ∆ m c 2 ) , то при образовании ядра выделяется некоторое количество энергии. Исходя из закона сохранения энергии можно сделать вывод о том, что ровно такое же количество энергии необходимо для того, чтобы разделить ядро на составляющие его элементы, другими словами отдалить нуклоны друг от друга на такие расстояния, при которых взаимодействия между ними не происходит. Данную энергию определяют как энергию связи ядра.
Заметим, что данная формула довольно неудобная в применении, так как в таблицах приводиться не массы ядер, а массы, которые относятся к массам нейтральных атомов. По этой причине ради удобства вычислений формулу преобразуют таким образом, чтобы в нее входили не массы атомов, а массы ядер. Для достижения этой цели в правой части формулы добавим и отнимем массу Z электронов ( m e ) . В таком случае E с в = Z m p + m e + A - Z m n - m я + Z m e c 2 = Z m H 1 1 + A - Z m n - m a c 2 — масса атома водорода, m a — масса атома.
В ядерной физике энергию зачастую выражают в мегаэлектрон-вольтах ( М э В ) . Если речь идет о практическом применении ядерной энергии, то ее измеряют в джоулях. В случае сравнения энергии двух ядер используют массовую единицу энергии -- соотношение между массой и энергией ( E = m c 2 ) . Массовая единица энергии ( l e ) равняется энергии, что соответствует массе в одну а . е . м . Она равняется 931 , 502 М э В .

Кроме энергии, важное значение имеет удельная энергия связи ядра — энергия связи, которая припадает на один нуклон: ω = E c в / A . Эта величина меняется сравнительно медленно по сравнению со сменой массового числа A , имея почти постоянную величину 8 . 6 М э В в средней части периодической системы и уменьшается до ее краев.
Дефект массы
Энергия связи в М э В : E с в = ∆ m · 931 , 502 = 0 , 030359 · 931 , 502 = 28 , 3 М э В ;
§1 Заряд и масса, атомных ядер
Важнейшими характеристиками ядра являются его заряд и масса М.
Z - заряд ядра определяется количеством положительных элементарных зарядов сосредоточенных в ядре. Носителем положительного элементарного заряда р = 1,6021·10 -19 Кл в ядре является протон. Атом в целом нейтрален и заряд ядра определяет одновременно число электронов в атоме. Распределение электронов в атоме по энергетическим оболочкам и подоболочкам существенно зависит от их общего числа в атоме. Поэтому заряд ядра в значительной мере определяет распределение электронов по их состояниям в атоме и положение элемента в периодической системе Менделеева. Заряд ядра равен q я = z · e , где z -зарядовое число ядра, равное порядковому номеру элемента в системе Менделеева.

Масса атомного ядра практически совпадает с массой атома, потому что масса электронов всех атомов, кроме водородного, составляет примерно 2,5· 10 -4 массы атомов. Массу атомов выражают в атомных единицах массы (а.е.м.). За а.е.м. принята1/12 масса атома углерода .
1 ае.м. =1,6605655(86)·10 -27 кг.
Изотопами, называются разновидности атомов данного химического элемента, обладающие одинаковым зарядом, но различающееся массой.

Целое число ближайшее к атомной массе, выраженной в а.е. м . называется массовым число м и обозначается буквой А. Обозначение химического элемента: А - массовое число, X - символ химического элемента, Z -зарядовое число - порядковый номер в таблице Менделеева ( ):
Бериллий ; Изотопы: , ', .


где А - массовое число.
§2 Состав ядра

Ядро атома водорода называется протоном

m протона = 1,00783 а.е.м. , .
Схема атома водорода
В 1932 г. была открыта частица названная нейтроном, обладающая массой близкой к массе протона ( m нейтрона = 1,00867 а.е.м.) и не имеющая электрического заряда. Тогда же Д.Д. Иваненко сформулировал гипотезу о протонно - нейтроном строении ядра: ядро состоит из протонов и нейтронов и их сумма равна массовому числу А. 3арядовое число Z определяет число протонов в ядре, число нейтронов N =А – Z .
§3 Энергия связи ядра. Дефект массы. Ядерные силы
Ядерные частицы - протоны и нейтроны - прочно удерживаются внутри ядра, поэтому между ними действуют очень большие силы притяжения, способные противостоять огромным силам отталкивания между одноименно заряженными протонами. Эти особые силы, возникающие на малых расстояниях между нуклонам, называются ядерными силами. Ядерные силы не являются электростатическими (кулоновскими).
Изучение ядра показало, что действующие между нуклонами ядерные силы обладают следующими особенностями:
а) это силы короткодействующие - проявляющееся на расстояниях порядка 10 -15 м и резко убывающие даже при незначительном увеличения расстояния;
б) ядерные силы не зависят от того, имеет ли частица (нуклон) заряд - зарядовая независимость ядерных сил. Ядерные силы, действующие между нейтроном и протоном, между двумя нейтронами, между двумя протонами равны. Протон и нейтрон по отношению к ядерным силам одинаковы.


Измерение масс ядер показывает, что масса покой ядра меньше, чем сумма масс покоя составляющих его нуклонов.

служит мерой энергия связи и называется дефектом массы.
Уравнение Эйнштейна в специальной теории относительности связывает энергию и массу покоя частицы.

В общем случае энергия связи ядра может быть подсчитана по формуле

где Z - зарядовое число (число протонов в ядре);
А - массовое число (общее число нуклонов в ядре);
Дефект массы (Δm) равны.й 1 а.е. м. (а.е.м. - атомная единица массы) соответствует энергий связи (Есв), равной 1 а.е.э. (а.е.э. - атомная единица энергии) и равной 1а.е.м.·с 2 = 931 МэВ.
Изменения ядер при взаимодействии их с отдельными частицами и друг с другом принято называть ядерными реакциями.
Различают следующие, наиболее часто встречающиеся ядерные реакции.
- Реакция превращения . В этом случае налетевшая частица остается в ядре, но промежуточное ядро испускает какую-либо другую частицу, поэтому ядро - продукт отличается от ядра-мишени.


- Реакция радиационного захвата . Налетевшая частица застревает в ядре, но возбужденное ядро испускает избыточную энергию, излучая γ- фотон (используется в работе ядерных реакторов)
Пример реакции захвата нейтронов кадмием


- Рассеяние . Промежуточное ядро испускает частицу, тождественную
с налетевшей, причем может быть:
Упругое рассеяние нейтронов углеродом (используется в реакторах для замедления нейтронов):


- Реакция деления . Это реакция, идущая всегда с выделением энергии. Она является основой для технического получения и использования ядерной энергии. При реакции деления возбуждение промежуточного составного ядра столь велико, что оно делится на два, примерно равных осколка, с выделением нескольких нейтронов.

Если энергия возбуждения невелика, то разделение ядра не происходит, а ядро, потеряв избыток энергии путем испускания γ - фотона или нейтрона, возвратится в нормальное состояние (рис. 1). Но если вносимая нейтроном энергия велика, то возбужденное ядро начинает деформироваться, в нем образуется перетяжка и в результате оно делится на два осколка, разлетающихся с огромными скоростями, при этом испускается два нейтрона (рис. 2).
Цепная реакция - саморазвивающаяся реакция деления. Для осуществления её необходимо, чтобы из вторичных нейтронов, образующихся при одном акте деления, хотя бы один смог вызвать следующий акт деления: (так как некоторые нейтроны могут участвовать в реакциях захвата не вызывая деления) . Количественно условие существования цепной реакции выражает коэффициент размножения

k k = 1 ( m = m кр ) - цепная реакций с постоянным количеством нейтронов (в ядерном реакторе>, k > 1 ( m > m кр ) - ядерные бомбы.
§1 Естественная радиоактивность
Радиоактивность представляет собой самопроизвольное превращение неустойчивых ядер одного элемента в ядра другого элемента. Естественной радиоактивностью называется радиоактивность, наблюдающаяся у существующих в природе неустойчивых изотопов. Искусственной радиоактивностью называется радиоактивность изотопов, полученных в результате ядерных реакций.

Испускание ядрами некоторых химических элементов α-системы двух протонов и двух нейтронов, соединенных воедино (а-частица - ядро атома гелия )


α-распад присущ тяжелым ядрам с А > 200 и Z > 82. При движении в веществе α-частицы производят на своем пути сильную ионизацию атомов (ионизация - отрыв электронов от атома), действуя на них своим электрическим полем. Расстояние, на которое пролетает α-частица в веществе до полной её остановки, называется пробегом частицы или проникающей способностью (обозначается R , [ R ] = м, см). . При нормальных условиях α- частица образует в воздухе 30000 пар ионов на 1 см пути. Удельной ионизацией называется число пар ионов образующихся на 1 см длины пробега. α- частица оказывает сильное биологическое действие.
Правило смещения для α-распада:

а) электронный (β - ): ядро испускает электрон и электронное антинейтрино

б) позитронный (β + ):ядро испускает позитрон и нейтрино

Эта процессы происходят, путем превращения одного вида нуклона в ядре в другой: нейтрона в протон или протона в нейтрон.
Электронов в ядре нет, они образуются в результате взаимного превращения нуклонов.

Позитрон - частица, отличающаяся от электрона только знаком заряда (+е = 1,6·10 -19 Кл)

Из эксперимента следует, что при β - распаде изотопы теряют одинаковое количество энергии. Следовательно, на основании закона сохранения энергии В. Паули предсказал, что выбрасывается еще одна легкая частица, названная антинейтрино. Антинейтрино не имеет заряда и массы. Потери энергии β - частицами при прохождении их через вещество вызываются, главным образом, процессами ионизации. Часть энергии теряется на рентгеновское излучение при торможении β - частицы ядрами поглощающего вещества. Так как β - частицы обладают малой массой, единичным зарядом и очень большими скоростями, то их ионизирующая способность невелика, (в 100 раз меньше, чем у α - частиц), следовательно, проникающая способность (пробег) у β - частиц существенно больше, чем у α - частиц.
β - - распад происходит у естественных и искусственных радиоактивных ядер. β + - только при искусственной радиоактивности.
Правило смещения для β - - распада :


в) К - захват (электронный захват) - ядро поглощает один из электронов, находящихся на оболочке К ( реже L или М ) своего атома, в результате чего один из протонов превращается а нейтрон, испуская при этом нейтрино


Схема К - захвата:
Место е электронной оболочке, освобожденное захваченным электроном, заполняется электронами из вышележащих слоев, в результате чего возникают рентгеновские лучи.
Обычно все типы радиоактивности сопровождаются испусканием γ- лучей. γ-лучи - это электромагнитное излучение, обладающее длинами волн от одного до сотых долей ангстрем λ’=~ 1-0,01 Å=10 -10 -10 -12 м. Энергия γ-лучей достигает миллионов эВ.
Ядро, испытывающее радиоактивный распад, как правило, оказывается возбужденным, н его переход в основное состояние сопровождается испусканием γ – фотона. При этом энергия γ-фотона определяется условием

Е2- энергия в возбужденном состоянии;
Е1 - энергия в основном состоянии.
Поглощение γ-лучей веществом обусловлено тремя основными процессами:
- фотоэффектом (при hv
- образованием пар электрон – позитрон;


Поглощение γ-лучей происходит по закону Бугера:

где μ- линейный коэффициент ослабления, зависящий от энергий γ - лучей и свойств среды;
І 0 - интенсивность падающего параллельного пучка;
I - интенсивность пучка после прохождения вещества толщиной х см.
γ-лучи - одно из наиболее проникающих излучений. Для наиболее жестких лучей ( hνmax ) толщина слоя половинного поглощения равна в свинце 1,6 см, в железе - 2,4 см, в алюминии - 12 см, в земле - 15 см.
§2 Основной закон радиоактивного распада.
Число распавшихся ядер dN пропорционально первоначальному числу ядер N и времени распада dt , dN ~ N dt . Основной закон радиоактивного распада в дифференциальной форме:

Коэффициент λ называется постоянной распада для данного вида ядер. Знак “-“ означает, что dN должно быть отрицательным, так как конечное число не распавшихся ядер меньше начального.

следовательно, λ характеризует долю ядер, распадающихся за единицу времени, т е. определяет скорость радиоактивного распада. λ не зависит от внешних условий, а определяется лишь внутренними свойствами ядер. [λ]=с -1 .
Основной закон радиоактивного распада в интегральной форме

где N 0 - первоначальное число радиоактивных ядер при t =0;
N - число не распавшихся ядер в момент времени t ;
λ - постоянная радиоактивного распада.
О скорости распада на практике судят используя не λ, а Т1/2 - период полураспада - время, за которое распадается половина первоначального количества ядер. Связь Т1/2 и λ

Т1/2 U 238 = 4,5·10 6 лет, Т1/2 Ra = 1590 лет, Т1/2 Rn = 3,825 сут. Число распадов в единицу времени А = - dN / dt называется активностью данного радиоактивного вещества.



[А] = 1Беккерель = 1распад/1с;
[А] = 1Ки = 1Кюри= 3,7·10 10 Бк.



Закон изменения активности

где А0 =λ N 0 - начальная активность в момент времени t = 0;
Атомное ядро — это центральная часть атома, состоящая из протонов и нейтронов (которые вместе называются нуклонами ).
Атомное ядро — это центральная часть атома, состоящая из протонов и нейтронов (которые вместе называются нуклонами).
Ядро было открыто Э. Резерфордом в 1911 г. при исследовании прохождения α-частиц через вещество. Оказалось, что почти вся масса атома (99,95%) сосредоточена в ядре. Размер атомного ядра имеет порядок величины 10 -1 3 -10 - 12 см, что в 10 000 раз меньше размера электронной оболочки.
Предложенная Э. Резерфордом планетарная модель атома и экспериментальное наблюдение им ядер водорода, выбитых α -частицами из ядер других элементов (1919-1920 гг.), привели ученого к представлению о протоне. Термин протон был введен в начале 20-х гг XX ст.
Протон (от греч. protons — первый, символ p) — стабильная элементарная частица, ядро атома водорода.
Протон — положительно заряженная частица, заряд которой по абсолютной величине равен заряду электрона e= 1,6 · 10 -1 9 Кл. Масса протона в 1836 раз больше массы электрона. Масса покоя протона mр= 1,6726231 · 10 -27 кг = 1,007276470 а.е.м.
Второй частицей, входящей в состав ядра, является нейтрон.
Нейтрон (от лат. neuter — ни тот, ви другой, символ n) — это элементарная частица, не имеющая заряда, т. е. нейтральная.
Масса нейтрона в 1839 раз превышает массу электрона. Масса нейтрона почти равна (незначительно больше) массе протона: масса покоя свободного нейтрона mn = 1,6749286 · 10 -27 кг = 1,0008664902 а.е.м. и превосходит массу протона па 2,5 массы электрона. Нейтрон, наряду с протоном под общим названием нуклон входит в состав атомных ядер.

Нейтрон был открыт в 1932 г. учеником Э. Резерфорда Д. Чедвигом при бомбардировке бериллия α-частицами. Возникающее при этом излучение с большой проникающей способностью (преодолевало преграду из свинцовой пластины толщиной 10-20 см) усиливало свое действие при прохождении через парафиновую пластину (см. рисунок). Оценка энергии этих частиц по трекам в камере Вильсона, сделанная супругами Жолио-Кюри, и дополнительные наблюдения позволили исключить первоначальное предположение о том, что это γ-кванты. Большая проникающая способность новых частиц, названных нейтронами, объяснялась их электронейтральностью. Ведь заряженные частицы активно взаимодействуют с веществом и быстро теряют свою энергию. Существование нейтронов было предсказано Э. Резерфордом за 10 лет до опытов Д. Чедвига. При попадании α-частиц в ядра бериллия происходит следующая реакция:


Здесь — символ нейтрона; заряд его равен нулю, а относительная атомная масса приблизительно равна единице. Нейтрон — нестабильная частица: свободный нейтрон за время ~ 15 мин. распадается на протон, электрон и нейтрино — частицу, лишенную массы покоя.
После открытия Дж. Чедвиком нейтрона в 1932 г. Д. Иваненко и В. Гейзенберг независимо друг от друга предложили протонно-нейтронную (нуклонную) модель ядра. Согласно этой модели, ядро состоит из протонов и нейтронов. Число протонов Z совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
Заряд ядра Q определяется числом протонов Z, входящих в состав ядра, и кратен абсолютной величине заряда электрона e:
Число Z называется зарядовым числом ядра или атомным номером.
Массовым числом ядра А называется общее число нуклонов, т. е. протонов и нейтронов, содержащихся в нем. Число нейтронов в ядре обозначается буквой N. Таким образом, массовое число равно:
Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону — нулевое значение.
Представлению о составе ядра содействовало также открытие изотопов.
Изотопы (от греч. isos — равный, одинаковый и topoa — место) — это разновидности атомов одного и того же химического элемента, атомные ядра которых имеют одинаковое число протонов (Z) и различное число нейтронов (N).
Изотопами называются также ядра таких атомов. Изотопы являются нуклидами одного элемента. Нуклид (от лат. nucleus — ядро) — любое атомное ядро (соответственно атом) с заданными числами Z и N. Общее обозначение нуклидов имеет вид ……. где X — символ химического элемента, A = Z + N — массовое число.
Изотопы занимают одно и то же место в Периодической системе элементов, откуда и произошло их название. По своим ядерным свойствам (например, по способности вступать в ядерные реакции) изотопы, как правило, существенно отличаются. Химические (b почти в той же мере физические) свойства изотопов одинаковы. Это объясняется тем, что химические свойства элемента определяются зарядом ядра, поскольку именно он влияет на структуру электронной оболочки атома.
Исключением являются изотопы легких элементов. Изотопы водорода 1 Н — протий, 2 Н— дейтерий, 3 Н — тритий столь сильно отличаются по массе, что и их физические и химические свойства различны. Дейтерий стабилен (т.е. не радиоактивен) и входит в качестве небольшой примеси (1 : 4500) в обычный водород. При соединении дейтерия с кислородом образуется тяжелая вода. Она при нормальном атмосферном давлении кипит при 101,2 °С и замерзает при +3,8 ºС. Тритий β-радиоактивен с периодом полураспада около 12 лет.
У всех химических элементов имеются изотопы. У некоторых элементов имеются только нестабильные (радиоактивные) изотопы. Для всех элементов искусственно получены радиоактивные изотопы.
Изотопы урана. У элемента урана есть два изотопа — с массовыми числами 235 и 238. Изотоп составляет всего 1/140 часть от более распространенного .
Читайте также:

