Фосфатидилинозитоловая система кратко и понятно
Обновлено: 05.07.2024
В этой системе активация рецептора в результате взаимодействия с лигандом вызывает в свою очередь активацию фосфоинозитидазы (фосфолипазы С) с последующим гидролизом фосфолипидов мембраны и образованием фосфатидил-инозитола-4, 5-дифосфата, который служит источником для образования двух посредников: инозитол-1,4,5-трифосфата и диацилглицерола.
А. Инозитол-1, 4, 5-трифосфат дает начало следующей цепи процессов:
выход ионов кальция из эндоплазматического ретикулума
(рецепторный белок для кальция)
фосфорилирование клеточных белков
Б. Диацилглицерол с участием кальция активирует протеинкиназу С, модулирующую проницаемость ионных каналов мембран, и является источником эйкозаноидов (простагландинов и лейкотриенов), которые могут быть вторичными мессенджерами для внутриклеточных процессов и участвуют в межклеточной сигнализации.
Таким образом, практически все эффекты этой системы связаны с участием ионов кальция, которые играют роль универсального вторичного мессенджера.
Через фосфатидилинозитоловую систему осуществляется действие ангиотензина-2 на синтез альдостерона, действие факторов, активирующих лейкоциты, и другие эффекты.
3. Тирозиновые протеинкиназы
Некоторые клеточные рецепторы содержат тирозинкиназную активность в своем составе. Лиганд, связываясь с внеклеточным доменом рецептора, приводит к аллостерической активации внутриклеточного белкового домена с тирозинкиназной активностью, которая опосредует все биологические эффекты. В частности, этот класс энзимов может опосредовать процессы роста клеток. Мембранные рецепторы для инсулина, инсулиноподобного фактора роста, эпидермального фактора роста, колоний-стимулирующего фактора макрофагов могут быть примером использования такого механизма.
Внутриклеточная рецепция
Различают два вида внутриклеточной рецепции: цитозольный и ядерный.
1. Цитозольный тип рецепции характерен для стероидных гормонов, хорошо растворимых в липидах. Они взаимодействуют с мембраной, вызывая специфические конформационные и функциональные изменения, и проникают внутрь клетки. Дальнейшая последовательность событий:
взаимодействие гормона со специфическим рецептором
транслокация комплекса в ядро и связывание с хроматином
регуляция транскрипции специфических генов
2. Ядерный тип рецепции установлен для тиреоидных гормонов. После проникновения через цитоплазматическую мембрану они достигают ядра, взаимодействуют с рецептором и усиливают экспрессию генетической информации. При этом увеличивается синтез специфических нуклеиновых кислот, кодирующих энзимы и обеспечивающих специфичность биологического ответа.
Особенности тканевой реактивности и резистентности высших организмов зависят также от количества в ткани сульфгидрильных групп (глутатион, цистеин и др.), которые связаны с процессами окисления и активируют ферменты, участвующие в процессах роста и размножения. От количества сульфгидрильных групп зависит чувствительность тканей к действию химических веществ и их устойчивость к этому действию.
Многие гормоны (амины, пептиды, белки, простагландины F2α, тромбоксан А2, лейкотриены) через Gq-белок включают фосфотидилинозитольную систему. Здесь работают липидкиназы, они вводят фосфат в 4 и 5 положение инозитола с образованием ФИФ2(фосфатидилбисфосфата) и ФИ(3)киназы (фосфорилируют 3 положение с образованием фосфатидилтрисфосфата – ФИФ3). Липидкиназы отличаются от ПК не только субстратом, но и тем, что образуют вторые посредники, а не реализуют их действие.. При связывании гормона со своим рецептором через Gq-белок активируется фосфолипаза С (ФЛС). Она гидролизуетФИФ2 с образованием двух вторых посредников: инозитолтрифосфата (ИФ3)и диацилглицерина (ДАГ).
ИФ3мобилизует Са 2+ из ЭПР и увеличивает поступление в цитозоль Са 2+ через медленные кальциевые каналы плазматической мембраны. Он является внутриклеточным посредником ряда гормонов. При мобилизации Са 2+ под действием ИФ3 он связывается со своим рецепторным белком кальмодулином. Комплекс Са 2+ -КМ (кальмодулин) активирует многие цитозольные ферменты либо прямо, либо через КМПК (кальмодулин-зависимую протеинкиназу). Ионы Са 2+ – один из наиболее универсальных вторых посредников. Он необходим для метаболизма, сокращения мышц, пролиферации, активации многих ферментов, секреции желез, возбудимости мембран, агрегации тромбоцитов. Комплекс Са 2+ -КМ проникает в ядро и активирует ядерную КМПК, в результате происходит транскрипция многих генов.
ДАГ при физиологических концентрациях ионов Са 2+ активирует ПКС (транслокация в ядро и ее активирование), фосфорилирующую белки, существенные для экспрессии генов, деления и дифференцировки клеток, воспаления, иммунных реакций, клеточного шока, трансформации клеток. Активаторами ПКС являются промоторы канцерогенеза – форболовые эфиры и вирусы гепатитов В, С и Е, вызывающие рост и деление клеток. Показано улучшение результатов лечения рака молочной железы и легких при добавлении к химиотерапии ингибитора ПКС.
ФИФ3 образуется при активации фермента ФИ(3)киназы некоторыми гормонами или другими сигналами (инсулин, лейкотриены, тромбоксаны, продукты распада бактерий). ФИФ3, не выходя из мембраны, запускает каскад своих протеинкиназ, они фосфорилируют белки, а фосфорилированные белки вызывают эффекты.
Для ингибиторных нейромодуляторов ацетилхолина (М-рецепторы), норадреналина и адреналина (a2-рецепторы), дофамина (D2-рецепторы), ГАМК (В-рецепторы), аденозина (А1-рецепторы), опиоидов (m-рецепторы) характерно использование различных Gi-,белок-зависимых механизмов. Это снижение активности АЦ (аденилилциклазы) и уровня цАМФ, ингибирование Са 2+ -каналов со снижением концентрации ионов Са 2+ в цитозоле, открытие К-каналов, вызывающее выход К + из клетки и её гиперполяризацию (торможение). Эти механизмы снижают активность клетки.
Многие гормоны (амины, пептиды, белки, простагландины F2α, тромбоксан А2, лейкотриены) через Gq-белок включают фосфотидилинозитольную систему. Здесь работают липидкиназы, они вводят фосфат в 4 и 5 положение инозитола с образованием ФИФ2(фосфатидилбисфосфата) и ФИ(3)киназы (фосфорилируют 3 положение с образованием фосфатидилтрисфосфата – ФИФ3). Липидкиназы отличаются от ПК не только субстратом, но и тем, что образуют вторые посредники, а не реализуют их действие.. При связывании гормона со своим рецептором через Gq-белок активируется фосфолипаза С (ФЛС). Она гидролизуетФИФ2 с образованием двух вторых посредников: инозитолтрифосфата (ИФ3)и диацилглицерина (ДАГ).
ИФ3мобилизует Са 2+ из ЭПР и увеличивает поступление в цитозоль Са 2+ через медленные кальциевые каналы плазматической мембраны. Он является внутриклеточным посредником ряда гормонов. При мобилизации Са 2+ под действием ИФ3 он связывается со своим рецепторным белком кальмодулином. Комплекс Са 2+ -КМ (кальмодулин) активирует многие цитозольные ферменты либо прямо, либо через КМПК (кальмодулин-зависимую протеинкиназу). Ионы Са 2+ – один из наиболее универсальных вторых посредников. Он необходим для метаболизма, сокращения мышц, пролиферации, активации многих ферментов, секреции желез, возбудимости мембран, агрегации тромбоцитов. Комплекс Са 2+ -КМ проникает в ядро и активирует ядерную КМПК, в результате происходит транскрипция многих генов.

ДАГ при физиологических концентрациях ионов Са 2+ активирует ПКС (транслокация в ядро и ее активирование), фосфорилирующую белки, существенные для экспрессии генов, деления и дифференцировки клеток, воспаления, иммунных реакций, клеточного шока, трансформации клеток. Активаторами ПКС являются промоторы канцерогенеза – форболовые эфиры и вирусы гепатитов В, С и Е, вызывающие рост и деление клеток. Показано улучшение результатов лечения рака молочной железы и легких при добавлении к химиотерапии ингибитора ПКС.
ФИФ3 образуется при активации фермента ФИ(3)киназы некоторыми гормонами или другими сигналами (инсулин, лейкотриены, тромбоксаны, продукты распада бактерий). ФИФ3, не выходя из мембраны, запускает каскад своих протеинкиназ, они фосфорилируют белки, а фосфорилированные белки вызывают эффекты.
Для ингибиторных нейромодуляторов ацетилхолина (М-рецепторы), норадреналина и адреналина (a2-рецепторы), дофамина (D2-рецепторы), ГАМК (В-рецепторы), аденозина (А1-рецепторы), опиоидов (m-рецепторы) характерно использование различных Gi-,белок-зависимых механизмов. Это снижение активности АЦ (аденилилциклазы) и уровня цАМФ, ингибирование Са 2+ -каналов со снижением концентрации ионов Са 2+ в цитозоле, открытие К-каналов, вызывающее выход К + из клетки и её гиперполяризацию (торможение). Эти механизмы снижают активность клетки.
Фосфатидилинозиты. Влияние и обмен фосфатидилинозитов
В последние годы во многих странах мира наблюдается интенсивный рост исследований, связанных с изучением на молекулярном и клеточном уровнях роли фосфоинозитидов и продуктов их метаболизма в процессах нормального функционирования живой клетки. Кроме того, выясняется их участие в малоизученных механизмах возникновения и развития патологических явлений в организме.
Интерес к роли фосфоинозитидов в жизнедеятельности клеток связан с их непосредственным участием в регуляторной, транспортной, энергетической, рецепторной, пролиферативной и других функциях биологических мембран клеток.
В настоящее время доказано, что метаболизм фосфоинозитидов тесно связан со многими физиологически активными веществами, такими как гормоны, нейромедиаторы, простагландины, и что пути метаболизма фосфоинозитидов, вторичных мессенджеров, многократно пересекаются.
Роль метаболизма клеток в контроле скорости регенерации, пролиферации изучается не столь интенсивно, как эффекты биологически активных веществ, однако имеются работы, в которых представлены результаты исследований митогенной стимуляции, стимуляции пролиферации специфической сывороткой и пролиферогенной клеточной трансформации различными вирусами и микробами. Доказано увеличение скорости обмена фосфатидилинозита в клетках, находящихся в состоянии пролиферации, по сравнению с покоящимися клетками того же типа.
В процессах репарации большую роль играет арахидоновая кислота, так как из нее образуются активные метаболиты. Считается, что высвобождение арахидоно-вой кислоты из фосфоинозитидов происходит под действием различных факторов (нейромедиаторы, гормоны, Са-ионофор, механический и электрический стимул), хотя до настоящего времени детали этого процесса окончательно не выяснены.
Участие простагландинов в механизме репарации может состоять в том, что они расширяют микрососуды и повышают их проницаемость в очаге воспаления, вызывают агрегацию тромбоцитов, а также обладают пирогенным свойством.
Ряд исследователей подтверждают существование взаимосвязи между процессами пролиферации клеток и метаболизма фосфоинозитидов, скорость обмена которых в пролиферирующих клетках возрастает в сравнении с другими фосфолипидами, а также участие различных простагландинов в этих процессах.
Таким образом, анализ данных литературы показывает, что фосфоинозитиды и продукты их метаболизма, принимая непосредственное участие в регуляторной, транспортной, энергетической, рецепторной и пластической функциях биологических мембран, играют важную роль в жизнедеятельности клеток. Существование взаимосвязи между процессами пролиферации клеток и метаболизмом фосфоинозитидов, скорость обмена которых в пролиферирующих клетках возрастает, а также участие различных простагландинов в этих процессах служат обоснованием для изучения этих биохимических показателей в целях объективации состояния тканей пародонта и прогнозирования эффективности лечения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Функционирование инозитолфосфатной системы трансмембранной передачи сигнала (рис. 5-42) обеспечивают: R (рецептор), фосфолипаза С, Gр|с — белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля.
Последовательность событий, приводящих к активации фосфолипазы С:
• связывание сигнальной молекулы, например гормона с рецептором (R), вызывает изменение конформации и увеличение сродства к Gр|с-белку.
• образование комплекса [Г][R][Gр|с.-ГДФ] приводит к снижению сродства α-протомера Gр|с -белка к ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ.
• это вызывает диссоциацию комплекса; отделившаяся α-субъединица, связанная с молекулой ГТФ, приобретает сродство к фосфолипазе С.
α-ГТФ взаимодействует с фосфолипазой С и активирует её. Под действием фосфолипазы-С происходит гидролиз липида мембраны фосфатидилинозитол-4,5-бисфосфата(ФИФ2). В ходе гидролиза образуется и выходит в цитозоль гидрофильное вещество инозитол-1,4,5-трифосфат (ИФ3). Другой продукт реакции диацилглицерол (ДАГ) остаётся в мембране и участвует в активации фермента протеинкиназы С (ПКС). инозитол-1,4,5-трифосфат (ИФ3) связывается специфическими центрами Са 2+ -канала мембраны ЭР, это приводит к изменению конформации белка и открытию канала — Са 2+ поступает в цитозоль. В отсутствие в цитозоле ИФ3 канал закрыт.
Активация протеинкиназы С
• Повышение концентрации Са 2+ в цитозоле клетки увеличивает скорость взаимодействия Са 2+ с неактивным цитозольным ферментом протеинкиназой С (ПКС) и белком кальмо-дулином, таким образом сигнал, принятый рецептором клетки, раздваивается.
• На внутренней стороне мембраны образуется ферментативный комплекс — [ПКС][Са 2+ ][ДАГ][ФС] — активная протеинкиназа С, фосфорилируюшая специфические ферменты по серину и треонину.
Участие белка кальмодулина в инозитолфосфатной передаче сигнала
В клетках многих тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са 2+ , он имеет 4 центра для связывания Са 2+ . Комплекс [кальмодулин]-[4 Са 2+ ] не обладает ферментативной активностью, но взаимодействие комплекса с различными белками и ферментами приводит к их активации.
Саморегуляция системы
Как и большинство систем трансмембранной передачи сигналов, инозитолфосфатная система имеет не только механизм усиления, но и механизм подавления сигнала. Присутствующие в цитозоле инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАГ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты, катализирующие восстановление фосфолипида, активируются фосфорилированием протеинкиназой С.
Концентрация Са 2+ в клетке снижается до исходного уровня при действии Са 2+ -АТФ-аз цитоплазматической мембраны и ЭР, а также Na + /Са 2+ -и Н + /Са 2+ -транслоказ (активный антипорт) клеточной и митохондриальной мембран.
Функционирование транслоказ Са 2+ и Са 2+ -АТФ-аз может активироваться:
• комплексом [кальмодулин][4 Са 2+ ];
• протеинкиназой А (фосфорилированием);
• протеинкиназой С (фосфорилированием).
Понижение концентрации Са 2+ в клетке и диаиилглицерола в мембране приводит к изменению конформации протеинкиназы С, снижению её сродства к фосфатидилсерину, фермент диссоциирует в цитозоль (неактивная форма). Фосфорилированные протеинкиназой С ферменты и белки под действием фосфопротеинфосфатазы переходят в дефосфорилированную форму.
К. передача сигнала с помощью ВНУТРИКЛЕТОЧНЫХ РЕЦЕПТОРОВ
Передача сигнала липидорастворимых стероидных гормонов и тироксина возможна только при прохождении этих гормонов через плазматическую мембрану клеток -мишеней (рис. 5-43)

Рис. 5-43. Передача сигнала на внутриклеточные рецепторы.
Последовательность событий, приводящих к активации транскрипции:
• гормон проходит через двойной липидный слой клеточной мембраны.
• взаимодействие гормона с рецептором (R) приводит к изменению конформации рецептора и снижению сродства к белкам-шаперонам, отделяющимся от комплекса гормон-рецептор.
• комплекс гормон-рецептор проходит в ядро, взаимодействует с регуляторной нуклеотидной последовательностью в ДНК — энханером или сайленсером.
• увеличивается (при взаимодействии с энхансером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полимеразы.
• соответственно увеличивается или уменьшается скорость транскрипции структурных генов.
• увеличивается или уменьшается скорость трансляции.
• изменяется количество белков, которые могут влиять на метаболизм и функциональное состояние клетки.
Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуются часы
Однако в большинстве случаев процесс активации какого-либо метаболического процесса находится под контролем не одной, а нескольких систем внутриклеточной сигнализации, поэтому важным фактором ответа клеток служит взаимосвязь этих систем.

Сегодня внедряемся в научные изыскания. Статья будет сложной для прочтения. Я максимально упрощала материал, но проще - некуда. На написание меня как всегда "вдохновила" всеобщая бесконечная жалоба - "слабость, ничего не помогает, ваших капельниц, таблеток хватило на 2 недели. ". Сегодня рассмотрим самый сложный случай дефицита Энергии - дисфункция Митохондрий. Это еще малоизученная и сложная часть медицинской науки. Дисфункция митохондрий может быть врожденная и в нашем (рассматриваемом случае) - приобретенная.
Энергия в нашем организме представлена в следующем виде - молекула АТФ.
АТФ-аденозинтрифосфат, является основным источником энергии для клеток в частности и организма в целом. Представляет собой - эфир аденозина (пурин). Кроме того, является источником синтеза нуклеиновых кислот, для образования структуры ДНК!(наш генетический код)и посредником передачи в клетку гормонально сигнала! Вывод: нехватка АТФ - чревата извращение/недостатком гормонального ответа и не только. АТФ образуется в митохондриях (это маленькие структурные компоненты любой клетки, митохондрия имеет собственную ДНК!, как и ядро клетки. это высокоорганизованная структура ). Вот почему заболевания с нарушением синтеза АТФ - называются митохондриальные дисфункции.
В сутки в организме образуется 40 кг АТФ. Органы с максимальной выработкой АТФ: мозг 22%, печень 22%, мышцы 22 %, сердце 9%, жировая ткань всего - 4%, заметьте - ЩЖ с в этот перечень даже не вошла. Мозг и печень лидеры !
Теперь о самом процессе образования энергии. Смотрим на картинку.
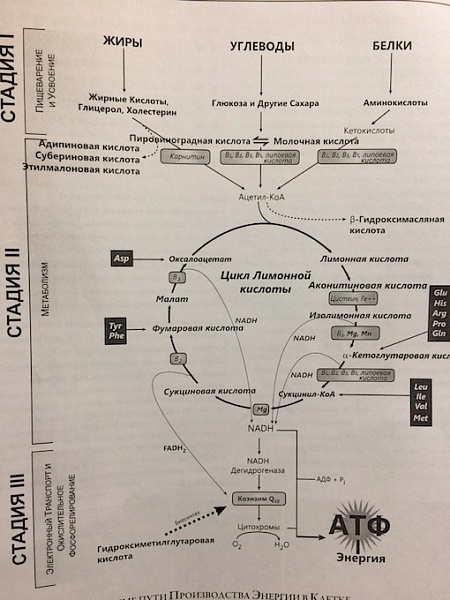
Процесс образования энергии можно разделить на 3 этапа.
1 этап - это получение более простых молекул( в цикл образования энергии) из углеводов(У), жиров(Ж) и белков пищи(Б). Углеводы расщепляются до моносахаров(глюкоза,фруктоза), жиры до жирных кислот, белки до аминокислот. "Расщепление" Б,Ж,У происходит как к кислородной среде(аэробной), так и в бескислородной(анаэробной) среде. Это крайне важно! Так как из анаэробного гликолиза 1 молекулы глюкозы образуется - 2 молекулы АТФ, из аэробного (кислородного) гликолиза 1 молекулы глюкозы - образуются 36 молекул АТФ, из аэробного окисления 1 молекулы жирной кислоты - 146 молекул АТФ, ( жиры и белки в бескислородной среде вообще не расщепляются!, вывод - например, при нелеченной анемии(дефицитО2) снижение веса почти невозможно). Так, и усвоение 1 молекулы глюкозы требует 6 молекул О2, а 1 молекулы жирных кислот -23 молекулы О2. Вывод - жиры основной источник энергии, и всем нужен О2.
2 этапом - образуется из всех молекул У, Ж, Б - АцетилКоА - промежуточный метаболит. Суть этого этапа, что кол-во выработанного АцетилКоА зависит от уровня многих витаминов и микроэлементов (витамина С, группы В, цинка, меди, железа и др). Почему так важно для образования энергии - восполнение дефицита этих элементов!
3 этап - этот самый АцетилКоА поступает в 2 основных биохимических пути выработки АТФ - это цикл Кребса( лимонной кислоты) и цикл окислительного фосфорилирования ( передачи электронов, "дыхательная цепь";), происходит образование НАД- и НАДН+. Связь между этими двумя б/х циклами - и "есть узкое горлышко", "слабое место" в образовании АТФ. И зависит от рН среды клетки - при развитии в/клеточной гипоксии = в/клеточного ацидоза и ухудшается процесс образования АТФ - организм захлебывается в избытке НАДН, а НАДН сопряжен с "утечкой кислорода из клетки"( механизм не буду расшифровывать) и образованием активных(агрессивных) форм кислорода ( свободных радикалов) - а это повреждающие агенты для клетки при образовании в избыточном количестве.
Метаболический ацидоз - это следствие первичного дефицита О2 в организме (сам ацидоз становится причиной вторичного дефицита О2-утечки кислорода). Ацидоз выражается накоплением промежуточного продукта обмена - лактата, избытком Н+(иона водорода), митохондрии "начинают задыхаться и стареть и гибнуть"! А в месте со старением митохондрий - стареет организм, вот почему так молодеют некоторые заболевания - раньше развиваются атеросклероз, б-нь Альцгеймера, сахарный диабет (да-да , это митохондриальное заболевание), рак, артериальная гипертензия, АИТ, синдром хр усталости, даже НЯК и болезнь Крона (как одна из теорий) и др.
Как цикл лимонной кислоты (цикл Кребса) , например, связан с ожирением? - активное поступления с пищей жирных кислот- приводят к истощению транспортных карнитиновых (всем известен для сравнения Карнитин для спорт -питания) систем( переносчиков жирных кислот, их и так немного) и снижения активности работы "дыхательной цепи" , снижается чувствительность тканей к инсулину- развивается многим известная инсулинорезистентость! Исход - метаболическая печалька - метаболический синдром.
Соответственно: причинами снижения синтеза АТФ прежде всего являются дефицит О2!(как бывает в больших городах, где мало зелени. загазованность - продукт сгорания бензина это не О2-а СО2 . люди не выходят из помещений, мало двигаются - "мелкие сосуды закрыты для доступа О2", причинами могут быть болезни органов дыхания и сердечно-сосудистые патологии), ацидоз = "закисление организма" (накопление лактата, избыток Н+), полидефицит витаминов и микроэлементов для улучшения усвоения Ж, Б, У. Для лечение дефицита О2 даже был придуман аппарат - в основе которого интервальная гипоксическая тренировка. Это новая эра в лечении многих патологий.
Как же заподозрить митохондриальные проблемы? Они сложны как для понятия, так и для диагностики.
Из "простых анализов", которые можно набрать любой лаборатории - снижение рН крови, О2, повышение: лактата, СРБ, фибриногена, холестерина, ЛПНП, триглицеридов, гомоцистеина, мочевой кислоты, (клинически - повышение Ад, учащение ЧСС в покое, одышка в покое), снижение ферритина, из редких - снижение глутатиона, витаминов крови, снижение Q10, нарушение в системе антиоксидантов (по крови).
Из более редких , но все же доступных анализов (более специфических) - органические кислоты мочи ( благодаря этому анализу можно определить примерно на каком уровне идет нарушение и чем его скорректировать).
Если патология так сложно выявляемая - "как это лечить?",- спросите вы
Прежде всего меняем образ жизни - улучшаем доставку О2!, бросаем курить! чаще дышим в парке и не только.. Лечим и приводим в ремиссию хронические дыхательные заболевания , восполняем дефицит витаминов и минералов!, добавляем антиоксиданты, сосудистые препараты(!) очень важно улучшить кровоток (слабость всегда сопровождается рассеянностью, снижением памяти и внимания, - правильно, максимальная сосудистая сеть в головном мозге!!), реже добавляем "энергетики" - янтарная кислота, Q10, карнитин, НАДН и др. Я не говорю здесь про врожденные митохондриальные дисфункции - это следствие генетической поломки,а мы говорим сейчас больше о приобретенных причинах. Будем ждать новых научных материалов по этой теме.
Читайте также:

