Формирование третичной структуры белка кратко
Обновлено: 02.07.2024
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).

Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 10 20 . Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.

Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Свойства белков
Купить проверочные работы
по биологии




Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н + определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).

Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакции повышается примерно в 2 раза при повышении температуры на каждые 10 °С. При температуре выше 40 °С белок подвергается денатурации и активность фермента падает. При температуре, близкой к точке замерзания, ферменты инактивируются.
При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.

Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность (пепсин — 2,0, амилаза слюны — 6,8, липаза поджелудочной железы — 9,0). При более высоких или низких значениях рН активность фермента снижается. При резких сдвигах рН фермент денатурирует.
Скорость работы аллостерических ферментов регулируется веществами, присоединяющимися к аллостерическим центрам. Если эти вещества ускоряют реакцию, они называются активаторами, если тормозят — ингибиторами.

Классификация ферментов
По типу катализируемых химических превращений ферменты разделены на 6 классов:
- оксиредуктазы (перенос атомов водорода, кислорода или электронов от одного вещества к другому — дегидрогеназа),
- трансферазы (перенос метильной, ацильной, фосфатной или аминогруппы от одного вещества к другому — трансаминаза),
- гидролазы (реакции гидролиза, при которых из субстрата образуются два продукта — амилаза, липаза),
- лиазы (негидролитическое присоединение к субстрату или отщепление от него группы атомов, при этом могут разрываться связи С–С, С–N, С–О, С–S — декарбоксилаза),
- изомеразы (внутримолекулярная перестройка — изомераза),
- лигазы (соединение двух молекул в результате образования связей С–С, С–N, С–О, С–S — синтетаза).
Классы в свою очередь подразделены на подклассы и подподклассы. В действующей международной классификации каждый фермент имеет определенный шифр, состоящий из четырех чисел, разделенных точками. Первое число — класс, второе — подкласс, третье — подподкласс, четвертое — порядковый номер фермента в данном подподклассе, например, шифр аргиназы — 3.5.3.1.
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Поскольку ни первичная структура, ни типы спиралей или сочетания спиральных и линейных участков полипептидной цепи не дают представления об объеме, форме полипептидной цепи, перед исследователем всегда стоит необходимость определения трехмерной или пространственной конфигурации белка. Основную роль в решении этих задач сыграл рентгеноструктурный анализ с высокой разрешающей способностью. Как было отмечено, метод успешно решает две главные проблемы химии белков: закономерность последовательностей аминокислотных остатков в полипептиде и закономерность конфигурации молекулы белка. Межатомные расстояния в молекулах органических веществ составляют 0,1–0,2 нм, а максимальная разрешающая способность современных аппаратов равна 0,2 нм. Это не позволяет установить местоположение каждого атома, хотя вполне могут быть различимы отдельные сочетания атомов, особенно при введении в молекулу белков атомов тяжелых металлов (последние благодаря своей высокой электронной плотности используются в качестве точек отсчета при математической обработке рентгенограмм).
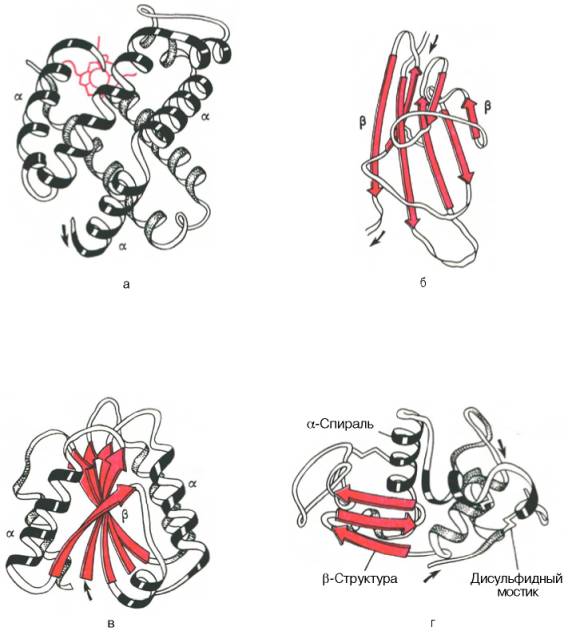
Рис. 1.19. Доменное строение глобулярных белков (по А. А. Болдыреву).
а - β-субъединица гемоглобина; б - константный домен иммуноглобулина; в - флаводоксин; г - лизоцим куриного яйца.
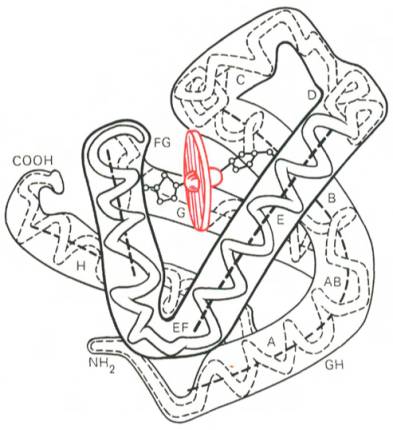
Рис. 1.20. Модель третичной структуры молекулы миоглобина (по Дж. Кендрью). Латинскими буквами обозначены структурные домены, красным цветом – гем.
Первым белком, третичная структура которого была выяснена Дж. Кендрью на основании рентгеноструктурного анализа, оказался мио-глобин кашалота. Это сравнительно небольшой белок с мол. м. 16700, содержащий 153 аминокислотных остатка (полностью выяснена первичная структура), представленный одной полипептидной цепью. Основная функция миоглобина – перенос кислорода в мышцах. Полипептидная цепь мио-глобина (рис. 1.20) представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелковый компонент, содержащий железо; см. главу 2).
На протяжении последних десятилетий в связи с повышением разрешающей способности рентгеноструктурного метода была расшифрована третичная структура более 1000 белков, в том числе гемоглобина, пепсина, химотрипсина, рибонуклеазы, лизоцима, трипсина и его ингибитора, ряда фрагментов иммуноглобулинов человека, цитохрома С, карбоангидразы человека, аспартатаминотрансферазы, инсулина и др. Примеры трехмерной структуры некоторых из них представлены на рис. 1.21.
Рентгеноструктурный анализ позволяет определить конформацию и ход полипептидной цепи в пространстве, поэтому для каждого белка может быть построена объемная модель, отражающая местоположение линейных и спирализованных участков. При изучении глобулярных белков было показано, что пространственная структура белков в сильной степени зависит от ряда факторов, в частности от ионной силы и рН раствора, температуры и т.д. Новейшие методы дифракции рентгеновских лучей позволили расшифровать кристаллическую структуру более 100 ферментов. Для выяснения трехмерной структуры белков в последнее время успешно применяются также методы низкотемпературной вычислительной техники, а также математические и компьютерные методы определения объемной структуры на основании данных последовательностей аминокислот.
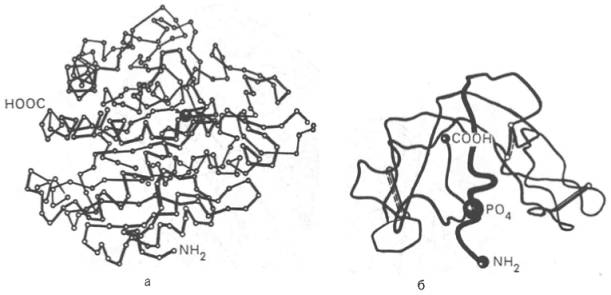
Рис. 1.21. Пространственная конфигурация карбоксипептидазы (а) и рибонуклеазы (б).
В настоящее время получены бесспорные доказательства, что в стабилизации пространственной структуры белков, помимо ковалентных связей (пептидные и дисульфидные связи), основную роль играют так называемые нековалентные связи (рис. 1.22). К этим связям относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия и т.д.
По современным представлениям, третичная структура белка после завершения его синтеза в рибосомах (см. главу 14) формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, в то время как полярные радикалы оказываются ориентированными в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы. В такой форме белковая молекула характеризуется минимальной свободной энергией. Молекулы белков в водных растворах обычно принимают ряд стабильных конформаций, индуцируемых не только изменениями рН и температуры, но и низкомолекулярными соединениями. Различают две основные формы конформаций: Т-форму (от англ. tensed – напряженная) и R-форму (от англ. relaxed – расслабленная). Между этими формами осуществляются переходы, соответственно отражающиеся в биологических свойствах.
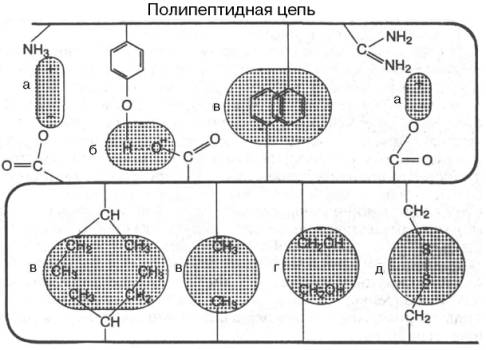
Рис. 1.22. Типы нековалентных связей, стабилизирующих третичную структуру белка.
Таким образом, линейная одномерная структура полипептидной цепи (т.е. последовательность аминокислотных остатков, обусловленная кодом белкового синтеза) наделена информацией другого типа – конформацион-ной, которая представляет собой образование белковой молекулы строго заданной формы с определенным пространственным расположением отдельных ее частей. Другими словами, третичная – объемная – структура белковой молекулы детерминирована аминокислотной последовательностью полипептидной цепи, а более конкретно – размером, формой и полярностью радикалов аминокислотных остатков. Эти представления могут служить основой для предсказания конформации белковой молекулы на основании аминокислотной последовательности. Следует указать, однако, что до сих пор представляется интригующей загадкой механизм этой тесной и тонкой связи между аминокислотной последовательностью и трехмерной структурой белковой молекулы. Оказывается, иногда полипептиды почти с одинаковыми последовательностями образуют разные структуры и, наоборот, полипептиды с разными последовательностями формируют одинаковую трехмерную структуру.
В свою очередь трехмерная структура белковой молекулы также содержит информацию, но уже совершенно нового типа, а именно функциональную, которую акад. В.А. Энгельгардт назвал интрамолекулярной информацией. Как будет показано далее, все биологические свойства белков (каталитические, гормональные, антигенные и др.) связаны с сохранностью их третичной структуры, которую принято называть нативной конформацией. Любые воздействия (термические, физические, химические), приводящие к нарушению этой конформации молекулы (разрыв водородных и других нековалентных связей), сопровождаются частичной или полной потерей белком его биологических свойств.
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой.
Третичная структура белка формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры, является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот группируются внутри белковой молекулы, в то время как полярные радикалы ориентируются в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы – глобула. В такой форме белковая молекула характеризуется минимальной свободной энергией. На конформацию возникшей глобулы оказывают влияние такие факторы как рН раствора, ионная сила раствора, а также взаимодействие белковых молекул с другими веществами. Стабилизация третичной структуры обеспечивается благодаря нековалентным взаимодействиям между атомными группировками боковых радикалов следующих типов:
- водородные связи могут возникать между функциональными группами боковых радикалов. Например, между ОН группой тирозина и –N
Между двумя "традиционными" структурными уровнями (вторичная структура белка и его детальная атомная трехмерная структура) находится промежуточный уровень — «мотив укладки" белковой цепи, определяемый взаимным расположением α- и/или β-участков в глобуле — и что именно на этом уровне проявляется сходство белков, не связанных ни эволюционно, ни функционально. В отличие от детальной, атомной трехмерной структуры, "мотивы укладки" удивительно просты и даже красивы
Почему стабильность плотной глобулы требует, чтобы каркас белковой молекулы выглядел бы как компактная упаковка α- и β-слоев, чтобы α- и β-участки шли от одного края глобулы до другого, и чтобы нерегулярные участки не лежали внутри глобулы? Тут все дело в водородных связях, которые стоят дорого, а потому все должны быть насыщены в стабильной структуре. Доноры и акцепторы таких связей есть в пептидной группе каждого аминокислотного остатка. Насытиться они могут или водой, или при образовании вторичной структуры. Поэтому только вторичные структуры могут не контактировать с водой — лежать внутри глобулы — а содержащие свободные полярные пептидные группы элементы — петли, края β-листов и концы α-спиралей — должны быть на поверхности.
Вытянутые α- и β-структуры должны, ради стабильности глобулы, со всех сторон плотно окружать гидрофобное ядро, создаваемое боковыми группами этих участков, и тем самым отделять его от воды. В то же время α-спирали и β-листы не могут смешиваться в одном слое, — пропадут водородные связи края β-листа. Значит, стабильность глобулы требует образования α-слоев и — отдельно — β-слоев. Такие слои (обычно не плоские — скрученные, иногда цилиндрические, а в α-спиральных глобулах — даже квазисферические) типичны для белковых глобул.
Подавляющее большинство доменов может быть представлено в виде двух-, трех- или (редко) четырехслойных структур, хотя отдельные белки (особенно те, которые содержат металлоорганические комплексы или много S-S связей боковых групп) могут и не вполне удовлетворять этой схеме. Более чем четырехслойных доменов нет. У них внутри, в отдалении от воды находилось бы слишком много остатков, и при типичном для белковых цепей — точнее, для цепей водорастворимых глобулярных белков — соотношении 1:1 между неполярными и полярными остатками многие полярные остатки увлекались бы внутрь белка, что энергетически крайне невыгодно: такой белок не был бы стабильным. Поэтому очень большие единые глобулы "обычного" аминокислотного состава должны быть нестабильны, и большие белки должны разбиваться на субглобулы, домены.
Статистический анализ показывает, что аминокислотные последовательности водорастворимых глобулярных белков — а о них-то сейчас и идет у нас речь — выглядят как "случайные". То есть в них разные аминокислотные остатки перемешаны примерно так, как можно было бы ожидать при случайной сополимеризации. Конечно, каждая последовательность не есть результат случайного биосинтеза; каждая белковая цепь кодируется геном. Однако аминокислотные последовательности водорастворимых глобулярных белков выглядят как "случайные", — в том смысле, что в них нет ни блочности, характерной для мембранных белков
(где явно гидрофобные куски перемежаются с явно гидрофильными), ни периодичности, характерной для белков фибриллярных.
Мотивы укладок белковых цепей часто удивительно красивы. Ход белковых цепей часто напоминает линии, орнаментирующие керамику. Это сходство не случайно — так как и линия орнамента, и белковая цепь "решает" одну и ту же задачу — окружить объем (в белке это центр глобулы, ее гидрофобное ядро), избежав самопересечений этой линии.
Физическая теория фазовых переходов. Понятие фазового перехода. Типы фазовых переходов. Образование и разрушение пространственной структуры белка с позиции теории фазовых переходов.
Фаза вещества – это состояние вещества, которому в данных условиях соответствует минимум свободной энергии. При изменении условий могут происходить переходы между фазами, изменение фазового состояния вещества. По характеру изменения свободной энергии выделяют три типа фазовых переходов.
ФП 1 рода. В процессе ФП наблюдается только начальное и конечное состояния, невозможно уловить промежуточные состояния. ФП происходит в узком диапазоне условий, зависимость свободной энергии от условий носит S-образный характер. Изменение фазы происходит по принципу "Всё или Ничего". Стабильные состояния между ФП 1 рода разделены достаточно высоким энергетическим барьером, поэтому они происходят достаточно длительное время.
ФП 2 рода. Для этого типа ФП характерно постепенное изменение фазы через многочисленные промежуточные состояния, принцип "Всё или Ничего" отсутствует. Скачок энергии в малом диапазоне условий отсутствует, поэтому ФП 2 рода происходят быстро и в более широком диапазоне условий. При достижении температуры ФП происходит скачок теплоёмкости системы, в результате дальнейший рост температуры сопровождается слабым ростом энергии.
Нефазовые переходы. Для них характерно значительное изменение упорядоченности системы без изменения её агрегатного состояния и размерности.
В процессах денатурации и ренатурации белка разные стадии представляют собой фазовые переходы разного рода. Для малых белков процесс можно считать одностадийным. Этот процесс происходит как ФП 1 рода. Для крупных белков этот процесс многостадийный, и разные его стадии происходят как ФП разного рода. Ранние этапы самосборки различаются в зависимости от типа вторичной структуры. Образование α-спирали происходит как нефазовый переход, так как оба фазовых состояния одномерны и не происходит изменения границы фаз. Образование β-листов происходит как ФП 1 рода, площадь контакта цепи с листом зависит от размера контактирующих элементов. Процесс образования β-структуры происходит значительно дольше.
Процесс образования и разрушения нативной структуры происходит как ФП 1 рода. В процессе этого перехода происходит изменение энтропии системы, компенсированное изменением свободной энергии. Это обеспечивается наличием большого числа слабых связей с низкой энергией.
К ФП 2 рода могут относиться процессы образования и разрушения доменных структур, которые часто сопровождаются ростом теплоёмкости системы.
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой.
Третичная структура белка формируется совершенно автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры, является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот группируются внутри белковой молекулы, в то время как полярные радикалы ориентируются в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная стабильная конформация молекулы – глобула. В такой форме белковая молекула характеризуется минимальной свободной энергией. На конформацию возникшей глобулы оказывают влияние такие факторы как рН раствора, ионная сила раствора, а также взаимодействие белковых молекул с другими веществами. Стабилизация третичной структуры обеспечивается благодаря нековалентным взаимодействиям между атомными группировками боковых радикалов следующих типов:
- водородные связи могут возникать между функциональными группами боковых радикалов. Например, между ОН группой тирозина и –N
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Белки – это состоящие из углерода, водорода, кислорода, серы и азота органические высокомолекулярные соединения.
Третичная структура белка – это пространственное строение (а также конформация) всей белковой молекулы, состоящей из одной цепи.
Третичные белки
По форме третичная структура белка может быть:
Фибриллярные белки имеют вытянутую форму (палочки, веретена, нити). Такие видоизменения белковой структуры не являются редкостью, но основным типом третичной структуры белка называют глобулу. Глобулярные белки, как правило имеют эллипсовидную форму,
Однако конфигурация третичной структуры белков еще не дает основания полагать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Эти структуры могут меняться. Изменение конфигурации третичной структуры зависит от многих факторов, но всегда несет адаптивное значение.
Например, α-кератин и парамиозин относятся к фибриллярным белкам, но при этом имеет палочковидную форму.
Третичная структура белка отличается тем, что обладает более высокой степенью компактности, чем исходная цепь первичной структуры. Третичная структура белка формируется совершенно автоматически, самопроизвольно. Основной движущей силой, которая приводит к образованию третичной структуры, является взаимодействие радикалов аминокислот с молекулами воды. При этом глобула становится термодинамической стабильной структурой, выгодной для белка. На дальнейшую конформацию белковой структуры влияют факторы рН и ионной силы раствора, а также взаимодействие белковых молекул с другими веществами.
Только после того, как белок приобретает собственную уникальную третичную структур, он может проявлять весь спектр своих свойств: ферментативных, антигенных, а также многих других. Именно третичная структура белка формирует активные центры ферментативных молекул. Любое воздействие на него приводит к разрушению третичной структуры, с потерей ее основных свойств.
Готовые работы на аналогичную тему
Свойства третичной структуры белка
Третичная структура в значительной степени определяется первичной структурой. На коечную форму белка при его конформации существенно влияет окружающая среда. Для того, чтобы третичная структура белка приобретала стабильную форму, необходимо наличие:
- ковалентных связей (формируются между двумя цистеиновыми остатками при образовании дисульфидных мостиков);
- ионных связей между боковыми группами аминокислотных заряженных остатков;
- водородных связей;
- гидрофильно-гидрофобных связей.
Третичная структура также характерна для нуклеиновых кислот, а именно РНК. Большинство молекул белков имеют полипептидные цепи, которые особым образом сворачиваются в компактную глобулу.
Внутри глобулы выделяют три типа связей, благодаря которым она удерживается:
- ионные;
- водородные;
- дисульфидные.
Все связи, удерживающие третичную структуру белка, делятся на слабые и сильные. К слабым связям относят: гидрофобные связи, водородные связи, ионные и электростатические связи.
К сильному типу связей относят: дисульфидную связь, псевдопептидную связь, сложно-эфирную связь.
За последнее время ученые открыли специализированные клеточные белки и ферментативные белки, регулирующие процесс сворачивания вновь созданных полипептидных цепей в обновленную третичную структуру. Например, фермент протеиндисульфидизомераза – катализирует расщепление неправильно образованных дисульфидных связей и формирует новые S-S-связи.
Кроме того, третичная структура белка поддерживается специфическими гидрофобными взаимодействиями. Если говорить о количественном отношении, то важны именно гидрофобные взаимодействия.
Для того, чтобы на практике определить наличие третичной структуры белка используют рентгеновский анализ. Основные типы таких экспериментов проводились Дж. Кендрью и М. Перцу. К началу 1959 года с помощью рентгеновского анализа ученые определили вторичную и третичную структуру белка мышц миоглобина, они также предложили модель молекулы данного белка. За эту работу ученые получили Нобелевскую премию.
Сегодня у миоглобина известны:
- первичная структура (полипептидная цепь из 153 аминокислотных остатков);
- вторичная структура миоглобина, имеющая а-спиральную конформацию (восемь спиральных участков);
- третичная структура белка представляет собой a – спираль, которая сворачивается нерегулярным образом в компактную глобулу.
Третичная структура белка обладает несколькими особенностями, например:
- миоглобин синтезируется внутри мышцах и благодаря наличию третичной структуры может запасать кислород;
- связи, стабилизирующие третичную структуру, образуются между боковыми радикалами аминокислот и их функциональными группами.
Другие белки в основной массе также имеют все виды структур от первичной до третичной (иногда четвертичной).
Полученные сведения смогли бы помочь сконструировать белок определенной структуры, который предназначен для выполнения специфических функций. Это могло бы стать прорывом в промышленности и медицине.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 24.11.2021
Анжелика Ивановна Иванова
Автор24 - это сообщество учителей и преподавателей, к которым можно обратиться за помощью с выполнением учебных работ.
Третичная структура белков. Особенности третичной структуры белков.
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается уже обсуждавшимися выше связями трех типов — ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями.
В количественном отношении наиболее важны именно гидрофобные взаимодействия; белок при этом свертывается таким образом, чтобы его гидрофобные боковые цепи были скрыты внутри молекулы, а гидрофильные, наоборот, выставлены наружу.

Для определения третичной структуры белков можно использовать метод рентгеновского анализа. В результате исследований, растянувшихся на несколько лет, Джон Кендрью и Макс Перуц (Kendrew, Perutz) к началу 1959 г. определили этим методом вторичную и третичную структуру миоглобина и предложили модель его молекулы.
За эту работу в 1962 г. они были удостоены Нобелевской премии. Теперь для миоглобина были известны:
первичная структура миоглобина — молекула представляет собой одну полипептидную цепь, построенную из 153 аминокислотных остатков (их последовательность была установлена в начале 60-х годов);
вторичная структура миоглобина — около 75% цепи имеет а-спиральную конформацию (восемь спиральных участков);
третичная структура миоглобина — а-спираль свернута нерегулярным образом в компактную глобулу;
простетинеская группа миоглобина — гемогруппа, или гем (содержит железо).
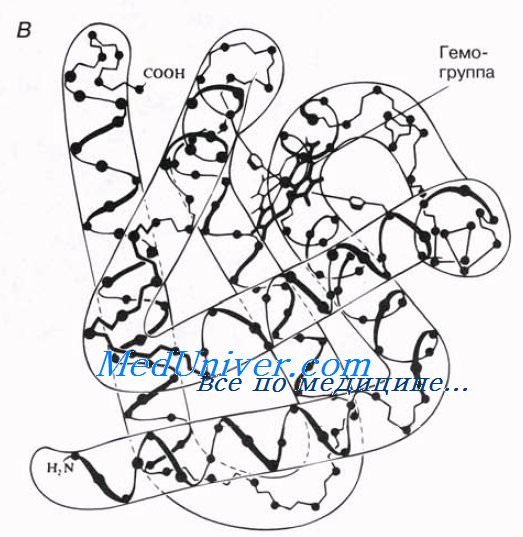
Миоглобин синтезируется в мышцах, где он служит для запасания кислорода. Как и в гемоглобине, кислород в его молекуле связывается с гемом; от гема зависит красный цвет мышц. Определение третичной структуры белков все еще остается весьма трудоемким процессом. В последнее время в молекулярной биологии все больше усилий затрачивается на попытки использовать компьютеры и прочую технику, которая позволила бы предсказывать третичную структуру белка исходя из его уже известной первичной и вторичной структуры. Это открыло бы возможности для конструирования белков с определенной структурой, предназначенных для определенных функций, что могло бы сыграть очень важную роль и в промышленности, и в медицине.
На рисунке представлено несколько способов изображения третичной структуры белка. Еще один способ показан на рисунке. У белков с третичной структурой функция теснейшим образом зависит от точной формы молекулы. В этом особенно легко убедиться при знакомстве с ферментами.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

