Фиш метод в генетике кратко
Обновлено: 05.07.2024
Гибридизация in situ – метод прямого выявления
нуклеиновых кислот в клеточных структурах в
условиях, позволяющих одновременно
исследовать их морфологию.
Видны изменения в хромосомах не в пробирке,
а непосредственно на гистологическом срезе.
По методу выявления:
Флуоресцентная
Хромогенная
Принцип FISH-метода
В основе FISH-метода лежит реакция гибридизации
между искусственно созданным ДНК-зондом и
комплементарной ему нуклеотидной
последовательностью ядерной ДНК.
Молекула ДНК представляет собой две спирально
соединенные нуклеотидные цепи, а гибридизация
возможна только в том случае, если цепи
разойдутся. Чтобы разъединить нуклеотидные
цепи ДНК прибегают к денатурации. После
денатурации ДНК-зонд гибридизируется с
комплементарной ему нуклеотидной
последовательностью и может быть обнаружен при
помощи флуоресцентного микроскопа.
ДНК-пробы представляют собой специально
синтезированные фрагменты ДНК,
последовательность которых комплементарна
последовательности ДНК исследуемых
аберрантных хромосом.
Интерпретация результатов
В ходе процесса гибридизации при наличии в
исследуемом образце аберрантных хромосом
происходит их связывание с ДНК-пробой, которое
при исследовании с помощью флуоресцентного
микроскопа определяется как флуоресцентный
сигнал (положительный результат FISH-теста).
При отсутствии аберрантных хромосом
несвязанные ДНК-пробы в ходе реакции
"отмываются", что при исследовании с помощью
флуоресцентного микроскопа определяется как
отсутствие флуоресцентного сигнала
(отрицательный результат FISH-теста).
Преимущества FISH
Эффективность, быстрота и относительная
простота метода относительная простота
метода FISH
делают его полезным инструментом для
диагностики хромосомных аномалий как в
постнатальном , так и в пренатальном
периоде, включая предимплантационный.
Недостатки
Зонды являются специфичными только к
одному участку генома и, как следствие, при
одном исследовании можно определить
наличие или число копий только этого участка
(или нескольких при использовании
многоцветных зондов). Поэтому важным
является правильная клинически предпосылка,
а FISH анализ может только подтвердить или не
подтвердить диагноз.
Хромосомные перестройки у супружеских пар с
бесплодием
Транслокации –
наиболее частые структурные
хромосомные перестройки,
определяемые у супружеских пар с
бесплодием, поскольку фенотипически
не проявляются у носителей.
В мейозе I дериватные
хромосомы и их нормальные
гомологи могут среагировать
с образованием несбалансированных гамет
Последствия:
•Бесплодие
•Невынашивание
•Мертворождение или ранняя детская
смертность
•Рождение детей с Рождение детей с
хромосомными аномалиями
Клинический пример
Пациент 1970 г.р.
Олигоастенотератозооспермия
У супружеской пары одно спонтанное
прерывание беременности в 12 нед.
Система описания хромосом
– Короткое плечо хромосом обозначают
латинской буквой р, длинное – q.
– Каждое плечо хромосомы разделяют на
районы, нумеруемые от центромеры к
теломере.
Если локализация гена точно известна, для ее
обозначения используют индекс полосы.
Например, обозначается 13р14 – четвертый
сегмент первого района короткого плеча
хромосомы 13
Флюоресцентная гибридизация in situ. Применение технологии FISH
Традиционная цитогенетика при изучении кариотипа всегда была ограничена бэндовым уровнем разрешения. Даже при использовании высокоразрешающих методов дифференциального окрашивания хромосом мы всего лишь выявляли большее количество бэндов на хромосоме, но не были уверены, что добираемся до молекулярного уровня разрешения. Последние достижения ДНК-технологий и цитогенетики сделали возможным использование методов FISH для анализа изменений хромосомной ДНК на молекулярном уровне. Молекулярная цитогенетика обеспечила революционный прорыв в цитогенетике, позволив:
• осуществлять анализ структуры ДНК хромосом в диапазоне 10-100 килобаз;
• проводить диагностику неделящихся интерфазных клеток, что оказало огромное влияние на пренатальную диагностику и преимплантационную генетическую диагностику (ПГД).
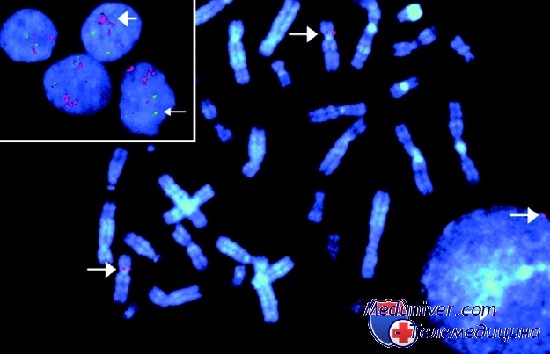
Возможность определения специфических генных сегментов, имеющихся или отсутствующих на хромосомах, позволила диагностировать синдромы генных последовательностей на уровне ДНК, как, впрочем, и транслокации в интерфазных ядрах, зачастую — в отдельных клетках.
Материалом для FISH могут служить или метафазные хромосомы, полученные из делящихся клеток, или интерфазные ядра из клеток, не находящихся в стадии деления. Срезы предварительно обрабатывают РНКазой и протеиназой для удаления РНК, которая может вступать в перекрестную гибридизацию с зондом и хроматином. Затем их нагревают в формамиде, чтобы денатурировать ДНК, и фиксируют ледяным спиртом. Затем зонд подготавливают к гибридизации путем нагревания. После этого зонд и хромосомный препарат смешивают и герметизируют покровным стеклом при 37 °С для гибридизации. Изменяя температуру инкубации или солевой состав раствора для гибридизации, можно повысить специфичность связывания и уменьшить фоновую маркировку.
Применение флюоресцентной гибридизации in situ - технологии FISH
Эффективность технологии FISH впервые была продемонстрирована при локализации генов на хромосомах. С внедрением метода флюоресцентного мечения, гибридизация in situ оказалась незаменимой для диагностики хромосомных аномалий, не выявляемых традиционными методами бэндинга. FISH также сыграла ключевую роль в совершении одного из самых необычных открытий современной генетики — геномного импринтинга.
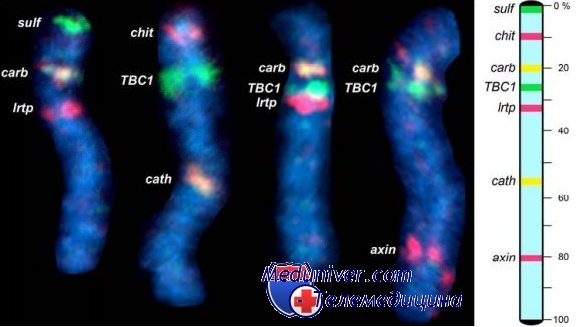
Свое развитие технология FISH получила в трех формах. Центромерные, или альфа-сателлитные, зонды характеризуются относительной хромосомной специфичностью, их использовали чаще всего в генетике интерфазных клеток. Эти зонды генерируют в некоторой степени диффузные сигналы адекватной силы в области центромеры, но не вступают в перекрестную гибридизацию с хромосомами, имеющими аналогичные центромерные последовательности. В настоящее время разработаны однокопийные зонды, дающие дискретный сигнал от специфического бэнда хромосомы и позволяющие избежать феномена перекрестной гибридизации. Эти зонды также можно использовать для определения копийности и специфичных регионов хромосомы, предположительно связанных с тем или иным синдромом. Однокопийные и центромерные зонды, разработанные для хромосом 13, 18, 21, X и Y, используют для пренатальной диагностики.
Метод FISH в пренатальной диагностике. Для женщин старшего репродуктивного возраста беременность может оказаться поводом не столько для радости, сколько для беспокойства. С возрастом женщины связан риск развития хромосомных аномалий плода. Амниоцентез, осуществляемый на 16-й неделе беременности, с последующим анализом кариотипа занимает 10-14 дней. Использование FISH в предварительном обследовании позволяет ускорить диагностику и уменьшить время ожидания. Большинство генетиков и лабораторий придерживаются мнения, что метод FISH не следует использовать изолированно для принятия решения о дальнейшем ведении беременности. Метод FISH обязательно следует дополнять кариотипическим анализом, и его результаты как минимум должны коррелировать с патологической картиной ультразвукового исследования (УЗИ) или биохимического скрининга по крови матери.
Синдромы генных последовательностей известны также под названием синдромов микроделеции, или сегментарной анеусомии. Это делеции смежных фрагментов хромосомы, вовлекающие, как правило, многие гены. Синдромы генных последовательностей были впервые описаны в 1986 г. с использованием классических методик цитогенетики. Теперь, благодаря FISH, возможна идентификация субмикроскопических делеции на уровне ДНК, что позволило выявлять наименьший делецированный регион, связанный с развитием того или иного синдрома, получивший название критического региона. После определения критического региона для синдрома зачастую становится возможным идентифицировать специфические гены, отсутствие которых признают ассоциированным с этим синдромом. В недавно вышедшем руководстве по синдромам генных последовательностей сообщают о 18 синдромах делеции и микроделеции, ассоциированных с 14 хромосомами. Некоторые наиболее часто встречающиеся синдромы генных последовательностей и их клинические проявления приведены в табл. 5-2.
Современный метод цитогенетического анализа, позволяющий определять качественные и количественные изменения хромосом (в том числе транслокации и микроделеции) и используемый для дифференциальной диагностики злокачественных заболеваний крови и солидных опухолей.
Синонимы русские
Флуоресцентная гибридизация in situ
Синонимы английские
Fluorescence in-situ hybridization
Метод исследования
Флуоресцентная гибридизация in situ.
Какой биоматериал можно использовать для исследования?
Образец ткани, образец ткани в парафиновом блоке.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Общая информация об исследовании
Флуоресцентная гибридизация in situ (FISH, от англ. fluorescence in-situ hybridization) – это один из самых современных методов диагностики хромосомных аномалий. Он основан на использовании ДНК-проб, меченных флуоресцентной меткой. ДНК-пробы представляют собой специально синтезированные фрагменты ДНК, последовательность которых комплементарна последовательности ДНК исследуемых аберрантных хромосом. Таким образом, ДНК-пробы различаются по составу: для определения разных хромосомных аномалий используются разные, специфические ДНК-пробы. ДНК-пробы также различаются по размеру: одни могут быть направлены к целой хромосоме, другие – к конкретному локусу.
В ходе процесса гибридизации при наличии в исследуемом образце аберрантных хромосом происходит их связывание с ДНК-пробой, которое при исследовании с помощью флуоресцентного микроскопа определяется как флуоресцентный сигнал (положительный результат FISH-теста). При отсутствии аберрантных хромосом несвязанные ДНК-пробы в ходе реакции "отмываются", что при исследовании с помощью флуоресцентного микроскопа определяется как отсутствие флуоресцентного сигнала (отрицательный результат FISH-теста). Метод позволяет оценить не только наличие флуоресцентного сигнала, но и его интенсивность и локализацию. Таким образом, FISH-тест – это не только качественный, но и количественный метод.
FISH-тест обладает рядом преимуществ по сравнению с другими методами цитогенетики. В первую очередь, исследование FISH может быть применено как к метафазным, так и к интерфазным ядрам, то есть к неделящимся клеткам. Это основное преимущество FISH по сравнению с классическими способами кариотипирования (например, окрашиванием хромосом по Романовскому-Гимзе), которые применяются только к метафазным ядрам. Благодаря этому исследование FISH является более точным методом для определения хромосомных аномалий в тканях с низкой пролиферативной активностью, в том числе в солидных опухолях.
Так как в FISH-тесте используется стабильная ДНК интерфазных ядер, для исследования могут быть использованы самые различные биоматериалы – аспираты тонкоугольной аспирационной биопсии, мазки, аспираты костного мозга, биоптаты и, что немаловажно, сохраненные фрагменты ткани, например гистологические блоки. Так, например, FISH-тест может быть с успехом выполнен на повторных препаратах, полученных из гистологического блока биоптата молочной железы при подтверждении диагноза "аденокарцинома молочной железы" и необходимости определения HER2/neu-статуса опухоли. Следует особо подчеркнуть, что в данный момент исследование FISH рекомендовано в качестве подтверждающего теста при получении неопределенного результата иммуногистохимического исследования опухоли на онкомаркер HER2/neu(ИГХ 2+).
Другим преимуществом FISH является его способность определять микроделеции, которые не выявляются с помощью классического кариотипирования или ПЦР. Это имеет особое значение при подозрении на синдром Ди Джорджи и велокардиофациальный синдром.
FISH-тест широко используется в дифференциальной диагностике злокачественных заболеваний, в первую очередь в онкогематологии. Хромосомные аномалии в сочетании с клинической картиной и данными иммуногистохимического исследования являются основой классификации, определения тактики лечения и прогноза лимфо- и миелопролиферативнх заболеваний. Классическими примерами являются хронический миелолейкоз – t (9;22), острый промиелоцитарный лейкоз – t (15;17), хронический лимфолейкоз – трисомия 12 и другие. Что касается солидных опухолей, наиболее часто FISH-исследование применяется при диагностике рака молочной железы, мочевого пузыря, толстой кишки, нейробластомы, ретинобластомы и других.
Исследование FISH также может быть использовано в пренатальной и преимплантационной диагностике.
FISH-тест часто проводят в сочетании с другими методами молекулярной и цитогенетической диагностики. Результат этого исследования оценивают в комплексе с результатами дополнительных лабораторных и инструментальных данных.
Научный руководитель проекта ГЕНОМЕД
Геномед – это инновационная компания с командой врачей-генетиков и неврологов, акушеров гинекологов и онкологов, биоинформатиков и лабораторных специалистов, представляющая комплексную и высокоточную диагностику наследственных заболеваний, нарушений репродуктивной функции, подбор индивидуальной терапии в онкологии.
В сотрудничестве с мировыми лидерами в области молекулярной диагностики мы предлагаем более 200 молекулярно-генетических исследований, основаных на самых современных технологиях.
Использование секвенирования нового поколения, микроматричного анализа с мощными методами биоинформационного анализа позволяют быстро поставить диагноз и подобрать правильное лечение даже в самых сложных случаях.
Наша миссия заключается в предоставлении врачам и пациентам комплексных и экономически эффективных генетических исследований, информационную и консультационную поддержку 24 часа в сутки.
ГЛАВНЫЕ ФАКТЫ О НАС
Руководители направлений

Жусина
Юлия Геннадьевна

Окончила педиатрический факультет Воронежского государственного медицинского университета им. Н.Н. Бурденко в 2014 году.
2015 - интернатура по терапии на базе кафедры факультетской терапии ВГМУ им. Н.Н. Бурденко.
2015-2016 – врач терапевт ВГКБСМП №1.

Канивец
Илья Вячеславович

Канивец Илья Вячеславович, врач-генетик, кандидат медицинских наук, руководитель отдела генетики медико-генетического центра Геномед. Ассистент кафедры медицинской генетики Российской медицинской академии непрерывного профессионального образования.
Основные направления деятельности: диагностика и ведение пациентов с наследственными заболеваниями и врожденными пороками развития, эпилепсией, медико-генетическое консультирование семей, в которых родился ребенок с наследственной патологией или пороками развития, пренатальная диагностика. В процессе консультации проводится анализ клинических данных и генеалогии для определения клинической гипотезы и необходимого объема генетического тестирования. По результатам обследования проводится интерпретация данных и разъяснение полученной информации консультирующимся.
Область профессиональных интересов – внедрение современных полногеномных исследований в клиническую практику, интерпретация их результатов.
Время приема: СР, ПТ 16-19
Прием врачей осуществляется по предварительной записи.

Шарков
Артем Алексеевич

Шарков Артём Алексеевич – врач-невролог, эпилептолог
В 2012 году обучался по международной программе “Oriental medicine” в университете Daegu Haanu в Южной Корее.
В 2013 году окончил Педиатрический факультет Российского национального исследовательского медицинского университета имени Н.И. Пирогова.
С 2016 года - руководитель неврологического направления лаборатории "Геномед".
В 2016 году повышение квалификации - "Инновационные генетические технологии для врачей", "Институт лабораторной медицины".
В настоящее время проводит научные исследования в области генетики эпилепсии под руководством профессора, д.м.н. Белоусовой Е.Д. и профессора, д.м.н. Дадали Е.Л.
Утверждена тема диссертации на соискание ученой степени кандидата медицинских наук "Клинико-генетические характеристики моногенных вариантов ранних эпилептических энцефалопатий".
Основные направления деятельности – диагностика и лечение эпилепсии у детей и взрослых. Узкая специализация – хирургическое лечение эпилепсии, генетика эпилепсий. Нейрогенетика.

Киевская
Юлия Кирилловна

Регулярно выступает с докладами на конференциях и семинарах. Читает лекции для врачей различных специальной в области репродуции и пренатальной диагностики
Проводит медико-генетическое консультирование беременных по вопросам пренатальной диагностики с целью предупреждения рождения детей с врождёнными пороками развития, а так же семей с предположительно наследственной или врожденной патологией. Проводит интерпретацию полученных результатов ДНК-диагностики.
СПЕЦИАЛИСТЫ

Латыпов
Артур Шамилевич

Латыпов Артур Шамилевич – врач генетик высшей квалификационной категории.
После окончания в 1976 году лечебного факультета Казанского государственного медицинского института в течение многих работал сначала врачом кабинета медицинской генетики, затем заведующим медико-генетическим центром Республиканской больницы Татарстана, главным специалистом министерства здравоохранения Республики Татарстан, преподавателем кафедр Казанского медуниверситета.
Автор более 20 научных работ по проблемам репродукционной и биохимической генетики, участник многих отечественных и международных съездов и конференций по проблемам медицинской генетики. Внедрил в практическую работу центра методы массового скрининга беременных и новорожденных на наследственные заболевания, провел тысячи инвазивных процедур при подозрении на наследственные заболевания плода на разных сроках беременности.
С 2012 года работает на кафедре медицинской генетики с курсом пренатальной диагностики Российской академии последипломного образования.
Область научных интересов – метаболические болезни у детей, дородовая диагностика.
Время приема: СР 12-15, СБ 10-14
Прием врачей осуществляется по предварительной записи.

Габелко
Денис Игоревич

Сфера профессиональных интересов: пренатальная диагностика, применение современных скрининговых и диагностических методов для выявления генетической патологии плода. Определение риска повторного возникновения наследственных болезней в семье.
Участник научно-практических конференций по генетике и акушерству и гинекологии.
Стаж работы 5 лет.
Консультация по предварительной записи
Прием врачей осуществляется по предварительной записи.

Гришина
Кристина Александровна

Область научно-практических интересов: медико-генетическое консультирование больных с наследственной синдромальной и мультифакториальной патологией.
Консультация врача-генетика позволяет ответить на вопросы:
являются ли симптомы у ребенка признаками наследственного заболевания какое исследование необходимо для выявления причины определение точного прогноза рекомендации по проведению и оценка результатов пренатальной диагностики все, что нужно знать при планировании семьи консультация при планировании ЭКО выездные и онлайн консультации

Горгишели
Кетеван Важаевна

ринимала участие в научно-практической школе "Инновационные генетические технологии для врачей: применение в клинической практике", конференции Европейского общества генетики человека (ESHG) и других конференциях, посвященных генетике человека.
Проводит медико-генетическое консультирование семей с предположительно наследственной или врожденной патологией, включая моногенные заболевания и хромосомные аномалии, определяет показания к проведению лабораторных генетических исследований, проводит интерпретацию полученных результатов ДНК-диагностики. Консультирует беременных по вопросам пренатальной диагностики с целью предупреждения рождения детей с врождёнными пороками развития.

Кудрявцева
Елена Владимировна

Врач-генетик, врач акушер-гинеколог, кандидат медицинских наук.
Специалист в области репродуктивного консультирования и наследственной патологии.
Окончила Уральскую государственную медицинскую академию в 2005 году.
- Бесплодие и невынашивание беременности
- Планирование беременности
- Беременность высокого риска
- Генетическая тромбофилия
- Вопросы пренатальной диагностики
- Наследственная патология в семье
Помимо консультирования пациентов, занимается научной и преподавательской деятельностью – работает в должности доцента на кафедре акушерства и гинекологии факультета повышения квалификации УГМУ.
Регулярно участвует в научных конференциях и симпозиумах.
Является автором ряда статей и методических рекомендаций.
Общий стаж работы – 11 лет

Удалова
Василиса Юрьевна

Регулярно участвует в научно-практических конференциях по генетике.
Основные направления деятельности: Консультирование по вопросам клинической и лабораторной диагностики генетических заболеваний и интерпретация результатов. Ведение пациентов и их семей с предположительно наследственной патологией. Консультирование при планировании беременности, а также при наступившей беременности по вопросам пренатальной диагностики с целью предупреждения рождения детей с врожденной патологией.
Данная статья описывает исследование преимплантационных эмбрионов с помощью FISH-метода (fluorescent in situ hybridization) у супружеских пар, проходящих лечение бесплодия методом экстракорпорального оплодотворения (ЭКО).
Суть исследования
Проводили определение пола у 360 эмбрионов, полученных у 42 супружеских пар в 60 циклах стимуляции суперовуляции в программе ЭКО. После биопсии и фиксации бластомеров пригодным к проведению диагностики оказалось 281 ядро, из них 217 (77,2%) не несли хромосомной патологии. 104 ядра содержали женский набор хромосом, 113 –мужской. В 64 ядрах (22,8%) были выявлены различные виды анеуплоидии гоносом. Дальнейшее развитие эмбрионов после проведения биопсии бластомера наблюдалось в 79%.
В 10 циклах стимуляции из 60 перенос не производился в связи с отсутствием эмбрионов нужного пола. Беременность наступила в 17 циклах (28% на цикл стимуляции и 34% на перенос эмбрионов). Из 13 клинически подтвержденных беременностей 4 прервались в 1-ом триместре, 1 –во 2-ом. 8 беременностей закончились рождением 10 (2 двойни) здоровых детей желаемого пола.
Из 64 ядер, содержащих хромосомную патологию, 19 (29,7%) имели моносомию X-хромосомы, 8 (12,5%) – моносомию Y-хромосомы. Трисомия была отмечена в 28 случаях (43,8%), полисомия в 8 (12,5%). Таким образом, полученные данные показали, что моносомия и трисомия являются наиболее частой хромосомной патологией гоносом.
Преимплантационная генетическая диагностика (ПД) возникла более 40 лет назад. Впервые R.Edwards и R.Gardner применили ее в 1967 г. для определения пола эмбрионов кролика. Уже тогда возникла идея использования данной технологии у человека для предотвращения передачи наследственных заболеваний от родителей детям. Однако такая возможность появилась только спустя 20 лет, когда в начале 90-х годов была разработана техника полимеразной цепной реакции (ПЦР), позволяющей выявлять мутации в единичных клетках [2]. Впервые ПЦР для проведения ПД в клинической практике применили A.Handyside и соавторы в 1990 г., выявив специфические последовательности для Y-хромосомы при определении пола эмбрионов у супружеских пар с X-сцепленными заболеваниями. С развитием науки от проведения ПЦР постепенно стали отказываться в пользу другого метода — флюоресцентной (нерадиоактивной) гибридизации in situ (FISH). Преимущество данного метода состояло в возможности одновременного определения как X-, так и Y-хромосомы. Кроме того, стало возможным определять не только пол эмбрионов, но и выявлять анеуплоидии половых хромосом (гоносом).
Молекулярно-цитогенетическое исследование FISH
На современном этапе развития медицины для определения пола преимплантационных эмбрионов используют молекулярно-цитогенетический метод FISH. Данный метод имеет ряд преимуществ перед другими способами молекулярной гибридизации: для генетического исследования методом FISH не требуется получения большого количества биологического материала, выделения ДНК из клеток, а также использования радиоизотопа P32. С помощью этого метода можно анализировать хромосомы на всех стадиях клеточного цикла, в том числе в интерфазе. Его принцип основан на специфической гибридизации определенных участков хромосом с флюоресцентно-меченными зондами. Метод позволяет определить структурные перестройки хромосом и выявить число их копий в интерфазных ядрах по флюоресценции зондов.
ПД молекулярно-цитогенетическим FISH-методом с определением пола, выявлением анеуплоидии и различных транслокаций в эмбрионах занимает большую часть от общего числа проводимой диагностики в рамках программ ВРТ. В большинстве клиник основными показаниями для определения пола эмбрионов являются: наличие рецессивного Х-сцепленного заболевания, наличие делеций в Y хромосоме, а также желание родителей.
Исследуя пол у эмбрионов, все авторы отметили у них высокий уровень анеуплоидии гоносом и мозаицизм. По данным разных авторов, клеточный мозаицизм у преимплантационных эмбрионов может наблюдаться до 50% случаев. Эти исследования подтвердили, что высокая доля хромосомных нарушений, выявленная у эмбрионов, не связана с недостатками методики FISH, а соответствует истинному кариотипу исследуемых клеток. Полученные результаты указывают на то, что при проведении преимплантационной генетической диагностики супружеским парам с целью определения пола эмбрионов необходимо одновременно исследовать их на наиболее распространенные трисомии.
Цель исследования
Определение пола эмбрионов и выявление патологии в комплексе гоносом.
Материалы и методы
В отделении вспомогательных технологий в лечении бесплодия НЦ АГиП им.академика В.И.Кулакова были проанализированы результаты проведения преимплантационной генетической диагностики (ПГД) с определением пола эмбрионов 42 супружеских пар по желанию пациентов. На момент исследования 2 пары были фертильны, остальные проходили лечение по программе ЭКО и ПЭ в связи с первичным или вторичным бесплодием. Средний возраст пациенток составил 32 года (от 23 до 43 лет). Исследование эмбрионов проводили с помощью FISH-метода.
Определение пола эмбриона проводили на ядрах бластомеров. Биопсия бластомера осуществлялась с помощью микроманипулятора. Для получения биологического материала прежде всего проводили пенетрацию наружной оболочки эмбриона (zona pellucida) до размера, достаточного для аспирации бластомера аспирационной микроиглой (20-40 мкм). Вскрытие zona pellucida осуществляли с помощью лазерного луча. Бластомер, содержащий четко видимое ядро, аспирировали в просвет микроиглы, соединенной с микрошприцем (50-100 мкл). Биопсированный бластомер помещали на предметное стекло, фиксировали и выполняли процесс гибридизации ДНК хромосом, содержащихся в ядре, и ДНК-зонда. Использовали зонды к X- и Y- хромосомам (фирма ABBOTT). Готовый препарат анализировали с помощью люминесцентного микроскопа (фирма Zeiss), при использовании которого каждая хромосома имеет свой, отличный от других, цвет свечения.
Результаты
Всего в 60 циклах стимуляции суперовуляции у 42 женщин было получено 520 ооцитов, после оплодотворения которых развился 371 эмбрион (71,3%). Биопсия бластомеров была проведена у 360 эмбрионов (11 эмбрионов были разрушены в ходе биопсии).
При исследовании 281 ядра, принадлежащего одноядерным бластомерам, нормальный набор по изучаемым хромосомам был определен в 217 из 281, что составило 77,2%, а в 64 отмечали различные типы анеуплоидии (22,8%). Женский набор хромосом был определен в 104 наблюдениях, мужской - в 113.
Среди выявленной патологии по изучаемым хромосомам наибольшая доля принадлежала моносомии X-хромосомы –29,7% (в 19 наблюдениях из 64). Моносомия Y-хромосомы была отмечена в 8 случаях (12,5%). Таким образом, общий уровень моносомии составил 42,2% (в 27 случаях из 64). Трисомия гоносом среди случаев выявленной анеуплоидии была отмечена в 28 наблюдениях, что составило 43,8%. Полисомия гоносом составила 12,5% (в 8 наблюдениях из 64).
После проведения процедуры забора бластомера дальнейшее развитие среди пригодных для биопсии эмбрионов наблюдали в 79% случаев. Из 60 случаев проведенной диагностики отмена переноса в связи с отсутствием нужного пола была в 10 случаях. Всего беременность наступила в 17 проведенных циклах, что составило 28% на цикл стимуляции и 34% на перенос эмбрионов. Из 13 клинических беременностей 4 остановились в развитии в 1-ом триместре беременности, 1 прервалась во 2-ом. 8 беременностей завершились родами, родилось 10 здоровых детей нужного пола (в 2-х случаях –двойни).
Выводы
Полученные нами данные показали, что проведение ПГД FISH-методом может успешно использоваться с целью определения пола эмбрионов и дальнейшего переноса в полость матки эмбриона желаемого пола. Кроме того, определение пола FISH-методом позволяет выявить патологию гоносом, что предотвращает перенос эмбриона с хромосомной патологией в полость матки пациентки, раннюю гибель эмбриона или рождение больного ребенка. Однако, учитывая наличие мозаицизма в эмбрионе, даже после проведения ПГД рекомендована пренатальная диагностика для исключения рождения ребенка с хромосомными нарушениями.
Читайте также:

