Цитогенетический метод это кратко
Обновлено: 05.07.2024
Существует ряд методов, которые позволяют проследить наследование признаков. Это позволяет установить диагноз, бороться с болезнями, провести консультацию лицам, нуждающимся в ней.
Близнецовый метод.
МZ (ОБ) однояйцевые.
1 яйцеклетка + 1 сперматозоид → зигота, которая далее на ранних стадиях делиться на 2 эмбриона.
Всегда одного пола (генетически эдентичны). Различия между ними зависят в основном от действия внешних факторов.
2 яйцеклетка + 2 сперматозоида = → 2 зиготы.
DZ (РБ). Они сходны между собой как 2 сестры или 2 брата, рождённые порознь. Могут быть и разнополые или однополые. Различия зависят от наследственности и от средовых факторов.
Метод позволяет разграничить роль наследственности и среды в разнообразии признаков человека.
Если возникновение признака (или его отсутствие) в значительной степени зависит от генетической конструкции тогда у ОБ совпадение наблюдается чаще.
Внутрипарное сходство близнецов (похожесть) называется конкорданность, у ОБ она > чем РБ.
(псориаз МЗ 61 % РБ 13%) . Шизофрения 69% (10%). Депрессия (психоз) 96% (19%).
- 90-100% оттенок кожи, форма носа, оттенок радужки, у ОБ
- группа крови, слюны, резусу у ОБ- 100%
- 81-90% дактилоскоп. Узору у ОБ.
Сущность метода: изучения внутрипарного сходства близнецов, при сравнении которых можно судить о влиянии среды и наследственности на развитие того или иного признака (воздействие хим. в-в, лекарств…).
Цитогенетический метод.
Это микроскопический анализ хромосом (кариотипа) позволяет выявить числовые и структурные изменения хромосом (перестройки, поломки и др..
Хромосомы изучают в делящихся клетках костного мозга, лимфоцитах крови, реже кожи, мышц.
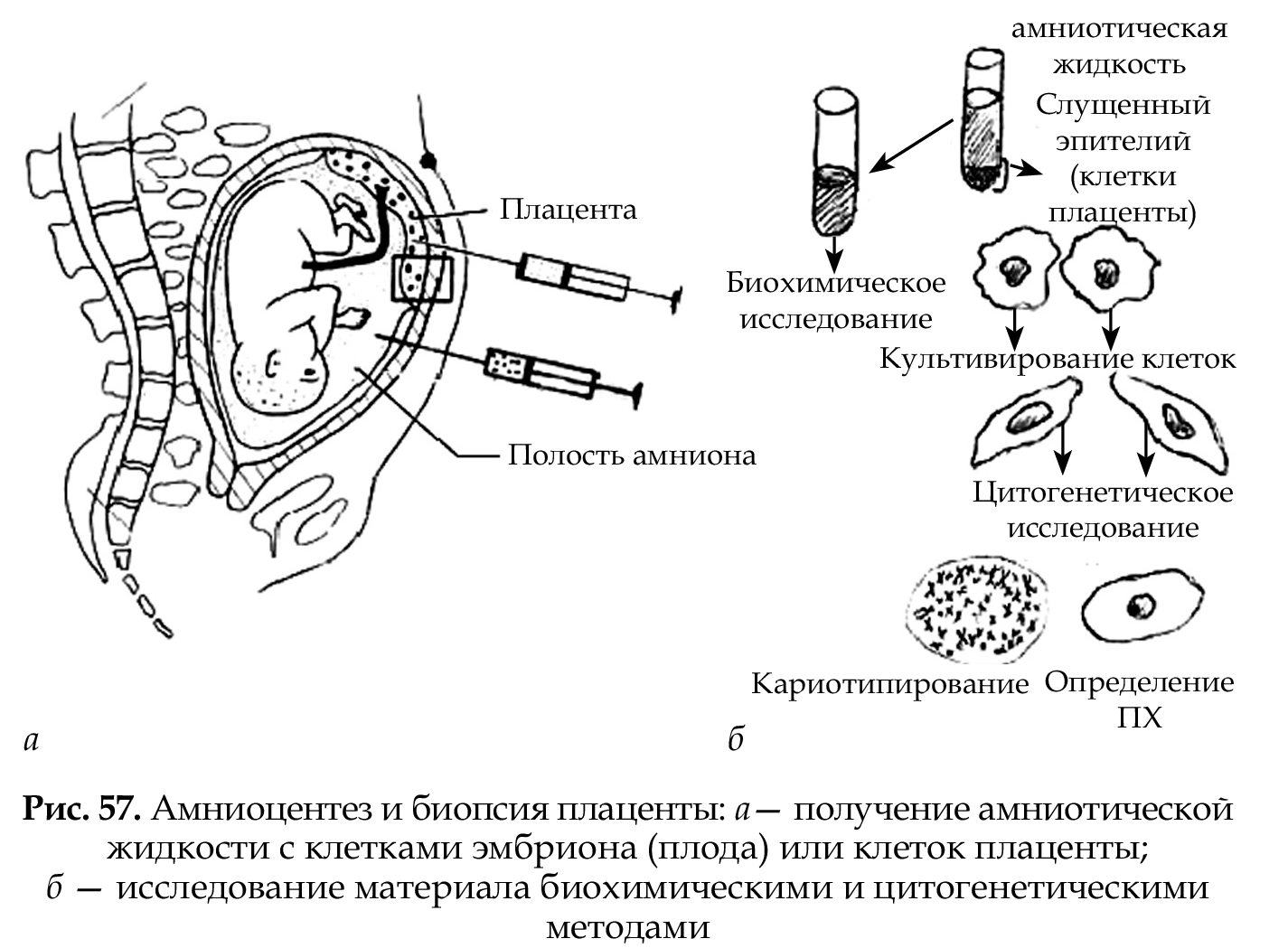
Хромосомы можно изучать и будущего ребёнка (эмбриона): ворсины хориона, клетки плаценты, пуповинной крови, амниотической жидкости (околоплодных вод- метод амниоцентез).
Клетки отбирают, выращивают на питательной среде, добавляют колхитин. Он останавливает митоз на стадии метафазы. Микропрепараты обязательно окрашивают. Существует различные методики цитогенетической диагностики. Методом можно определять половой хроматин (тельце Барра)
Показания к методу:
- у пробанда, его родителей или родственников при подозрении на хромосомную болезнь (уточнение диагноза)
- при тяжёлых психических расстройствах
- при первичной аменореи (отсутствие менструации) бесплодии
- при спонтанных абортах, мёртворожденных
- у детей с множественными пороками развития, не подходящими под какую либо болезнь.
- при изучении мутагенного действия, каких либо факторов (лекарственные средства, наркотики, радиация…)
- при проведении медико- генетического консультирования.
Метод приводит к более точной диагностики, к своевременному лечению и предупреждению рождения больного ребёнка.
Тема: Методы изучения наследственности человека.
Наследственность человека трудно поддается изучению:
- примерно одинаковая продолжительность жизни исследователя (врача) и пациента, максимально может изучит 3-4 поколения в семье,
- поздно наступающая половая зрелость человека и малое число потомков,
- большое число хромосом и генов,
- отсутствие записанных родословных в семье,
- гибридологический метод применять нельзя.
Существует ряд методов, которые позволяют проследить наследование признаков. Это позволяет установить диагноз, бороться с болезнями, провести консультацию лицам, нуждающимся в ней.

Близнецовый метод.
МZ (ОБ) однояйцевые.
1 яйцеклетка + 1 сперматозоид → зигота, которая далее на ранних стадиях делиться на 2 эмбриона.
Всегда одного пола (генетически эдентичны). Различия между ними зависят в основном от действия внешних факторов.
2 яйцеклетка + 2 сперматозоида = → 2 зиготы.
DZ (РБ). Они сходны между собой как 2 сестры или 2 брата, рождённые порознь. Могут быть и разнополые или однополые. Различия зависят от наследственности и от средовых факторов.
Метод позволяет разграничить роль наследственности и среды в разнообразии признаков человека.
Если возникновение признака (или его отсутствие) в значительной степени зависит от генетической конструкции тогда у ОБ совпадение наблюдается чаще.
Внутрипарное сходство близнецов (похожесть) называется конкорданность, у ОБ она > чем РБ.
(псориаз МЗ 61 % РБ 13%) . Шизофрения 69% (10%). Депрессия (психоз) 96% (19%).
- 90-100% оттенок кожи, форма носа, оттенок радужки, у ОБ
- группа крови, слюны, резусу у ОБ- 100%
- 81-90% дактилоскоп. Узору у ОБ.
Сущность метода: изучения внутрипарного сходства близнецов, при сравнении которых можно судить о влиянии среды и наследственности на развитие того или иного признака (воздействие хим. в-в, лекарств…).
Цитогенетический метод.
Это микроскопический анализ хромосом (кариотипа) позволяет выявить числовые и структурные изменения хромосом (перестройки, поломки и др..
Хромосомы изучают в делящихся клетках костного мозга, лимфоцитах крови, реже кожи, мышц.
Хромосомы можно изучать и будущего ребёнка (эмбриона): ворсины хориона, клетки плаценты, пуповинной крови, амниотической жидкости (околоплодных вод- метод амниоцентез).
Клетки отбирают, выращивают на питательной среде, добавляют колхитин. Он останавливает митоз на стадии метафазы. Микропрепараты обязательно окрашивают. Существует различные методики цитогенетической диагностики. Методом можно определять половой хроматин (тельце Барра)
Показания к методу:
- у пробанда, его родителей или родственников при подозрении на хромосомную болезнь (уточнение диагноза)
- при тяжёлых психических расстройствах
- при первичной аменореи (отсутствие менструации) бесплодии
- при спонтанных абортах, мёртворожденных
- у детей с множественными пороками развития, не подходящими под какую либо болезнь.
- при изучении мутагенного действия, каких либо факторов (лекарственные средства, наркотики, радиация…)
- при проведении медико- генетического консультирования.
Метод приводит к более точной диагностики, к своевременному лечению и предупреждению рождения больного ребёнка.
Цитогенетические исследования в гематологии: окрашивание хромосом, метод FISH
Цитогенетическое исследование — это микроскопический анализ хромосом, результаты которого весьма важны для постановки диагноза, классификации, лечения и научного исследования заболеваний системы крови, прежде всего — онкогематологических. Значение цитогенетических методов для диагноза и лечения определяется доступностью опухолевых клеток для кариотипирования и их гетерогенностью, а с научной точки зрения — возможностью изучения изменений в структуре и функции генетических локусов, ассоциированных со злокачественной трансформацией.
Морфология хромосом сильно варьирует во время клеточного цикла. Для микроскопического анализа хромосомы должны быть визуализированы как дискретные структуры. Наилучшим образом это достигается на стадии прометафазы митоза, когда каждая хромосома видна как две идентичные хроматиды, и особенно на стадии метафазы, когда хромосомы максимально конденсированы и располагаются в одной плоскости в центре клетки отдельно одна от другой.
Нормальные клетки человека содержат 22 пары аутосом и одну пару половых хромосом: две Х-хромосомы у женщин и по одной копии половых хромосом (X и Y) у мужчин.
Для цитогенетического анализа лейкозов, миелодиспластических синдромов и хронических миелопролиферативных заболеваний исследуют клетки костного мозга. При невозможности их получения может быть исследована кровь (если она содержит бласты). Цитогенетический анализ лимфом выполняется в клетках ткани лимфатического узла. Культивирование клеток из опухоли повышает митотический индекс (пропорцию клеток, находящихся в фазе митоза) и способствует пролиферации злокачественных клеток.
Сравнительное кариотипирование нормальных клеток проводят в Т-лимфоцитах периферической крови, которые предварительно культивируют в среде с митогеном растительного происхождения — фитогемагглютинином.
Окрашивание хромосом в гематологии
В конце 1960-х годов была разработана методология дифференциального окрашивания метафазных хромосом, а в 1971 г. создана номенклатура хромосомных сегментов, позволяющая точно описывать хромосомные аномалии. Позднее были внедрены методики окрашивания менее конденсированных и, соответственно, более длинных профазных и прометафазных хромосом, которые обладают более высоким разрешением, так как позволяют визуализацию 500-2000 сегментов (метафазное окрашивание визуализирует только 300 сегментов).
Достаточно большое количество профазных и прометафазных клеток для анализа получают путем синхронизации клеточного цикла, культивируя клетки в среде, содержащей антиметаболит (например, метотрексат), который ингибирует синтез ДНК. Подавление синтеза ДНК останавливает клеточный цикл в интерфазе. Затем клетки переносят в среду без метотрексата, обогащенную тимидином, где они одновременно входят в фазу митоза. Обработка клеточной культуры колхицином останавливает митоз одновременно во всех клетках на стадии профазы или прометафазы.
Первая стойкая хромосомная аномалия при злокачественной опухоли человека была выявлена в 1960 г. у больных хроническим миелолейкозом и получила название филадельфийской хромосомы (Ph), по имени города, в котором было сделано это открытие. Применение технологии хромосомного окрашивания позволило выявить множество хромосомных аномалий, большая часть которых встречается при онкогематологических заболеваниях. Некоторые красители окрашивают различные участки хромосом с вариабельной интенсивностью в зависимости от структуры хроматина в этих участках, их нуклеотидного и белкового состава.
В результате такого окрашивания получают уникальный паттерн чередования светлых и темных поперечных полос, специфичный для каждой хромосомы.
В настоящее время существуют несколько видов дифференциального окрашивания хромосом. При Q-окрашивании акрихин-ипритом (quinacrine) или акрихиндигидрохлоридом выявляется особый тип флюоресценции каждой хромосомы с образованием Q-исчерченности (Q-banding) — поперечных флюоресцентных полос, называемых Q-полосами (Q.-bands). Это позволяет идентифицировать отдельные хромосомы. Анализ Q-полос выполняют с помощью флюоресцентного микроскопа.
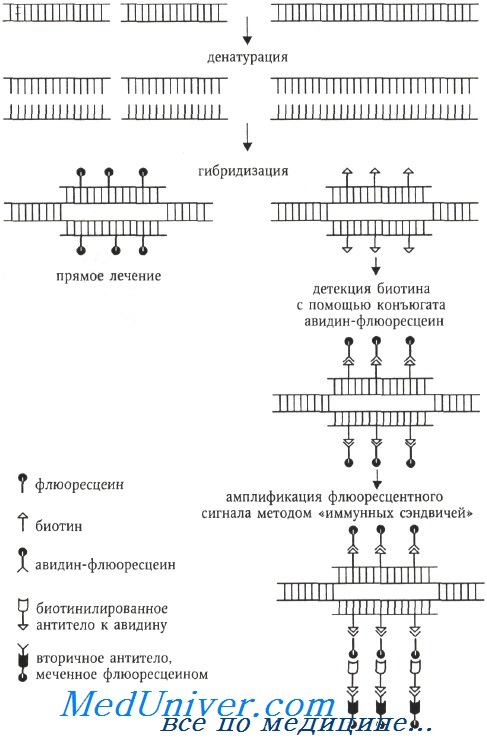
Схема анализа ДНК методом FISH
При окрашивании по Гимзе (G-banding) хромосомы приобретают вид серии темных и светлых полос или бэндов (bands). G-окрашивание применяется чаще, чем Q-окрашивание, так как анализ выполняется с помощью светового микроскопа, а G-полосы, в отличие от Q-полос, не выцветают со временем. Наиболее широко применяется методика, называемая GTG-окрашиванием (G bands by trypsin using Giemsa), с предварительной обработкой трипсином.
R-бэндинг (обработка хромосом горячим спиртовым раствором перед окрашиванием по Гимзе) выявляет полосы, которые обратны G-полосам и называются R-полосами (reverse of G bands).
Помимо Q-, G- и R-окрашивания, позволяющих выявлять полосы вдоль всей длины хромосомы, существуют методики, специализированные для исследования отдельных хромосомных структур, в том числе конститутивного гетерохроматина (С-окрашивание — от англ. constitutive), теломерного района (Т-окрашивание) и района ядрышкового организатора (NOR-окрашивание — от англ. nucleolus organizing region). Размеры и положение С-полос уникальны для каждой хромосомы, но преимущественно они включают центромерныи район и используются при исследовании хромосомных транслокаций, вовлекающих центромерные районы хромосом.
Цитогенетический анализ опухолевых клеток затруднен в связи с неясной морфологией хромосом и слабой различимостью полос. Если в исследование взяты наиболее удобные для анализа метафазные пластинки, образец может быть ошибочно охарактеризован как цитогенетически нормальный.
С развитием методов рекомбинантной ДНК стало возможным использование гибридизации in situ для определения местоположения на хромосомах или в клеточном ядре любой ДНК- и РНК-последовательности. С ее помощью можно изучать и диагностировать онкологические и наследственные генетические болезни. Молекулярная гибридизация in situ является важным инструментом цитогенетических исследований, позволяет выявлять хромосомные перестройки, идентифицировать маркерные хромосомы, проводить быстрое кариотипирование клеточных линий. Важно, что подобный анализ можно проводить не только на метафазных хромосомах, но и на интерфазных ядрах.
Несмотря на многоцелевое использование молекулярной гибридизации ДНК-ДНК (РНК) in situ, все модификации метода выполняются в соответствии с общими принципами. Существуют несколько вариантов, которые включают в себя несколько этапов: подготовка и мечение ДНК (РНК)-зонда, приготовление препаратов хромосом, собственно гибридизация, детекция гибридных молекул.
В 1980-х годах цитогенетическая методология обогатилась молекулярно-цитогенетическим методом, называемым флюоресцентной гибридизацией in situ (fluorescence in situ hybridization, FISH), который вскоре стал наиболее популярным. Суть этого метода заключается в гибридизации ДНК-зондов к специфическим последовательностям ДНК, меченных флюорохромами, с метафазными или интерфазными хромосомами, которые визуализируются флюоресцентной микроскопией. Определение нуклеотидной последовательности методом FISH выполняется непрямым способом, путем гибридизации синтетического олигонуклеотида (зонда) с анализируемой ДНК (называемой также матричной ДНК или ДНК-мишенью).
Если зонд синтезирован с включением флюоресцентных или антигенных молекул, которые распознаются флюоресцирующими антителами, становится возможной визуализация относительного положения зонда на анализируемой ДНК.
Флюорохром может быть связан с ДНК ковалентно (прямое мечение) или посредством иммуноцитохимических реакций, когда ДНК-зонд метят гаптеном (биотин, дигоксигенин), а флюорохром связан с алкалоидом авидином (стрептавидином), обладающим сильным сродством к биотину (или с антителами против биотина или дигоксигенина). При использовании гаптенов возможна амплификация флюоресцентного сигнала с помощью биотинилированных антител к авидину и вторичных антител, специфичных предыдущему слою антител и окрашенных флюорохромом.
Метод FISH предназначен для выявления:
1) гибридных клеток;
2) транслокаций и других, в том числе числовых, хромосомных аномалий;
3) меченых хромосом в интерфазных и метафазных клетках.
Высококонтрастная флюоресцентная гибридизация достигается благодаря использованию флюоресцентных красителей разного цвета. С помощью двуцветной FISH выявляются тонкие структурные аномалии, например хромосомные транслокации, в том числе и неразличимые при дифференциальном окрашивании.
В настоящее время возможно выполнение многоцветной гибридизации in situ для одновременного окрашивания всех хромосом в сложном кариотипе с множественными числовыми и структурными аномалиями. Комбинация разных модифицирующих агентов и флюорохромных красителей позволяет одновременно выявлять несколько последовательностей ДНК в одном ядре (флюоресцеин дает зеленую флюоресценцию, техасский красный и родамин — красную, гидроксикумарин — голубую и т. д.). Сочетание пяти флюорохромов в разных пропорциях и компьютерный анализ изображений позволяет одновременно окрасить разным цветом все хромосомы и визуализировать 27 различных ДНК-зондов, которые служат уникальной меткой для каждой хромосомы. Эта методика называется многоцветной FISH (multicolor, или multiplex, fluorescence in situ hybridization, M-FISH).
Значение цитогенетических методов неодинаково при разных онкогематологических заболеваниях. Миелоидные клетки обычно легко кариотипируются при дифференциальном окрашивании, и FISH лишь подтверждает результаты рутинной цитогенетики. Лимфоидные клетки у больных хроническим лимфолейкозом и, особенно, множественной миеломой кариотипировать значительно сложнее из-за низкого уровня пролиферации (даже при использовании В-клеточных митогенов). В этом случае FISH демонстрирует в несколько раз большую частоту анеуплоидии, чем обычные цитогенетические методики.
Клиническое значение цитогенетических исследований
Диагноз. Потомство клетки с приобретенной цитогенетической аномалией может иметь пролиферативное преимущество и давать начало клону — клеточной популяции, происходящей от одной клетки-предшественницы. Обнаружение клональных хромосомных аномалий способствует постановке диагноза клонального поражения костного мозга. Например, цитогенетический анализ позволяет установить диагноз миелодиспластического синдрома у пациентов с умеренной цитопенией или при наличии в аспирате костного мозга минимально выраженных качественных нарушений гемопоэза.
Присутствие специфических хромосомных аномалий помогает выделить подгруппы пациентов, которым требуется специфическая терапия. Например, транслокация t(15;17)(q22;qll-21) подтверждает диагноз острого промиелоцитарного лейкоза (ОМЛ — МЗ), в комплексном лечении которого используется ретиноевая кислота.
Прогноз. Результаты цитогенетического анализа имеют не только диагностическое, но и прогностическое значение. Например, обнаружение множественных хромосомных аномалий у больных острыми лейкозами до начала лечения является прогностически неблагоприятным и служит основанием для выполнения трансплантации костного мозга или стволовых клеток периферической крови в первой полной ремиссии.
Контроль результатов лечения. Цитогенетический анализ костного мозга пациентов после проведенного лечения помогает контролировать степень элиминации опухолевого клона и, следовательно, полноту ремиссии. Выявление хромосомных аномалий, характерных для опухолевых клеток данного пациента, является ранним признаком, свидетельствующим о приближающемся рецидиве.
Цитогенетический анализ имеет большое значение в диагностике и лечении гематологических заболеваний, которое все возрастает по мере совершенствования методологии и накопления знаний об этиологической и патогенетической роли хромосомных аномалий в развитии этих болезней.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитогенетические методы, применяемые для диагностики гемобластозов и других заболеваний системы кроветворения, включают в себя стандартное цитогенетическое исследование (СЦИ) и флуоресцентную гибридизацию in situ (FISH).
При помощи СЦИ анализируют хромосомы метафазных пластинок, обработанных таким образом, чтобы можно было получить характерную исчерченность хромосом, позволяющую их идентифицировать (Рис.1), а также выявлять перестройки отдельных хромосомных сегментов, называемых локусами.

Рис. 1. Стандартное цитогенетическое исследование (47,XY,+12).
Для многих видов гемобластозов известны повторяющиеся маркерные хромосомные аномалии: транслокации, делеции, инверсии, а так же численные аномалии (моносомия, трисомия). Обнаружение таких маркерных хромосом позволяет устанавливать однозначный диагноз и контролировать динамику роста опухолевой массы. Кроме того, в опухолевых клетках у больных гемобластозами часто возникают дополнительные хромосомные поломки, это явление называют клональной эволюцией опухоли. Клональная эволюция опухоли, которую обнаруживают при помощи СЦИ, является важным прогностическим признаком. Возможность выявления многочисленных дефектов хромосом при помощи СЦИ является важным преимуществом этого метода. Однако чувствительность СЦИ не превышает 5%, поэтому при значительном снижении опухолевой массы на фоне проводимой терапии дальнейший мониторинг необходимо осуществлять при помощи молекулярных методов, а также при помощи FISH.
Метод FISH основан на использовании протяженных ДНК-зондов, комплементарных тем хромосомным локусам, в которых при гематологических заболеваниях происходят перестройки. Современные зонды для FISH несут в своем составе флуоресцентные группировки, позволяющие визуализировать точки связывания зондов с соответствующими локусами, причем не только в хромосомах из метафазных пластинок, но и в том случае, когда они находятся в интерфазных ядрах (Рис.2).

Рис. 2 Транслокация (9;22). Зонд ON BCR/ABL t(9;22) Dual-color Extra Signal (Kreatech) красный сигнал 9q34, включающий ген ABL, зеленый сигнал -22q11, включающий ген BCR. Место наложения сигналов - слитый ген BCR/ABL.

Рис. 3 Амплификация гена KMT2A (MLL) Зонд ON MLL (11q23), Break
Красный и зеленый сигналы визуализируют увеличение числа копий гена МLL.
В связи с этим чувствительность метода FISH оказывается на порядок выше, чем у СЦИ, однако все же уступает на 1-2 порядка чувствительности молекулярных методов.
Цитогенетический метод изучения наследственности человека. Хромосомные болезни. Наследование, сцепленное с полом
Цитогенетический метод
Классификация хромосом человека
Генетические карты
Хромосомные болезни (синдромы)
Кариотипы, кариограммы
Тестовые задания
Цитогенетический метод
С помощью данного метода можно изучать наследственный материал клетки: совокупность хромосом в целом (кариотипирование) или наличие и количество Х-хромосом (определение полового хроматина — число глыбок полового хроматина или телец Барра). Исследование проводится с помощью светового микроскопа (изготовление и изучение микропрепаратов).
Кариотипирование
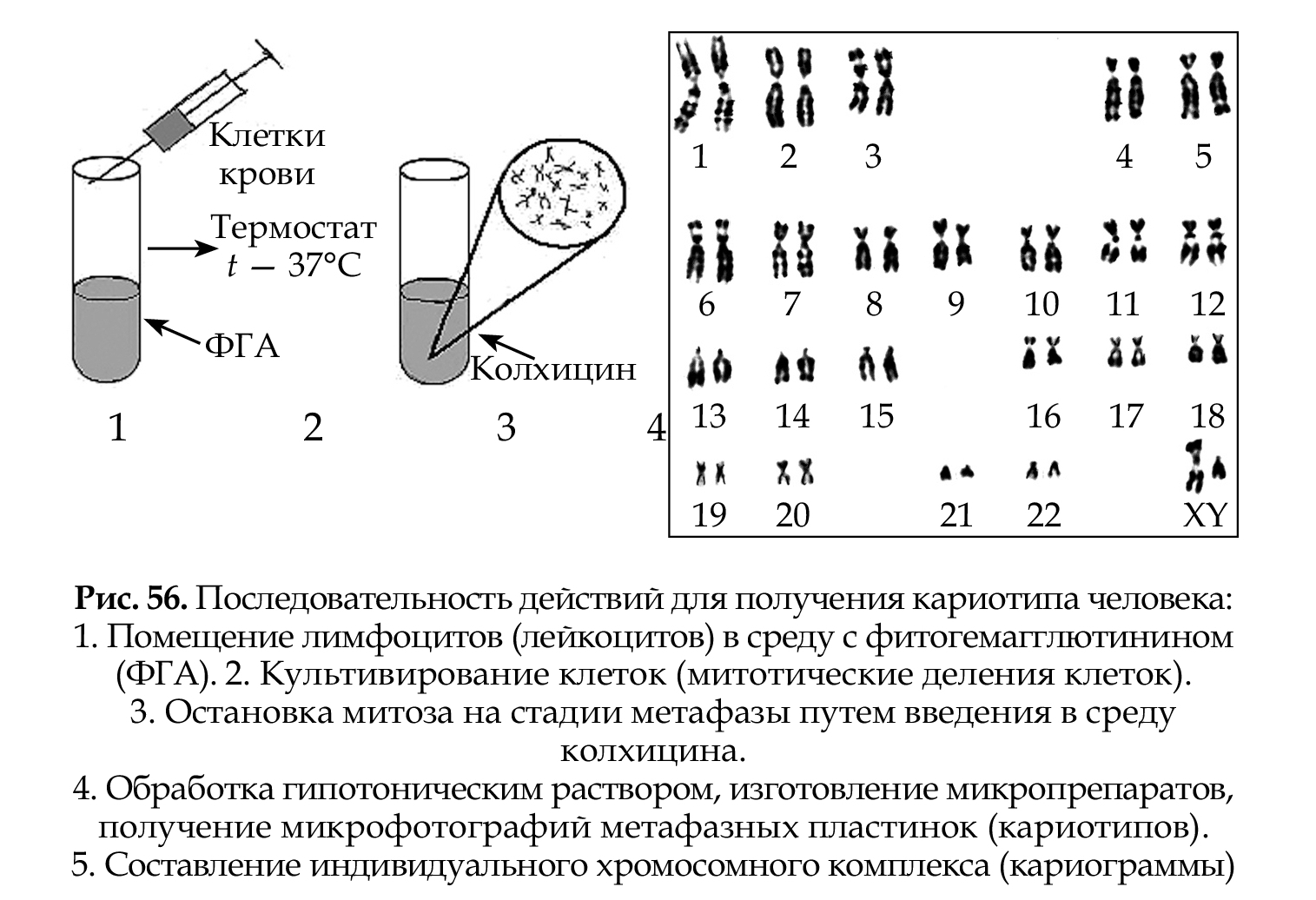
На рис. 56 представлена последовательность действий для получения кариотипа человека.
Половой хроматин
В клетках мужчин (кариотип 46, XY) Х-хромосома всегда выполняет ак-тивную функцию, а у женщин (46, XX) одна Х-хромосома является активной, а другая Х-хромосома находится в неактивном, спирализованном состоянии. Она выявляется в виде компактной темной глыбки в интерфазном ядре соматических клеток нормальных женщин и называется тельцем Барра или половым Х-хроматином. Инактивация одной из двух Х-хромосом происходит в эмбриогенезе, причем закономерности в инактивации отцовской или материнской хромосомы нет (гипотеза Лайон). При любом числе Х-хромосом в активном состоянии будет только одна, следовательно, половой Х-хроматин в норме выявляется только у женщин и отсутствует у мужчин.
Зная число глыбок полового хроматина, можно определить число Х-хромосом по формуле п + 1, где п — число глыбок, а 1 — активная Х-хромосома; и наоборот, зная число Х-хромосом, можно определить число телец Барра по формуле п -1, где п — число Х-хромосом, а 1 — активная Х-хромосома (табл. 12).
У мужчин в норме выявляется Y-половой хроматин (он представляет длинное плечо Y-хромосомы), который обнаруживается с помощью люминисцентной микроскопии и выглядит в виде яркого пятна диаметром 0,3-1 мкм.
Изменение числа глыбок полового хроматина происходит при геномных мутациях (изменение числа X- и Y-хромосом). Определение полового хроматина используется как экспресс-метод при пренатальном и постнатальном определении пола и диагностике хромосомных болезней (см. табл. 12).

Классификация хромосом человека
Хромосомный набор (кариотип) соматической клетки характеризуется формой хромосом, их количеством, размерами, характерными для каждого вида. Препараты хромосом можно приготовить извсех тканей и клеточных суспензий, содержащих делящиеся клетки. Наиболее часто препараты метафазных хромосом готовят из лимфоцитов периферической крови, которые предварительно культивируют в присутствии стимулятора митозов — митогена фитогемаг- глютинина (ФГА), так как клетки периферической крови не делятся.
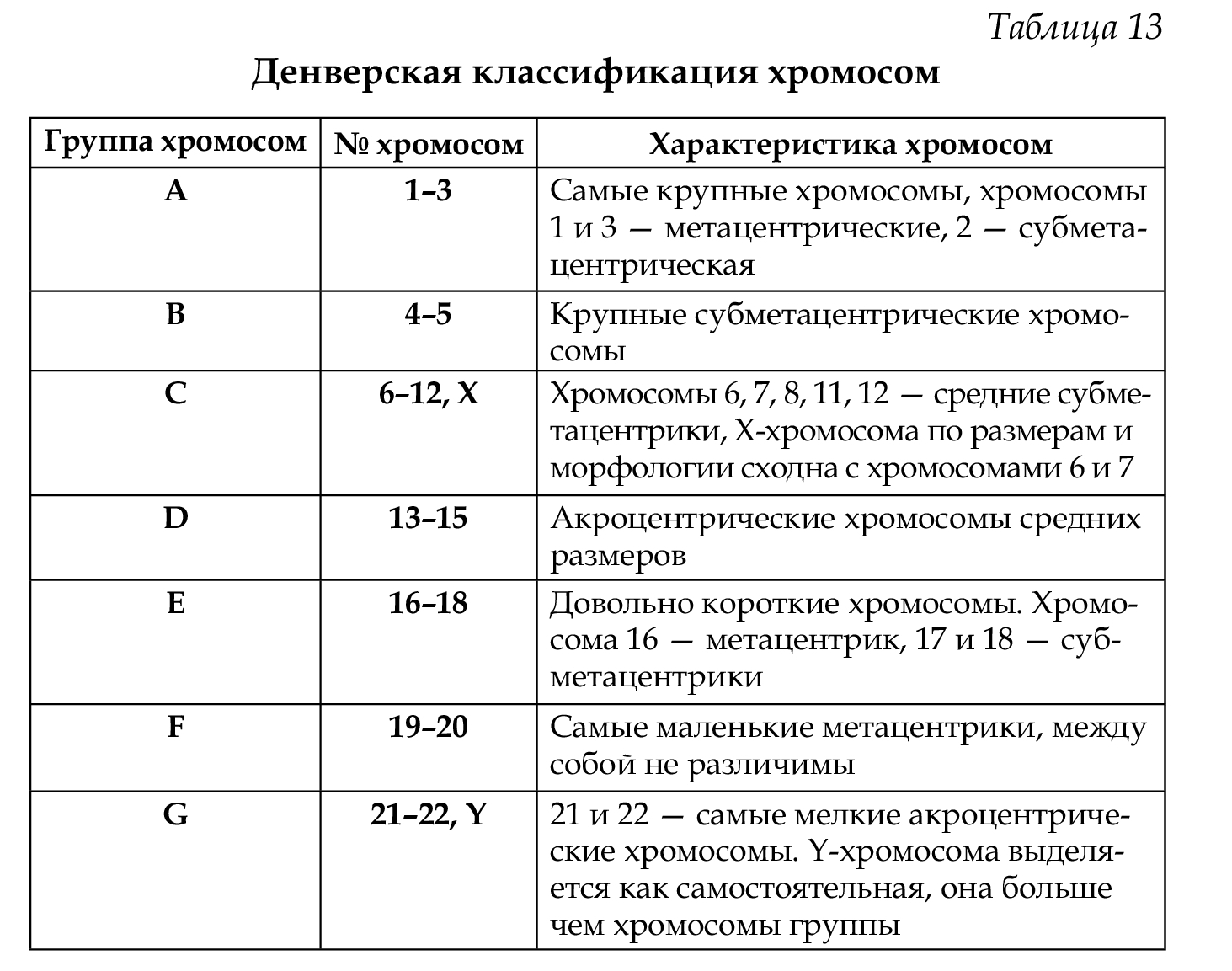
Классификация и номенклатура равномерно окрашенных хромосом (стандартное окрашивание) была разработана на международных совещаниях в Денвере (1960), Лондоне (1963) и Чикаго (1966). Согласно рекомендациям этих конференций, хромосомы располагаются в порядке уменьшения их длины от 1 до 23 хромосомы. Они разделены на 7 групп, которые обозначены буквами английского алфавита от А до G. Все пары хромосом предложено нумеровать арабскими цифрами: группа А 1-3, В 4-5, С 6-12 и Х-хромосома, D 13-15, Е 16-18, F 19- 20, G 21-22, Y-хромосома (табл. 13). При этом хромосомы различных групп хорошо отличаются друг от друга (критерии: размер и форма — метацентрические, субметацентрические, акроцентрические), в то время как внутри группы их сложно различить, за исключением хромосом группы А (рис. 64,65).
Важным параметром является центромерный индекс, который отражает в процентах длину короткого плеча к длине всей хромосомы, например, хромосома № 1 — 48,3%, хромосома № 22 — 22,1%.
Парижская классификация хромосом
В начале 70-х годов XX века был разработан метод дифференциальной окраски хромосом, выявляющий характерную сегментацию, который позволил индивидуализировать каждую хромосому (рис. 58). Различные типы сегментов обозначают по методам, с помощью которых они выявляются наиболее отчетливо (Q-сегменты, G-сегменты, Т-сегменты, S-сегменты). Каждая хромосома человека содержит свойственную только ей последовательность полос, что позволяет идентифицировать каждую хромосому. Хромосомы спирализованы максимально в метафазе, менее спирализованы в профазе и прометафазе, что позволяет выделить большее число сегментов, чем в метафазе.


Классификация хромосом человека
Хромосомная теория наследственности была сформулирована Т. Морганом, основные положения которой сводятся к следующему:
• гены находятся в хромосомах, каждый ген занимает в хромосоме определенное место (локус);
• гены в хромосомах располагаются линейно;
• каждая хромосома представляет собой группу сцепления генов;
• число групп сцепления у каждого вида равно гаплоидному набору хромосом;
• между гомологичными хромосомами в процессе кроссинговера происходит обмен аллельными генами, что приводит к формированию новых сочетаний аллелей в группах сцепления;
• расстояние между генами в хромосоме пропорционально проценту кроссинговера между ними.
Изучение сцепленного наследования явилось основой для составления генетических карт сцепления у разных организмов. Методы классической генетики, цитогенетики и молекулярной генетики позволили подойти к составлению современных генетических карт
Генетическая карта — это система элементов генома, упорядоченная на основе хромосомной принадлежности и взаимного расположения генов в пределах отдельных хромосом, т. е. она определяет принадлежность генов к хромосоме и их расположение относительно друг друга. Возможность ее построения обусловлена линейным характером локализации генов в хромосомах и относительной стабильностью их расположения.
Выделяют следующие генетические карты: карты сцепления, цитологические карты, цитогенетические карты индивидуальных хромосом, рестрикционные и секвенсовые карты. Они различаются единицами измерения (морганида, пара нуклеотидов — п. н., мегабаза — 1 млн оснований) и набором элементов генома.
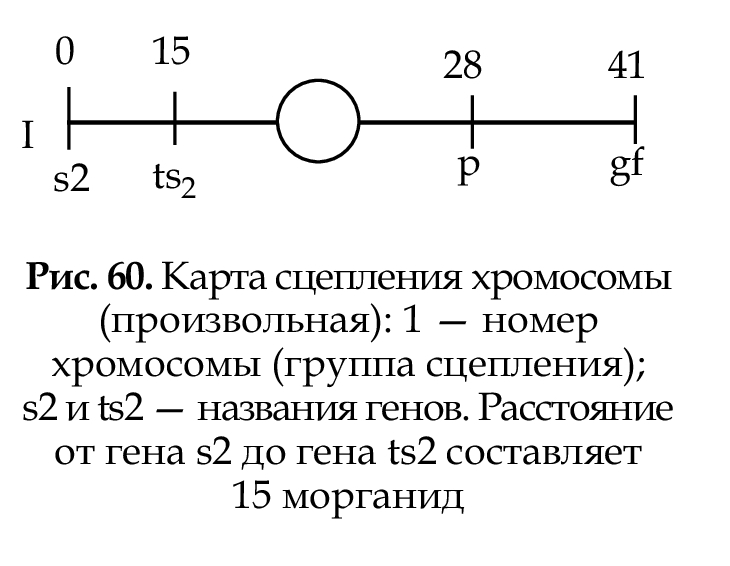
Карта сцепления — схема расположения генов, находящихся в одной группе сцепления, т. е в одной хромосоме (рис. 60). За единицу расстояния между генами принята морганида, которая отражает частоту кроссинговера.Одна морганида — расстояние между генами, при котором кроссинговер происходит в 1% гамет (1 морганида = 1% кроесинговера. При составлении картсцепления указываются: номер хромосомы; полное или сокращенное название генов;
расстояние в морганидах от одного из концов хромосомы, принятого за нулевую точку; место центромеры.
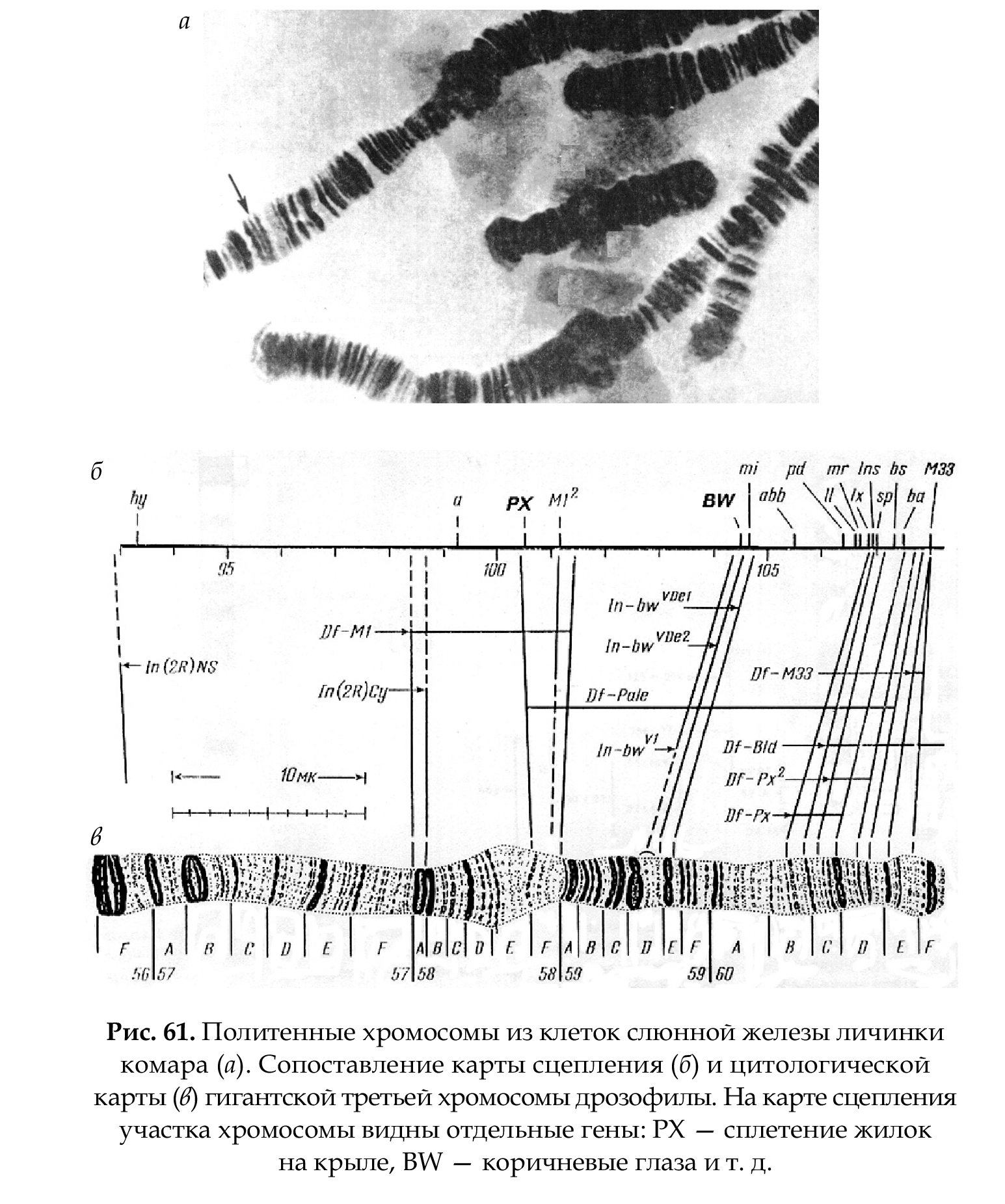
Цитологическая карта составляется на основании из- учения политенных хромосом (рис. 61 а, б), что позволяет сопоставить структуру синтезируемого белка с определенным участком хромосомы (геном), так как транскрибируемый участок определяется под ми- кроскопом в виде пуфа. Это позволяет определить локализацию гена. Изучение политенных хромосом имеет экспери- ментальный характер, так как у человека их нет.
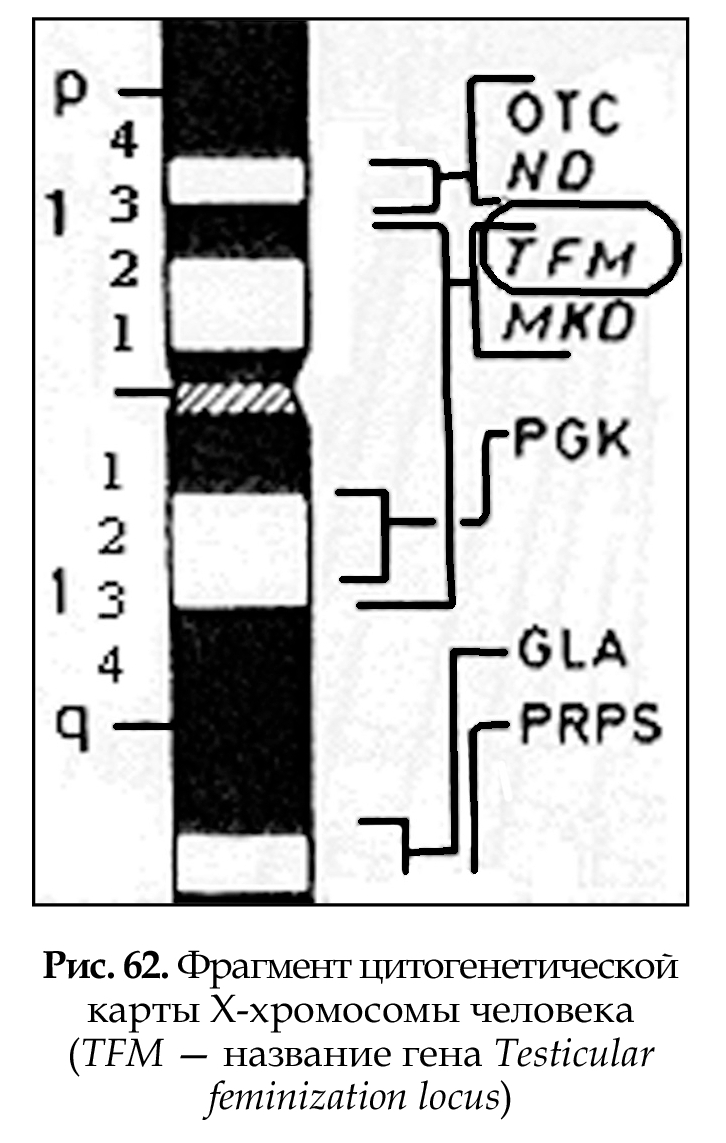
Цитогенетические карты хромосом (рис. 62) составляются на основе дифференциальной окраски (темные и светлые полосы) и картирования генов в отдельных локусах хромосом (основа Парижской классификации). Современные методы окрашивания позволяют выявить до 1000 полос. В среднем на хромосому человека приходится 50 полос. Каждая полоса содержит 3 х 106 пар нуклеотидов, что соответствует нескольким сотням генов (районы и сегменты). Картирование генов в хромосомах является результатом современных молекулярно-генетических методов исследования.
Различные хромосомы и их участки картированы с разной степенью детализации: на Х-хромосоме картировано 400 генов, на хромосоме № 1 — 200 генов. Плотность расположения уже картированных генов в разных хромосомах неравномерна: в 19 хромосоме — 178 генов, в 13 хромосоме — 40 генов, хотя 19 хромосома вдвое меньше, чем 13. На хромосомах № 2 и № 7 примерно одинаковое количество генов, около 175. Каждый картированный ген становится точкой отсчета в геноме, т. е. молекулярным маркером. Генетическое картирование необходимо для определения нуклеотидной последовательности гена и прилегающих к нему участков.
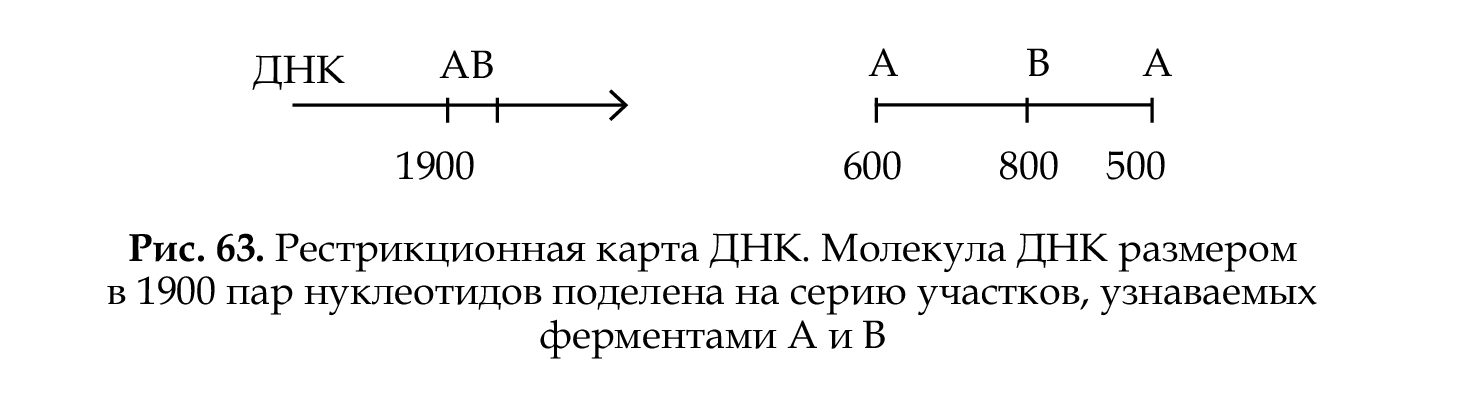
Рестрикционные карты ДНК представляют собой участки ДНК с определенной нуклеотидной последовательностью. Для их получения необходимо выделить ДНК, разрезать в определенных точках рестриктазами, локализовать точки разрыва — сайты расщепления. Карта ДНК, полученная в результате локализации точек разрыва, называется физической рестрикционной картой (рис. 63). Рестрикционная карта ДНК представляет собой линейную последовательность сайтов расщепления, находящихся на определенном расстоянии друг от друга. Расстояние между сайтами рестрикции измеряют в нуклеотидных парах ДНК.
Секвенсовые карты содержат данные о последовательности всех нуклеотидов в целой молекуле ДНК, а не в отдельных ее фрагментах.

Цитогенетическое исследование – это качественное и количественное изучение набора хромосом для выявления аномалий, которые могут явиться причиной бесплодия, наследственных заболеваний или рождения ребенка с врожденными пороками развития.
Показания к назначению цитогенетического исследования
Цитогенетический метод используется для изучения кариотипа человека и диагностики наследственных заболеваний, вызванных хромосомными мутациями. Также он представляет диагностическую ценность при выявлении мутагенного воздействия лекарственных веществ.
- подозрение хромосомной патологии по симптомам;
- первичная аменорея;
- бесплодие неясного генеза;
- многократные спонтанные аборты, замершая беременность;
- врожденные пороки развития у ребенка;
- задержка умственного и физического развития у ребенка;
- случаи мертворождения, врожденных пороков развития и ранней детской смертности в семье;
- нарушение формирования половых различий у новорожденного.
Цитогенетическое исследование (кариотипирование) проводится у детей для обнаружения генетических заболеваний и у семейных пар при бесплодии. Также анализ необходим перед проведением вспомогательной репродуктивной технологии (ЭКО, ИКСИ).
Как подготовиться к исследованию
Кариотипирование назначается после консультации врача-генетика по показаниям.
Генетическая диагностика требует соблюдения следующих правил подготовки:
- за 1,5-2 часа до сдачи необходимо принять пищу, так как нельзя сдавать анализ натощак;
- накануне исключить алкоголь, курение, значительные физические нагрузки;
- исключить прием антибиотиков за один месяц до сдачи;
- не рекомендуется одновременная сдача анализов, требующих строгой подготовки (клинические, биохимические);
- нельзя сдавать анализ на фоне инфекционных/воспалительных заболеваний (отложить на две недели).
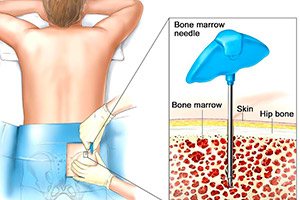
Молекулярное исследование может проводиться прямой и непрямой методикой. Прямой метод – это цитогенетический анализ клеток костного мозга, эмбриона или опухолей. Для непрямого метода в качестве материала используются лейкоциты периферической крови (лимфоциты), которые исследуют после специальной подготовки.
Результаты исследования
Результат составляется согласно Международной номенклатуре цитогенетики. Запись кариотипа должна отвечать стандартному формату: [общее количество аутосом], [половые X или Y-хромосомы], [особенности].
В норме человеческий кариотип выглядит так:
- 46, XY – нормальный мужской;
- 46, XX – нормальный женский.
Варианты патологии могут выражаться различными формами кариотипов. Различают следующие виды хромосомных нарушений:
- количественные аномалии (триплоидия, полиплоидия, моносомия, дисомия, трисомия, полисомия, аномалии половых хромосом);
- структурные аномалии (делеции, инверсии, транслокации, кольцевая хромосома, изохромосома).
Структурные аномалии встречаются редко, но характеризуются тяжелой симптоматикой. Обнаружение хромосомных перестроек цитогенетическим анализом позволяет определить причину бесплодия и спрогнозировать риск рождения детей с генетическими заболеваниями.
Факторы, влияющие на результаты исследований

На качество диагностики влияет соблюдение подготовки, курение, алкоголь, физические нагрузки и стресс. Состав рациона питания и прием лекарственных препаратов не оказывают никакого влияния.
Основными факторами являются:
- правильно выбранный материал для цитогенетического исследования;
- качество окрашивания препарата;
- квалификация врача-цитогенетика.
Достоверные результаты требуют соблюдения всех этапов анализа. После взятия крови лимфоциты культивируются на специальной среде, активирующей митоз (деление клеток). При достижении метафазы добавляется вещество, останавливающее деление (колхицин/колцемид). В эту фазу набор хромосом наиболее различим. После обработки гипотоническим раствором лимфоциты переносят на предметное стекло, фиксируются и окрашиваются. Окрашенный препарат изучается под световым микроскопом. Цитогенетическое исследование клеток костного мозга не требует дополнительных воздействий на клетки.
Интерпретация результата
Расшифровка результатов должна проводиться врачом. При постановке диагноза учитываются результаты цитогенетического исследования хромосом, анамнез, клиническая картина и показатели других лабораторных тестов.
В норме кариотип человека состоит из 22 пар аутосом и двух половых хромосом (46XX, 46XY).
При генетических заболеваниях кариотипы могут представляться следующим образом:
Структурные патологии записываются в форме: [номер хромосомы], [плечо], [номер участка], [номер полосы]. Длинное плечо обозначается буквой q, а короткое – буквой p. Делеции, выявленные у мужчины, зачастую являются причиной мужского бесплодия. А в некоторых случаях они могут провоцировать врожденные патологии у плода.
Если выявлен патологический хромосомный набор, то в обязательном порядке показана консультация медицинского генетика. Только специалист может провести правильную интерпретацию результатов. Если патология обнаружена на этапе планирования беременности, врач объяснит паре риск рождения больного ребенка. Дальнейшее решение будут принимать будущие родители.
Читайте также:

