Доклад по теме алканы алкены алкины
Обновлено: 07.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Государственное бюджетное образовательное учреждение
средняя общеобразовательная школа №225 Адмиралтейского района Санкт-Петербурга
А Л К Е Н Ы
Туганова Диана Владиславовна
Воронаев Иван Геннадьевич
Рисунок 1 - Структурная формула n-алкенов
Алкены - ненасыщенные ациклические углеводы, называемые также олефинами, имеющих общую формулу CnH2n, структурная формула представлена на рисунке 1. Алкены имеют один или более двойных связей между атомами углерода, поэтому называются ненасыщенными. Другое название - олефины.
Этилен, являющийся простейшим алкеном, плоский с валентными углами, близкими к 1200. Это соответствует sp2-гибридизации обоих атомов углерода. В рамках модели гибридных орбиталей связи С-Н образуются путем перекрывания sp2-гибридных АО углерода и 1S-орбиталей водорода. Связь С-Н в этилене (1,076Е , 108ккал/моль) короче и прочнее связи С-Н в этане (1,095Е , 98 ккал/моль), которая образована перекрыванием sp3-гибридной орбитали углерода и 1S-орбитали водорода. Это означает, что sp2-орбиталь более короткая и более электроотрицательная по сравнению с sp3-орбиталью атома углерода. -Связь двух атомов углерода в этилене образуется за счет перекрывания двух эквивалентных sp2-гибридных орбиталей каждого из атомов углерода, тогда как -связь возникает при перекрывании двух негибридизованных рz-орбиталей каждого из углеродных атомов. Эти орбитали параллельны, что обеспечивает их максимальное перекрывание. -Связь имеет плоскость симметрии, перпендикулярную плоскости всей молекулы этилена.
Суммарное распределение электронной плотности - и -связей между атомами углерода в этилене сильно отличается от того, которое можно представить на основании только -связи или только -связи. Вращение вокруг углерод-углеродной связи должно сопровождаться нарушением перекрывания рZ-орбиталей и, следовательно, энергетический барьер для такого вращения должен быть достаточно высок. Известны, например, два 1,2-дидейтероэтилена, резко различающихся по своим спектральным характеристикам и другим физическим свойствам.[1]
Впервые этилен был получен в 1669 немецким химиком и врачом Бехером действием серной кислоты на этиловый спирт. Ученый установил, что его "воздух" более химически активный, чем метан, однако, идентифицировать полученный газ он не смог и названия ему не дал [2].
Во второй и тем же способом "воздух Бехера" был получен и описан голландские химики Дейман, Потс-ван-Трооствиком, Бондом и Лауверенбургом в 1795. Они назвали его "маслородным газом" так как при взаимодействии с хлором, он образовывал маслянистую жидкость - дихлорэтан (об этом стало известно позже). Французский химик Антуан Фуркруа ввел этот термин в практику, а когда были обнаружены другие углеводороды такого же типа, это название стало нарицательным для всего класса олефинов (или, по современной номенклатуре, алкенов) [3].
В начале XIX века французский химик Ж. Гей-Люссак обнаружил, что этанол состоит из "маслородного" газа и воды. Этот же газ он проявил и в хлористый этил [4] 1828 года Ж. Дюма и П. Булле предположили, что этилен представляет собой основу, способную давать соли подобно аммиака. Якоб Берцелиус принял эту идею, назвав состав "етерином" и обозначив буквой E [5].
Определив, что этилен состоит из водорода и углерода, долгое время химики не могли выписать его истинную формулу. В 1848 Кольбе писал формулу этилена как С 4 Н 4, этого же мнения придерживался и Либих. Ж. Дюма правильно определил состав вещества, но его структура и ранее была описана неверно: В2НН3 [6] .
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия при повышенном давлении.

Присоединение галогенов по двойной связи С=С происходит легко при обычных условиях (при комнатной температуре, без катализатора). Образуются дигалогеналканы:
![]()

При взаимодействии алкенов с галогеноводородами (НCl, НBr) образуются галогеналканы.


Присоединение галогеноводородов к алкенам несимметричного строения происходит по правилу В.В. Марковникова.
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются одноатомные спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов.
![]()

Присоединение воды к несимметричным алкенам идет по правилу Марковникова.

Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и др.
А) Полное (избыток О2).
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
Как и все углеводороды, алкены горят в кислороде, и при этом образуют диоксид углерода и воду [7]:
Алкены обладают большой реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π–Связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов.
Наличие подвижной, легко поляризуемой π–связи приводит к тому, что алкены легко вступают в реакции присоединения.
Главные свойства алкенов:
1. Непредельные углеводороды активно вступают в реакции присоединения.
2. Реакционная активность алкенов связана с тем, что - связь под действием реагентов легко разрывается.
3. В результате присоединения происходит переход атомов углерода из sp2 – в sp3- гибридное состояние. Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других алкенов под давление или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение.
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Этилен (этен) Н2С=СН2 используется для получения политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Применяется как средство для ускоренного созревания фруктов.
Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука. [8]
Курц А.Л., Ливанцов М.В., Ливанцова Л.И. АЛКЕНЫ (Часть I). Методическая разработка для студентов III курса – М., 1998
Меншуткин Н. Очеркъ развития химическихъ воззри Ҍ ней. - С-Петербургъ: Тип. В.Демакова, 1888. - С. 252-264.
Фигуровский Н. А. История химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. - М.: Просвещение, 1979. - С. 102.
Меншуткин Н. Очеркъ развития химическихъ воззри Ҍ ней. - С-Петербургъ: Тип. В.Демакова, 1888. - С. 252-264.
Нециклические и циклические углеводороды. Последовательность органических соединений с одинаковыми функциональными группами и однотипным строением. Физические свойства циклоалканов, алкенов, алканов и алкинов. Химические свойства циклопарафинов.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 05.10.2011 |
| Размер файла | 82,5 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Углеводороды имеют важное научное и практическое значение. Во-первых, представления о строении и свойствах этих веществ служат основой для изучения органических соединений других классов, т.к. молекулы любых органических веществ содержат углеводородные фрагменты. Во-вторых, знание свойств углеводородов позволяет понять исключительную ценность этих соединений как исходного сырья для синтеза самых разнообразных органических веществ, широко используемых человеком.
Углеводороды содержатся в земной коре в составе нефти, каменного и бурого углей, природного и попутного газов, сланцев и торфа. Запасы этих полезных ископаемых на Земле не безграничны. Однако до настоящего времени они расходуются главным образом в качестве топлива (двигатели внутреннего сгорания, тепловые электростанции, котельные) и лишь незначительная часть используется как сырье в химической промышленности. Так, до 85% всей добываемой нефти идет на получение горюче-смазочных материалов и лишь около 15% применяется как химическое сырье. Поэтому важнейшей задачей является поиск и разработка альтернативных источников энергии, которые позволят более рационально использовать углеводородное сырье.
АЛКАНЫ,АЛКИНЫ,АЛКЕНЫ,ЦИКЛОПАРАФИНЫ И ДИЕНЫ
Первым членом гомологического ряда алканов является метан СН4. Окончание -ан является характерным для названий предельных углеводородов. Далее следует этан С2Н6, пропан С3Н8, бутан С4Н10. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания -ан. Это пентан С5Н12 гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т. д.
В гомологическом ряду наблюдается постепенное изменение физических свойств углеводородов: повышаются температуры кипения и плавления, возрастает плотность. При обычных условиях (температура ~ 22°С) первые четыре члена ряда (метан, этан, пропан, бутан) -- газы, с С5Н12 до С16Н34 - жидкости, а с С17Н36 -- твердые вещества.
Алканы, начиная с четвертого члена ряда (бутана), имеют изомеры .
Все алканы насыщены водородом до предела (максимально). Их атомы углерода находятся в состоянии sp 3 --гибридизации, а значит, имеют простые (одинарные) связи.
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 -- 30 °С. При обычных условиях алкены С2 - С4 -- газы. С5 - С15 -- жидкости, начиная с C16 -- твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Алкинами называются непредельные углеводороды, молекулы которых содержат одну тройную связь. Первый представитель этого класса -- ацетилен НС ? СН, в связи с чем алкины также называют ацетиленовыми углеводородами. Ближайшие гомологи ацетилена:
органический углеводород алкан
Простейший алкин с разветвленным углеродным скелетом:
Общая формула гомологического ряда алкинов СnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами.
Строение. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Две s-связи, образованные гибридными орбиталями, располагаются по одной линии под углом 180° друг к другу; две p-связи образованы при перекрывании двух пар негибридных 2p-орбиталей соседних атомов углерода. Дополнительное связывание двух атомов углерода приводит к тому, что расстояние между ядрами уменьшается, поскольку тройная связь является сочетанием одной s- и двух p-связей. Длина тройной связи С ? С составляет 0,120 нм, что меньше длины как одинарной, так и двойной связи. Энергия тройной связи составляет 828 кДж/моль.
Структурная изомерия алкинов обусловлена изомерией углеродного скелета (например, 3-метилбутин-1 и пентин-1) и изомерией положения тройной связи (бутин-1 и бутин-2). Пространственная изомерия для алкинов не характерна.
Номенклатура. В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алкана окончание -ан заменяется на -ин. В разветвленных алкинах выбирают главную цепь так, чтобы она содержала тройную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение тройной связи, например:
Диемны (диеновые углеводороды) -- ненасыщенные углеводороды с открытой цепью, содержащие в молекуле не менее двух двойных связей и образующие гомологический ряд общей формулы CnH2n-2. Диены являются структурными изомерами алкенов.
Диеновые углеводороды различаются расположением двойных связей:
1) кумулированными, как в бутадиене-1,2 (CH2=C=CH-CH3)
2) сопряжёнными, как в бутадиене-1,3 (СH2=CH-CH=CH2)
3) изолированнми, когда двойные связи располагаются через две и более простые связи С-С
Наибольшее значение имеют диеновые углеводороды с сопряжёнными двойными связями, в их молекулах двойные связи разделены одной одинарной связью. Например, дивинил СН2=СН--СН=СН2, изопрен СН2=С(СНз)--СН=СН2 и др.
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название - циклоалканы (циклопарафины). Общая формула гомологического ряда циклоалканов CnH2n, то есть циклоалканы изомерны этиленовым углеводородам. Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан.
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами
Для циклопарафинов, начиная с C4H8, характерны некоторые виды структурной изомерии, связанные: a) с числом углеродных атомов в кольце - например, (этилциклопропан), (метилциклобутан); b) с числом углеродных атомов в заместителях - (1-метил-2-пропилциклопентан), (1,2-диэтилциклопентан) c) с положением заместителя в кольце - (1,1-диметилциклогексан), (1,2-диметилциклогексан)
Для циклоалканов характерна также межклассовая изомерия с алкенами. При наличии двух заместителей в кольце у разных углеродных атомов возможна геометрическая цис-транс-изомерия, начиная с C5H10, и оптическая изомерия. Оптическая изомерия проявляется в том случае, если молекула не имеет плоскости симметрии.
Для изучения названных видов изомерии необходимо просмотреть анимационный фильм "Цис-транс-изомерия в циклических соединениях" (данный материал доступен только на CD-ROM). Текст, сопровождающий этот фильм, в полном объеме перенесен в данный подраздел и ниже следует.
Цис-транс-изомерия в циклических соединениях
“При наличии двух заместителей в циклических соединениях также возможна цис-транс-изомерия. Метильные группы в приведенных примерах могут располагаться по одну сторону плоскости кольца (такой изомер называется цис-изомером) и по разные стороны (такой изомер называется транс-изомером).
Естественно, что при наложении друг на друга моделей цис- и транс- изомеров они не совмещаются. Взаимные изомеризации требуют разрыва цикла с последующим его замыканием или разрыва связи заместителя с углеродным атомом цикла и образованием новой связи с другой стороны цикла.
Следует отметить, что в циклических соединениях возможно возникновение не только цис-транс-, но и зеркальной изомерии. При наложении модели молекулы цис-изомера с одинаковыми заместителями и ее зеркального отражения они совмещаются, в то время как таковое невозможно для цис-изомера с различными заместителями. Для транс-изомеров совмещение модели молекулы и ее зеркального отражения невозможно как при одинаковых, так и различающихся заместителях.
Кроме того, в ряду циклоалканов существенное значение имеет поворотная изомерия. Для изучения этого вида изомерии в применении к циклическим соединениям необходимо просмотреть анимационные фильмы "Циклобутан, циклопентан и их конформации" и "Циклогексан и его конформации" (данный материал доступен только на CD-ROM). Тексты, сопровождающие эти фильмы, в полном объеме перенесены в данный подраздел и ниже следуют.
Циклобутан, циклопентан и их конформации
“Циклические соединения - это такие органические соединения,в которых углеродные атомы составляют замкнутые цепи, т.е. циклы. Простейшими представителями таких соединений являются циклопарафины или циклоалканы.
Прочность связей в циклических соединениях зависит от числа атомов, участвующих в образовании цикла. Она определяется степенью его напряженности, обусловленной изменением валентных углов атомов цикла и отклонением этих атомов от нормального направления (см. "теорию напряжения" Байера, разработанную им в 1885 году).
Для циклопропана межъядерные углы составляют 60?, как в равностороннем треугольнике, для циклобутана - 90?, как в квадрате, а в циклопентане - 108?, как в правильном пятиугольнике. Нормальный валентный угол для атома углерода - 109,5?. Поэтому при расположении в названных соединениях всех атомов углерода в одной плоскости уменьшение валентных углов составляет в циклопропане - 49,5?, в циклобутане - 19,5?, в циклопентане - 1,5?.
Чем больше отклонение валентного угла от нормального, тем более напряжены и, следовательно, непрочны циклы. Однако в отличие от циклопропана циклобутан и циклопентан имеют неплоские циклы. Один из атомов углерода непрерывно выходит из плоскости. Циклобутан существует в виде неплоских "сложенных" конформаций. Циклопентан характеризуется конформацией "конверт". Таким образом, обсуждаемые циклы находятся в колебательном движении, приводящем к уменьшению "заслоненности" атомов водорода у соседних углеродных атомов и снижению напряжения."
Циклогексан и его конформации "Для циклогексана, как правильного шестиугольника, межъядерные углы составляют 120?. Если бы молекула циклогексана имела плоское строение, то отклонение от нормального валентного угла атома углерода составляло:109,5?-120? = 10,5?.
Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях "кресла" и "ванны". Конформация "кресла" менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию (inversio - с латинского переворачивание, перестановка) с промежуточным образованием конформера II:
ось симметрии II III I
Двенадцать связей C-H, которые имеются у циклогексана в конформации "кресла", делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e- связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a- связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три - в другую (имеется чередование: вверх-вниз)."
Одними из наиболее часто применяющихся способов получения циклоалканов являются следующие:
1) циклизация дигалогенопроизводных углеводородов:
a) при действии цинка в этиловом спирте на соответствующее дигалогенопроизводное цепь углеродных атомов замыкается, приводя к циклоалкану (Г.Густавсон).
Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях.
Алкены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) - sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее - вторичный и заметно труднее - первичный.
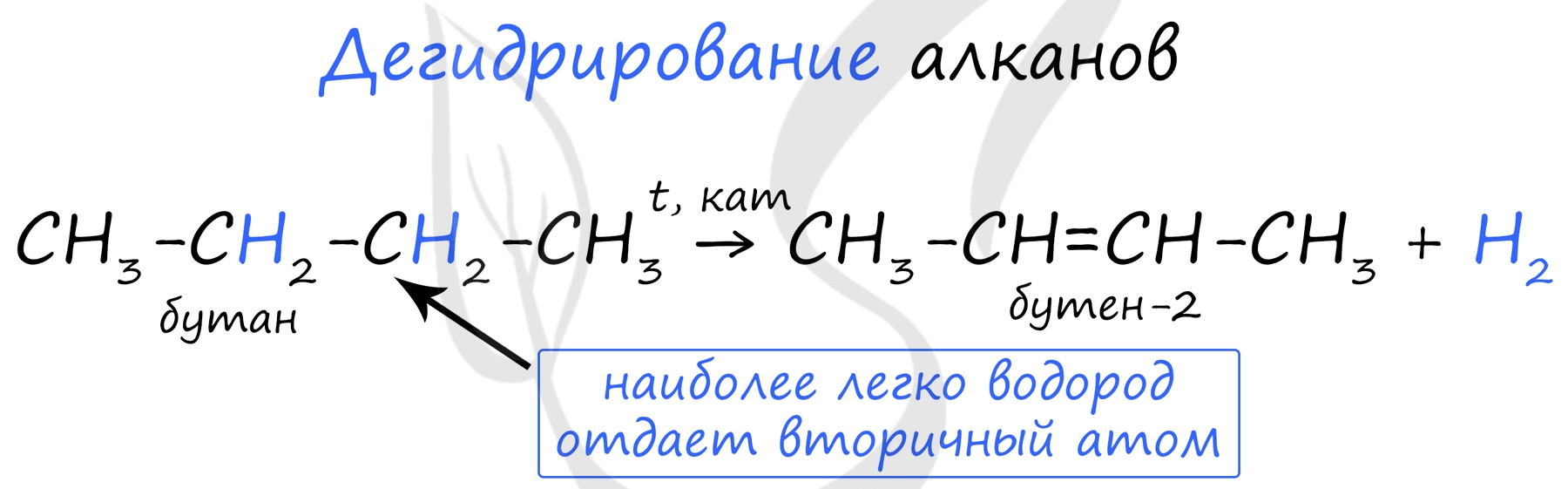
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) - двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой - H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены - ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.

Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа - к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды - полное окисление. При неполном окислении образуются окиси.

Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета - MnO2.
В более жестких условиях - при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы - двойной связи.

Полимеризация - цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс "n", степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Предельными углеводородами (алканами) называются соединения, состоящие из атомов углерода и водорода, соединенных между собой только σ-связями. В алканах атомы углерода находятся в состоянии sp 3 -гибридизации.
3.1 Алканы: определениек,изомерия и номенклатура
Для предельных углеводородов характерна структурная изомерия. Изомеры этого типа отличаются друг от друга порядком связей между отдельными атомами в молекуле (структурой углеродной цепи).

триметилизобутилметан трет-бутилнеопентилметан
Способы получения алканов
Главным природным источником предельных углеводородов является нефть, а для первых членов гомологического ряда – природный и попутный газы.
Выделение индивидуальных соединений из нефти или продуктов ее крекинга – задача весьма трудоемкая, поэтому приходится прибегать к синтетическим методам получения.
1. Алканы могут быть получены при восстановлении алкенов или алкинов водородом в присутствии катализаторов. Катализаторами гидрирования и дегидрирования чаще всего используют специальным образом обработанные металлические платину, палладий или никель.


2. Самые разнообразные производные алканов могут быть восстановлены при высокой температуре восстановителями или водородом на катализаторе. Обычно эта реакция используется для восстановления галогенопроизводных:


бромистый этил этан
3. Предельные углеводороды образуются при действии воды на металлоорганические соединения:

бромистый этилмагний этан
4. В лабораторной практике алканы получают сплавлением солей карбоновых кислот со щелочами:

ацетат натрия метан
5. При действии металлического натрия на моногалогенопроизводные (реакция Вюрца):

2 CH3─CH2─J 2NaJ + CH3─CH2─CH2─CH3
Если в реакции Вюрца участвуют два типа галогенопроизводных, то образуется смесь трех различных алканов, так как вероятность встречи в реакционном комплексе молекул одинаковых или разных равна:

6. Электролиз солей карбоновых кислот (реакция Кольбе):

Анионы кислотного остатка окисляются на аноде с образованием свободных радикалов:

которые объединяются в молекулы предельных углеводородов:

Физические свойства
Согласно теории химического строения А.М.Бутлерова, физические свойства алканов, как и других органических соединений, определяются их составом и строением.
В гомологическом ряду предельных углеводородов четыре первых члена при обычной температуре – газы, далее следуют жидкости и, начиная с С16Н34 – твердые вещества.
Таблица 3.1 - Физические свойства некоторых алканов
| Углеводород | tпл, о С | tкип, о С | Плотность г/см 3 | Показатель рефракции |
| Метан СН4 Этан С2Н6 Пропан С3Н8 н-Бутан С4Н10 Изобутан С4Н10 н-Пентан С5Н12 Изопентан С5Н12 Неопентан С5Н12 н-Гексан С6Н14 н-Гептан С7Н16 н-Октан С8Н18 Изооктан (2,2,4-триметилпентан) н-Нонан С9Н20 н-Декан С10Н22 н-Пентадекан С15Н32 н-Эйкозан С20Н42 н-Гектан С100Н202 | -182,5 -182,8 -187,6 -138,3 -159,4 -129,8 -159.9 -16,6 -95,3 -90,6 -56,8 -107,4 -53.6 -29,7 10,0 36,4 115,2 | -161,6 -88,6 -42,1 -0,5 -11,7 36,0 27,9 9,5 68,7 98,5 125,7 99,2 150,8 174,0 270,5 205,0 (2кПа) - | 0,416 1 0,546 1 0,508 2 0,584 2 0,563 2 0,563 0,626 0,613 0,660 0,684 0,703 0,692 0,718 0,730 0,765 0,777при tпл - | - - 1,3378 1 1,3326 - 1,3575 1,3537 1,3513 1,3749 1,3838 1,3974 1,3915 1,4056 1,4120 1,4313 - - |
1 .При температуре кипения
2 . В жидком состоянии под давлением
Алканы – вещества неполярные и труднополяризуемые. Растворимость их в воде ничтожна. Атомы в молекулах предельных углеводородов соединены только σ-связями. Расстояния между соседними углеродными атомами 0,154 нм. В коротких цепях по С-С связям возможно свободное или почти свободное вращение.
Алканы поглощают ультрафиолетовое излучение в области длин волн менее 200 нм (они бесцветны). В ИК спектрах для них характерны полосы в области 2800 – 3000 см –1 (валентные колебания связи С-Н) 1380 -1470 см –1 (деформационные колебания той же связи). Полосы поглощения, отвечающие колебаниям связи С-С, мало интенсивны и трудно идентифицируются.
ЯМР-спектры алканов трудно расшифровываются, так как химические сдвиги различным образом расположенных протонов имеют близкие значения (около 0,5 – 2 м.д.)
Химические свойства
Химические превращения предельных углеводородов могут происходить либо за счет разрыва цепи углеродных атомов, либо за счет отрыва атомов водорода с последующим замещением их другими атомами или группами. Поэтому для предельных углеводородов характерны реакции расщепления и замещения.

Процессы расщепления связей С-С или С-Н с образованием свободных радикалов требуют большой энергии активации и поэтому при обычной температуре идут только в присутствии катализаторов.
Место вступления заместителя в молекулу алкана определяется в первую очередь вероятностью образования того или иного радикала, т.е. прочностью связей водородного атома с углеродом и стабильностью возникающего радикала.
Радикальное галогенирование
Замещение водородных атомов на галоген – одна из наиболее характерных реакций предельных углеводородов. С F2 реакция идет со взрывом, а с J2 – процесс ограничен равновесием, т.к. йодистый водород восстанавливает образующиеся йодистые алкилы. Следовательно, скорость галогенирования с одной стороны зависит от природы галогена (F>>Cl>Br>J), а с другой от строения углеводорода. Общеизвестно, что легче всего галогенирование протекает по третичному углеродному атому, а труднее всего – по первичному.
Галогеном можно заместить как один атом водорода в молекуле, так и все.




Галогенирование алканов на свету или под действием высоких температур протекает по цепному радикальному механизму и является типичным примером радикального замещения (SR).
На первой стадии под влиянием света происходит гомолитический разрыв связи в молекуле брома и она распадается на два радикала:

Br2 2 Br *
Атом или молекула подобного типа, содержащие неспаренный электрон, называются свободными радикалами и, как правило, существуют лишь доли секунды, так как мгновенно реагируют с присутствующими веществами.
Поэтому на следующей стадии реакции радикал Br • атакует молекулу метана, образуя бромистый водород и углеводородный радикал – метил:
Образовавшийся органический радикал атакует молекулу брома и регенерирует радикал галогена:
Этот процесс может продолжаться бесконечно долго, но на практике течение цепных реакций ограничивается так называемыми процессами обрыва цепи, при которых радикалы, реагируя один с другим, выбывают из процесса:
Кроме того, они могут взаимодействовать с примесями или со стенками сосуда.
Нитрование
Концентрированная азотная кислота при обычной температуре почти не действует на предельные углеводороды, а при нагревании действует как окислитель. М. И. Коновалов предложил проводить нитрование предельных углеводородов разбавленной азотной кислотой при нагревании (около 140 о С). По механизму реакция нитрования является свободно радикальным процессом:

В случае разветвленной молекулы алкана легче всего замещается водород у третичного углеродного атома. В промышленных условиях нитрование осуществляют оксидами азота.
Читайте также:

