Доклад по химии пропан
Обновлено: 02.07.2024
Пропан C3H8 – это предельный углеводород, содержащий три атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :

При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:

Это соответствует тетраэдрическому строению.
| Например, в молекуле пропана C3H8 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет образует угол, т.е. геометрия молекулы — уголковая или V-образная. |
Для пропана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Пропан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для пропана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для пропана характерны радикальные реакции.
Пропан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Пропан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании пропана образуется смесь хлорпроизводных.
Бромирование протекает более медленно и избирательно.
Хлорпропан может взаимодействовать с хлором и дальше с образованием дихлорпропана, трихлорпропана, тетрахлорпропана и т.д.
1.2. Нитрование пропана
Пропан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в пропане замещается на нитрогруппу NO2.
2. Дегидрирование пропана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
3. Окисление пропана
Пропан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Пропан горит с образованием углекислого газа и воды. Реакция горения пропана сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении пропана в недостатке кислорода может образоваться угарный газ СО или сажа С.
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии бутаноата натрия с гидроксидом натрия при сплавлении образуются пропан и карбонат натрия:
CH3–CH2 – CH2 –COONa + NaOH → CH3–CH2 – CH3 + Na2CO3
3. Гидрирование алкенов и алкинов
Пропан можно получить из пропилена или припина:

При гидрировании пропена образуется пропан:

При полном гидрировании пропина также образуется пропан:

4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
Это промышленный процесс получения алканов.
Из угарного газа и водорода можно получить пропан:
5. Получение пропана в промышленности
В промышленности пропан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы.

Пропан — это органическое соединение, третий представитель алканов в гомологическом ряду. При комнатной температуре он представляет собой газ без цвета и запаха. Химическая формула пропана - C3H8. Пожаро- и взрывоопасен. Обладает небольшой токсичностью. Он оказывает слабое воздействие на нервную систему и обладает наркотическими свойствами.
Строение
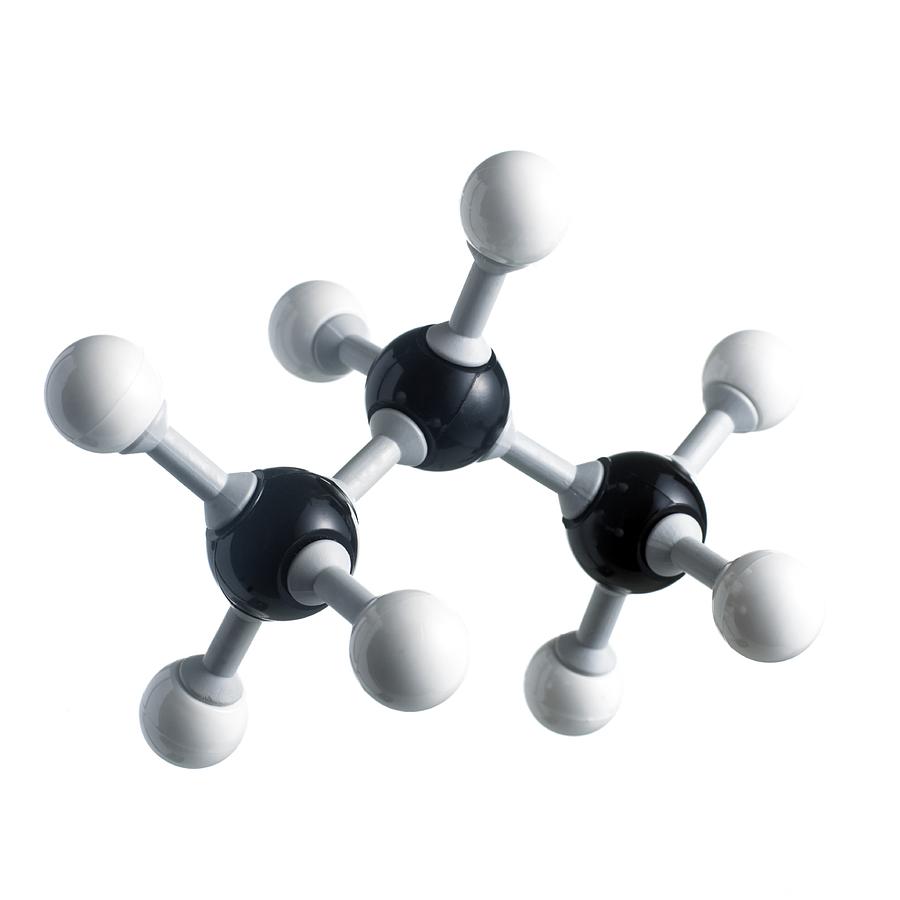
Пропан — это предельный углеводород, состоящий из трех атомов углерода. По этой причине он имеет изогнутую форму, но из-за постоянного вращения вокруг осей связей существует несколько молекулярных конформаций. Связи в молекуле ковалентные: С-С неполярные, C-H слабополярные. Из-за этого их сложно разорвать, а вещество довольно трудно вступает в химические реакции. Это и задает все химические свойства пропана. Изомеров у него нет. Молярная масса пропана - 44,1 г/моль.
Способы получения
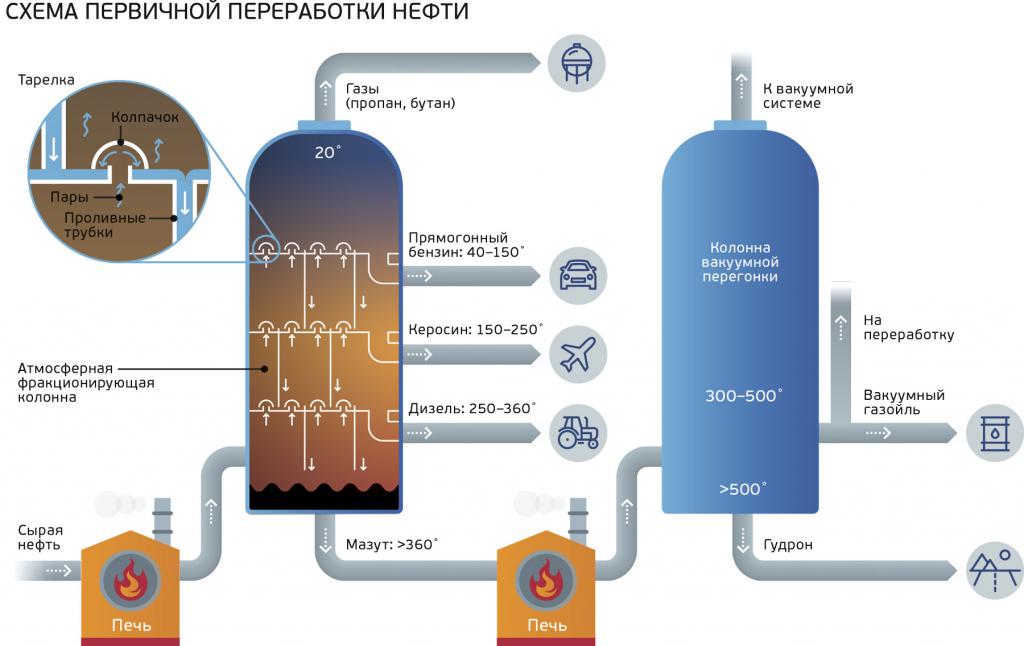
В промышленности пропан почти не синтезируют искусственно. Его выделяют из природного газа и нефти с помощью перегонки. Для этого существуют специальные производственные установки.
В лаборатории пропан можно получить следующими химическими реакциями:
-
Данная реакция идет только при повышении температуры и при наличии катализатора (Ni, Pt, Pd).
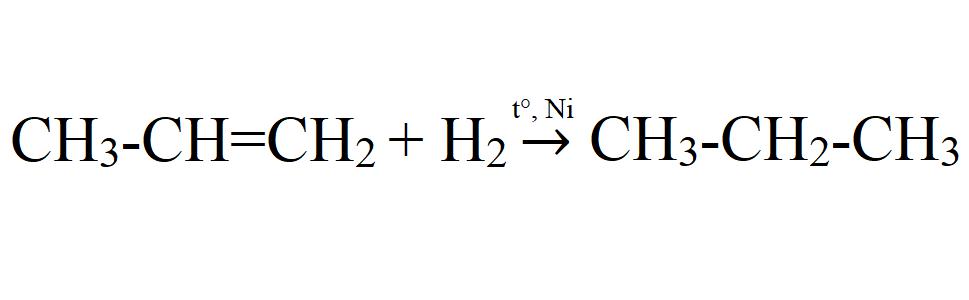
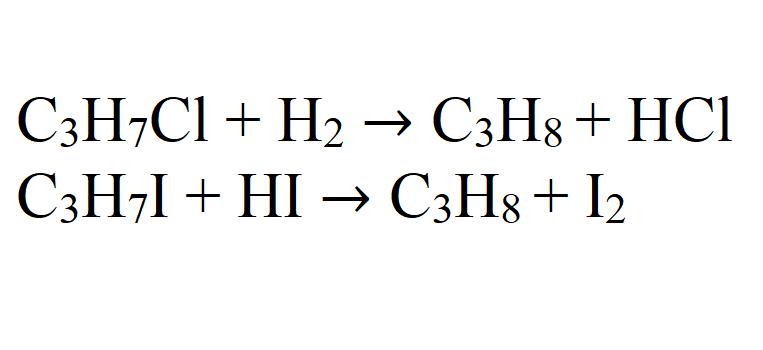
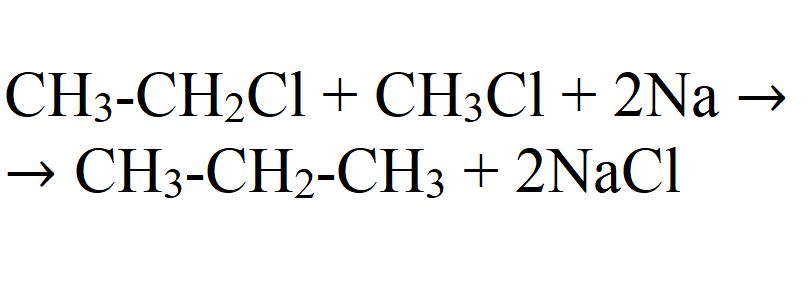
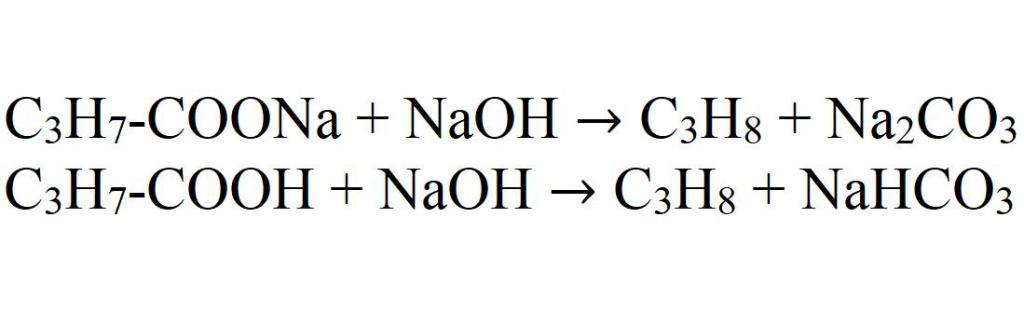
Физические свойства пропана
Как уже упоминалось, пропан — это газ без цвета и запаха. Он не растворяется в воде и других полярных растворителях. Зато растворяется в некоторых органических веществах (метанол, ацетон и другие). При - 42,1 °C сжижается, а при − 188 °C становится твердым. Огнеопасен, так как образует с воздухом легковоспламеняющиеся и взрывоопасные смеси.
Химические свойства пропана
Они представляют собой типичные свойства алканов.
-
Каталитическое дегидрирование. Осуществляется при 575 °C с использованием катализатора оксида хрома (III) или оксида алюминия.
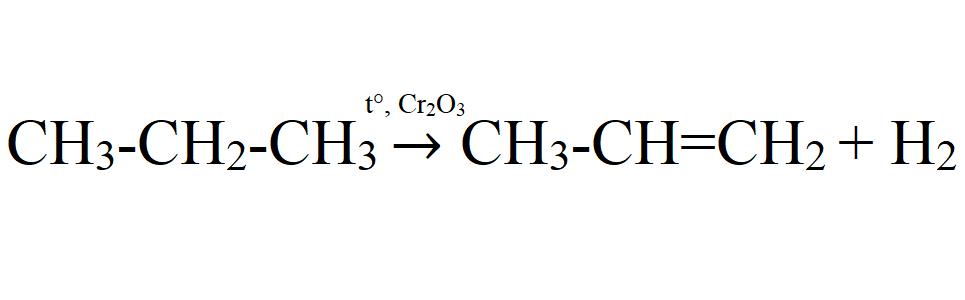
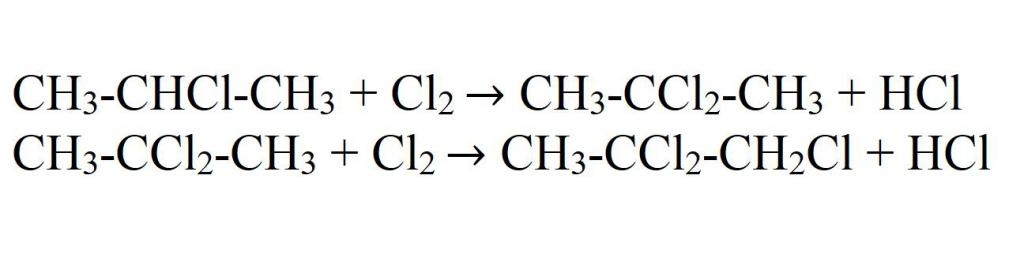
Механизм реакций галогенирования — цепной. Под действием света или высокой температуры молекула галогена распадается на радикалы. Они вступают во взаимодействие с пропаном, отнимая у него атом водорода. В результате этого образуется свободный пропил. Он взаимодействует с молекулой галогена, вновь разбивая ее на радикалы.
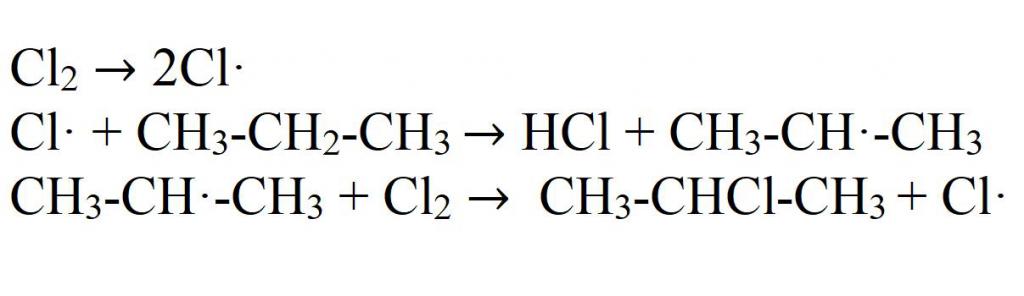
Бромирование происходит по такому же механизму. Йодирование можно осуществлять только специальными йодсодержащими реагентами, так как пропан не взаимодействует с чистым йодом. При взаимодействии с фтором происходит взрыв, образуется полизамещенное производное пропана.
Нитрование может осуществятся разбавленной азотной кислотой (реакция Коновалова) или оксидом азота (IV) при повышенной температуре (130-150 °C).
Сульфоокисление и сульфохлорирование осуществляется при УФ-свете.
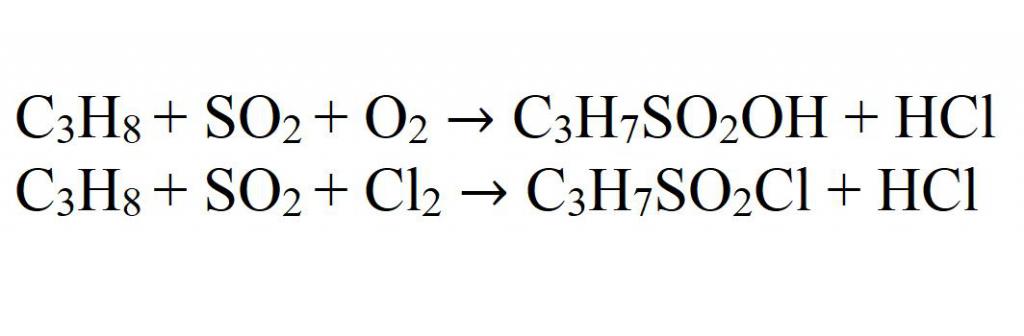
Можно провести и более мягкое окисление, используя определенные катализаторы. Реакция горения пропана будет другой. В этом случае получают пропанол, пропаналь или пропионовую кислоту. В качестве окислителей, кроме кислорода, могут использоваться перекиси (чаще всего перекись водорода), оксиды переходных металлов, соединения хрома (VI) и марганца (VII).
Пропан реагирует с серой с образованием изопропилсульфида. Для этого в качестве катализаторов используется тетрабромэтан и бромид алюминия. Реакция идет при 20 °C в течение двух часов. Выход реакции составляет 60 %.
С теми же катализаторами может реагировать с оксидом углерода (I) с образованием изопропилового эфира 2-метилпропановой кислоты. Реакционная смесь после реакции должна быть обработана изопропанолом. Итак, мы рассмотрели химические свойства пропана.
Применение

Из-за хорошей горючести пропан находит применение в быту и промышленности как топливо. Он может быть использован также в качестве горючего для автомобилей. Пропан горит с температурой почти 2000° C, поэтому его используют для сварки и резки металла. Пропановыми горелками разогревают битум и асфальт в дорожном строительстве. Но зачастую на рынке используется не чистый пропан, а его смесь с бутаном (пропан-бутан).
Как ни странно, но нашел он применение и в пищевой промышленности как добавка Е944. Благодаря своим химическим свойствам пропан используется там в качестве растворителя ароматизаторов, а также для обработки масел.
Смесь пропана и изобутана используется как хладагент R-290a. Он более эффективен, чем старые хладагенты, и также является экологически чистым, так как не разрушает озоновый слой.
Большое применение пропан нашел в органическом синтезе. Его используют для получения полипропилена и различного рода растворителей. В нефтепереработке его используют для деасфальтизации, то есть уменьшения доли тяжелых молекул в битумной смеси. Это необходимо для вторичного использования старого асфальта.
Содержание
Физические свойства
Бесцветный газ без запаха [3] . Очень мало растворим в воде. Точка кипения −42,1 °C. Точка замерзания −188 °C. Образует с воздухом взрывоопасные смеси при концентрации паров от 2,1 до 9,5 %. Температура самовоспламенения пропана в воздухе при давлении 0,1 МПа (760 мм рт. ст.) составляет 466 °С. Критическая температура пропана Tкр = 370 К, критическое давление Pкр = 4,27 МПа, критический удельный объем Vкр = 0,0444 м 3 /кг [4] Плотность сжатого и сжиженного пропана при 298 K — 0,493 кг/л.
- Плотность жидкой фазы = 510 кг/м 3 [5] .
- Плотность газовой фазы при нормальных условиях = 2,019 кг/м 3 .
- Плотность газовой фазы при температуре при 15°С = 1,900 кг/м 3 .
Химические свойства
Аналогичны свойствам других представителей ряда алканов (дегидрирование, хлорирование и т. д.)
Применение
Топливо


- При выполнении газопламенных работ на заводах и предприятиях:
- в заготовительном производстве;
- для резки металлолома;
- для сварки неответственных металлоконструкций.
- При кровельных работах.
- Для обогрева производственных помещений в строительстве.
- Для обогрева производственных помещений (на фермах, птицефабриках, в теплицах).
- Для газовых плит, водогрейных колонок в пищевой промышленности.
- В быту
- при приготовлении пищи в домашних и походных условиях;
- для подогрева воды;
- для сезонного обогрева отдалённых помещений — частных домов, отелей, ферм;
- для сварки труб, теплиц, гаражей и других хозяйственных конструкций с использованием газосварочных постов.
- В последнее время широко используется в качестве автомобильного топлива, так как дешевле и экологически безопаснее бензина.
Хранится и перевозится в металлических баллонах ярко-красного цвета (не путать с коричневыми баллонами для гелия)
Химия и пищевая промышленность
В химической промышленности используется при получении мономеров для производства полипропилена.
Является исходным сырьём для производства растворителей.
Хладагент
Смесь из осушенного чистого пропана (R-290a) (коммерческое обозначение для описания изобутаново-пропановых смесей) с изобутаном (R-600a) не разрушает озонового слоя и обладает низким коэффициентом парникового потенциала (GWP). Смесь подходит для функционального замещения устаревших хладагентов (R-12, R-22, R-134a) в традиционных стационарных холодильных установках и систем кондиционирования воздуха (с обязательной сменой типа компрессорного масла).
Примечания
- Алканы
- Нефтепродукты
- Пищевые добавки
- Хладагенты
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Пропан" в других словарях:
ПРОПАН — (С3Н8), бесцветный, легковоспламеняющийся газ, третий в АЛИФАТИЧЕСКОМ РЯДУ УГЛЕВОДОРОДОВ. Встречается в ПРИРОДНОМ ГАЗЕ, из которого пропан и добывается. Получается также при ПЕРЕГОНКЕ нефти. Пропан применяется в качестве топлива (в виде… … Научно-технический энциклопедический словарь
пропан — а, м. propan m. нем. Propan <гр. pro перед, до + pion жир. Органическое соединение, представляющее собой насыщенный углеводород; применяется как бытовое топливо и в двигателях внутреннего сгорания. БАС 1. Только газ гармонирует с современным… … Исторический словарь галлицизмов русского языка
ПРОПАН — Углеводород, находимый в сырой нефти, газ. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. пропан органическое соединение, насыщенный углеводород алифатического ряда; газ без цвета и запаха; содержится в природных… … Словарь иностранных слов русского языка
ПРОПАН — СН3СН2СН3, бесцветный газ, tкип ?42,1 .С. Содержится в природных и нефтяных газах, образуется при крекинге нефтепродуктов. Применяется, напр., для получения пропилена, нитрометана. В смеси с бутаном используется как бытовой газ … Большой Энциклопедический словарь
Пропан — С3Н8, насыщенный углеводород парафинового ряда. В стандартных условиях П. газ без цвета и запаха, относится к пожаро и взрывоопасным веществам. Молекулярная масса 44,097 кг/кмоль, температура плавления 85,47 К, температура кипения 231,08 К,… … Энциклопедия техники
пропан — сущ., кол во синонимов: 3 • алкан (37) • топливо (48) • углеводород (77) Словарь синонимов ASIS … Словарь синонимов
Пропан — Пропан, диметилметан, C3H8= СН3. СН2. СН3 углеводород предельногоряда CnH2n+2, находится в природе в сырой нефти, газообразен, сгущаетсяв жидкость ниже 17 … Энциклопедия Брокгауза и Ефрона
ПРОПАН — (CH3CH2CH3) предельный (насыщенный) углеводород ряда метана; бесцветный газ. Содержится в природных и нефтяных газах, в газах нефтепереработки. Применяют в органическом синтезе (напр., в производстве пропилена), а также как растворитель,… … Российская энциклопедия по охране труда
Пропан — ПРОПАН, C3H8, бесцветный горючий газ, tкип 42,1 °C. Содержится в природных и нефтяных газах, образуется при крекинге нефтепродуктов. В смеси с бутаном используется как бытовое и моторное топливо. … Иллюстрированный энциклопедический словарь
Физические свойства
Бесцветный газ без запаха[4]. Очень мало растворим в воде. Точка кипения −42,1 °C. Точка замерзания −188 °C. Образует с воздухом взрывоопасные смеси при концентрации паров от 1,7 до 10,9 %. Критическая температура пропана Tкр = 370 К, критическое давление Pкр = 4,27 МПа, критический удельный объём Vкр = 0,00444 м3/кг[5] Плотность сжиженного пропана при 298 K — 0,493 т/м3.
- Плотность газовой фазы при нормальных условиях = 2,019 кг/м3.
- Плотность газовой фазы при температуре 15°С = 1,900 кг/м3.
- Удельная теплота сгорания = 48 МДж/кг.
![]()
Пропан является ископаемым топливом и компонентом природного газа. На протяжении миллионов лет он образовывался из органических остатков организмов и добывался из подземных отложений. Газ пропан — это органическое соединение, состоящее из трех молекул атомов углерода, связанных с восемью атомами водорода. Тип углерод-углерод-углерод-водородных связей определяет структуру молекул пропана, которая следует той же схеме, что и другие типы природных газов, таких как метан и бутан.
Пропан. Классификация
Пропан классифицируется как органическое соединение, потому что он содержит углерод. Кроме того, он классифицируется как углеводород, потому что он принадлежит к группе органических соединений, которые состоят только из углерода и водорода. Более конкретно, пропан представляет собой тип углеводорода, называемый алканом. Атомы в молекулах алканов удерживаются вместе ковалентными связями, а атомы углерода всегда образуют четыре ковалентные связи.
Химическая формула пропана
Алканы следуют общей формуле с заданным отношением атомов углерода к атомам водорода: C_nH2_n + 2. Простейшим алканом является метан, иначе известный как природный газ. Он содержит один атом углерода, связанный с четырьмя атомами водорода. Для метана n = 1, поэтому число атомов водорода у него равно 2 (1) +2, что равно 4. Этан содержит два атома углерода, связанных вместе, и каждый атом углерода связан с тремя атомами водорода в общей сложности шесть атомы водорода. Пропан имеет цепочку из трех атомов углерода с химической формулой C3H8, потому что цепочка из трех атомов углерода требует 2 (3) +2 атомов водорода, что равно восьми. Бутан, другой распространенный алкан, используемый в качестве топлива в ручных газовых горелках, имеет четыре атома углерода, связанных с десятью атомами водорода, с химической формулой C4H10.
Структура пропана
Алканы могут иметь структуру с прямой или разветвленной цепью. Пропан представляет собой алкан с прямой цепью, с атомами углерода, структурированным C-C-C. Средний углерод имеет одну связь с каждым из конечных атомов углерода и имеет два атома водорода. Каждый из концевых атомов углерода имеет связь с центральным атомом углерода и каждый из них связан с тремя атомами водорода. С точки зрения отдельных атомов углерода, пропан может быть выражен как CH3CH2CH3, который эквивалентен C3H8, но делает структуру пропана более явной.
Свойства пропана
Помимо структурных сходств, общих для алканов с прямой цепью, они также имеют сходные свойства. Пропан и другие углеводороды являются неполярными. Это свойство диктует, что они могут смешиваться только с другими неполярными веществами. Например, масла и другие виды топлива изготавливаются из смеси углеводородов. Они не будут смешиваться с полярным веществом, таким как вода; притяжение между молекулами разделяет масло и воду. В случае алканов с прямой цепью температура кипения и температура плавления увеличиваются с увеличением числа молекул углерода. Температура кипения пропана составляет -44 градуса по Фаренгейту (-42 градуса по Цельсию), а температура плавления составляет -306 градусов по Фаренгейту (-189 градусов по Цельсию). Метан, имеющий только один углерод, имеет более низкую температуру кипения, чем пропан, при температуре -164 градуса Цельсия. Октан имеет восемь атомов углерода и температуру кипения 98 градусов по Цельсию.
Использование пропана
Из-за низкой температуры кипения пропан обычно находится в газообразном состоянии. Когда к пропану применяются правильные значения давления и температуры, он проходит процесс, называемый сжижением, который переводит газ пропан в жидкое состояние. Пропан может храниться в виде жидкости в резервуарах под давлением значительно выше его температуры кипения. Сжиженный газ пропан используется в качестве топлива для отопления, которое сжигается в энергетических печах и водонагревателях. Он также используется в качестве топлива для приготовления пищи на открытом воздухе на газовых грилях и в походных печах, работающих на газе. Газ пропан также является компонентом пропеллентов, используемых в аэрозольных баллончиках. Пропан также используется в качестве компонента в некоторых типах клеев, герметиков и красок.
Применение
Топливо
Несмотря на более высокую цену, пропан во многом удобнее природного газа (метана), т.к. в отличие от метана сжижается при комнатной температуре и сравнительно невысоком давлении (12-15 атм), а метан при комнатной температуре не сжижается, и его приходится хранить сжатым под высоким давлением (200-250 атм). Поэтому баллоны для пропана значительно легче и дешевле метановых, и содержат гораздо больше газа (например, 50-литровый метановый баллон весит 55 кг и вмещает 9 кг газа, а пропановый такого же объема весит 19 кг и вмещает 22 кг газа, кроме того, пропановый баллон в 3-4 раза дешевле. Композитные баллоны в 2-3 раза легче, но еще в несколько раз дороже). Это делает пропан гораздо более удобным для хранения и транспортировки, поэтому пропан (или его смесь с бутаном) широко применяется для подключения переносного газового оборудования (переносные газовые плитки, газовые горелки для кровельных работ и т.д.), в качестве автомобильного топлива, а также для газификации небольших отдаленных населенных пунктов или отдельных зданий, для которых строительство газопровода природного газа экономически нецелесообразно.
![]()
Баллон пропана на лёгком грузовике![]()
Классический стальной газовый баллон на 50 литров- При выполнении газопламенных работ на заводах и предприятиях: в заготовительном производстве;
- для резки металлолома;
- для сварки неответственных металлоконструкций.
- При кровельных работах.
- При дорожных работах для разогрева битума и асфальта.
- В качестве топлива для переносных электрогенераторов.
- Для обогрева производственных помещений в строительстве.
- Для обогрева производственных помещений (на фермах, птицефабриках, в теплицах).
- Для газовых плит, водогрейных колонок в пищевой промышленности.
- В быту при приготовлении пищи в домашних и походных условиях;
- для подогрева воды;
- для сезонного обогрева отдалённых помещений — частных домов, отелей, ферм;
- для сварки труб, теплиц, гаражей и других хозяйственных конструкций с использованием газосварочных постов.
- В последнее время широко используется в качестве автомобильного топлива, так как дешевле и экологически безопаснее бензина.
Хранится и перевозится в металлических баллонах ярко-красного цвета и полимерно-композитных баллонах (не путать с коричневыми баллонами для гелия)
Химия и пищевая промышленность
В химической промышленности используется для получения пропилена, сырья для производства полипропилена.
Является исходным сырьём для производства растворителей.
Используется как пропеллент.
Хладагент
Смесь из осушенного чистого пропана (R-290a) (коммерческое обозначение для описания изобутаново-пропановых смесей) с изобутаном (R-600a) не разрушает озоновый слой и обладает низким коэффициентом парникового потенциала (GWP). Смесь подходит для функционального замещения устаревших хладагентов (R-12, R-22) в традиционных стационарных холодильных установках и системах кондиционирования воздуха (с обязательной сменой типа компрессорного масла).
Пропан — органическое вещество класса алканов (насыщенные углеводороды, парафины — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2). Содержится в природном газе, образуется при крекинге нефтепродуктов (высокотемпературная переработка нефти и её фракций с целью получения, как правило, продуктов меньшей молекулярной массы — моторных топлив, смазочных масел и т. п., а также сырья для химической и нефтехимической промышленности).
Бесцветный газ без запаха, очень мало растворим в воде. Температура кипения -42,1°С. Температура плавления -187,6°С. Образует с воздухом взрывоопасные смеси при концентрации паров от 2,1 до 9,5%. Температура самовоспламенения пропана в воздухе при давлении 0,1 МПа (760 мм рт. ст.) составляет 466 °С.
Аналогичны свойствам других представителей ряда алканов (горение, дегидрирование, галогенирование, нитрирование, крегинг).
Благодаря своим свойствам, таким как высокая теплотворная способность при сгорании, сгорание без остатка, безвредность и безопасность при правильной эксплуатации, удобство в использовании, пропан является универсальным газом и широко используется и на производстве, и в быту. Для производственных и бытовых целей поставляется в виде смеси пропан-бутановой технической. Бутан (C4H10) — органическое соединение класса алканов. На сегодняшний день спрос на СПБТ огромен.
На производстве При выполнении газопламенных работ на заводах и предприятиях: — в заготовительном производстве; — для резки металлолома; — для сварки неответственных металлоконструкций. При кровельных работах. Для обогрева производственных помещений в строительстве. Для обогрева производственных помещений (на фермах, птицефабриках, в теплицах). Для газовых плит, водогрейных колонок в пищевой промышленности. В быту — при приготовлении пищи в домашних и походных условиях; — для подогрева воды; — для сезонного обогрева отдалённых помещений — частных домов, отелей, ферм; — для сварки труб, теплиц, гаражей и других хозяйственных конструкций с использованием газосварочных постов.
Хладагент. Смесь из осушенного чистого пропана (R-290a) (коммерческое обозначение для описания изобутаново-пропановых смесей) с изобутаном (R-600a) не разрушает озонового слоя и обладает низким коэффициентом парникового потенциала (GWP). Смесь подходит для функционального замещения устаревших хладагентов (R-12, R-22, R-134a) в традиционных стационарных холодильных установках и систем кондиционирования воздуха.
Показатели качества газов углеводородных сжиженных определяются по ГОСТ 10157-79.
Пропан — взрывоопасный газ. С воздухом образует взрывоопасную смесь. Однако, при правильной эксплуатации практически безвреден.
Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Бутан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании бутана образуется смесь хлорпроизводных.
Например, при хлорировании бутана образуются 1-хлорбутан и 2-хлорбутан:
Бромирование протекает более медленно и избирательно.
Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом.
С третичный–Н > С вторичный–Н > С первичный–ННапример, при бромировании пропана преимущественно образуется 2-бромбутан:
Хлорбутан может взаимодействовать с хлором и дальше с образованием дихлорбутана, трихлорбутана, тетрахлорбутана и т.д.1.2. Нитрование бутана
Бутан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в бутане замещается на нитрогруппу NO2.
[td]
Например. При нитровании бутана образуется преимущественно 2-нитробутана:Химические свойства пропана:
Пропан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства пропана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование пропана:
CH3-CH2-CH3 → CH2=CH-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, to = 575 °C).
CH3-CH2-CH3 + Br2 → CH3-CHBr-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH3 + I2 → CH3-CHI-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы пропана, отрывая у них атом водорода, в результате этого образуется свободный пропил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH3 + Br· → CH3-CH·-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH3 + Br2 → CH3-CHBr-CH3 + Br·;
CH3-CH·-CH3 + Br· → CH3-CHBr-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование пропана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH3 + Br2 → CH3-CHBr-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH3 + Br2 → CH3-CBr2-CH3 + HBr (hv или повышенная to);
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
См. нитрование этана.
При избытке кислорода:
C3H8 + 5O2 → 3CO2 + 4H2O.
Горит желтым пламенем.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование пропана:
C3H8 + SO2 + Cl2 → C3H7-SO2Cl + … (hv).
2C3H8 + 2SO2 + О2 → 2C3H7-SO2ОН (повышенная to).
Пропан
Физические свойства
Бесцветный газ без запаха. Очень мало растворим в воде. Точка кипения −42,1 °C. Точка замерзания −188 °C. Образует с воздухом взрывоопасные смеси при концентрации паров от 2,1 до 9,5 %. Температура самовоспламенения пропана в воздухе при давлении 0,1 МПа (760 мм рт. ст.) составляет 466 °С. Критическая температура пропана Tкр = 370 К, критическое давление Pкр = 4,27 МПа, критический удельный объем Vкр = 0,0444 м3/кг. Плотность сжатого и сжиженного пропана при 298 K — 0,493 кг/л.
- Плотность жидкой фазы = 510 кг/м3.
- Плотность газовой фазы при нормальных условиях = 2,019 кг/м3.
- Плотность газовой фазы при температуре при 15°С = 1,900 кг/м3.
Химические свойства
Аналогичны свойствам других представителей ряда алканов (дегидрирование, хлорирование и т. д.)
Применение
Топливо
- При выполнении газопламенных работ на заводах и предприятиях: в заготовительном производстве;
- для резки металлолома;
- для сварки неответственных металлоконструкций.
- При кровельных работах.
- Для обогрева производственных помещений в строительстве.
- Для обогрева производственных помещений (на фермах, птицефабриках, в теплицах).
- Для газовых плит, водогрейных колонок в пищевой промышленности.
- В быту при приготовлении пищи в домашних и походных условиях;
- для подогрева воды;
- для сезонного обогрева отдалённых помещений — частных домов, отелей, ферм;
- для сварки труб, теплиц, гаражей и других хозяйственных конструкций с использованием газосварочных постов.
- В последнее время широко используется в качестве автомобильного топлива, так как дешевле и экологически безопаснее бензина.
Хранится и перевозится в металлических баллонах ярко-красного цвета (не путать с коричневыми баллонами для гелия)
Химия и пищевая промышленность
В химической промышленности используется при получении мономеров для производства полипропилена.
Является исходным сырьём для производства растворителей.
Используется как пропеллент.
Хладагент
Смесь из осушенного чистого пропана (R-290a) (коммерческое обозначение для описания изобутаново-пропановых смесей) с изобутаном (R-600a) не разрушает озонового слоя и обладает низким коэффициентом парникового потенциала (GWP). Смесь подходит для функционального замещения устаревших хладагентов (R-12, R-22, R-134a) в традиционных стационарных холодильных установках и систем кондиционирования воздуха (с обязательной сменой типа компрессорного масла).
![]()
Пропан (общие сведения)
Краткая информация
Пропан представляет собой органическое вещество и относится к классу алканов. Являясь
углеводородным газом, пропан абсолютно прозрачен, взрывоопасен и малотоксичен. Он часто применяется в качестве автомобильного топлива, для отопления и сварочных работ.Формула: C3H8
Температура кипения: 42,09 °C
Плотность при нормальной температуре: 0,5005 г/см3
Температура плавления: 187,6 °C
Молярная масса вещества: 44,1 г/моль
Удельная теплота сгорания: 48 МДж/кг.Общие сведения о пропане
Пропан не способен образовываться естественным путем. При переработке нефти и газа он синтезируется наряду с бензином, дизелем, керосином и смазочными маслами. Этот бытовой газ обычно хранится в виде жидкости под действием давления.
Пропан является третьим членом гомологического ряда насыщенных углеводородов (после метана и этана). При сжигании пропана выделяется огромное количество тепла, а пламя в процессе горения обладает бледно-голубым или бесцветным свечением.
Являясь классическим представителем ряда алканов, пропан не ядовит для человека, но обладает легким наркотическим действием. Кроме того, он взрыво- и пожароопасен.История открытия пропана
Предыстория открытия пропана связана с обнаружением Клодом Луи Бертолле в 1785 году первого газа в гомологическом ряду насыщенных углеводородов. Французский химик, изучая болотный газ, определил его состав и молекулярную формулу. Газ был назван метаном.
Позже, в 30-х годах ХIХ века, Карл фон Райхенбах из буковой смолы сумел образовать смесь высших насыщенных углеводородов. Эту смесь немецкий химик назвал парафином, полагая, что получил не несколько веществ, а одно. Середина ХIХ века была ознаменована получением прочих углеводородов, а в 1868 году они были объединены в общий класс.
В 1910 году эксперт по взрывчатым веществам Горного бюро США – талантливый химик доктор Уолтер О. Снеллинг – впервые выделил пропан, опираясь на данные, полученные ранее Бертолле и Райхенбахом. К 1911 году доктор Снеллинг сумел подготовить некоторое количество этого газа в чистом виде. В 1913 году использованный им способ производства газа был запатентован.Свойства пропана
Пропан лишен цвета и запаха, но при горении может испускать голубоватое свечение. Он плохо растворяется в воде. Вскипает этот газ при температуре 42,1 °C, а замерзает при 188 °C. Присутствие пропана в воздухе в концентрации от 2,1 до 9,5 % делает смесь взрывоопасной. Самостоятельно этот газ, находясь в составе воздуха, способен вспыхнуть при температуре 466 °С (давление, необходимое для самовоспламенения при этой температуре, составляет 760 мм рт. ст.).
Химические свойства пропана полностью определены его принадлежностью к ряду алканов. Пропан вступает в реакции горения, крекинга, дегидрирования, нитрирования, галогенирования. Являясь типичным насыщенным алифатическим углеводородом, пропан обладает большей способностью к вступлению в реакции с другими веществами, чем первые два члена гомологического ряда насыщенных углеводородов – метан и этан.Получение пропана
В чистом виде пропан в природе не существует и естественным путем образовываться не может.
Пропан образуется в ходе нефтехимических процессов, в результате термического разложения – пиролиза – иных органических соединений.
Еще одним промышленным способом получения пропана является некаталитическая прямая гидрогенизация – так называемый процесс Бергиуса. При температуре в 400-500 °С проходит расщепление угля, идет крекинг (высокотемпературная переработка). Под действием катализаторов полученные в результате крекинга ароматические и непредельные углеводороды гидрируются, вступая в реакцию с водородом, подача которого также обеспечивается на производстве. Именно таким образом проходит образование жидких алканов, в том числе пропана.
Пропан, наряду с бутаном и этаном, выделяется при переработке природного газа.
Пропан также образуется как побочный продукт, получаемый в ходе различный химических реакций, например в процессе крекинга нефти в бензин.Применение пропана
В производстве пропан часто используется для проведения сварочных работ, резки металлов и прочих газопламенных работ.
Высокая теплоотдача пропана позволяет с успехом применять его для обогрева производственных помещений, подогрева воды в больших объемах и для газовых плит, используемых в пищевой промышленности. В сфере пищевого производства пропан используется и как пищевая добавка с кодом Е944.
В химической промышленности пропан используют для производства растворителей и как пропеллент – вещество для создания избыточного давления в аэрозольных баллонах.
Очищенный и осушенный пропан в смеси с изобутаном используется в качестве хладагента в стационарных холодильных установках и кондиционерах.
Бытовая сфера применения пропана определяется использованием этого газа в хозяйственных целях. При помощи пропана осуществляется нагрев воды, приготовление пищи, сезонный обогрев частных домов, зданий, используемых для нужд сельского хозяйства, отдельно стоящих отелей. Кроме того пропан может использоваться для сварки небольших металлоконструкций, гаражей, теплиц, труб.
Актуальным становится применение пропана в качестве автомобильного топлива. Этот газ гораздо более экологичен, чем бензин, а стоимость его на порядок ниже.Интересные факты о пропане
Читайте также:
- Доклад хлеб в сша история происхождения
- Главные направления в развитии православной музыки и православного пения доклад
- Размер алиментов взыскиваемых на супругов и бывших супругов в судебном порядке доклад
- Доклад на тему стратегическое планирование и его значение в образовании
- Куликовская битва доклад с картинками





