Ароматизаторы на основе сложных эфиров доклад
Обновлено: 05.07.2024
Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых кислотный водород заменён на алкильные (или вообще углеводородные) радикалы.
Сложные эфиры делятся в зависимости от того, производной какой кислоты они являются (неорганической или карбоновой).
Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Цель моей работы заключается в подробном ознакомлении с таким классом органических соединений, как сложные эфиры и углублённом рассмотрении области применения отдельных представителей этого класса.
Общая формула сложных эфиров карбоновых кислот:
где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Общая формула жиров:
гдеR', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
2. Капроновая кислота СН3 — (CH2 )4 — СООН
3. Пальмитиновая кислота СН3 — (CH2 )14 — СООН
4. Стеариновая кислота СН3 — (CH2 )16 — СООН
5. Олеиновая кислота С17 Н33 СООН
6. Линолевая кислота С17 Н31 СООН
7. Линоленовая кислота С17 Н29 СООН
2. Номенклатура и изомерия
Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс - ат, например:
Для сложных эфиров характерны следующие виды изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинаетсясо сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
3. Физические свойства и нахождение в природе
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.
Приятный аромат цветов, плодов, ягод в значительной степени обусловлен присутствием в них тех или иных сложных эфиров.
Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи.
По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными. Жиры растворимы в органических растворителях и нерастворимы в воде.
4. Химические свойства
1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:
Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
5. Получение
1. Реакция этерификации:
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
2. Взаимодействием ангидридов кислот со спиртами:

3. Взаимодействием галоидангидридов кислот со спиртами:

6. Применение
6.1 Применение сложных эфиров неорганических кислот
Эфиры борной кислоты — триалкилбораты — легко получаются нагреванием спирта и борной кислоты с добавкой концентрированной серной кислоты. Борнометиловый эфир (триметилборат) кипит при 65° С, борноэтиловый (триэтилборат) — при 119° С. Эфиры борной кислоты легко гидролизуются водой.
Реакция с борной кислотой служит для установления конфигурации многоатомных спиртов и была неоднократно использована при изучении Сахаров.
Ортокремневые эфиры — жидкости. Метиловый эфир кипит при 122° С, этиловый при 156° С. Гидролиз водой проходит легко уже на холоду, но идет постепенно и при недостатке воды приводит к образованию высокомолекулярных ангидридных форм, в которых атомы кремния соединены друг с другом через кислород (силоксановые группировки):

Эти высокомолекулярные вещества (полиалкоксисилоксаны) находят применение в качестве связующих, выдерживающих довольно высокую температуру, в частности для покрытия поверхности форм для точной отливки металла.
Аналогично SiCl4 реагируют диалкилдихлорсиланы, например ((СН3 )2 SiCl2 , образуя диалкоксильные производные:

Их гидролиз при недостатке воды дает так называемые полиалкилсилоксаны:

Они обладают разным (но очень значительным) молекулярным весом и представляют собой вязкие жидкости, используемые в качестве термостойких смазок, а при еще более длинных силоксановых скелетах — термостойкие электроизоляционные смолы и каучуки.
Эфиры ортотитановой кислоты. Их получают аналогично ортокремневым эфирам по реакции:

Это жидкости, легко гидролизующиеся до метилового спирта и TiO2 применяются для пропитки тканей с целью придания им водонепроницаемости.
Эфиры азотной кислоты. Их получают действием на спирты смеси азотной и концентрированной серной кислот. Метилнитрат СН3 ONO2 , (т. кип. 60° С) и этилнитрат C2 H5 ONO2 (т. кип. 87° С) при осторожной работе можно перегнать, но при нагревании выше температуры кипения или при детонации они очень сильно взрывают.

Нитраты этиленгликоля и глицерина, неправильно называемые нитрогликолем и нитроглицерином, применяются в качестве взрывчатых веществ. Сам нитроглицерин (тяжелая жидкость) неудобен и опасен в обращении.
Пентрит — тетранитрат пентаэритрита С(CH2 ONO2 )4 , получаемый обработкой пентаэритрита смесью азотной и серной кислот, — тоже сильное взрывчатое вещество бризантного действия.
Нитрат глицерина и нитрат пентаэритрита обладают сосудорасширяющим эффектом и применяются как симптоматические средства при стенокардии.
Эфиры фосфорной кислоты — высококипящие жидкости, лишь очень медленно гидролизуемые водой, быстрее щелочами и разбавленными кислотами. Эфиры, образованные этерификацией высших спиртов (и фенолов), находят применение как пластификаторы пластмасс и для извлечения солей уранила из водных растворов.
Известны эфиры типа (RO)2S═O, но они не имеют практического значения.
Из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты производят моющие средства. В общем виде образование таких солей можно изобразить уравнениями:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Они и обладают прекрасными моющими способностями. Принцип их действия тот же, что и у обычного мыла, только кислотный остаток серной кислоты лучше адсорбируется частицами загрязнения, а кальцевые соли алкилсерной кислоты растворимы в воде, поэтому это моющее средство стирает и в жесткой, и в морской воде.
6.2 Применение сложных эфиров органических кислот
Наибольшее применение в качестве растворителей получили эфиры уксусной кислоты - ацетаты. Прочие эфиры (кислот молочной - лактаты, масляной - бутираты, муравьиной - формиаты) нашли ограниченное применение. Формиаты из-за сильной омыляемости и высокой токсичности в настоящее время не используются. Определенный интерес представляют растворители на основе изобутилового спирта и синтетических жирных кислот, а также алкиленкарбонаты. Физико-химические свойства наиболее распространенных сложных эфиров приведены в таблице (см. приложение).
Метилацетат СН3 СООСН3 . Отечественной промышленностью технический метилацетат выпускается в виде древесно-спиртового растворителя, в котором содержится 50% (масс.) основного продукта. Метилацетат также образуется в виде побочного продукта при производстве поливинилового спирта. По растворяющей способности метилацетат аналогичен ацетону и применяется в ряде случаев как его заменитель. Однако он обладает большей токсичностью, чем ацетон.
Этилацетат С2 Н5 СООСН3 . Получают методом этерификации на лесохимических предприятиях при переработке синтетической и лесохимической уксусной кислоты, гидролизного и синтетического этилового спирта или конденсацией ацетальдегида. За рубежом разработан процесс получения этилацетата на основе метилового спирта.
Этилацетат подобно ацетону растворяет большинство полимеров. По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей летучести). Добавка 15-20 % этилового спирта повышает растворяющую способность этилацетата в отношении эфиров целлюлозы, особенно ацетилцеллюлозы.
Пропилацетат СН3 СООСН2 СН2 СН3 . По растворяющей способности подобен этилацетату.
Изопропилацетат СН3СООСН(СН3 )2 . По свойствам занимает промежуточное положение между этил- и пропилацетат.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Имеющиеся в продаже эссенции, имитирующие эти запахи, содержат подобные эфиры.
Винилацетат CH2 =CHOOCCH3 , образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок.
Мыла — это соли высших карбоновых кислот.Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
Обычное мыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так как содержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли:
В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды.
Использованные источники информации
1. Цветков Л.А. Органическая химия: Учебник для 10-11 классов общеобразовательных учебных заведений. - М.: Гуманит. изд. центр ВЛАДОС, 2001;
2. Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М.,1969-70.;
3. Глинка Н. Л. Общая химия: Учебное пособие для вузов. – 23-е изд., испр./ Под ред. В. А. Рабиновича. – Л.: Химия, 1983;
Сложные эфиры – это органические соединения, молекулы которых содержат сложноэфирную группу –СОО– . Также сложные эфиры часто называют функциональными производными карбоновых кислот, атом водорода в карбоксильной группе которых замещен на группу –ОН.

Номенклатура сложных эфиров
Названия сложных эфиров можно построить двумя способами.
Способ 1: углеводородный радикал + название соли кислоты
Рассмотрим на примере эфира, полученного из уксусной кислоты и этилового спирта.
Если от молекулы этанола отнять гидроксильную группу, то останется углеводородный радикал – этил. Остаток уксусной кислоты носит название ацетат. Итого: этил + ацетат = этил ацетат
Способ 2: остаток спирта + эфир + название кислоты
Этилацетат также часто называют этиловым эфиром уксусной кислоты.

Получение сложных эфиров
Сложные эфиры получают по реакции этерификации.
Реакция этерификации – взаимодействие карбоновых кислот со спиртами, в результате которого образуется сложный эфир.

Виды сложных эфиров
Эфиры карбоновых кислот часто встречаются в природе. Все природные эфиры можно подразделить на три группы:
I. Фруктовые эфиры – эфиры низших и средних карбоновых кислот с низшими и средними спиртами.
Название этих эфиров связано с их приятным запахом. Некоторые из них являются составными частями эфирных масел, многие получаются синтетически и используются в качестве ароматизаторов к фруктовым сокам, лимонадам и т.д.
Например, этилформиат (ромовая эссенция) используется для приготовления ромовой отдушки, изоамилацетат (грушевая эссенция) – для приготовления грушевого, ананасного и малинового масел. Изоамилизовалерат придает запах бананам и используется для приготовления яблочного, ананасного и персикового масел.
Сложные эфиры как ароматизаторы

II. Воски – эфиры высших одноатомных спиртов с высшими карбоновыми кислотами
Основная функция восков – защитная. Например, воски образуют защитную пленку на поверхности кожи животных и листьев растений: предохраняют от высыхания и болезнетворных микроорганизмов. Пчелиный воск, в свою очередь, имеет структурную функцию. Основная составляющая пчелиного воска – мирицилпальмитат:

III. Жиры – эфиры глицерина с высшими и средними жирными кислотами.

Жидкие жиры (масла) — эфиры глицерина с высшими и средними непредельными карбоновыми кислотами. Как правило, это жиры растительного происхождения: льняное, подсолнечное и другие масла. Однако встречаются животного происхождения – например, рыбий жир.
Твердые жиры — эфиры глицерина с высшими и средними предельными кислотами. Обычно это жиры животного происхождения, напр., бараний жир. Но есть и исключения, например, пальмовое масло.
Есть близкая по смыслу тема «Биологическая роль жиров«
Представители высших жирных карбоновых кислот

Химические свойства сложных эфиров
1. Гидрирование
Сложные эфиры, которые содержат двойные связи, легко подвергаются гидрогенизации. Именно эта реакция лежит в основе получения маргарина.

2. Гидролиз
Гидролизом называют химическую реакцию взаимодействия с водой, при которой исходное вещество разлагается с образованием новых соединений.

Однако, при проведении гидролиза в щелочной среде, схема реакции другая:

Омыление – гидролиз жиров в щелочной среде.
В промышленности для омыления, как правило, используют животные жиры, пальмовое, кокосовое и хлопковое масла. Если их нагревать с едким натром, то образуется раствор (так называемый мыльный клей), который содержит глицерин и мыло. Затем к этой горячей массе добавляют поваренную соль (NaCl), для высаливания натриевого мыла. Так получают твердое мыло, которое легко отделяется от раствора. А, например, жидкие мыла готовят с использованием едкого кали.
Мыла – натриевые или калиевые соли карбоновых кислот.
3. Окисление
В быту окисление жиров, сопровождающееся гидролизом и бактериальным окислением. Например, это можно отметить при прогоркани сливочного или растительного масла, образуются дурно пахнущие соединения – альдегиды и кетоны.
Сложные эфиры широко распространены в природе. Мы живём в мире разнообразных запахов и ароматов, они будоражат наше воображение, напоминают о благоухающем саде, цветущем луге и свежести фруктов. Красота и многообразие цветов — этих удивительно красивых и необыкновенно ароматных созданий природы и человека. Они излучают нежные ароматы, которые в жизни растений имеют большое значение. Ароматы цветов привлекают насекомых для опыления, а фруктовые запахи притягивают животных и способствуют распространению семян. Представьте себе розу. Можно долго любоваться её красотой, вслушиваться в дыхание её лепестков и листьев, но впечатление будет неполным, если не ощущать аромат царственного цветка. Цветочно-фруктовые запахи излучают сложные эфиры. Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — также, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, полимеры, синтетические волокна и многое, многое другое.
В жизни мы непрерывно сталкиваемся с запахами. Древние мудрецы считали запахи тончайшим проявлением материальной природы. Влияние ароматов на физическое и психическое состояние человека изучалось с давних времен. При раскопках древних цивилизаций находят сосуды для благовоний и изображения душистых растений. В древних книгах можно найти описания возможных эффектов применения натуральных ароматических веществ: магических, эстетических и лекарственных.
Многим из них более 5000 лет. Тогда же стали применять ароматические свечи и палочки. В древнем Риме, в Египте и Греции благовония ценились как драгоценные металлы и считались символами богатства. Поэты, художники и философы обращали внимание на очищающее и укрепляющее действие ароматов, на их способность наполнять мысли спокойствием и умиротворением, управлять настроением человека и его работоспособностью.
С различными болезнями боролись с помощью окуривания воздуха, для чего сжигали засушенные ароматические растения, благовония в виде порошков и ароматические свечи.
Все это было началом ароматерапии, которая сейчас является одним из популярных и быстро развивающихся направлений медицины. Методы ароматерапии вводят ароматы в систему кровообращения человека, которая разносит целебные молекулы по всему организму, в результате чего улучшаются обменные процессы и улучшается состояние.
Мы заинтересовались природой запахов с точки зрения химии: что это за вещества, как они получаются в природе, как можно их получить в условиях лаборатории, как их применяют. И выдвинули следующую гипотезу : допустим, что в условиях лаборатории можно получить сложные эфиры с помощью реакции этерификации между низшими карбоновыми кислотами и низшими спиртами. Тогда можно предположить, что полученные эфиры будут обладать запахами фруктов и цветов, аналогичными природным. Если это так, то искусственные эфиры можно использовать для изготовления ароматических композиций, и мы сможем сами приготовить эссенцию для аромолампы и изготовить ароматическую свечу.
Общая характеристика сложных эфиров.
Сложные эфиры - класс органических соединений, представляющих собой производные неорганических или органических кислот, в которых гидроксильная группа заменена на алкоксильную группу.
Если исходная кислота многоосновная, то возможно образование либо полных эфиров – замещены все ОН-группы,
либо кислых эфиров – частичное замещение.
Для одноосновных кислот возможны только полные эфиры.
Существует несколько способов составления названий сложных эфиров. Длинное название состоит из четырех слов:
Метиловый эфир уксусной кислоты CH 3 -CH 2 -COOCH 3
Изопропиловый эфир масляной кислоты C 3 H 7 -COOCH(CH 3 ) 2
Короткие названия этих эфиров: метилацетат и изопропилбутанат.
В природе и в живых организмах эфиры выполняют много различных функций:
- Энергетическую ( выделяется 38,9 кДж при окислении 1г жира)
- Структурную ( в составе клетки)
- Защитную (воск на плодах, жировая прослойка под кожей)
- Пластическую (в клеточных мембранах)
- Растворителей (в обмене веществ)
Эфиры были впервые получены в середине XVIII века Л. де Лаурагваисом, который в процессе перегонки уксусной кислоты с винным спиртом, получил жидкость отличную по запаху от исходных веществ.
СН 3 -СООН + С 2 Н 5 ОН = СН 3 СООС 2 Н 5 + Н 2 О
Аналогичным способом был получен в 1777г. Этиловый эфир муравьиной кислоты.
Сложные эфиры низших карбоновых кислот и простейших спиртов - бесцветные летучие жидкости, часто с приятным фруктовым запахом; сложные эфиры высших карбоновых кислот - твердые бесцветные воскообразные вещества, практически лишенные запаха, их температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.
Сложные эфиры труднее растворимы в воде, чем образующие их спирты и кислоты. Так, этиловый спирт и уксусная кислота смешиваются с водой во всех отношениях, тогда как этилацетат трудно растворим в воде. При растворении в воде образуют два несмешивающихся слоя (две фазы), при этом эфир имеет меньшую плотность и находится сверху. Это позволяет использовать сложные эфиры в аналитической химии как экстрагенты при экстракции различных веществ (например, изотопов) из водных растворов. Сложные эфиры плохо растворимы в воде, но хорошо - в органических растворителях (спирте, ацетоне и др.).
1.Гидролиз сложных эфиров.
Гидролиз сложных эфиров - основное химическое свойство. Гидролиз протекает с расщеплением сложных эфиров под действием воды. Эта обратная реакция для реакции этерификации. Реакция протекает как в кислой (катализаторы реакции – протоны Н+), так и в щелочной среде (катализаторы реакции – гидроксид-ионы ОН –).
В присутствии щелочи реакция необратима, т.к. происходит омыление – образование солей карбоновых кислот.
Щелочной гидролиз сложных эфиров, при котором происходит образование солей карбоновых кислот, называют омылением.
Способностью легко гидролизоваться сложные эфиры резко отличаются от простых эфиров, которые очень стойки к гидролизу. Ионы водорода, катализирующие реакцию этерификации, ускоряют также и омыление сложных эфиров.
Щелочи, дающие гидроксильные ионы, ускоряют омыление сложных эфиров еще сильнее, чем кислоты, дающие водородные ионы. Омыление сложных эфиров щелочами протекает в ряде случаев в 1000 и более раз быстрее, чем омыление кислотами.
Механизм кислотного гидролиза можно представить следующим образом . Водородный ион и молекула воды образуют реакционный комплекс (переходное состояние), в котором протон сближен с кислородным мостиком эфира, а вода парой свободных электронов кислородного атома - с углеродным атомом карбоксильной группы:
В природных условиях сложные эфиры легко (при обычной температуре) омыляются ферментами, носящими название эстераз.
Восстановление сложных эфиров водородом приводит к образованию двух спиртов, из которых один содержит столько же атомов углерода, сколько было в исходной кислоте, а второй – столько же, сколько в исходном спирте:
RCOOR 1 --------------RCH 2 OH + R 1 OH
Восстановление сложных эфиров протекает гораздо легче, чем восстановление свободных кислот, что связано с легкостью присоединения к карбонильной группе сложного эфира.
3.Взаимодействие с аммиаком.
Под действием аммиака сложные эфиры превращаются в амиды кислот:
CH 3 COOH + NH 3 ----- CH 3 OO - NH 4 + -------CH 3 CONH 2
Карбонильная группа сложных эфиров вступает еще в целый ряд реакций присоединения.
Сложные эфиры в природе.
Эфиры встречаются в цветах, листьях, кожуре плодов и даже в древесине. Они содержатся в виде капелек в особых клетках. Их называют эфирными маслами.
Сложные эфиры входят в состав эфирных масел многих растений и фруктов, придавая им специфический приятный запах:
Многие запахи определяются одним конкретным эфиром. Но есть запахи, составленные как букет из различных эфирных ароматов. Например запах земляники составляют 40 различных эфиров.
В значительных количествах сложные эфиры представлены в природе восками. Основа природных восков - эфиры высших одноосновных кислот и высших одноатомных спиртов. Например, пчелиный воск на 70% состоит из эфира пальмитиновой кислоты и мирицилового спирта С 15 Н 31 СООС 31 Н 63 ; кашалотовый воск – это сложный эфир пальмитиновой кислоты и цетилового спирта С 15 Н 31 СООС 16 Н 33.
Воск в природе является строительным материалом сотов пчелиных ульев, растительные воскоподобные вещества образуют защитную пленку на поверхности плодов и листьев.
Сложные эфиры, образованные трехатомным спиртом глицерином и высшими карбоновыми кислотами являются жирами. Человек издавна использовал в повседневной жизни жиры животного и растительного происхождения.
Применение сложных эфиров.
Сложные эфиры применяются в технике и различных отраслях промышленности. Они хорошие растворители органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения, их используют как растворители лаков и красок, ароматизаторы изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты – запах ананасов, изобутиловый эфир уксусной кислоты – запах бананов.
Сложные эфиры могут служить в качестве пластификаторов-веществ, которые вводят в состав полимерных материалов для придания (или повышение) эластичности или пластичности при переработке и эксплуатации.
В конце 19-начале 20 века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местно-раздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами. Также эфиры применяют в качестве часто потребляемых нами в современной жизни продуктов, таких как: газировка, йогурты, различные сладости и растворители в парфюмерной промышленности.
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
Многие сложные эфиры используются в органическом синтезе, а также при изготовлении лекарственных средств.
Сложные эфиры непредельных спиртов используются для изготовления лаков и красок, так как вступают в реакции присоединения по двойной связи и образуют полимеры. Например, винилацетат - сложный эфир уксусной кислоты и винилового спирта CH 3 −C(O)−O−CH=CH 2 CH 3 −C(O)−O−CH=CH 2 при полимеризации образует поливинилацетат, который используется для изготовления кожезаменителя, его еще называют винилкожей или дермантином.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.
Жиры вместе с углеводами и белками составляют набор необходимых для питания пищевых продуктов, они входят в состав всех растительных и животных клеток, кроме того, накапливаясь в организме, играют роль энергетического запаса. Из-за низкой теплопроводности жировой слой хорошо предохраняет животных (в особенности, морских – китов или моржей) от переохлаждения. Животные и растительные жиры представляют собой сырье для получения высших карбоновых кислот, моющих средств и глицерина, используемого в косметической промышленности и как компонент различных смазок.
Нитроглицерин – известный лекарственный препарат и взрывчатое вещество, основа динамита.
Фруктовые эфиры. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлен летучими эфирами, например этиловым и изоамиловым эфирами муравьиной кислоты.
Методы получения сложных эфиров карбоновых кислот.
1. Реакция этерификации
Сложные эфиры могут быть получены при непосредственном взаимодействии кислоты и спирта. Для органических кислот реакция протекает очень медленно, причем, скорость образования эфира зависит от строения исходных кислот и спирта. Скорость этерификации увеличивается при нагревании и, особенно, в присутствии минеральных кислот благодаря каталитическому действию ионов водорода. Чаще всего, в качестве катализатора применяют концентрированную серную кислоту (В.В. Марковников, 1873г.), которая одновременно является водоотнимающим средством, поэтому связывает образующуюся воду и делает реакцию необратимой. Соотношение всех реагирующих веществ в момент равновесия зависит от строения кислоты и спирта, а также от склонности сложного эфира к гидролизу.
Чтобы увеличить количество образующегося эфира, то есть сместить равновесие реакции этерификации вправо, одно из реагирующих веществ (то, которое доступнее) берут в избытке (в соответствии с законом действия масс). При избытке спирта в реакцию может вступить практически вся кислота, при избытке кислоты – весь спирт.
Другой способ увеличения выхода сложного эфира заключается в постоянном выведении из реакции одного из образующихся веществ – эфира или воды. Вода связывается кислотой, а эфир отгоняется и конденсируется с помощью обратного холодильника или емкости со снегом или холодной водой.
2. Получение эфиров из солей кислот и галогенпроизводных
Сложные эфиры могут быть получены из солей кислот при действии на них галогенпроизводных. Например, из ацетата серебра и хлористого этила можно получить этилацетат:
Данная реакция необратима и эфир получается с хорошим выходом. В этом заключается преимущество метода перед методом этерификации.
3. Получение из хлорангидридов кислот и алкоголятов
Метод аналогичен предыдущему:
CH3C(O)Cl+CH3−CH 2 −ONa⟶CH3C(O)−O−CH2CH3+NaClCH3C(O)Cl+CH3−CH2−ONa⟶CH3C(O)−O−CH2CH3+NaCl
4. Получение из ангидридов кислот
При действии спиртов на ангидриды кислот также достигаются хорошие выходы сложных эфиров:
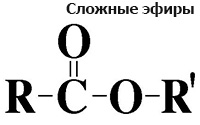
В прошлой статье мы рассказывали о простых эфирах, а сейчас поговорим о сложных. Сложные эфиры широко распространены в природе. Сказать, что сложные эфиры играют большую роль в жизни человека — ничего не сказать. Мы сталкиваемся с ними, когда нюхаем цветок, обязанный ароматом простейшим сложным эфирам. Подсолнечное или оливковое масло — это тоже сложный эфир, но уже высокомолекулярный — также, как и животные жиры. Мы моемся, моем и стираем средствами, которые получают химической реакцией переработки жиров, то есть сложных эфиров. Еще они используются в самых разных областях производства: с их помощью делают лекарства, краски и лаки, духи, смазки, полимеры, синтетические волокна и многое, многое другое.
Сложные эфиры — органические соединения на основе кислородосодержащих органических карбоновых или неорганических кислот. Структуру вещества можно представить как молекулу кислоты, в которой атом Н в гидроксиле ОН— замещен углеводородным радикалом.
Получают сложные эфиры в результате реакции кислоты и спирта (реакция этерификации).
Классификация
— Фруктовые эфиры — жидкости с фруктовым запахом, молекула содержит не более восьми атомов углерода. Получают из одноатомных спиртов и карбоновых кислот. Эфиры с цветочным запахом получают с помощью ароматических спиртов.
— Воски — твердые вещества, содержат в молекуле от 15 до 45 атомов С.
— Жиры — содержат в молекуле 9-19 атомов углерода. Получают из глицерина (трехатомного спирта) и высших карбоновых кислот. Жиры могут быть жидкими (растительные жиры, называемые маслами) и твердыми (животные жиры).
— Сложные эфиры минеральных кислот по своим физическим свойствам тоже могут быть как маслянистыми жидкостями (до 8 атомов углерода), так и твердыми веществами (от девяти атомов C).
Свойства
В нормальных условиях сложные эфиры могут быть жидкими без цвета, с фруктовым или цветочным запахом, или твердыми, пластичными; как правило, без запаха. Чем длиннее цепочка углеводородного радикала, тем тверже вещество. Почти неводорастворимы. Хорошо растворяются в органических растворителях. Горючи.
Вступают в реакции с аммиаком с образованием амидов; с водородом (именно эта реакция превращает жидкие растительные масла в твердые маргарины).
В результате реакции гидролиза разлагаются на спирт и кислоту. Гидролиз жиров в щелочной среде приводит к образованию не кислоты, а ее соли — мыла.
Сложные эфиры органических кислот малотоксичны, оказывают на человека наркотическое воздействие, в основном относятся ко 2-му и 3-му классу опасности. Некоторые реактивы на производстве требуют использования специальных средств защиты для глаз и дыхания. Чем больше длина молекулы эфира, теми он токсичнее. Эфиры неорганических фосфорных кислот ядовиты.
В организм вещества могут попадать через органы дыхания и кожу. Симптомами острого отравления служат возбуждение и нарушенная координация движений с последующим угнетением ЦНС. Регулярное воздействие может привести к болезням печени, почек, сердечно-сосудистой системы, нарушениям формулы крови.
Применение

— В органическом синтезе.
— Для производства инсектицидов, гербицидов, смазок, пропиток для кожи и бумаги, моющих средств, глицерина, нитроглицерина, олиф, масляных красок, синтетических волокон и смол, полимеров, оргстекла, пластификаторов, реагентов для обогащения руд.
— Как добавка к моторным маслам.
— В синтезе парфюмерных отдушек, пищевых фруктовых эссенций и косметических ароматизаторов; лекарственных средств, например, витаминов А, Е, В1, валидола, мазей.
— Как растворители красок, лаков, смол, жиров, масел, целлюлозы, полимеров.
Бутилацетат
Применяется как растворитель; в парфюмерной промышленности для изготовления отдушек; для дубления кож; в фармацевтике — в процессе изготовления некоторых лекарств.
Твин-80
Читайте также:

