Законы термодинамики какой класс школы
Обновлено: 30.06.2024
Задача учителя — рассмотреть в единстве два метода описания тепловых явлений и процессов: термодинамический (феноменологический), основанный на понятии энергии, и статистический, основанный на молекулярно-кинетических представлениях о строении вещества. При рассмотрении статистического и термодинамического методов необходимо четко разграничить знания, полученные эмпирически, и знания, полученные в результате моделирования внутреннего строения вещества и происходящих с ним явлений и процессов.
Важно показать, что эти два подхода, по сути, описывают с разных точек зрения состояние одного и того же объекта и потому дополняют друг друга. В связи с этим, формируя такие понятия, как температура, внутренняя энергия, идеальный газ и т. д., учитель должен раскрыть их содержание как с термодинамической, так и с молекулярно-кинетической точки зрения.
В разделе получают дальнейшее развитие энергетические представления, происходит обобщение закона сохранения энергии на тепловые процессы, вводят формулу первого закона термодинамики и рассматривают применение этого закона к анализу конкретных процессов. Изучение одного из основных принципов термодинамики имеет огромное познавательное и мировоззренческое значение для десятиклассников.
Велико политехническое значение этого раздела курса физики. Достижения молекулярной физики являются научной основой такой отрасли промышленности, как материаловедение. Знание внутреннего строения тел позволяет создавать материалы с заранее заданными свойствами, целенаправленно работать над повышением твердости, термостойкости, теплопроводности металлов и сплавов.
Изучение тепловых явлений дает возможность ознакомить учащихся c основами теплоэнергетики, отрасли, занимающей в нашей стране первое место в обеспечении энергией нужд промышленности и быта.
§ 2. СТРУКТУРА И СОДЕРЖАНИЕ РАЗДЕЛА
При индуктивном изучении газовых законов вначале на качественном уровне рассматривают основные положения молекулярно-кинетической теории, затем некоторые вопросы термодинамики, газовые законы вводят эмпирически и объясняют с точки зрения молекулярных представлений и на основе термодинамического подхода. Методическая идея в этом случае заключается в совместном изучении тепловых явлений и молекулярной физики, в опытном изучении свойств веществ и их объяснении на основе теории. В этом случае раздел имеет следующую структуру: основные положения молекулярно-кинетической теории - основы термодинамики (тепловое равновесие, параметры состояния, температура, газовые законы, абсолютная температура, первый закон термодинамики) - молекулярно-кинетическая теория идеального газа (основное уравнение молекулярно-кинетической теории газов, температура - мера средней кинетической энергии молекул) — свойства газов, жидкостей и твердых тел и их взаимные превращения.
Эмпирический подход к изучению газовых законов вполне доступен для учащихся, при его использовании представления и понятия формируют на чувственно-конкретной основе, он не требует высокого уровня абстрактного мышления, соответствует истории открытия газовых законов и позволяет знакомить учащихся с путями развития физики. Недостатком этого подхода является то, что он не позволяет полностью использовать молекулярно-кинетическую теорию для описания свойств идеального газа.
При дедуктивном подходе вначале изучают молекулярно-кинетическую теорию идеального газа: выводят основное уравнение

уравнения состояния идеального газа и подтверждают экспериментально. Далее можно изучать законы термодинамики и рассматривать применение первого закона термодинамики к изопроцессам.
Такой подход имеет целый ряд достоинств по сравнению с индуктивным, одно из которых заключается в соответствии его основной идее современного школьного курса — усилению роли научных теорий. Кроме того, он позволяет наглядно продемонстрировать тот факт, что фундаментальных законов в физике не так много, большинство же могут быть получены как частные случаи из более общих законов. Применение здесь дедуктивного метода играет большую роль в формировании научного мировоззрения и развитии мышления школьников. Он также позволяет получить выигрыш во времени.
При дедуктивном подходе к изучению газовых законов возможна и иная структура раздела, при которой школьников сначала знакомят с основными понятиями и законами молекулярно- кинетической теории и термодинамики, а затем применяют в единстве аппарат этих теорий для изучения свойств макроскопических систем. В этом случае раздел имеет следующую структуру: основные положения молекулярно-кинетической теории — основы термодинамики — строение и свойства газов, жидкостей и твердых тел - агрегатные превращения.
Что касается введения понятия температуры, то при индуктивном изучении газовых законов последовательность его раскрытия такова: температура как параметр состояния макроскопической системы — абсолютная температура (из закона Шарля или Гей-Люссака) — температура — мера средней кинетической энергии молекул (из основного уравнения молекулярно-кинетической теории газов и эмпирически полученного уравнения состояния идеального газа).
При дедуктивном изучении газовых законов понятие температуры вводят следующим образом: температура как параметр состояния макроскопической системы — абсолютная температура — температура — мера средней кинетической энергии молекул (из основного уравнения молекулярно-кинетической теории газов и

для всех газов в состоянии теплового равновесия показывают, что абсолютная температура пропорциональна средней кинетической энергии молекул).
При дедуктивном изучении газовых законов можно ввести понятие температуры и по следующей схеме: температура как параметр состояния макроскопической системы - температура — мера средней кинетической энергии молекул (по определению после рассмотрения основного уравнения молекулярно-кинетической теории газов) — абсолютная температура.
Вопросы молекулярно-кинетической теории изучают здесь более глубоко, особое внимание уделяют опытным обоснованиям молекулярно-кинетической теории: рассматривают броуновское движение, достаточно детально изучают характеристики молекул, методы их теоретического и экспериментального определения, при объяснении взаимодействия между молекулами проводят анализ графика сил взаимодействия.
Затем в этой же теме изучают основное уравнение молекулярно-кинетической теории идеального газа, понятие температуры, уравнение Менделеева-Клапейрона и изопроцессы. Знания, полученные школьниками при изучении этого материала, используют для объяснения свойств паров, жидкостей и твердых тел.
§ 3. СТАТИСТИЧЕСКИЙ И ТЕРМОДИНАМИЧЕСКИЙ МЕТОДЫ ИЗУЧЕНИЯ ТЕПЛОВЫХ ЯВЛЕНИЙ
Сущность статистического метода изучения явлений соответствует положению диалектического материализма о соотношении необходимого и случайного. Движение каждой молекулы тела или системы подчиняется законам классической механики, однако ее поведение в каждый момент времени случайно, оно зависит от множества причин, которые невозможно учесть. Например, скорость, энергия, импульс каждой молекулы зависят от столкновений ее с другими молекулами, и предсказать значения этих величин в каждый момент времени невозможно.
С другой стороны, поведение всей совокупности частиц подчиняется определенным закономерностям, которые называют статистическими и которые проявляются при изучении поведения большого числа частиц. Например, если скорость каждой молекулы в данный момент времени - величина случайная, то большинство молекул имеет скорость, которая близка к некоторому определенному при данных условиях значению, называемому наиболее вероятным.
Под случайным понимают событие, которое может наступить, а может не наступить в данных условиях. Случайное событие характеризуется следующими признаками: а) невозможностью однозначного предсказания случайного события; б) наличием большого числа причин, обусловливающих случайное событие; в) предсказуемостью хода процесса в массовом коллективе случайных событий; г) вероятностью события как математического выражения возможности предсказания процесса.
Эти признаки можно рассмотреть на примере совокупности большого числа молекул. В частности, невозможно однозначно предсказать движение каждой отдельной молекулы, так как оно зависит от поведения множества других молекул. Это можно сделать лишь с определенной вероятностью.
Вероятность — это числовая характеристика возможности появления события в тех или иных условиях. Чем больше вероятность, тем чаще происходит данное событие. Если число всех проведенных испытаний N, ΔN—число испытаний, в которых происходит данное событие, то вероятность этого события вычисляют по формуле: ω= .
Можно под N понимать общее число частиц в системе, а под ΔN — число частиц, находящихся в определенном состоянии. В этом случае ω — вероятность существования частицы в данном состоянии.

В теоретических расчетах бывает сложно вычислить вероятность, так как не представляется возможным предсказать число испытаний, в которых событие произойдет. Задача упрощается, если изучают равновероятные события, т. е. события, происходящие с равной частотой. Именно с равновероятными событиями имеют дело при рассмотрении хаотического движения молекул: вдоль любых выделенных направлений движется одинаковое число частиц. Следует пояснить учащимся, что понятие вероятности имеет смысл лишь для массовых событий. В противном случае частота наступления события может существенно отличаться от значения вероятности.
Понятие о статистическом распределении вводят, используя опыт с доской Гальтона (рис. 46), который достаточно наглядно иллюстрирует распределение молекул по координатам. С вопросом о распределении десятиклассники сталкиваются при выводе основного уравнения молекулярно-кинетической теории газов, рассматривая равновероятное распределение молекул по объему и по направлениям движения. Изучая вопрос о скоростях молекул, школьники знакомятся с максвелловским распределением.
При изучении молекулярно-кинетической теории учащиеся широко используют среднее значение случайных величин. Важно подчеркнуть, что среднее значение случайной величины - характеристика статистического распределения. Именно для большого числа частиц среднее значение случайной величины постоянно. К таким величинам относится, например, скорость движения молекул. Не имея возможности определить скорость каждой отдельной молекулы, для расчетов используют значение скорости, равное среднему квадрату:

При выводе основного уравнения кинетической теории газов рассчитывают давление газа на стенки сосуда. Речь идет о среднем значении давления, так как в разные моменты времени о стенку ударяется разное число молекул, имеющих различные скорости. Но при большом числе молекул можно считать давление постоянным, а флуктуацию давления достаточно малой.
У учащихся может сложиться впечатление, что статистический метод был введен в науку как некий искусственный прием, позволивший описать поведение молекул, и что динамические законы являются основными по сравнению со статистическими. Следует предупредить эту ошибку и объяснить, что статистические законы существуют объективно. Классическая статистика возникла в XIX в. Этот факт выражал прогрессивное направление науки и был связан с изучением внутреннего строения вещества. В настоящее время известно, что поведение всех микрообъектов подчиняется статистическим законам, причем в квантовой физике в отличие от классической статистические законы проявляются не только вследствие массовости и хаотичности движения, но и в связи с самой природой квантовых объектов (с невозможностью одновременного точного определения координаты и скорости частицы). Целесообразно подчеркнуть, что статистический метод является основой современной физики. В частности, вероятностные, статистические законы господствуют в мире элементарных частиц.
Похожие документы:
Методика изучения раздела "квантовая физика" в школьном курсе значение изучения квантовой физики
. МЕТОДИКА ИЗУЧЕНИЯ РАЗДЕЛА "КВАНТОВАЯ ФИЗИКА" В ШКОЛЬНОМ КУРСЕ ЗНАЧЕНИЕ ИЗУЧЕНИЯ КВАНТОВОЙ ФИЗИКИ В СРЕДНЕЙ ШКОЛЕ И ОСОБЕННОСТИ . вещества. В курсе физики строение вещества рассматривали в основном на молекулярном уровне. Молекулярно-кинетическая теория .
. физика”: значение, место и содержание вопросов квантовой физики в школьном курсе физики; основные понятия и законы квантовой физики, изучаемые в школьном курсе физики . Термодинамика и молекулярная физика. - М.,1986. Сивухин Д.В. Курс физики. Ч.1,2,3. - .
. по физике. Проблемы содержания школьного курса физики Межпредметные связи школьного курса физики. Школьный физический . физики в средней школе (механика, молекулярная физика, оптика, электричество, ядерная физика). Вопросы экологии в курсе физики .
Рабочая программа по физике 7 класса учителя физики и информатики
. их объяснение на основе молекулярно-кинетических представлений Фронтальная . по курсу физики 7 кл Урок 70/2 Обобщающее повторение по курсу физики . образовательным стандартом по физике. Значение физики в школьном образовании определяется ролью .
Задачи из любой области школьного курса; литературу, по которой они будут готовить собственные работы
Работа системы против внешних сил – это работа, которую совершает газ, преодолевая внешнее давление.
Адиабатный процесс – это процесс, протекающий в системе без теплообмена.
Необратимый процесс – Необратимым называется такой процесс, который самопроизвольно протекает только в одном направлении; в обратном направлении он протекает так, что система не проходит через те же состояния и не возвращается в исходное состояние.
Первый закон термодинамики – закон сохранения энергии для термодинамических систем.
Количество теплоты, сообщённое системе, равно сумме работы газа против внешних сил и изменения внутренней энергии системы.
Второй закон термодинамики определяет направление термодинамических процессов. Одна из формулировок второго закона: невозможен такой процесс, единственным результатом которого является переход тепла от менее нагретого тела к более нагретому телу.
Основная и дополнительная литература по теме урока:
Мякишев Г. Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 216-224.
Рымкевич А.П. Сборник задач по физике. 10-11 класс. - М.: Дрофа, 2009.- С.81-89.
Основное содержание урока
Закон сохранения энергии, записанный применительно к термодинамической системе, выглядит следующим образом:
где Q – количество теплоты, переданное системе;
A / - работа системы (газа);
∆U - изменение внутренней энергии системы (газа).
Первый закон термодинамики: сообщенное системе количество теплоты расходуется на совершение системой работы против внешних сил и изменение внутренней энергии системы. Если работу совершают внешние по отношению к системе тела, то работа газа считается отрицательной, работа внешних тел положительной и А = - A /
Тогда первый закон термодинамики лучше написать в виде ∆U = Q + А.
Применение первого закона термодинамики к изопроцессам.
∆T = 0; ∆U =0, Q = A /
∆V = 0; A / = 0.

Р = const; A / >0, ∆U>0

Используя уравнение Менделеева-Клапейрона, получим
Подстановка в уравнение первого закона термодинамики количества теплоты дает

Процесс, протекающий без теплообмена, т.е. Q = 0.
Тогда система может совершать работу либо за счет уменьшения внутренней энергии (газ расширяется) A / = - ∆U, либо за счет работы внешних тел над системой (происходит сжатие газа) А = ∆U.
Уравнение теплового баланса.
Если в замкнутой системе тела обмениваются энергией и работа этими телами не совершается, то суммарное изменение внутренней энергии системы равно нулю; тогда соответственно равна нулю и сумма количеств теплоты, полученных или отданных телами системы,
Первый закон термодинамики не определяет направление тепловых процессов. Необратимыми называются такие явления, которые самопроизвольно протекают только в одном направлении; в обратном направлении они протекают только при внешнем воздействии.
Формулировка второго закона термодинамики: невозможно перевести тепло от менее нагретого тела к более нагретому телу при отсутствии других одновременных изменений в обеих системах или в окружающих их телах (или невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого, к телу более нагретому).
Статистический характер второго закона термодинамики.
Состояние макроскопической системы (например, газ в баллоне) может быть реализовано огромным числом микросостояний (комбинацией в расположении молекул). Вероятность того, что первоначально находившийся в какой-либо части объёма газ весь снова соберется в какой-то момент времени в той же его части очень мала. А при очень большом числе частиц - ничтожно мала.
Вероятность обратимых процессов, наоборот, тем больше, чем меньше число частиц в системе. Поэтому справедливость второго закона термодинамики определяется достаточно большим объёмом и достаточно большим числом частиц системы. Так, например, ничтожно мала (реально равна 0) вероятность того, что спокойно висящий маятник начнет раскачиваться в результате одновременного, направленного в одну сторону удара всех молекул воздуха, до какого-то момента, двигавшихся хаотично по всем сторонам.
Направление термодинамических процессов определяется вторым законом термодинамики. Первый и второй законы термодинамики позволяют сделать заключение о невозможности создания вечного двигателя I и II рода.
Разбор тренировочных заданий
1. Гелий, находящийся в сосуде под подвижным поршнем, изотермически сжимают. Начальное давление газа p0, а его объём V0. Масса газа в сосуде остаётся неизменной. Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от объёма V газа. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца.
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ

1.
Б) Внутренняя энергия U(V)

2.

4.

Решение: В изотермическом процессе p0V0 = pV; откуда . В этом процессе сохраняется внутренняя энергия. Для одноатомного газа:

Из уравнения Менделеева-Клапейрона:


Правильный ответ: А – 3, Б – 4.
2. Чему равна внутренняя энергия 2 молей идеального одноатомного газа при температуре 127 0 С? R = 8,31Дж/(моль·К).
Решение: Переведём температуру в СИ:
Т = 127 + 273 = 400 К.
Формула для вычисления внутренней энергии одноатомного идеального газа:

Термодинамика – раздел физики, изучающий тела, находящиеся в состоянии термодинамического равновесия и явления, сопровождающие переходы между этими состояниями.
Термодинамическое равновесие – состояние тел (или частей тела), при котором остаются постоянными все величины, характеризующие эти тела (или части тела): объёмы, давления, расположение масс и др.
Температура – единственная физическая величина, всегда одинаковая у всех тел (или частей тела), находящихся в состоянии термодинамического равновесия.
Термометр – прибор для измерения температуры. Единица температуры – 1 кельвин (1 К). Также используется 1 °С, равный 1 К.
Теплообмен – переход внутренней энергии одного тела во внутреннюю энергию другого тела без совершения механической работы.
Количество теплоты – физическая величина, показывающая энергию, полученную (отданную) телом при теплообмене.
Калориметр – прибор для измерения количества теплоты. Единица количества теплоты – 1 джоуль (1 Дж).
Удельная теплоемкость вещества – физическая величина, показывающая количество теплоты, необходимое для изменения температуры 1 кг этого вещества на 1 °С. Единица удельной теплоёмкости – 1 Дж/(кг·°С).
Количество теплоты, полученное (отданное) телом при теплообмене, пропорционально массе тела и изменению его температуры. Коэффициент пропорциональности – удельная теплоёмкость вещества.
Превращение твёрдого тела в жидкость называют плавлением.Обратное явление называют отвердеванием. Если при этом получается кристаллическое тело, то отвердевание называют кристаллизацией.
Температура
Температурой плавления называют температуру, при которой нагреваемое кристаллическое тело тело начинает плавиться, и при этом одновременно существуют твёрдое и жидкое состояния его вещества.
Температурой кристаллизации называют температуру, при которой охлаждаемая жидкость начинает кристаллизоваться, и при этом одновременно существуют её твёрдое и жидкое состояния.
Как правило, температура кристаллизации вещества равна температуре его плавления. Температура плавления/кристаллизации вещества зависит от внешнего давления и других факторов.
Удельная теплота плавления – физическая величина, показывающая количество теплоты, необходимое для плавления или выделяющееся при кристаллизации 1 кг вещества, находящегося при температуре плавления/кристаллизации. Единица удельной теплоты плавления – 1 Дж/кг.
Количество теплоты, поглощаемое (выделяющееся) при плавлении (кристаллизации), пропорционально массе расплавившегося (кристаллизовавшегося) вещества. Коэффициент пропорциональности – удельная теплота плавления вещества.
Видами парообразования являются: испарение – парообразование, происходящее с поверхности жидкости; кипение – парообразование, происходящее по всему объёму жидкости вследствие возникновения и всплытия на поверхность пузырей пара; сублимация – парообразование, происходящее с поверхности твёрдого тела.
Температурой кипения называют температуру, при которой наблюдается кипение вещества (интенсивное парообразование по всему объёму этого вещества). Температура кипения зависит от внешнего давления и других факторов.
Удельная теплота парообразования – физическая величина, показывающая количество теплоты, необходимое для превращения в пар 1 кг вещества (как правило, при температуре кипения). Единица удельной теплоты парообразования – 1 Дж/кг.
Количество теплоты, поглощённое кипящей (или испаряющейся при постоянной температуре) жидкостью, прямо пропорционально массе образовавшегося пара. Коэффициент пропорциональности – удельная теплота парообразования вещества.
При охлаждении/кристаллизации/конденсации выделяется точно такое же количество теплоты, которое было затрачено для нагревания/плавления/парообразования вещества (если температуры и давления при прямом и обратном процессах соответствуют друг другу).Утверждение будет верным и наоборот.
Тепловые явления

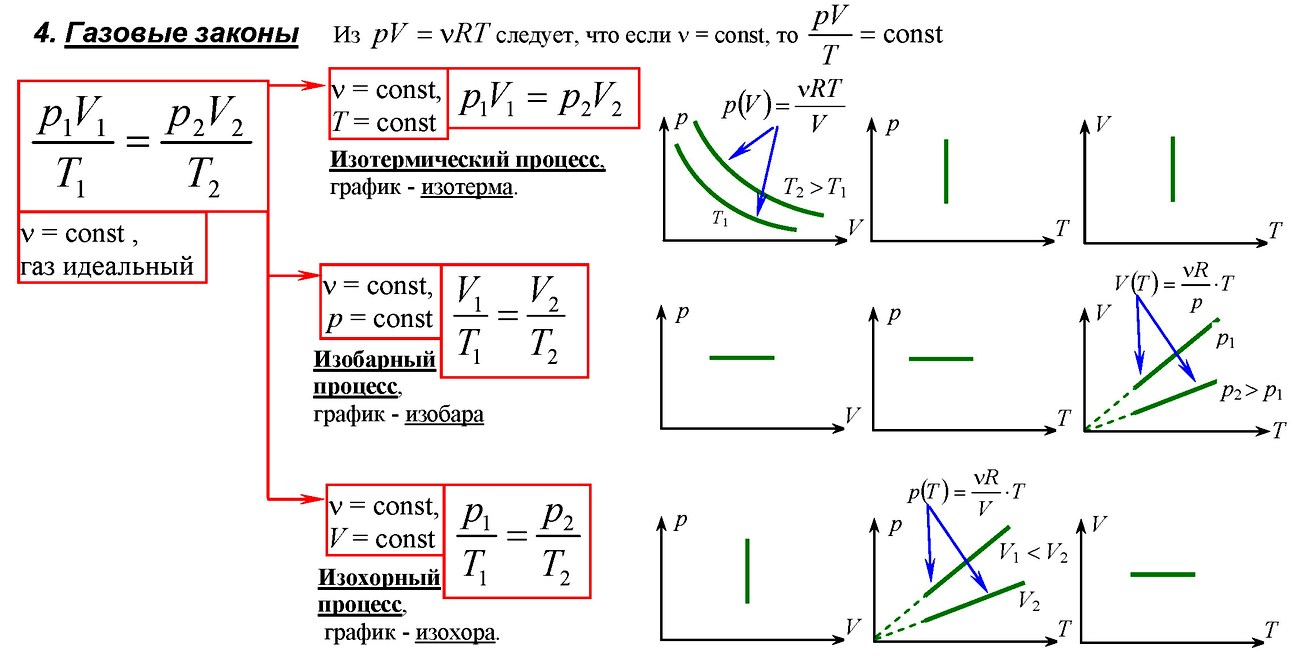
Законы термодинамика
Первый закон термодинамики устанавливает равенство между изменением внутренней энергии тела и суммой полученной телом теплоты и совершённой над ним работы.
Тепловой двигатель – периодически действующее устройство, служащее для превращения внутренней энергии рабочего тела (как правило, газа или пара) в механическую энергию.
Количество теплоты, выделяющееся при полном сгорании вещества (топлива), прямо пропорционально массе сгоревшего вещества (топлива). Коэффициент пропорциональности – удельная теплота сгорания топлива.
Известно три способа теплопередачи (теплообмена) – теплопроводность, конвекция и излучение. При теплопроводности теплота проникает через вещество без его перемещения (в случае отсутствия вещества теплопроводность является нулевой). При конвекции теплота перемещается неравномерно нагретым движущимся веществом (в условиях, когда возможно возникновение архимедовой силы). При излучении теплота передаётся через пространство или вещество в виде электромагнитных волн (для излучения наличие вещества не является обязательным, в отличие от первых двух способов теплопередачи).
Второй закон термодинамики гласит, что теплообмен самостоятельно протекает только в таком направлении, что температура менее нагретого тела возрастает, а более нагретого – уменьшается.

Дополнительные материалы по теме:





Попробуем создать тепловую машину (длинный стеклянный сосуд с водой – горячей в нижней части и холодной в верхней), проверим ее работу в соответствии законами термодинамики.
Учитель и лаборант ставят эксперимент, по ходу разбирают принцип работы, учащиеся делают зарисовку установки в тетради, указывая основные элементы: рабочее тело (воздух в пипетке), нагреватель (сосуд с горячей водой), холодильник (сосуд с холодной водой). См. Приложение, фото №1.
Следует отметить следующие закономерности:
- Если вода в нижнем резервуаре будет иметь температуру воздуха в пипетке, воздух не сможет получить количество теплоты, что противоречило бы первому закону термодинамики, следовательно, он не сможет совершить работу, т.е. подняться вверх. Делаем вывод: наша установка не является вечным двигателем первого рода.
- Получая энергию от нагревателя, газ в пипетке нагревается, расширяется и под действием силы Архимеда, поднимается вверх. Учащиеся замечают, что, не отдавая некоторое количество теплоты холодильнику, т.е. воде в верхнем резервуаре, газ не смог бы остыть, сжаться и уже под действием силы тяжести опуститься вниз. А значит, процесс не был бы периодическим.
3. Формулирование второго закона термодинамики в различных интерпретациях
Запрещая вечный двигатель первого рода, первый закон термодинамики допускает создание такой тепловой машины периодического действия, которая была бы способна превратить в полезную работу все подводимое тепло. Такую машину называют вечным двигателем второго рода (двигатель, совершающий работу за счет охлаждения какого-либо тела). Если бы это было возможным, человечество получило бы неограниченный источник энергии, черпая его из океанов, охлаждая последние. Однако, охлаждение океана, как только его температура становится ниже температуры окружающей среды, означала бы переход теплоты от менее нагретого тела к более нагретому, а такой процесс сам собой идти не может. Второй закон термодинамики указывает направление процессов в природе.
Например, кинофильм. Разбивается ваза. Прокрутив пленку в обратном порядке, мы увидим, как ваза вновь собирается из осколков. Этот процесс не противоречит закону сохранения энергии и законам механики. Кроме второго закона термодинамики. Процесс превращения вазы в осколки необратим. Самопроизвольно обратное превращение невозможно. Наиболее типичные необратимые процессы:
- Переход механической энергии во внутреннюю (математический маятник).
- Переход теплоты от горячего тела к холодному (на плитке нагревается вода в сосуде).
Второй закон термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость процессов в природе.
Все процессы в природе протекают в одном направлении. И самопроизвольно в обратном направлении протекать не могут. Самые трагические из них - старение и смерть организмов. Обратный переход возможен только при участии другого тела, за счет его энергии. В случае математического маятника, необходимо периодически его толкать, например, рукой. В холодильных установках - тепло переходит от холодного тела к нагретому за счет электрической энергии.
Как и первый закон термодинамики, второй закон имеет несколько формулировок. В учебнике на странице 20 первая формулировка принадлежит английскому ученому С. Карно (учащиеся зачитывают). Вторая формулировка - немецкого физика Р. Клаузеуса (учащиеся зачитывают). Существуют и другие формулировки. Все они выражают в сущности одно и тоже и поэтому равноценны.
Еще раз обращаемся к установке тепловой машины. Вопрос к учащимся: до каких пор машина будет работать? Легко заметить, что пока есть разница температур (есть возможность получать часть тепла от нагревателя и отдавать часть тепла холодильнику), пипетка будет двигаться вверх и вниз, т.е. совершать периодическое движение.
Идея вечного движения захватывала умы человечества еще в средние века. Действительно, примером может служить непрекращающееся движение Луны вокруг Земли, Земли вокруг Солнца. Вот и возникла идея найти источник вечного движения и на Земле. Но еще Леонардо да Винчи высказывался по этому поводу о невозможности создания perpetuum mobile.
4. Самостоятельное изучение формулировки третьего закона термодинамики
Экспериментальное изучение свойств веществ при сверхнизкой температуре, близкой к абсолютному нулю (-273 о С), привело к установлению третьего закона термодинамики, который называется принципом недостижимости абсолютного нуля температуры. На 20-21 страницах учебника зачитаем формулировку третьего закона термодинамики и выпишем в тетрадь.
5. Закрепление нового материала и материала, изученного на предыдущих уроках. Практическое применение законов термодинамики
Дидактический материал. С.А. Тихомирова стр.50, задание 113. Стихотворение Баратынского. Какие виды энергии использует пироскаф для своего движения? (Используется энергия пара и ветра). См. Приложение, фото №3.
Запасы внутренней энергии в океанах и земной коре можно считать практически неограниченными. Но располагать запасами энергии еще недостаточно. Необходимо уметь за счет энергии приводить в движение станки на фабриках и заводах, средства транспорта, тракторы и другие машины, вращать роторы генераторов электрического тока. Человечеству нужны двигатели - устройства, способные совершить работу. Большую часть механической и электрической энергии вырабатывают тепловые двигатели. Пока равной замены им нет.
6. Самостоятельная работа учащихся, выполнение тестовых заданий (См. Приложение)
Время выполнения - 10 минут.
7. Самопроверка качества выполнения самостоятельной работы, самодиагностика учащихся
Учащиеся сдают учителю выполненную работу, оставляя условия заданий на столе, и коллективно проверяют правильность выполнения. Разбираются допущенные ошибки. Учащиеся выставляются оценки с учетом работы над правильностью выполнения заданий.
8. Подведение итогов урока, домашнее задание, выставление оценок учащимся
Читайте также:
- Можно ли серебро расплавить в муфельной печи кратко
- Что такое декреты в истории франции кратко
- Особенности организации предпринимательской деятельности за рубежом кратко
- Бесплатное питание в школе иркутская область кому положено 2021
- Является ли венчание в церкви официальным закреплением семейных отношений в россии кратко

