В чем суть ядерной планетарной модели атома кратко
Обновлено: 07.07.2024
И физика, и химия, а также другие науки долгое время старались найти ответ на вопрос о строении атома. Данное знание позволило бы науке продвинуться в изучении химических элементов, их свойств, связей между ними и их соединениях в веществах.
Атом — наименьшая часть химического элемента, сохраняющая его свойства.
Однако в конце XIX — начале XX веков данные представления были опровергнуты.
Предпосылками к открытию внутреннего строения атома стали:
В 1909 – 1911 годах свои опыты продолжал Э. Резерфорд. Он заявил об открытии, перевернувшем представления о химии не только общества философов, перед которым выступал ученый, но и всего научного мира.
Опыт Резерфорда по бомбардировке золотой фольги положительно заряженными альфа-частицами показал, что некоторые частицы заметно отклонялись от первоначального направления движения. Открытие привело к установлению внутренней структуры атома.
Благодаря открытиям ученых конца XIX — начала XX веков удалось определить, что атом состоит из:
Атомное ядро состоит из элементарных частиц:
На самом деле, Резерфорд не создал новую модель атома. Своими опытами он опроверг одну модель Томсона и подтвердил состоятельность другой, которая изначально предполагала планетарное строение атома.
Самой сложной частью атома в то время являлось и до сих пор остается атомное ядро. Точное теоретическое описание модели атомного ядра практически не представляется возможным из-за малого размера частиц, составляющих его. Из-за этого появляется множество представлений о строении атомного ядра, некоторые из которых являются взаимоисключающими, противоречащими или дополняющими друг друга.
Теории строения атомного ядра начали выдвигаться учеными в 30-х годах 20 века. Были предложены:
- оболочечная теория (Д. Д. Иваненко и Е. Н. Гапон в 1932 году, дополнена М. Гёпперт-Майер и Х. Йенесоном в 1949 году);
- капельная теория (Н. Бор в 1936 году);
- кластерная или модель нуклонных ассоциаций (вторая половина 30-х годов 20 века);
- статистическая (в 1936 году и в 1937 году была параллельно открыта Я. Френкелем и Л. Ландау);
- коллективная (О. Бор и Б. Моттельсон в 1952 году);
- обобщенная Бора – Моттельсона (также О. Бор и Б. Моттельсон в 1952 году);
- сверхтекучая (предложена в 1958 году О. Бором и Дж. Валатином);
- ротационная;
- оптическая;
- вибрационная.
Каково строение согласно модели Резерфорда
На сегодняшний день модель Резерфорда является единой утвержденной во всем мире. Атом, согласно общим представлением, представляет собой структуру, напоминающую планеты в космосе, вращающиеся вокруг Солнца.
Основная масса атома находится в атомном ядре, которое очень мало по отношению ко всему атому. Ядро положительно заряжено благодаря заряду протонов внутри него. Его размер равен примерно 10-14 — 10-15 метрам относительно размера всего атома, равного 10-10 метрам.
Вокруг атомного ядра по своим орбитам — электронным орбиталям — вращаются планеты-электроны. Они имеют отрицательный заряд, и в сумме с положительным зарядом ядра делают заряд всего атома электронейтральным.
Чем отличается от модели Томпсона
Томсон в своей модели атома попытался ответить на вопрос нейтрального заряда атома при явном наличии в нем отрицательно заряженных электронов.
Данная теория оказалась опровергнута Резерфордом в ходе его экспериментов по рассеиванию альфа-частиц.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 6 мая 2012.


Новую модель строения атома Резерфорд предложил в 1911 году как вывод из эксперимента по рассеянию альфа-частиц на золотой фольге, проведённого под его руководством. При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10 -10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд пропорционален атомной массе.
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора, постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Планетарная модель атома" в других словарях:
планетарная модель атома — planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. planetary atom model vok. Planetenmodell des Atoms, n rus. планетарная модель атома, f pranc. modèle planétaire de l’atome, m … Fizikos terminų žodynas
Боровская модель атома — Боровская модель водородоподобного атома (Z заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро … Википедия
Модель (в науке) — Модель (франц. modèle, итал. modello, от лат. modulus мера, мерило, образец, норма), 1) образец, служащий эталоном (стандартом) для серийного ли массового воспроизведения (М. автомобиля, М. одежды и т. п.), а также тип , марка какого либо… … Большая советская энциклопедия
Модель — I Модель (Model) Вальтер (24.1.1891, Гентин, Восточная Пруссия, 21.4.1945, близ Дуйсбурга), немецко фашистский генерал фельдмаршал (1944). В армии с 1909, участвовал в 1 й мировой войне 1914 18. С ноября 1940 командовал 3 й танковой… … Большая советская энциклопедия
СТРОЕНИЕ АТОМА — (см.) построен из элементарных частиц трёх видов (см.), (см.) и (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного (см.), электроны образуют электронную оболочку. В ядре действуют силы (см.), благодаря которым… … Большая политехническая энциклопедия
Атом — У этого термина существуют и другие значения, см. Атом (значения). Атом гелия Атом (от др. греч … Википедия
Резерфорд Эрнест — (1871 1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член корреспондент РАН (1922) и почетный член АН СССР (1925). Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Άτομο — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускул — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускулы — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Первая попытка создания модели атома была предпринята Дж. Томпсоном. Он полагал, что атом – это электронейтральная система формы шара с радиусом 10 - 10 м . На рисунке 6 . 1 . 1 . показано, как одинаково распределяется положительный заряд атома, причем отрицательные электроны располагаются внутри него. Чтобы получить объяснение линейчатых спектров атомов, Томпсон тщетно пытался определить расположение электронов в атоме, для расчета частоты их колебаний в положении равновесия. Спустя время Э. Резерфорд доказал, что заданная Томсоном модель была неверна.
Рисунок 6 . 1 . 1 . Модель Дж. Томпсона.
Электроны в атоме. Опыты Резерфорда и Томпсона
Внутренняя структура атомов была исследована Э. Резарфордом, Э. Марсденом, Х. Гейгером еще в 1909 - 1911 годах. Было применено зондирование атома α -частицами, возникающими во время радиоактивного распада радия и других элементов. Их масса в 7300 раз больше массы электрона, а положительный заряд равняется удвоенному элементарному заряду.
В опытах Резерфорда были использованы α -частицы, имеющие кинетическую энергию 5 М э в .
Альфа-частицы – это ионизированные атомы гелия.
Рисунок 6 . 1 . 2 . Схема опыта Резерфорда по рассеянию α -частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп.
Радиоактивный источник, заключенный в свинцовый контейнер, располагается таким образом, что
α -частицы направляются от него к тонкой металлической фольге. Рассеянные частицы попадают на экран со слоем кристаллов сульфида цинка, светящиеся от их ударов. Сцинтилляции (вспышки) можно наблюдать при помощи микроскопа. Угол φ к первоначальному направлению пучка не имеет ограничений для данного опыта.
После испытаний было выявлено, что α -частицы, проходящие через тонкий слой металла, не испытывали отклонений. Наблюдались их отклонения и на углы, превышающие 30 градусов и близкие к 180 .
Модели атомов Томпсона и Резерфорда
Результат Резерфорда противоречил модели Томпсона, так как положительный заряд не был распределен по всему объему атома. Согласно модели Томпсона, заряд не имеет возможности создавать сильное электрическое поле, которое впоследствии отбросит α -частицы. Такое поле однородно заряженного шара максимально на его поверхности и убывает до нуля к центру.
При уменьшении радиуса шара с положительным зарядом атома максимальная сила отталкивания, действующая на α -частицы, по закону Кулона увеличилась бы в n 2 раз.
Если размеры α -частиц достаточно большие, тогда рассеивание может достичь угла в 180 градусов.
Резерфорд пришел к выводу, что пустота атома связана с наличием положительного заряда, сосредоточенного в малом объеме. Данная часть была названа атомным ядром.
Далее возникла ядерная модель атома, показанная на рисунке 6 . 1 . 3 .
Рисунок 6 . 1 . 3 . Рассеяние α -частицы в атоме Томсона ( a ) и в атоме Резерфорда ( b ) .
Резерфорд выяснил, что центр атома имеет положительно заряженное ядро с диаметром 10 - 14 - 10 - 15 м . Оно занимает 10 - 12 полного объема атома, но содержит весь положительный заряд и около 99 , 95 % его массы. Вещество, входящее в состав атома, предполагало наличие плотности p ≈ 10 15 г / с м 3 , а заряд ядра равнялся суммарному заряду электронов. Было установлено, что при взятии за 1 значение заряда электрона, заряд ядра равнялся числу из таблицы Менделеева.
Планетарная модель
Опыты Резерфорда приводили к радикальным выводам и сомнениям ученых. Используя классическое представление о движении микрочастиц, он предлагает планетарную модель атома. Ее смысл заключался в том, что центр атома состоит из положительно заряженного ядра, которое является основной частью массы элементарной частицы. Атом считается нейтральным. При наличии кулоновских сил вокруг ядра по орбиталям вращаются электроны, как показано на рисунке 6 . 1 . 4 . Электроны всегда находятся в состоянии движения.
Рисунок 6 . 1 . 4 . Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов.
Предложенная Резерфордом планетарная модель была толчком в развитии знаний о строении атома. Благодаря ей, опыты по рассеиванию α -частиц смогли объяснить. Но вопрос об его устойчивости остался открытым. Исходя из закона классической электродинамики, заряд, движущийся с ускорением, излучает электромагнитные волны, забирающие и распределяющие энергию. За время 10 - 8 с все электроны потратить всю энергию, вследствие чего упасть на ядро. Так как это не происходит, есть объяснение – внутренние процессы не выполняются согласно классическим законам.
Раздел ОГЭ по физике: 4.2. Опыты Резерфорда по рассеянию альфа-частиц. Планетарная модель атома.
Проводя опыты по изучению строения вещества, Резерфорд показал несостоятельность модели Томсона. Резерфорд облучал тонкую металлическую фольгу α-частицами, имеющими большую энергию. В соответствии с моделью Томсона а-частицы должны были отражаться от атома. Однако очень небольшое число частиц рассеивалось на углы от 90° до 180°. Большинство частиц проходило через фольгу, отклоняясь от направления движения на незначительные углы.

В результате экспериментов Резерфорд предложил новую модель строения атома, названную планетарной моделью. Он сделал следующие выводы:
- в атоме существует положительно заряженная частица, названная ядром атома, которая отталкивает α-частицы;
- размеры ядра малы по сравнению с размерами атома, поскольку отталкивается очень небольшое число α-частиц, а большинство α-частиц свободно проходит через фольгу; ядро имеет диаметр порядка 10 –14 — 10 –15 м.
- масса ядра сравнима с массой β-частицы, поскольку масса электронов в 8000 раз меньше массы а-частицы и электроны не смогли бы изменить направление её движения.
Таким образом, в соответствии с моделью атома Резерфорда в центре атома расположено положительное ядро, вокруг которого движутся отрицательно заряженные электроны. Поскольку масса электронов мала, то масса атома в основном сосредоточена в ядре.
Так как атом в целом нейтрален, то положительный заряд ядра должен быть равен суммарному заряду электронов. Число электронов в нейтральном атоме равно порядковому номеру Z элемента в периодической системе Д.И. Менделеева. Заряд атомного ядра qR равен произведению Z и заряда электрона е: qR= Z • е.
Большинство из нас думает, что знает об атомах достаточно много. Мы знаем какие они маленькие и даже можем дать определение атому. Но как же человечество пришло к пониманию, что такое атом и каковы основы строения атомов?
Модель атома Томпсона (пудинг с изюмом)
Эти лучи он назвал катодными лучами, позднее их стали называть электронными лучами. С помощью магнита, Томпсон определил, что эти лучи содержат частицы с отрицательным зарядом. После большой серии опытов ему удалось установить, что отрицательные частицы (электроны) очень малы, по сравнению с тем, что дает положительный заряд атому.


Модель атома Томпсона
Модель атома Резерфорда (ядерная модель)

Опыт резерфорда
Но вот произошло то, что он никак не ожидал увидеть: хотя большинство частиц летели прямо, некоторые отклонялись на большой угол, а некоторые летели назад в сторону источника. Этот эксперимент позволил предположить, что весь положительный заряд находится в ядре атома, а отрицательно заряженные электроны плавают вокруг него. Согласно ядерной модели строения атома по Резерфорду, большую часть атома занимает пустое пространство.
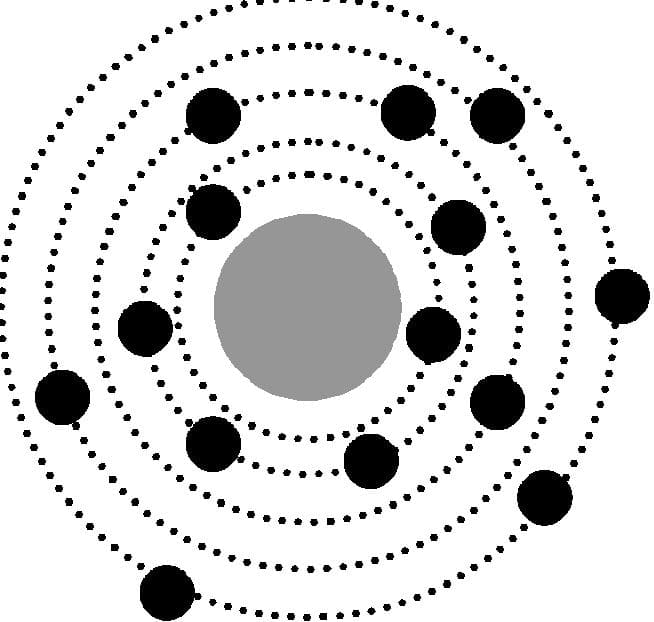
Модель атома Резерфорда
Модель атома Бора (планетарная модель)
Пока другие ученые ставили эксперименты с катодными лучами, Нильс Бор был озадачен теми линиями, которые давал водород при добавлении ему энергии. И вот возникла планетарная модель атома, в которой Бор предположил, что электроны движутся вокруг ядра по круговым орбитам, подобно планетам, вращающихся вокруг Солнца.
Также он полагал, что чем дальше электрон находится от ядра, тем большей энергией он обладает. При получении атомом дополнительной энергии, электроны с ближних орбит могут перескакивать на более отдаленные. Начальная орбиталь называется основной, а конечная – возбужденной. Энергия, полученная атомом должна куда-то уйти, и она высвобождается в виде квантов электромагнитного излучения. Т.к. существует несколько возбужденных состояний, то испускаются кванты различных энергий. Этим он объяснил полученный спектр водорода.

Опыт Нильса Бора
Современная модель атома (квантовая модель)
Во что мы верим сейчас? Из предыдущего раздела Основные понятия и законы химии, мы знаем, что Атом состоит из ядра и электронов. Атомное ядро имеет положительный заряд и состоит из протонов (Z) и нейтронов (N), а сумма масс протонов (Z) и нейтронов (N) атомного ядра называется массовым числом A = Z + N. Электроны атома расположены вокруг ядра на своих орбиталях.
Читайте также:
- Почему социалистическая ориентация не получила развития в освободившихся странах кратко
- Страны центральной и юго восточной европы 9 класс план урока
- Что тебе известно об обычаях славян обществознание 7 класс кратко
- Рисунок и план местности на урок окружающего мира
- Что произошло в тевтобургском лесу история кратко

