Растворы как физико химические системы кратко
Обновлено: 28.06.2024
Растворами называют гомогенные системы из двух или нескольких веществ, состав которых может изменяться в довольно широких пределах.
В настоящее время растворы рассматривают как физико-химические системы, занимающие по свойствам промежуточное положение между механическими смесями (физическими системами) и химическими соединениями.
В растворах, как в механических смесях, сохраняются химические свойства первоначально взятых веществ (в химических соединениях свойства исходных веществ исчезают и появляются новые). Растворы и механические смеси не обладают постоянным составом, состав же химических соединений строго постоянен. Растворы – гомогенные системы, механические смеси – гетерогенны. Растворение как химическое взаимодействие сопровождается тепловыми эффектами, которые не наблюдаются при простом смешении.
По агрегатному состоянию растворы делят на:
растворы газов в газах (газовые смеси);
Далее будут рассматриваться только жидкие растворы, которые подразделяются на:
растворы твердых тел в жидкостях;
растворы жидкостей в жидкостях;
растворы газов в жидкостях.
Растворы являются частным случаем дисперсных систем. Дисперсными называют системы, состоящие из вещества, раздробленного до частиц большей или меньшей величины и распределенного в другом веществе. Измельченное (раздробленное) вещество называют дисперсной фазой. Вещество, в котором распределена дисперсная фаза, называют дисперсионной средой.
Чем больше степень дисперсности, тем меньше размер частиц. По степени дисперсности все системы можно разделить на грубодисперсные, коллоиднодисперсные, молекулярнодисперсные и ионнодисперсные.
а) Грубодисперсные системы (размер частиц 10ˉ 5 – 10ˉ 3 см) – это суспензии, эмульсии, пены.
Суспензии – гетерогенные системы, в которых частицы твердой дисперсной фазы распределены в жидкой дисперсионной среде. Это, например, взвесь крахмала в воде, раствор кофе, известковый и цементный раствор.
Эмульсии образуются двумя несмешивающимися жидкостями. Примерами эмульсий служат молоко, майонез, маргарин, эмульсия бензола в воде.
Пены состоят из ячеек, заполненных газом и отделенных друг от друга жидкими или твердыми пленками. Это мыльная пена, пемза, пенопласты.
Грубодисперсные системы видны в обычный микроскоп и даже невооруженным глазом. Могут задерживаться бумажным фильтром. Из-за больших размеров частиц эти системы неустойчивы и со временем дисперсная фаза отделяется от дисперсионной среды.
б) Коллоиднодисперсные системы (коллоидные растворы). Размер частиц дисперсной фазы составляет 10ˉ 7 – 10ˉ 5 см, а размер частиц дисперсионной среды 10ˉ 8 см. Коллоидные частицы не оседают под действием силы тяжести, проходят через бумажные фильтры; но они невидимы в обычный микроскоп. Коллоидные растворы обычно называют золями. В зависимости от природы дисперсионной среды золи называют гидрозолями – дисперсионная среда – жидкость, аэрозолями – дисперсионная среда воздух.
в) Молекулярнодисперсные и ионнодисперсные системы (истинные растворы). Размеры частиц составляют 10ˉ 8 см, т.е. равны размерам молекул и ионов. В таких системах гетерогенность исчезает - системы становятся гомогенными, образуются истинные растворы. К ним относятся растворы сахара, спирта, неэлектролитов, электролитов и слабых электролитов.
Основной характеристикой всякого раствора является концентрация, которая показывает, в каком соотношении (весом, объемном) взяты растворитель и растворенное вещество. В физической химии применяют в основном следующие способы выражения концентраций растворов:
При постоянной массе раствора
а) Массовая доля (масс.%) – это масса растворенного вещества, содержащаяся в 100 единицах массы раствора.
б) Молярная доля – Xi – число молей растворенного вещества в 100 молях раствора.
При постоянной массе растворителя
а) Моляльная концентрация Сm – количество молей растворенного вещества, содержащееся в 1 кг растворителя [моль/кг].
При постоянном объеме раствора
а) Молярная концентрация СМ – количество молей растворенного вещества, содержащееся в 1 литре раствора [моль/л].
б) Молярная концентрация эквивалентов (нормальная концентрация) СН – количество молей эквивалентов вещества, содержащееся в 1 литре раствора [моль/л].
в) Титр раствора Т – масса растворенного вещества, содержащаяся в 1 миллилитре раствора [г/мл].
Растворы твердых тел в жидкостях
Растворение – процесс самопроизвольный, идущий с убылью свободной энергии при соприкосновении растворяемого вещества с растворителем.
Процесс разрушения твердых тел в жидкостях идет в две стадии:
разрушение кристаллической решетки (активную роль играют молекулы растворителя, которые ослабляют силы связи между частицами и способствуют переходу вещества из твердого состояния в жидкое);
диффузия растворенного вещества в объем растворителя (очень медленная стадия, определяет общую скорость процесса).
Скорость растворения изменяется во времени – уменьшается по мере увеличения концентрации раствора. Скорость можно увеличить:
путем измельчения вещества (возрастает поверхность соприкосновения);
Если растворитель соприкасается с большим количеством растворенного вещества, то через некоторое время раствор окажется насыщенным. Насыщенным называют такой раствор, который находится в фазовом динамическом равновесии с избытком растворяемого вещества. В таком растворе в единицу времени кристаллизуется столько вещества, сколько его растворяется (скорость кристаллизации равна скорости растворения).
Всякий раствор, концентрация которого меньше концентрации раствора, насыщенного при данной температуре, называется ненасыщенным. В таком растворе возможно дополнительное растворение вещества до предела насыщения.
Изменение растворимости с температурой принято изображать графически в виде кривых растворимости. По оси абсцисс откладывают состав раствора, по оси ординат – температуру. Если кривая растворимости не содержит изломов, то при любой температуре из раствора выделяется в виде кристаллов вещество с одинаковым составом.
Появление одного или нескольких изломов на кривых растворимости говорит о том, что в составе выпадающих кристаллов произошли какие-то изменения (кристаллогидрат переходит в безводную соль, либо в кристаллогидрате уменьшилось содержание воды – см.рис.). Иногда излом на кривой соответствует полиморфному превращению.
Равновесие в системе вода – сульфат натрия
АК – выделение кристаллов льда из растворов с малым содержанием соли
КВС – кривая растворимости сульфата натрия
В – точка перехода, соответствует превращению кристаллогидрата в безводную соль. При этом система безвариантна, т.к. при наличии двух компонентов находятся в равновесии 4 фазы: 2 соли, жидкий раствор и пар.
С = К + 2 – Ф = 2 + 2 – 4 = 0. Равновесие в точке В может существовать только при температуре 32,38 0 С и концентрации Na2SO4 32,2%.
К – криогидратная точка, соответствует одновременному равновесию четырех фаз: кристаллов льда, Na2SO410H2O, жидкого раствора, пара. Криогидрат имеет постоянную температуру плавления (кристаллизации), т.к. в системе при указанном равновесии отсутствуют степени свободы.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Раствор - это система, состоящая из растворителя и растворённого вещества.
Раствор - дисперсная система, состоящая из дисперсной фазы (мелко раздробленного вещества) и дисперсионной среды (растворителя – однородной фазы, в котором распределена дисперсная фаза).
Растворами называются гомогенные (однородные) системы, содержащие не менее двух веществ.
Вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке, - растворённым веществом.
Растворы могут быть жидкими, твёрдыми и газообразными.
По растворимости все вещества делятся на хорошо растворимые, малорастворимые,практически нерастворимые.
Хорошо растворимые вещества:
- Твёрдые: сахар, большинство солей, сода, медный купорос, щавелевая кислота, лимонная кислота, щелочи NaOH, KОH.
- Газы: аммиак, хлороводород, бромоводород, йодоводород и т. д.
Малорастворимые вещества:
- Твёрдые: гипс, гидроксид кальция.
- Жидкости: диэтиловый эфир, анилин.
Практически нерастворимые вещества:
- Твёрдые: стекло, серебро, золото, медь, AgCl, BaSO4, CaCO3.
- Жидкости: жиры, растительное масло, нефть, нефтепродукты.
· Газы: благородные газы.
Абсолютно нерастворимых веществ не существует.
С увеличением температуры растворимость большинства твёрдых веществ увеличивается, а растворимость газообразных веществ уменьшается (кипение воды – выделяется кислород). Растворимость газообразных веществ увеличивается с повышением давления (получение газированной воды).
Процесс растворения – физико-химический процесс.
Физический процесс растворения заключается в разрушении межмолекулярных и меж ионных химических связей, кристаллической решётки, что сопровождается поглощением энергии – эндотермический процесс, а так же идёт распределение частиц растворённого вещества между молекулами растворителя (диффузия).
Химический процесс растворения заключается во взаимодействии частиц растворённого вещества с молекулами растворителя, что сопровождается выделением энергии – экзотермический процесс.
Таким образом, в целом процесс растворения веществ сопровождается выделением или поглощением энергии. Если на разрушение химических связей затрачивается больше энергии, чем её выделяется при взаимодействии частиц растворённого вещества с молекулами растворителя, то в процессе растворения энергия поглощается и наоборот. Например, с поглощением энергии идёт процесс растворения нитратов калия и аммония, хлорида натрия. С выделением энергии растворяется серная кислота, безводный сульфат меди (II), гидроксиды натрия, калия и др. вещества.
В зависимости от величины частиц растворённого вещества различают взвеси, истинные растворы и коллоидные растворы.
Взвеси – это грубо дисперсные системы. Они неоднородны . Частицы растворённого вещества можно увидеть не только в микроскоп, но и невооружённым глазом. Взвеси делятся на суспензии и эмульсии.
Суспензии – это дисперсные системы, где дисперсной фазой является твёрдое вещество, а дисперсионной средой – жидкость, причём твёрдое вещество нерастворимо в жидкости.
Например, глина, песок, мел в воде. Со временем частички, образующие взвесь, осаждаются, причём, чем они меньше, тем дольше сохраняется суспензия.
Эмульсии – это дисперсные системы, в которых дисперсная фаза и дисперсионная среда являются взаимно не смешивающимися жидкостями (нефть и нефтепродукты в воде, масло в воде). Со временем эмульсия расслаивается.
Частицы растворённого вещества из суспензий и эмульсий можно отделить отстаиванием и фильтрованием.
Коллоидные растворы занимают промежуточное положение между истинными растворами и взвесями. Это тонкодисперсные однородные системы. Такие частицы способны рассеивать свет, и их можно увидеть в ультрамикроскоп.
Коллоидные растворы делят на золи (коллоидные растворы) и гели (студни).
К коллоидным растворам или золям относятся желатин, конторский и столярный клей, яичный белок, крахмальный клейстер, большинство жидкостей живой клетки (цитоплазма, кариоплазма – ядерный сок, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, пищеварительные соки, тканевая жидкость, и т. д). Коллоидные растворы могут быть получены в результате некоторых химических реакций: при взаимодействии раствора силиката натрия с раствором соляной кислоты образуется коллоидный раствор кремниевой кислоты, при гидролизе хлорида железа (III) в горячей воде.

Коллоидные растворы сохраняются достаточно долго, но со временем осаждаются, а при нагревании или добавлении кислот, щелочей, солей, коагулируют (свёртываются).
Истинные растворы однородны (гомогенны), сохраняются сколь угодно долго, не фильтруются и не отстаиваются. Их нельзя увидеть даже в современные ультрамикроскопы, так как растворённое вещество раздроблено до молекул или ионов, а они не рассеивают свет. Это растворы кислот, щелочей, солей, сахар, спирт в воде.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, (т. е., раствор, находящийся в равновесии с растворяемым веществом), называется насыщенным (всякая жидкость над осадком есть насыщенный раствор).
Раствор, в котором при данной температуре можно ещё растворить добавочное количество данного вещества, называется ненасыщенны. (раствор, который содержит меньшее количество растворённого вещества, чем в насыщенном растворе при тех же условиях).
Раствор, содержащий больше растворённого вещества, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Такие растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворённого вещества (кристаллизация), и раствор становится насыщенным.
Насыщенные и ненасыщенные растворы нельзя путать с разбавленными и концентрированными растворами.
По относительным количествам растворённого вещества и растворителя растворы делятся на разбавленные и концентрированные.
Разбавленные растворы – это растворы с небольшим содержанием растворённого вещества.
Концентрированные растворы – это растворы с большим содержанием растворённого вещества.
Растворы.
Раствор - это система, состоящая из растворителя и растворённого вещества.
Раствор - дисперсная система, состоящая из дисперсной фазы (мелко раздробленного вещества) и дисперсионной среды (растворителя – однородной фазы, в котором распределена дисперсная фаза).
Растворами называются гомогенные (однородные) системы, содержащие не менее двух веществ.
Вещество, взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке, - растворённым веществом.
Растворы могут быть жидкими, твёрдыми и газообразными.
По растворимости все вещества делятся на хорошо растворимые, малорастворимые,практически нерастворимые.
Хорошо растворимые вещества:
- Твёрдые: сахар, большинство солей, сода, медный купорос, щавелевая кислота, лимонная кислота, щелочи NaOH, KОH.
- Газы: аммиак, хлороводород, бромоводород, йодоводород и т. д.
Малорастворимые вещества:
- Твёрдые: гипс, гидроксид кальция.
- Жидкости: диэтиловый эфир, анилин.
Практически нерастворимые вещества:
- Твёрдые: стекло, серебро, золото, медь, AgCl, BaSO4, CaCO3.
- Жидкости: жиры, растительное масло, нефть, нефтепродукты.
· Газы: благородные газы.
Абсолютно нерастворимых веществ не существует.
С увеличением температуры растворимость большинства твёрдых веществ увеличивается, а растворимость газообразных веществ уменьшается (кипение воды – выделяется кислород). Растворимость газообразных веществ увеличивается с повышением давления (получение газированной воды).
Процесс растворения – физико-химический процесс.
Физический процесс растворения заключается в разрушении межмолекулярных и меж ионных химических связей, кристаллической решётки, что сопровождается поглощением энергии – эндотермический процесс, а так же идёт распределение частиц растворённого вещества между молекулами растворителя (диффузия).
Химический процесс растворения заключается во взаимодействии частиц растворённого вещества с молекулами растворителя, что сопровождается выделением энергии – экзотермический процесс.
Таким образом, в целом процесс растворения веществ сопровождается выделением или поглощением энергии. Если на разрушение химических связей затрачивается больше энергии, чем её выделяется при взаимодействии частиц растворённого вещества с молекулами растворителя, то в процессе растворения энергия поглощается и наоборот. Например, с поглощением энергии идёт процесс растворения нитратов калия и аммония, хлорида натрия. С выделением энергии растворяется серная кислота, безводный сульфат меди (II), гидроксиды натрия, калия и др. вещества.
В зависимости от величины частиц растворённого вещества различают взвеси, истинные растворы и коллоидные растворы.
Взвеси – это грубо дисперсные системы. Они неоднородны . Частицы растворённого вещества можно увидеть не только в микроскоп, но и невооружённым глазом. Взвеси делятся на суспензии и эмульсии.
Суспензии – это дисперсные системы, где дисперсной фазой является твёрдое вещество, а дисперсионной средой – жидкость, причём твёрдое вещество нерастворимо в жидкости.
Например, глина, песок, мел в воде. Со временем частички, образующие взвесь, осаждаются, причём, чем они меньше, тем дольше сохраняется суспензия.
Эмульсии – это дисперсные системы, в которых дисперсная фаза и дисперсионная среда являются взаимно не смешивающимися жидкостями (нефть и нефтепродукты в воде, масло в воде). Со временем эмульсия расслаивается.
Частицы растворённого вещества из суспензий и эмульсий можно отделить отстаиванием и фильтрованием.
Коллоидные растворы занимают промежуточное положение между истинными растворами и взвесями. Это тонкодисперсные однородные системы. Такие частицы способны рассеивать свет, и их можно увидеть в ультрамикроскоп.
Коллоидные растворы делят на золи (коллоидные растворы) и гели (студни).
К коллоидным растворам или золям относятся желатин, конторский и столярный клей, яичный белок, крахмальный клейстер, большинство жидкостей живой клетки (цитоплазма, кариоплазма – ядерный сок, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, пищеварительные соки, тканевая жидкость, и т. д). Коллоидные растворы могут быть получены в результате некоторых химических реакций: при взаимодействии раствора силиката натрия с раствором соляной кислоты образуется коллоидный раствор кремниевой кислоты, при гидролизе хлорида железа (III) в горячей воде.
Коллоидные растворы сохраняются достаточно долго, но со временем осаждаются, а при нагревании или добавлении кислот, щелочей, солей, коагулируют (свёртываются).
Истинные растворы однородны (гомогенны), сохраняются сколь угодно долго, не фильтруются и не отстаиваются. Их нельзя увидеть даже в современные ультрамикроскопы, так как растворённое вещество раздроблено до молекул или ионов, а они не рассеивают свет. Это растворы кислот, щелочей, солей, сахар, спирт в воде.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, (т. е., раствор, находящийся в равновесии с растворяемым веществом), называется насыщенным (всякая жидкость над осадком есть насыщенный раствор).
Раствор, в котором при данной температуре можно ещё растворить добавочное количество данного вещества, называется ненасыщенны. (раствор, который содержит меньшее количество растворённого вещества, чем в насыщенном растворе при тех же условиях).
Раствор, содержащий больше растворённого вещества, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Такие растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворённого вещества (кристаллизация), и раствор становится насыщенным.
Насыщенные и ненасыщенные растворы нельзя путать с разбавленными и концентрированными растворами.
По относительным количествам растворённого вещества и растворителя растворы делятся на разбавленные и концентрированные.
Разбавленные растворы – это растворы с небольшим содержанием растворённого вещества.
Концентрированные растворы – это растворы с большим содержанием растворённого вещества.
ЛЕКЦИЯ № 3. Растворы
1. Общая характеристика растворов
Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной среды. Различают девять систем (табл. 1):
Дисперсные системы

где Г – газ;
Т – твердое тело;
Ж – жидкость.
Существуют жидкие, газовые и твердые растворы. Растворы отличаются от химических соединений тем, что их состав может изменяться непрерывно. Как и любая химически равновесная в данных условиях система, растворы должны обладать минимумом свободной энергии Гиббса. По своему агрегатному состоянию дисперсные системы могут быть: газообразными, жидкими, твердыми; по степени дисперсности – взвесями, коллоидными и истинными растворами. Взвеси – гетерогенные системы, нестабильные во времени. Частицы их очень малы и сохраняют все свойства фазы. Взвеси расслаиваются, причем диспергированная фаза или выпадает в виде осадка, или всплывает в зависимости от соотношения плотностей. Примеры: туман (жидкость распределена в газе), суспензия (твердое тело – жидкость), эмульсия (жидкость – жидкость, C2H5OH + H2O – этиловый спирт и вода).
В истинном растворе распределенное в среде вещество диспергировано до атомного или молекулярного уровня. Примеры многочисленны: газообразный раствор – воздух, состоящий из главного компонента азота – 78% N2; сплавы, представляющие собой твердые растворы, например, медные Cu – Zn, Cu – Cd, Cu – Ni и др.
Коллоидные растворы – микрогетерогенные системы, занимают промежуточное положение между истинными растворами и взвесями. Растворы состоят из растворенного вещества и растворителя. Растворителем считают тот компонент, который преобладает в растворе. Свойства растворов зависят от концентрации. Рассмотрим способы выражения концентрации растворов.
2. Концентрация и способы ее выражения
Концентрация – количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя. При определении концентрации растворов используются различные методы аналитической химии: весовые, объемные, а также методы, основанные на измерении плотности, показателя преломления и других физико-химических свойств.
Виды концентрации
Массовая доля растворенного вещества в растворе ?, % – отношение массы вещества к массе раствора:

Пример: пусть m(CaCl2) = 10 г, тогда ?(CaCl2) = (10/100) ґ 100% = 10%.
Молярность раствора – число молей растворенного вещества в одном литре раствора.
Пример: 1 моль H2SO4 – 98 г, до одного литра надо добавить воду.
Моляльность – число молей растворенного вещества на 1000 г растворителя. Пример:
Мольная доля растворенного вещества в растворе, N

где n1 – растворенное вещество (моль);
n2 – растворитель (моль).
Пример: имеем 20% NaOH (едкий натр).

Титр – число растворенного вещества в одном миллилитре раствора. Существует титриметрический анализ – метод количественного анализа, при котором содержание определяемого вещества Х рассчитывают на основании измерения количества реактива, затраченного на взаимодействие с Х, выполнение реакции в титриметрическом анализе является конечной стадией анализа. Пример: объем кислоты оттитруем щелочью каплями до исчезновения окрас-ки – полная нейтрализация. При титровании

где Н – нормальность – число моль-эквивалентов растворенного вещества в одном литре раствора.
Основной характеристикой растворов является их растворимость – масса вещества, способная раствориться в ста граммах растворителя при данной температуре; этот процесс сопровождается тепловым эффектом. Количественно растворимость твердого тела, газа, жидкости в жидком растворителе определяется концентрацией насыщенного раствора при данной температуре, т. е. сколько вещества по массе (объему) в данном растворителе. Пример: m(NaCl) – 58,5 г на 100 г H2O при данной температуре. Насыщенный раствор – раствор, находящийся в равновесии, с избытком растворяемого вещества. Пересыщенный – неустойчивый раствор, содержащий больше вещества, чем это определяется его растворимостью.
Качественная характеристика состоит в способности растворяться или не растворяться, например, сера в воде не растворяется, йод в воде практически нерастворим. Процесс растворения состоит из двух стадий:
1. Растворимость в воде твердых веществ (разрушение кристаллов – эндотермическая реакция, т. е. тепло поглощается –q1).
2. Отдельные частицы взаимодействуют с водой, этот процесс носит название – гидратация, при ней тепло выделяется +q2
Если –q1 > q2, то суммарный эффект отрицателен (–Q), если наоборот, то положителен (+Q).
?H = 0 – одинаковые эффекты, ?H 0 – тепло поглощается.
Тепловой эффект растворения – количество тепла одного моля вещества.
вещество + растворитель - насыщенный раствор + Q.
То вещество, которое растворяется с понижением температуры, увеличивает свою растворимость. Рассмотрим растворимость некоторых веществ. Пример, NH4NO3 – нитрат аммония, растворимость падает до нуля, эндотермический эффект реакции. Рассмотрим стадии подробно: на первой стадии – эффект разрушения кристаллической решетки, эндотермический. На второй – равномерное распределение по объему с водой, гидратация – экзотермический.
q1 > q2 > – Q – тепло поглощается,
Другой пример, NaOH – едкий натр, экзотермический эффект реакции,
q1 +Q – тепло выделяется.
Значит, растворимость определяется природой соли вещества и растворителя.
Другой характеристикой растворов является диэлектрическая проницаемость – во сколько раз сила взаимодействия между двумя зарядами меньше, чем в вакууме.
Если растворить в ста миллилитрах водопроводной воды 10 г едкого натра NaOH, то температура резко повышается до 60 o С (температура воды из водопроводного крана +20 o С).
Если растворить 40 г нитрата аммония NH4NO3 в 100 мл этой же воды, то температура резко понижается от +20 o С до –7 o С.
Если растворить хлорид натрия NaCl в 100 мл водопроводной воды, то температура не изменяется.
3. Растворимость газов в жидкостях
Она зависит от давления и температуры. Растворимость газов неодинакова из-за различной химической природы.
N2, H2 – мало растворимы в воде, растворимость NH3, HCl очень велика, в одном объеме H2O растворяется 700 объемов аммиака NH3.
Газ + H2O > 3,5 объема О2 в одном объеме Н2О экзотермический процесс. С повышением температуры растворимость некоторых газов уменьшается. При постоянной температуре и невысоком давлении растворимость газов, не вступающих в химическое взаимодействие с растворителем, подчиняется закону Генри – Дальтона, который состоит из нескольких частей.
1 часть: масса газа, растворяющаяся в данном объеме жидкости, пропорциональна давлению, которое газ производит на жидкость.
Например, CO2 под давлением загоняем в бутылку.
2 часть: объем газа не зависит от давления.
3 часть: если смесь газов растворять, то растворимость каждой составной части пропорциональна своему парциальному давлению.
Газы, реагирующие с водой, не подчиняются закону Генри – Дальтона.
4. Растворы неэлектролитов. Закон Рауля и его следствия
Рассмотрим модель идеального раствора. Раствор называется идеальным, если в нем отсутствует взаимодействие между частицами (молекулами, атомами, ионами). Растворы неэлектролитов – частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть PBO – давление пара над чистым растворителем, при постоянной температуре T1; PB – давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В:
Разность PBO – PB равна понижению давления пара.
Величина (PBO – PB) /PBO – относительное понижение упругости пара = XA = ?P/PBO, где XA – мольная доля, PBO > PB, ?P = PBO – PB – абсолютное понижение упругости пара.
Закон Рауля. Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.

барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
где Э – эбуллиоскопическая константа, +0,52.
где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа – разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа – разница между температурой замерзания раствора и температурой чистого растворителя.
Для решения задач об этих константах необходимо знать массу растворенного вещества и массу раствора. Например, масса хлороформа (трихлорметан CHCl3) рассчитывается по формуле:

где m1 – масса растворенного вещества;
m2 – масса растворителя;
?t – величина, показывающая на сколько градусов понизилась температура;
К – криоскопическая константа.
Осмос – явление селективной диффузии определенного сорта частиц через полупроницаемую перегородку. Это явление впервые описал аббат Нолле в 1748 г. Перегородки, проницаемые только для воды или другого растворителя и непроницаемые для растворенных веществ, как низкомолекулярных, так и высокомолекулярных, могут быть изготовлены из полимерных пленок (коллодия) или гелеобразных осадков, например, ферроцианида меди Cu2[Fe(CN)6]; этот осадок образуется в порах перегородки стеклянного фильтра при погружении пористого материала сначала в раствор медного купороса (CuSO4 x 5H2O), а затем желтой кровяной соли K2[Fе(CN)6] . Вещества диффундируют через такую перегородку, что является важным случаем осмоса, позволяющим измерять осмотическое дав-ление, т. е. осмотическое давление – мера стремления растворенного вещества перейти вследствие теплового движения в процессе диффузии из раствора в чистый растворитель; распределяется равномерно по всему объему растворителя, понизив первоначальную концентрацию раствора.
За счет осмотического давления сила заставляет жидкость подниматься вверх, это осмотическое давление уравновешивается гидростатическим давлением. Когда скорости диффундирующих веществ станут равны, тогда осмос прекратится.
Закономерности:
1. При постоянной температуре осмотическое давление раствора прямо пропорционально концентрации растворенного вещества.
2. Осмотическое давление пропорционально абсолютной температуре.
В 1886 г. Я. Г. Вант-Гофф показал, что величина осмотического давления может быть выражена через состояние газа
Закон Авогадро применим к разбавленным растворам: в равных объемах различных газов при одинаковой температуре и одинаковом осмотическом давлении содержится одинаковое число растворенных частиц. Растворы различных веществ, имеющие одинаковые молярные концентрации при одинаковой температуре, имеют одинаковое осмотическое давление. Такие растворы называются изотоническими.
Осмотическое давление не зависит от природы растворяемых веществ, а зависит от концентрации. Если объем заменить на концентрацию, получим:

Рассмотрим закон Вант-Гоффа: осмотическое давление раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, если бы оно в виде идеального газа занимало при данной температуре объем, равный объему раствора.
Все описанные законы относятся к бесконечно разбавленным растворам.
Парциальное давление
Парциальное давление – то давление, которое оказывал бы газ, входящий в газовую смесь, если бы из нее были удалены все остальные газы при условии сохранения постоянными температуры и объема.
Общее давление газовой смеси определяется законом Дальтона: общее давление смеси газов, занимающих определенных объем, равно сумме парциальных давлений, которыми обладал бы каждый отдельно взятый газ, если бы он занимал объем, равный объему смеси газов.
где Р – общее давление;
Рк – парциальное давление компонентов.
Фугитивность – функция, характеризующая состояние данного вещества в чистом виде или в смеси с другими веществами при заданных температуре и давлении. По-другому она называется термодинамическая летучесть; является величиной, количественно характеризующей способность вещества к выходу из данной фазы, но выражающей эту характеристику в единицах давления. Для жидкостей и твердых тел она связана с давлением насыщенного пара и становится равной ему, когда к пару применимы законы идеальных газов. Для идеального газа, чтобы найти, например, изменение энергий Гиббса при изотермическом процессе, надо просто решить задачу в соответствии с уравнением Менделеева – Клапейрона:

Для упрощения расчета Г. Льюисом в 1901 г. была введена функция f от Р – фугитивность. Заменяя давление фугитивностью, мы сохраняем простую математическую форму, которую имеют термодинамические зависимости для идеального газа.
Итак, новая функция определяется уравнением:


Значения фугитивности при больших давлениях (и низких температурах) сильно отличаются от Р. Так, при t = 0 и Р = 1200, fco = 2663, при t = 0, P = 100, fNH3 = 204, а для N2 при t = –75, P = 6000, f – 2 x 10 6 , то есть фугитивность становится несоизмеримой с давлением.
Фугитивность можно определить как давление, которое должна производить данная реальная система, чтобы оказывать такое же действие, как и идеальная. Она характеризует отклонение от идеального состояния и, подобно давлению для идеального газа, может рассматриваться как мера рассеиваемости вещества. С приближением реального газа к идеальному состоянию/по величине приближается к Р, так что для идеального газа при всех давлениях обе величины становятся равными, то есть:

Видно, что размерность/совпадает с размерностью Р. Следует подчеркнуть, что замена Р на/в уравнениях идеального газа при переходе к реальному справедлива только для изотермического процесса, так как в соответствии с (2) фугитивность является специфической изотермической функцией. Для характеристики степени отклонения газа от идеального состояния вводят также величину

где ? – коэффициент фугитивности.
Фугитивность растворителя в разбавленном растворе не зависит от природы растворенного вещества и вычисляется по закону Рауля, то есть:

Так как фугитивность жидкости или твердого раствора равна фугитивности насыщенного пара, когда растворитель в парообразном состоянии ведет себя как идеальный газ, уравнение (4) переходит в

Зная зависимостьf1 от состава, можно найти зависимость f2 от N2 по уравнению:

ln f2 = ln N2 + const.
Переписывая это уравнение в виде
ln f2 = ln N2+ ln K(P, T),
получим при P,T= const

Если в последнем уравнении рассматривать f2 как фугитивность растворенного вещества в газовой фазе, сосуществующей жидкой (твердой), то она является точной термодинамической формой закона Генри.
Его формулировка: зависимость растворимости газа в жидкости от давления, заключается в том, что при постоянной температуре газа, растворенного в данной жидкости, растворимость газа пропорциональна его давлению над раствором.
Краткая формулировка: растворимость газа пропорциональна давлению. Этот закон установлен в 1803 г. Ему отвечает уравнение:

где Р2 – парциальное давление растворенного газа.
Газовый закон Генри точно соблюдается только для идеальных растворов и применим лишь в области невысоких давлений к газам, достаточно хорошо подчиняющимся законам Бойля – Мариотта и Гей-Люссака.
Таким образом, для разбавленного раствора фугитивность растворителя вычисляется по закону Рауля, а фугитивность растворенного вещества – по закону Генри. Константа Генри приобретает смысл фугитивности (давления) чистого растворенного вещества при давлении, равном общему давлению над раствором.


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Растворение как физико-химический процесс. Растворимость. Типы растворов"
В каждой нашей клеточке напоминание о зарождении жизни. По нашим сосудам: артериям, венам и капиллярам тоже течет раствор, где содержание солей около 0,9%. Плазма крови, желудочный сок тоже являются растворами. Все физико-химические процессы, происходящие в живых организмах, протекают тоже в растворах. Природные водные растворы участвуют в почвообразовании и снабжают растения питательными веществами. Многие технологические процессы также протекают в растворах (получение бумаги, красок, металлов, удобрений, продуктов питания).
Растворы в организме человека
Растворы в промышленности

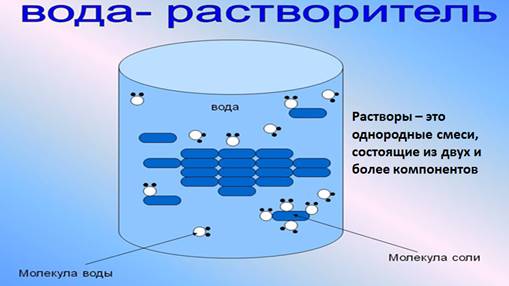
Растворы – это однородные смеси, состоящие из двух и более компонентов.
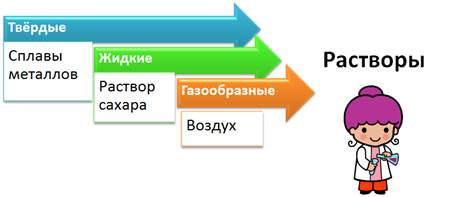
По агрегатному состоянию растворы делят на: твердые (например, сплавы металлов), жидкие (раствор сахара), газообразные (смесь газов – воздух). Наиболее распространены жидкие растворы.
Растворы состоят из растворителя и растворенного вещества (твердого, жидкого или газообразного). Растворителем может быть вода, тогда раствор является водным, а также бензин, эфир, спирт.

Как происходит растворение веществ?
Сторонники физической теории растворов, как Вант-Гофф, Аррениус, Оствальд, считали, что процесс растворения является результатом диффузии, т.е. проникновения молекул растворенного вещества между молекулами воды.
Сторонники химической теории растворов, одним из которых был Д. И. Менделеев, считали, что растворение является химическим взаимодействием растворенного вещества и воды.
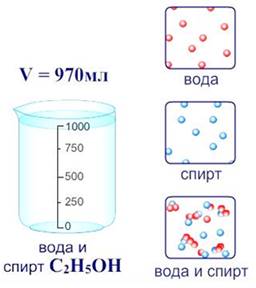
В настоящее время принята физико-химическая теория растворов, которую ещё в 1906 г. предсказывал Д. И. Менделеев. Поэтому растворение является физико-химическим процессом.
Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя. Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
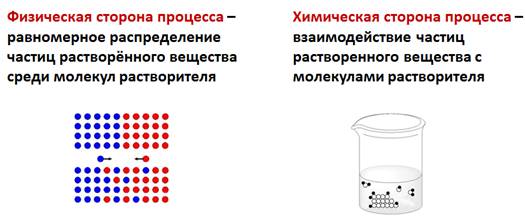
В результате взаимодействия растворенного вещества и воды образуются гидраты. Растворение сопровождается тепловыми эффектами: при растворении серной кислоты воду добавляют к кислоте, из-за сильного разогревания раствора, т.е. теплота выделяется, а при растворении нитрата аммония, хлорида натрия, теплота, наоборот, поглощается.
Кроме гидратов есть еще кристаллогидраты, т.е. это кристаллические вещества, содержащие молекулы воды. Вода, входящая в их состав – кристаллизационная. Примером кристаллогидратов служит медный купорос – CuSO4 · 5H2O. Медный купорос является веществом голубого цвета, а безводный сульфат меди (II) – белый, при растворении в воде, раствор становится голубого цвета.

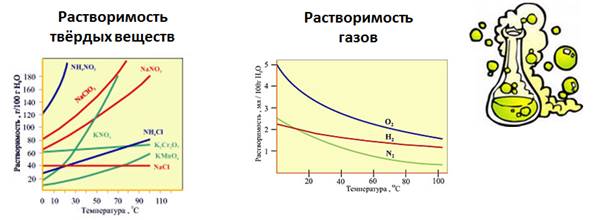
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.
Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды. Если добавить больше соли, то сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный. Раствор, в котором при данной температуре вещество больше не растворяется является насыщенным. Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным. Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.
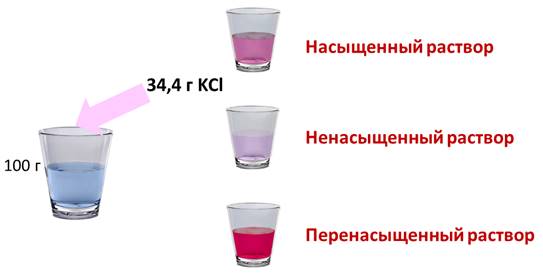
При охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадает в осадок, то образуется перенасыщенный раствор. Перенасыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора. В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.

По растворимости вещества делятся на хорошо растворимые, если при комнатной температуре в 100 г воды растворяется более 1 г вещества, если меньше 1 г вещества, то такие вещества являются малорастворимыми, и если вещества растворяется меньше 0,01 г на 100 г воды, то такие вещества относятся к практически нерастворимым. Совершенно нерастворимых веществ нет. Даже атомы серебра чуть-чуть переходят в раствор из изделий, помещенных в воду.
Читайте также:

