Почему валентность водорода принята за единицу 8 класс кратко
Обновлено: 03.07.2024
Презентация на тему: " 8 к л а с с. Прогнозируемый результат 1. Что такое валентность химических элементов? 2. Почему валентность водорода принята за единицу? 3. Научиться определять." — Транскрипт:
2 Прогнозируемый результат 1. Что такое валентность химических элементов? 2. Почему валентность водорода принята за единицу? 3. Научиться определять валентность по формулам. 4.Запомнить элементы с постоянной и переменной валентностью. 5.Научиться составлять формулы по валентности.
3 Валентность – это свойство атомов химического элемента присоединять определенное число атомов других химических элементов
8 Определение валентности по водороду I I I II III I IV I
9 З а п о м н и т е! I
10 Чтоб валентность элемента в данной формуле узнать, надо рядом с элементом водород пересчитать, римской цифрою представить и над формулой поставить II I III
11 Если рядом с элементом кислород, двухвалентен он, не то что водород, сумму всех его валентностей найди и на индекс элемента раздели Определение валентности по кислороду
12 II IVI III V VII
13 З а п о м н и т е! II
16 I III IV I IIIVI VVII
19 П р и м е р ы: II III I IIII III
20 Составление формул по валентности
21 1. Пишут рядом химические знаки элементов, которые входят в состав соединения: NaO CaBr AlCl Fe O Над знаками химических элементов проставляют их валентность: I II II I III I III II NaO CaBr AlCl Fe O А л г о р и т м
22 3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов: I II II I III I III II NaO CaBr AlCl Fe O 4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс 1 не пишут): Na2O CaBr2 AlCl 3 Fe2 O
23 Валентность некоторых химических элементов Валент ность Химические элементы Примеры формул соединений IH Na K LiH2O Na2O IIO Be Mg Ca Ba ZnMgO CaO IIIAl BAl2O3 I и IICuCu2O CuO II и IIIFe Co NiFeO Fe2O3
24 Натрий, калий, серебро С водородом заодно. С кислородом – магний, ртуть, Кальций, барий и бериллий С ними цинк не позабудь. Трехвалентен алюминий.
25 В старой, пожелтевшей рукописи были приведены химические формулы, но их трудно было разобрать. Неразборчивые символы и индексы мы обозначили крестиками. Восстановите формулы: 1.FexO3 AlX3 P2Ox NHx NaxS З а д а н и е 1. 2Cl 5 32
26 Один ученик очень любил составлять формулы и говорил, что никогда не делает ошибок. Проверьте: так ли это? Вот какие формулы были им написаны: CaCl3 NaO2 Fe4O3 P3 O5 З а д а н и е 2. CaCl2Na2O Fe2O3 P2O5
27 В одной лаборатории были обнаружены склянки с испорченными этикетками. Формулы на них было трудно прочитать. Зная валентность элементов, восстановите формулы: BaClx AlxO3 ZnClx XCl XCl3 З а д а н и е 3. BaCl2 Al2O3 ZnCl2HCl PCl3
28 Вариант 1. (облегченный) 1. Составьте формулы оксидов следующих металлов: натрия, кальция, ртути (I и II), хрома (III). 2. Составьте формулы сульфидов металлов: серебра, магния, алюминия. Сера в этих соединениях двухвалентна. Вариант 2. (средней сложности) 1. Составьте формулы возможных оксидов следующих элементов: калия, меди, железа, алюминия, цинка. 2. Составьте формулы хлоридов металлов: кальция, натрия, хрома, серебра. Хлор в данных соединениях одновалентен. Вариант 3. (повышенной сложности) 1. Составьте формулы нитридов, т. е. соединений с азотом (III), следующих металлов: натрия, алюминия, кальция, калия, магния. 2. Составьте формулы водородных соединений следующих элементов: серы (II), фосфора (III), брома (I), кремния (IV)/
29 Составьте формулы оксидов натрия, кальция, алюминия, ртути(I), ртути (II), хрома (II), хрома (III),хрома (VI), меди(II), железа (III), цинка. Определите валентности элементов, символы которых выделены в химических формулах веществ: Al2O3 PH3. Напишите формулу соединения между этими элементами. Сколько двухвалентных элементов входит в соединения, имеющие формулы: NH3 SO3 ZnCl2 Ca3N2 ? а) 1 б) 2 в) 3 г) 4
30 Определите число одно- и двухвалентных элементов в следующих соединениях: NaCl H2O Al2O3 KH CaO а) 4, 1 б) 1, 4 в) 5,3 г) 3, 5 Высшая валентность серы в соединении с кислородом равна номеру группы, а с водородом – разности между 8 и номером группы. Напишите формулы этих соединений.
31 Определите валентность элементов в соединениях: KCl PH3 Fe2O3 Cl2O SO2 SO3 K2S Определите валентности элементов, символы которых выделены в химических формулах веществ: Cr2O3 и HCl. Напишите формулу соединения между этими элементами.
32 Составьте формулы сульфидов следующих металлов: серебра, магния, алюминия, цинка, калия. (Сера- двухвалентна) Составьте формулы бромидов следующих металлов: серебра, магния, алюминия, цинка, калия, хрома (III), железа (II). (Бром – одновалентен)
Свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента называют валентностью.
Атомы водорода не могут присоединять более одного атома другого химического элемента, поэтому валентность водорода принята за единицу.
Некоторые элементы в разных соединениях проявляют различную валентность.
Вещества, состоящие из двух химических элементов, называют бинарными соединениями.
Зная формулу бинарного соединения и валентность одного из элементов, можно вычислить валентность другого химического элемента.
При определении валентности элемента по формуле бинарного соединения следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента.
Валентность водорода принята за еденицу, потому что под валентностью химических элементов обычно понимается способность свободных его атомов к образованию определённого числа ковалентных связей у водорода число связей, которые может образовывать атом, равно числу его неспаренных электронов, идущих на образование общих электронных пар, т.е. 1.
Есть в химии такое понятие как валентность. По простому, это способность атома образовать химическую связь с другим атомом или атомами.
А как атом может образовать химическую связь с другим атомом? Если он образует с ним общую электронную пару. В атомах может быть разное количество электронов, чем выше порядковый номер атома в периодической системе, тем больше он содержит электронов. Но в образовании химической связи могут участвовать только электроны внешние, наиболее свободные.
У атома водорода только один несчастный электрон. В ядро атома водорода - это один протон. Ну или еще нейтрон, и даже пара нейтронов для изотопов.
Один электрон означает, что атом водорода может организовать только одну общую пару с любым другим атомом. Отдать свой единственный электрон. А одна пара электронов - это одна связь. Вот и принята валентность водорода за единицу. Водород всегда одновалентен.
Не в большей степени, чем метан бывает причиной взрыва на шахте. Основная причина - несовершенство технологий и несоблюдение регламента эксплуатации. Накопление водорода конечно возможно. В "холодном" состоянии выделение водорода в газообразном виде происходит в паровом объеме компенсатора давления. В состоянии "останов для ремонта" и в переходных режимах выделение газообразного водорода происходит в полостях оборудования реакторной установки. Взрывоопасными газовыми смесями, которые могут образоваться в газовых полостях, являются водородно-кислородны е и водородно-воздушные смеси с объемной долей водорода от 4,1%. Накопление взрывоопасной смеси может привести к её детонации. И, разумеется, не выдумка авторов, т.к. случаи детонации именно по такой причине происходили.
В 1989 году на Калининской АЭС произошёл врыв водорода под крышкой реактора, который там накопился вследствие радиолиза.
В 1991 году на Запорожской АЭС произошёл взрыв водорода в коллекторе парогенератора из-за недостаточной вентиляции контура при проведении ремонта.
И, наконец, в 2011 году снова на Калининской АЭС произошёл взрыв водорода при проведении проверки плотности оборудования реакторной установки
Давление водорода (да и любого газа) внутри шарика определяется давлением на него оболочки шара плюс давлением воздуха снаружи. И чем больше это давление, тем меньше объём шарика. Ведь при увеличении давления объём уменьшается и наоборот. И всем давно известно, что атмосферное давление с высотой уменьшается. А в космосе так вообще к нулю приближается. Поэтому при наборе шариком высоты соответственно у него и увеличивается объём. Просто выравнивается давление внутри и снаружи шара.
Надежного способа для хранения водорода нет. Сейчас его хранят под большим давлением в баллонах. Но он постоянно оттуда испаряется. Конечно, взрывоопасных концентраций не создается, но баллоны охлаждаются ощутимо.
Именно поэтому водород отметается, как источник питания двигателей будущего. Пока все указывает на метанол.

Диэлектрические материалы состоят из атомов. А все атомы состоят из положительно заряженного ядра и вращающихся вокруг ядра отрицательно заряженного электронов. Когда отсутствует внешняя электрическое поле, электроны вращаются по своей орбите и центры положительного и отрицательного зарядов совпадают друг другу. Если этот материал поместить в электрическое поле, то отрицательно заряженные электроны смешается в сторону положительного электрода. Центр отрицательно заряженного электрона изменяется, и образуется диполь. В этом случае произошла поляризация диэлектрика.
И это называется электронной поляризации. Она происходит мгновенно (≈ 10^-15с).

При рассмотрении химических элементов можно заметить, что количество атомов у одного и того же элемента в разных веществах разнится. Каким же образом правильно записать формулу и не ошибиться в индексе химического элемента? Это легко сделать, если иметь представление, что такое валентность.
Для чего нужна валентность?
Валентность химических элементов – это способность атомов элемента образовывать химические связи, то есть присоединять к себе другие атомы. Количественной мерой валентности является число связей, которые образует данный атом с другими атомами или атомными группами.
В настоящее время валентность представляет собой число ковалентных связей (в том числе возникших и по донорно-акцепторному механизму), которыми данный атом соединен с другими. При этом не учитывается полярность связей, а значит, валентность не имеет знака и не может быть равной нулю.
Ковалентная химическая связь – это связь, осуществляемая за счет образования общих (связывающих) электронных пар. Если между двумя атомами имеется одна общая электронная пара, то такая связь называется одинарной, если две – двойной, если три – тройной.
Как находить валентность?
Первый вопрос, который волнует учеников 8 класса, начавших изучать химию – как определить валентность химических элементов? Валентность химического элемента можно посмотреть в специальной таблице валентности химических элементов
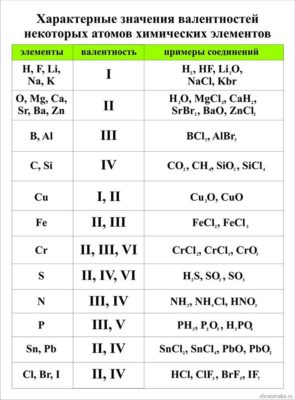
Рис. 1. Таблица валентности химических элементов
Валентность водорода принята за единицу, так как атом водорода может образовывать с другими атомами одну связь. Валентность других элементов выражаем числом, которое показывает, сколько атомов водорода может присоединить к себе атом данного элемента. Например, валентность хлора в молекуле хлористого водорода равна единице. Следовательно формула хлористого водорода будет выглядеть так: HCl. Так как и у хлора и у водорода валентность равна единице, никакой индекс не используется. И хлор и водород являются одновалентными, так как одному атому водорода соответствует один атом хлора.
Рассмотрим другой пример: валентность углерода в метане равна четырем, валентность водорода – всегда единица. Следовательно, рядом с водородом следует поставить индекс 4. Таким образом формула метана выглядит так: CH4 .
Очень многие элементы образуют соединения с кислородом. Кислород всегда является двухвалентным. Поэтому в формуле воды H2O, где встречаются всегда одновалентный водород и двухвалентный кислород, рядом с водородом ставится индекс 2. Это значит, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
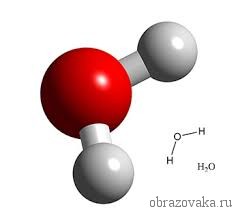
Рис. 2. Графическая формула воды
Не все химические элементы имеют постоянную валентность, у некоторых она может изменяться в зависимости от соединений, где используется данный элемент. К элементам с постоянной валентностью относятся водород и кислород, к элементам с переменной валентностью относятся, например, железо, сера, углерод.
Как определить валентность по формуле?
Если у вас перед глазами нет таблицы валентности, но есть формула химического соединения, то возможно определение валентности по формуле. Возьмем для примера формулу оксид марганца – Mn2O7
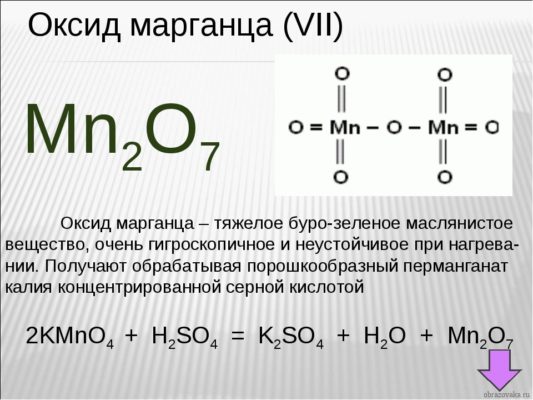
Рис. 3. Оксид марганца
Как известно, кислород является двухвалентным. Чтобы выяснить, какой валентностью обладает марганец, необходимо валентность кислорода умножить на число атомов газа в этом соединении:
Получившееся число делим на количество атомов марганца в соединении. Получается:
7 (VII) – валентность марганца в данном соединении
Что мы узнали?
В данной теме раскрывается информация о том, что такое валентность. Валентность – способность образовывать химические соединения посредством присоединения к атомам одного элемента атомов другого элемента. Валентность бывает постоянная и переменная. Зная валентность того или иного элемента, можно легко научиться записывать формулы соединений.
Читайте также:

