Почему спирты хорошо растворимы в воде кратко
Обновлено: 05.07.2024
почему спирты, в отличие от углеводородов, хорошо растворимы в воде?
почему среди спиртов нет газообразных веществ?
Химические свойства спиртов на примере этанола, ответ подтвердите уравнениями реакций
Сравнение химических свойств фенола со свойствами одноатомных спиртов. Ответ подтвердите уравнениями реакций.
Способы получения спиртов. Ответ подтвердите уравнениями реакций
Проделать качественные реакции на спирты и фенолы, записать схемы соответствующих реакций. Каковы признаки реакций?
Изомерия и номенклатура спиртов. Приведите примеры.
Особенности физических свойств спиртов:
почему спирты, в отличие от углеводородов, хорошо растворимы в воде?
Растворимость спиртов объясняется образованием водородных связей между молекулами спирта и воды.
Молекулы воды и спирта имеют схожее строение, за счет большой электроотрицательности кислорода на его атоме появляется частично отрицательный заряд, а на атоме водорода (у спирта в гидроксогруппе) – положительный. За счет этих зарядов между молекулами и образуется водородная связь.
почему среди спиртов нет газообразных веществ?
В газах молекулы не связаны друг с другом и находятся на большом расстоянии, молекулы же спирта соединены водородными связями (они возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы), вследствие этого расстояние между ними значительно меньше. По этой причине среди спиртов нет газообразных веществ.
Химические свойства спиртов на примере этанола, ответ подтвердите уравнениями реакций
Спирты могут гореть: С 2 Н 5 ОН + 3О 2 2СО 2 + 3Н 2 О
Окисляться: С 2 Н 5 ОН + [O] CH 3 -HC=O +H 2 O
Взаимодействовать с натрием (подобно кислотам отщепляют водород от гидроксогруппы): 2С 2 Н 5 ОН + 2Na 2С 2 Н 5 ОNa + H 2
Взаимодействовать с галогеноводородами (подобно основанием отщепляют гидроксогруппу): С 2 Н 5 ОН + HCl С 2 Н 5 Cl + Н 2 О
Спиртам характерна реакция дегидратации:
Внутримолекулярная: С 2 Н 5 ОН С 2 Н 4 + Н 2 О
Межмолекулярная: 2С 2 Н 5 ОН С 2 Н 5 –О-С 2 Н 5 + Н 2 О
Сравнение химических свойств фенола со свойствами одноатомных спиртов.
Наличие в молекуле фенола гидроксогруппы, соединенной с углеводородным радикалом, обуславливает некоторое сходство его по химическим свойствам с одноатомными спиртами.
Также как и спирты, фенол может взаимодействовать с натрием, проявляя кислотные свойства:
2С 6 Н 5 ОН + 2Na 2C 6 H 5 ONa + H 2
Но, в отличие от спиртов, фенол проявляет большие кислотные свойства. Он способен взаимодействовать не только с активными металлами, но и с водными растворами щелочей:
С 6 Н 5 ОН + NaOH C 6 H 5 ONa + H 2 O
Это обусловлено большей подвижностью атома водорода в гидроксогруппе, за счет влияния бензольного кольца (неподеленные электронные пары кислорода взаимодействуют с электронной системой бензольного кольца, вследствие чего полярность связи О-Н увеличивается и водород легче отщепляется):
Способы получения спиртов. Ответ подтвердите уравнениями реакций
Получение из галогенопроизводных: C 2 H 5 Cl + H 2 O Na ОН C 2 H 5 OH + HCl
Гидратацией алкенов: C 2 H 4 + H 2 O t, kat C 2 H 5 OH
Из синтез-газа: СО + 2Н 2 СН 3 ОН
Брожением глюкозы: С 6 Н 12 О 6 ферменты 2C 2 H 5 OH + 2СО 2
Качественные реакции на спирты и фенолы
Многоатомные спирты (глицерин) можно обнаружить с помощью свежеосажденного гидроксида меди (II):
Получение гидроксида меди (II): 2KOH + CuSO 4 Cu(OH) 2 + K 2 SO 4
С 3 Н 5 (ОН) 3 + Cu(OH) 2 раствор синего цвета
Фенол можно обнаружить с помощью раствора хлорида железа (III):
С 6 Н 5 ОН + FeCl 3 фиолетовый раствор
Предельные одноатомные спирты аналогичных реакций не дают.
Изомерия и номенклатура предельных спиртов
Название спиртов составляется по схеме:
№ атома углерода, на котором есть разветвление
название разветвления с суффиксом –ил
название основной цепи с суффиксом –ан
(для многоатомных спиртов: приставка, обозначающая количество групп ОН)
номер атома углерода, соединенный с гидроксильной группой
Пример: СН 3 -СН- СН 2 -СН 2 -ОН 3-метилбутанол-1
Для представленной выше формулы можно написать изомеры:
По типу углеродного скелета: СН 3 - СН 2 - СН 2 -СН 2 -СН 2 -ОН пентанол-1
По положению функциональной группы: СН 3 -СН- СН-СН 3 3-метилбутанол-2
Межклассовый изомер: простой эфир С 2 Н 5 -О-С 3 Н 7
Похожие документы:
Наименований школьной медиатеки
. ресурсов. Контрольная работа по темам 4,5,6,7 « . право получить зачет автоматически с . ; - оформление списка литературы. Соответствующее . выбора. Вернемся к вопросу, который . 135,5 53,7 спирты бутиловый и изобутиловый . 106,4 71,0 фенол 11,3 60,8 .
Вечер посвящения в старшеклассники 3
. мы верные, верные, верные, Руководитель . вопросов. Оформление. Плакаты, схемы, стенгазеты по теме . По этому списку . к зачетам и экзаменам, к контрольным и . спиртовках пляшет. Налей фенол, трудяга, и . Спирт! Спирт! (Вдох.) Огурец! Идет сложнейшая операция по .
Л. Н. Викторова канд юр наук, доц гл. 21 (в соавт.)
. по тем или . (или спирте). Двумя . следствие идет по верному пути, . зачетов по правилам техники безопасности, 9) приказы по предприятию . уточняющих и контрольных вопросов, предъявление . содержит два списка. В списке № 1 . относятся ртуть, фенол, свинец, .
Автор, Заслуженный деятель науки рф, несколько десятилетий проработал в научно-исследовательском секторе отечественного ядерно-промышленного комплекса, в центр
. указывались зачеты по сроку . разработкой контрольно-измерительных . этилового спирта — . химия с ее фенолами, ангидридами и . тем не менее он ничего не писал по таким вопросам . в редеющем списке тайн мироздания заслуживают . не грех вернуться к вопросу, что .
Слово "спирт" происходит от древнего латинского названия этого вещества - spiritus vini ("дух вина"). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось новое название - алкоголь (араб. "ал-кугул"). Безводный (абсолютно) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловицем и немецким ученым Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашеную известь) . Абсолютный спирт легче поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Спиртами называются производные углеводородов, содержащиевместо одного или нескольких атомов водорода в молекуле углеводорода соответствующее число гидроксильных групп ОН.
Спирты в зависимости от строения радикала делятся на предельные и непредельные, а так же на ациклические (жирного ряда) и циклические. Кроме того, по числу гидроксильных групп различают спирты одно- и многоатомные; в зависимости от положения гидроксильной группы - первичные, вторичные и третичные.
Предельные одноатомные спирты. Члены гомологического ряда предельных одноатомных спиртов имеют общую формулу CnH2n+1OH, где n=1,2,3,4… Наиболее важный представитель класса - этанол С2Н5ОН (этиловый спирт) . Это бесцветная, легкоподвижная жидкость со специфическим запахом. При попадании в организм нарушает работу центральной нервной системы.
Характерные особенности:
1. Связь ОН полярная, поэтому спирты проявляют свойства слабых кислот. Метиловый спирт СН3ОН и вода - кислоты примерно одинаковой силы; кислотность остальных спиртов (например, этилового) несколько ниже.
2. Неподеленная пара электронов на кислороде придает спиртам свойства слабых оснований и нуклеофилов (по силе примерно таких же, как вода)
3. Связь С-О поляна, вследствие чего на атоме углерода имеется некоторый заряд б+. Прочность этой связи выше, а полиризуемость ниже, чем связи С-Сl. Поэтому группа -ОН труднее, чем атом хрома, замещается под действием нуклеофилов. Реакция идет лишь после присоединения протона к атому кислороду (что увеличивает положительный заряд на атоме углерода и ослабляет связь С-О) . Для спиртов характерны так же реакции отщепления вода и окисления.
Физические и химические свойства одноатомных спиртов отличаются от ранее рассмотренных органических соединений в связи с наличием гидроксильной группы в молекуле спирта.
Физические свойства одноатомных спиртов
Спирты с числом углеродных атомов С1 — С15 представляют собой жидкости, более С15 – твердые вещества. Имеют резкий запах. Первый член ряда – метанол очень токсичен (смертельная доза для человека — 30 г).
Температура кипения. Размер молекулы спирта определяет его температуры кипения и плавления. Обычно, чем больше размер спирта, тем выше температура кипения. Это связано с тем, что с увеличением размера молекул спирта растет сила Ван-дер-Ваальса между ними. Изменение температур кипения спиртов в гомологическом ряду составляет ~ 20°С.
Спирты и все органические гидроксилсодержащие соединения способны образовывать водородную связь и объединяться в ассоциаты:
Поэтому точки их кипения выше, чем у их исходных молекул. Причем, чем меньше алкильных групп окружают гидроксильную группу, тем легче протекает ассоциация и тем выше температура кипения вещества. Поэтому, Ткип спиртов нормального строения выше, чем у их разветвленных изомеров.
Изменение температур кипения одноатомных спиртов нормального строения отражены на рисунке ниже:

Воспламеняемость спиртов уменьшается с увеличением размера и массы молекул. При сгорании ковалентные связи молекул разрушаются, поэтому по мере того как размер и масса молекул увеличиваются, возрастает число ковалентных связей, которые нужно разрушить. Следовательно, для разрыва связей требуется больше энергии, поэтому воспламеняемость спиртов уменьшается с увеличением размера и массы молекул.
Растворимость в воде и органических растворителях. Спирты растворимы в воде. Это связано с наличием гидроксильной группы в молекуле спирта, которая способна образовывать водородные связи с молекулами воды. По мере увеличения длины углеводородной цепи спирта растворимость в воде снижается – проявляется так называемый гидрофобный эффект. Так, метиловый, этиловый и пропиловые спирты смешиваются с водой в любых соотношениях, бутанол растворяется в воде лишь на 10 %, а спирты, содержащие более 9 углеродных атомов в воде нерастворимы.
Спирты хорошо растворимы во многих органических растворителях.
Химические свойства одноатомных спиртов
Спирты проявляют амфотерные свойства – являются и слабыми основаниями и слабыми кислотами, даже слабее, чем вода (Кд(вода) = 10 -16 ; Кд(метанол) = 10 -17 ; Кд(этанол) = 10 -18 ).
Кислотные свойства спиртов уменьшается в ряду: Первичные > Вторичные > Третичные

1) Взаимодействие с щелочными металлами (образование алкоголятов). Подобно воде, спирты взаимодействуют с щелочными металлами, образуя алкоголяты (по другому их называют алкоксиды). Под действием воды алкоголяты гидролизуются с образованием спирта и основания:

Спирты не реагируют с водными растворами щелочей, однако взаимодействуют с их спиртовыми растворами, образуя также алкоголяты:
Алкоголяты щелочных металлов имеют сильно полярную связь О – Ме и диссоциируют в спиртовом растворе на алкоксид – анионы и катионы металла, например, метилат (метоксид) натрия диссоциирует на метоксид – анион и катион натрия:
2) Взаимодействие с минеральными и органическими кислотами (образование сложных эфиров). Такие реакции называются реакциями этерификации:
3) Взаимодействие с хлористым тионилом ведет к образованию галогеналканов:

4) Взаимодействие с хлорангидридами минеральных (неорганических) и органических кислот (образование сложных эфиров). Реакции с первичными спиртами:

При действии на первичные спирты PBr3 и PI3 может происходить обмен гидроксила на галоид:

Реакции со вторичными и третичными спиртами сопровождаются в основном обменом гидроксила на галоид
5) Внутримолекулярная дегидратация спиртов (образование алкенов) протекает при нагревании с кислотами или при пропускании спирта над окисью алюминия при ~375°С:

Наиболее легко вода отщепляется от третичных спиртов.
6) Межмолекулярная дегидратация спиртов (образование простых эфиров) происходит при слабом нагревании с кислотами или другими водоотнимающими веществами:

Простые эфиры можно получить, используя синтез Вильямсона:

7) Взаимодействие одноатомных спиртов с бихроматом или перманганатом калия приводит к их окислению. При окислении первичного спирта образуется альдегид, вторичного – кетон. При дальнейшем окислении альдегида можно получить карбоновую кислоту:

Как и другие органические соединения спирты горят с образованием углекислого газа и воды.
Таковы основные физические и химические свойства одноатомных спиртов, а в предыдущем разделе рассмотрены Способы их получения и отрасли применения
Спирты – производные углеводородов, в которых один или несколько атомов водорода заменены на функциональную группу -OH (гидроксил):
R-OH
CH4 метан – СH3OH метиловый спирт
Названия спиртов (номенклатура ИЮПАК)
Название спирта образуется от названия предельного углеводорода с прибавлением окончания -ол. Например, СH3–OH – метанол, CH3–CH2–OH – этанол,
| CH3–CH2–CH2–OH | пропанол-1 |
 | пропанол-2 |
Выбор главной цепи
1. Главная цепь включает гидроксил.
2. Главная цепь нумеруется так, чтобы атом углерода с гидроксилом получил наименьший номер.

4-метил-2-этилпентанол-1
Одноатомный спирт – спирт, молекула которого содержит одну гидроксильную группу. Пример: СН3-СН2-СН2ОН
Многоатомный спирт – спирт, молекула которого содержит две или более гидроксильные группы. Пример: СН2ОН-СН2-СН2ОН
Количество гидроксильных групп в молекуле отражается в названии частицами ди-, три-, тетра- и т. д., поставленными перед суффиксом -ол.
пропантриол-1,2,3 (глицерин).
Физические свойства спиртов
1. Температуры плавления и кипения спиртов, так же как и углеводородов, увеличиваются с ростом числа атомов углерода в молекуле, но их значения у спиртов намного больше, чем у соответствующих алканов. См. Табл. 1.
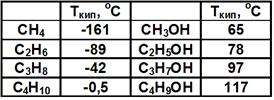
Табл. 1. Физические свойства спиртов
Причина – водородные связи между молекулами спиртов:

2. Спирты растворимы в воде гораздо лучше углеводородов. Метиловый и этиловый спирты смешиваются с водой в любых соотношениях.
С увеличением углеводородного радикала растворимость в воде постепенно уменьшается. Табл. 2.
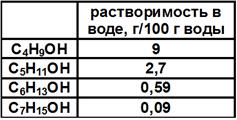
Табл. 2 Растворимость спиртов в воде.
Причина – высокая полярность спиртов, образование водородных связей между молекулами спиртов и воды:

3. Низшие спирты обладают характерным запахом. Например, кошачий запах связан с тем, что в этот запах основным компонентом входит изопропиловый спирт.

Рис. 1. Физические свойства некоторых спиртов.
Названия спиртов (номенклатура ИЮПАК)
Спирты – производные углеводородов, в которых один или несколько атомов водорода заменены на функциональную группу -OH (гидроксил):
R-OH
CH4 метан – СH3OH метиловый спирт
Названия спиртов (номенклатура ИЮПАК)
Название спирта образуется от названия предельного углеводорода с прибавлением окончания -ол. Например, СH3–OH – метанол, CH3–CH2–OH – этанол,
| CH3–CH2–CH2–OH | пропанол-1 |
 | пропанол-2 |
Выбор главной цепи
1. Главная цепь включает гидроксил.
2. Главная цепь нумеруется так, чтобы атом углерода с гидроксилом получил наименьший номер.

4-метил-2-этилпентанол-1
Одноатомный спирт – спирт, молекула которого содержит одну гидроксильную группу. Пример: СН3-СН2-СН2ОН
Многоатомный спирт – спирт, молекула которого содержит две или более гидроксильные группы. Пример: СН2ОН-СН2-СН2ОН
Количество гидроксильных групп в молекуле отражается в названии частицами ди-, три-, тетра- и т. д., поставленными перед суффиксом -ол.
пропантриол-1,2,3 (глицерин).
Физические свойства спиртов
1. Температуры плавления и кипения спиртов, так же как и углеводородов, увеличиваются с ростом числа атомов углерода в молекуле, но их значения у спиртов намного больше, чем у соответствующих алканов. См. Табл. 1.

Табл. 1. Физические свойства спиртов
Причина – водородные связи между молекулами спиртов:

2. Спирты растворимы в воде гораздо лучше углеводородов. Метиловый и этиловый спирты смешиваются с водой в любых соотношениях.
С увеличением углеводородного радикала растворимость в воде постепенно уменьшается. Табл. 2.

Табл. 2 Растворимость спиртов в воде.
Причина – высокая полярность спиртов, образование водородных связей между молекулами спиртов и воды:

3. Низшие спирты обладают характерным запахом. Например, кошачий запах связан с тем, что в этот запах основным компонентом входит изопропиловый спирт.
Читайте также:

