Почему митохондрии можно назвать силовыми станциями клетки кратко
Обновлено: 08.07.2024
Потому что митохондрии вырабатывают Адезинтрифосфорную кислоту (АТФ) в цикле химических реакций, который называется циклом Креббса по митохондриям. Для любителнй фитнеса это полезно знать подробнее. На западе это входит в стандарт обучения.
Митохондрии - это двумембранный сферический или эллипсоидный органоид диаметром обычно около 1 микрометра, выполняют энергетическую функцию. Энергия расходуется и на работу мышц, они выполняют силовую функцию, поэтому митохондрии называют "силовыми станциями" клетки.
Клетки микроглии участвуют в образовании мозговых оболочек. Клетки глии обеспечивают также электрическую изоляцию отдельных нейронов от воздействия других нейронов и важной особенностью клеток глии является то, что в отличие от нейронов они сохраняют способность делиться на протяжении всей своей жизни. Это деление в некоторых случаях приводит к опухолевым заболеваниям головного мозга человека,увы.
Строение клетки эукариот хорошо изучено и разобрано по частям.
Строение ядра клетки также достаточно изучено.
Но есть образование в клеточных ядрах, которые есть не у всех ядерных организмов.
Это тельце Кахаля, названное так по фамилии ученого, открывшего его (Рамона-и-Кахаля).
Основная функция телец Кахаля заключается в образовании малых ядерных и ядрышковых
рибонуклеиновых кислот. Кроме того, они участвуют в сборке рибонуклеопротеиновы х комплексов.
Многие ядерные клетки не имеют телец Кахаля, но они есть в ядрах клеток нейронов и в раковых
Тельцы Кахяля можно обнаружить в течение всей интерфазы, но в митозе они исчезают.
Тельца Кахаля являются самоорганизующейся структурой.


Потому что клетка по своим функциям действует как самостоятельный орган. она питается, обладает способностью расти, делиться, выделять продукты энергетического и пластического обмена. то есть клетка - это единица всего живого.
Если "на пальцах", то примерно так. Значит, ДНК состоит из структурных и регуляторных генов, сигнальных последовательностей, в результате скоординированной работы которых функционирует "биохимическая машина", в частности, синтезируются структурные белки - основной материал, из которого строятся клетки и ее органеллы (ее структурно-функциональные составляющие). Белок нарабатывается по следующей схеме: ДНК (ген) --> РНК (этот процесс перекодировки называется транскрипцией) --> полипептидная цепь ("предбелок; синтез закодированной в ДНК и перекодированной в РНК полипептидной цепи называется трансляцией (происходит в специальных органеллах - рибосомах)); итак, белок нарабатывается, клетка "отстраивается", вырастает вдвое, а попутно удваивается (реплицируется) и ДНК. После того, как "все удвоится", клетка готова к делению. Разделилась. Итог: была одна клетка, стало 2. Итак, ДНК - вместилище всей наследственной информации, и реализация этой информации есть не что иное, как скоординированно протекающие биохимические процессы и, в частности, рост клеток, целого организма.
Пластиды – это органоиды, которые научились использовать свет. Пластиды похожи на бактерий или на клетки, у них есть мембрана и ДНК. Но особенностью пластидов является то, что они способны использовать световую энергию. Сами пластиды состоят из так называемых протопластидов, которые представляют из себя мелкие прозрачные мемебранные образования.
Пластиды могут быть разных цветов, в зависимости от разновидностей.
Самые простые пластиды – лейкопласты – бесцветные, они служат для накопления питательных веществ. Хромопласты - это пластиды желтого, красного, оранжевого цвета, содержащие каротиноиды.
Самые сложные и интересные пластиды – хлоропласты. Эти пластиды зеленого цвета за счет содержания в них хлорофилла. Именно эти пластиды и преобразовывают солнечный свет в питательные вещества для растения, а также придают листьям растений зеленый цвет

Сегодня внедряемся в научные изыскания. Статья будет сложной для прочтения. Я максимально упрощала материал, но проще - некуда. На написание меня как всегда "вдохновила" всеобщая бесконечная жалоба - "слабость, ничего не помогает, ваших капельниц, таблеток хватило на 2 недели. ". Сегодня рассмотрим самый сложный случай дефицита Энергии - дисфункция Митохондрий. Это еще малоизученная и сложная часть медицинской науки. Дисфункция митохондрий может быть врожденная и в нашем (рассматриваемом случае) - приобретенная.
Энергия в нашем организме представлена в следующем виде - молекула АТФ.
АТФ-аденозинтрифосфат, является основным источником энергии для клеток в частности и организма в целом. Представляет собой - эфир аденозина (пурин). Кроме того, является источником синтеза нуклеиновых кислот, для образования структуры ДНК!(наш генетический код)и посредником передачи в клетку гормонально сигнала! Вывод: нехватка АТФ - чревата извращение/недостатком гормонального ответа и не только. АТФ образуется в митохондриях (это маленькие структурные компоненты любой клетки, митохондрия имеет собственную ДНК!, как и ядро клетки. это высокоорганизованная структура ). Вот почему заболевания с нарушением синтеза АТФ - называются митохондриальные дисфункции.
В сутки в организме образуется 40 кг АТФ. Органы с максимальной выработкой АТФ: мозг 22%, печень 22%, мышцы 22 %, сердце 9%, жировая ткань всего - 4%, заметьте - ЩЖ с в этот перечень даже не вошла. Мозг и печень лидеры !
Теперь о самом процессе образования энергии. Смотрим на картинку.
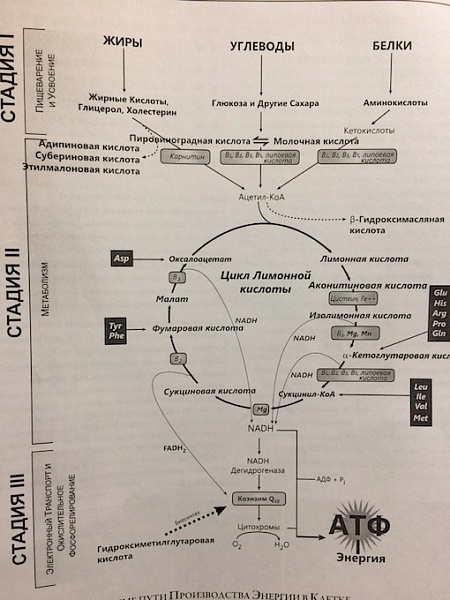
Процесс образования энергии можно разделить на 3 этапа.
1 этап - это получение более простых молекул( в цикл образования энергии) из углеводов(У), жиров(Ж) и белков пищи(Б). Углеводы расщепляются до моносахаров(глюкоза,фруктоза), жиры до жирных кислот, белки до аминокислот. "Расщепление" Б,Ж,У происходит как к кислородной среде(аэробной), так и в бескислородной(анаэробной) среде. Это крайне важно! Так как из анаэробного гликолиза 1 молекулы глюкозы образуется - 2 молекулы АТФ, из аэробного (кислородного) гликолиза 1 молекулы глюкозы - образуются 36 молекул АТФ, из аэробного окисления 1 молекулы жирной кислоты - 146 молекул АТФ, ( жиры и белки в бескислородной среде вообще не расщепляются!, вывод - например, при нелеченной анемии(дефицитО2) снижение веса почти невозможно). Так, и усвоение 1 молекулы глюкозы требует 6 молекул О2, а 1 молекулы жирных кислот -23 молекулы О2. Вывод - жиры основной источник энергии, и всем нужен О2.
2 этапом - образуется из всех молекул У, Ж, Б - АцетилКоА - промежуточный метаболит. Суть этого этапа, что кол-во выработанного АцетилКоА зависит от уровня многих витаминов и микроэлементов (витамина С, группы В, цинка, меди, железа и др). Почему так важно для образования энергии - восполнение дефицита этих элементов!
3 этап - этот самый АцетилКоА поступает в 2 основных биохимических пути выработки АТФ - это цикл Кребса( лимонной кислоты) и цикл окислительного фосфорилирования ( передачи электронов, "дыхательная цепь";), происходит образование НАД- и НАДН+. Связь между этими двумя б/х циклами - и "есть узкое горлышко", "слабое место" в образовании АТФ. И зависит от рН среды клетки - при развитии в/клеточной гипоксии = в/клеточного ацидоза и ухудшается процесс образования АТФ - организм захлебывается в избытке НАДН, а НАДН сопряжен с "утечкой кислорода из клетки"( механизм не буду расшифровывать) и образованием активных(агрессивных) форм кислорода ( свободных радикалов) - а это повреждающие агенты для клетки при образовании в избыточном количестве.
Метаболический ацидоз - это следствие первичного дефицита О2 в организме (сам ацидоз становится причиной вторичного дефицита О2-утечки кислорода). Ацидоз выражается накоплением промежуточного продукта обмена - лактата, избытком Н+(иона водорода), митохондрии "начинают задыхаться и стареть и гибнуть"! А в месте со старением митохондрий - стареет организм, вот почему так молодеют некоторые заболевания - раньше развиваются атеросклероз, б-нь Альцгеймера, сахарный диабет (да-да , это митохондриальное заболевание), рак, артериальная гипертензия, АИТ, синдром хр усталости, даже НЯК и болезнь Крона (как одна из теорий) и др.
Как цикл лимонной кислоты (цикл Кребса) , например, связан с ожирением? - активное поступления с пищей жирных кислот- приводят к истощению транспортных карнитиновых (всем известен для сравнения Карнитин для спорт -питания) систем( переносчиков жирных кислот, их и так немного) и снижения активности работы "дыхательной цепи" , снижается чувствительность тканей к инсулину- развивается многим известная инсулинорезистентость! Исход - метаболическая печалька - метаболический синдром.
Соответственно: причинами снижения синтеза АТФ прежде всего являются дефицит О2!(как бывает в больших городах, где мало зелени. загазованность - продукт сгорания бензина это не О2-а СО2 . люди не выходят из помещений, мало двигаются - "мелкие сосуды закрыты для доступа О2", причинами могут быть болезни органов дыхания и сердечно-сосудистые патологии), ацидоз = "закисление организма" (накопление лактата, избыток Н+), полидефицит витаминов и микроэлементов для улучшения усвоения Ж, Б, У. Для лечение дефицита О2 даже был придуман аппарат - в основе которого интервальная гипоксическая тренировка. Это новая эра в лечении многих патологий.
Как же заподозрить митохондриальные проблемы? Они сложны как для понятия, так и для диагностики.
Из "простых анализов", которые можно набрать любой лаборатории - снижение рН крови, О2, повышение: лактата, СРБ, фибриногена, холестерина, ЛПНП, триглицеридов, гомоцистеина, мочевой кислоты, (клинически - повышение Ад, учащение ЧСС в покое, одышка в покое), снижение ферритина, из редких - снижение глутатиона, витаминов крови, снижение Q10, нарушение в системе антиоксидантов (по крови).
Из более редких , но все же доступных анализов (более специфических) - органические кислоты мочи ( благодаря этому анализу можно определить примерно на каком уровне идет нарушение и чем его скорректировать).
Если патология так сложно выявляемая - "как это лечить?",- спросите вы
Прежде всего меняем образ жизни - улучшаем доставку О2!, бросаем курить! чаще дышим в парке и не только.. Лечим и приводим в ремиссию хронические дыхательные заболевания , восполняем дефицит витаминов и минералов!, добавляем антиоксиданты, сосудистые препараты(!) очень важно улучшить кровоток (слабость всегда сопровождается рассеянностью, снижением памяти и внимания, - правильно, максимальная сосудистая сеть в головном мозге!!), реже добавляем "энергетики" - янтарная кислота, Q10, карнитин, НАДН и др. Я не говорю здесь про врожденные митохондриальные дисфункции - это следствие генетической поломки,а мы говорим сейчас больше о приобретенных причинах. Будем ждать новых научных материалов по этой теме.

Митохондрия – это органоиды в клетках, являющиеся источником энергии для этих клеток. Они считаются частью клетки и отвечают за превращение органических веществ из пищи в энергию для тела.
Сегодня снова перед научным миром встает вопрос, что представляет собой митохондрия?
А что происходит в старости?
Когда основная масса митохондрий будет повреждена свободными радикалами или их количество резко сократится, то они не смогут производить достаточное количество энергии для поддержания жизни – наступает старение мышечных волокон человека. Это отражается на внутренних органах, которые начинают чахнуть.
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.

Рис. 1. Схематическое строение митохондрии
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Итак, если в клетку какой-либо из этих тканей (кроме некоторых нейронов в мозге, об этом потом) поступает большое количество питательных веществ (поступление превышает затраты), то митохондрии находятся в разделенном (фрагментированном) состоянии. Если клетка находится в состоянии голода (поступления меньше затрат), то происходит слияние митохондрий и они находятся в соединенном состоянии. [3,4]. Так поддерживается гомеостаз клетки (рис.2).

Рис. 2 Регулирование морфологии и биоэнергетической эффективности митохондрий в ответ на избыточное или недостаточное поступление питательных веществ [из 2]
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).

Рис.3 Баланс энергопотребления и энерогообеспечения связан с соответствующими изменениями архитектуры митохондрий и их биоэнергетической эффективностью [из 3]
Физиологические процессы, связанные с увеличением спроса на энергию и снижением энергопоставок, (например, острый стресс, голодание и фаза G1/S) характеризуются удлинением митохондрий и дыханием, связанным с синтезом АТФ. С другой стороны, физиологические процессы, связанные с уменьшением спроса на энергию и увеличением ее поставок (высокий уровень питательных веществ, ожирение и диабет типа 2), связаны с фрагментацией митохондрий, выделением тепла или снижением функции митохондрий.
Здоровые циклы деления и слияния – залог метаболического здоровья клетки
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
Длительное ингибирование деления митохондрий (при длительном клеточном голодании) приводит к накоплению поврежденных митохондрий, которые не могут быть сегрегированы [3, 4].
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.

Рис.4 Жизненный цикл митохондрий и его регулирование доступностью питательных веществ [из 3]
Митофузины – не просто какие-то белки
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Гипоталамус, митохондрии, метаболическая дисфункция и старение
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).

Рис. 5. Гипоталамический контроль метмболизма энергии. Мозг интегрирует метаболические сигналы (лептин, инсулин, грелин, PYY3-36) от периферических тканей, таких как поджелудочная железа, жировая ткань, желудок. В мозге специализированные нейронные сети координируют адаптивные изменения в поглощении и расходе пищи [из 5].
Так кто и как регулирует чувствительность нейронов гипоталамуса?
Изучение динамики митохондрий в тканях мозга показало, что динамика митохондрий играет существенную роль в способности нейронов гипоталамуса контролировать уровень глюкозы и гомеостаз энергии в организме [6,7,8].
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).

Рис.6. Метаболическая адаптация к стимулам окружающей среды [из 2]
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
Как повлиять на динамику митохондрий?
1. Питание и физические упражнения
Циклы питания Избыток пищи и высокожировая диета (HFD) ингибирует слияние митохондрий в клетках (в некоторых нейронах мозга механизм иной). Незавершенный цикл деления-слияния митохондрий нарушает процессы аутофагии → увеличивается внутриклеточная гетерогенность митохондрий → не происходит селективного удаления митохондрий → накапливаются митохондрии с дисфункцией.
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
К насыщенным жирным кислотам относится пальмитиновая (С16) и стеариновая (С18). Показано, что употребление стеариновой кислоты (C18:0) стимулирует процесс слияния митохондрий. Действие ее связано с влиянием на митофузины. У мышей диетические добавки стеариновой кислоты могут частично восстанавливать митохондриальную дисфункцию, вызванную мутациями в генах Pink1 или parkin. В нейтрофилах людей, находящихся 2 дня на low-С18:0 диете, митохондрии находятся во фрагментированном состоянии (50% клеток имели фрагментированные МХ, 10 % соединенные МХ). Употребление стеариновой кислоты приводило у них к слиянию митохондрий через 3 часа [8]. Таким образом., стериновая кислота важна для поддержания циклов динамики митохондрий. Больше всего стеариновой кислоты находится в какао-бобах (31-34 %).
Фосфолипиды – основные компоненты мембран органелл. Они также регулируют динамику митохондрий, при этом их влияние различно [9].
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Для повышения эффективности доставки насыщенных жирных кислот в мембрану возможно использование переносчиков. Например, – использование насыщенного фосфатидилхолина (дипальмитофосфатидилхолин и дисероилфосфатидилхолин), который, потенциально, сможет доставить насыщенные ЖК прямо в кардиолипин [10]. Холин, как переносчик, легко проходит через цитозоль и поступает в митохондрии.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).

Рис.7 Регулирование слияния митохондрий фосфатидной кислотой (PA) и кардиолипином (CL) [из 9].
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Генная терапия митохондрий
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Ранее считалось, что образ жизни, в том числе переедание, приводит к образованию свободных радикалов, окислительному стрессу, мутациям митохондриального генома и, последовательно, нарушениям функциии митохондрий. Однако, в последнее время есть убедительные доказательства того, что мутации митохондриальной ДНК неизбежны, есть у всех (heteroplasmic DNA point mutations) и связаны с ошибками репликации, а не с оксидативными повреждениями, к которым митохондриальная ДНК довольно устойчива [12]. Уже на этапе оплодотворенной яйцеклетки часть наших митохондрий несут мутации. Со временем они делятся, мутантных митохондрий становится больше, они не могут нормально выполнять свою функцию.
Тут очень кстати можно было бы использовать редактирование генома митохондрий in vivo. Было показано, что для heteroplasmic DNA point mutations у мышей уже был достигнут значительный успех при помощи targeted zinc-finger nucleases (mtZFN) с доставкой при помощи аденовирусного вектора [13].
Перенос митохондрий

Рис.9 Способы доставки экзогенных митохондрий в клетку
Читайте также:

