Почему галогены образуют двухатомные молекулы кратко
Обновлено: 02.07.2024
Эти галогены являются химическими элементами по 17 - й группе (столбец) из таблицы Менделеева , ранее групп VII , A: они являются фтором 9 F, то хлор 17 Cl, то бром 35 Br, то йод 53 Я, астатин 85 В и теннесс 117 ц. Эти последние два элемента являются очень радиоактивными , теннесс даже синтетическими , только первые четыре хорошо охарактеризованы и образуют семейство одноименных химических элементов с очень однородными свойствами: особенно электроотрицательными , они очень химически активны, их реакционная способность уменьшается, когда их атомный номер увеличивается; Таким образом, фтор является наиболее реактивным из них, образуя соединения со всеми другими известными химическими элементами, кроме гелия и неона . Астатин принадлежит к группе галогенов, но не к семейству галогенов, будучи скорее классифицированным среди металлоидов, учитывая его физические свойства, которые являются более металлическими, чем свойства йода; астатин можно рассматривать как принадлежащий как к семейству галогенов, так и к семейству металлоидов. Что же касается Теннеси, он был произведен только со скоростью нескольких атомов с очень короткой продолжительности жизни - The полураспада из изотопы 293 Ts и 294 Ts составляет порядка от 22 мс и 51 мс , соответственно , - таким образом , что его макроскопическая физическая и химические свойства неизвестны: поэтому он не отнесен ни к одному семейству элементов.
При 0 ° C и атмосферном давлении простые тела этого семейства состоят из двухатомных молекул . Их стандартное состояние - газообразное для дифтора F 2. и хлор Cl 2 , жидкость для брома br 2 , и сплошной для диода I 2 . Обычно они не встречаются в природе в этой форме, хотя в антозоните был обнаружен дифтор . Поскольку их валентная оболочка содержит семь электронов, они легко образуют анионы , называемые галогенидами : фторид F - , хлорид Cl - , бромид Br - и йодид I - . За исключением фторида водорода ( плавиковой кислоты ) HF их соединения с водородом являются все сильные кислоты : сол ную кислоту (водный раствор хлористого водорода HCl), в частности.

Общая электронная конфигурация для всех галогенов ns2 np5, т.
Е. для завершения внешнего электронного слоя не хватает 1 электрона, чтобы образовалась устойчивая электронная конфигурация, как у инертных газов, поэтому атомы галогенов легко соединяются в двухатомные гомоядерные молекулы, т.
К. связь между атомами в молекулах галогенов неустойчивая (ковалентная неполярная), они легко распадаются.

Двухатомные молекулы при обычных условиях имеет1) хлор2) кальций3) фосфор4) кремний?
Двухатомные молекулы при обычных условиях имеет

Решите пожалуйста)Задание?
1. Написать уравнение реакции двухатомного спирта с натрием.
С галоген водородами
Написать реакцию этирификации двухатомного спирта с уксусной кислотой.
3. Написать реакцию окисления CuO.

Атомы какого химического элемента образуют двухатомные молекулы?
Атомы какого химического элемента образуют двухатомные молекулы?

Теория, Галогены?
Цель : изучить строение атомов и молекул галогенов.
1. Как были открыты галогены?
2. Где в ПСХЭ расположены галогены?
3. Сколько электронов находиться на внешнем уровне и как это сказывается на их свойствах?
4. Почему галогены называют "солеобразующими"?
Связи существуют в галогенах и в их соеденениях.
Помогите ответить на эти вопросы, мне на них отвечать устно.
Т. е напишите самое основное, потому что в инете слишком много ненужного.
Заранее всем за помощь большое спасибо!

Какие из указанных неметаллов образуют двухатомные молекулы?
Какие из указанных неметаллов образуют двухатомные молекулы?
Фосфор Фтор Кислород Криптон Кремний.

Почему молекула брома двухатомна?
Почему молекула брома двухатомна?

Все элементы главной подгруппы 7 образуют простые вещества, состоящие из двухатомных молекул?
Все элементы главной подгруппы 7 образуют простые вещества, состоящие из двухатомных молекул.
Запишите электронную схему образования и структурную формулу таких молекул, пользуясь общим химическим знаком для всей подгруппы Г(галоген).

Вычислите массу азота (молекулы двухатомны) который займёт при н?
Вычислите массу азота (молекулы двухатомны) который займёт при н.
У. объёма 8, 96 л.

Сколько граммов натрия потребуется для взаимодействия с 8 г брома?
Сколько граммов натрия потребуется для взаимодействия с 8 г брома?
(при составлении уравнения учтите, что бром - двухатомная молекула).

Галоген, в молекуле которого длина связи максимальная,1) бром 2) фтор 3) хлор 4) йод?
Галоген, в молекуле которого длина связи максимальная,
1) бром 2) фтор 3) хлор 4) йод.
Вы открыли страницу вопроса Почему галогены образовывают двухатомные молекулы?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 10 - 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.

Это задачи на избыток и недостаток. Решение есть на фотографии. Когда находят , что дано в недостатке, рассуждают так(в данном конкретном случае) : для взаимодействия 24 г сульфата магния необходимо 16 г гидроксида натрия, а его по условию задачи д..

А) + 5, + 3, - 4, + , + 4, + , + 3, + 5 б) + 3, + , + 4, + 3, + 6, + 6, + 6 в) + 3, + 2, + 4, + 6, + 7 г) + 2, + 3, + 3, + 6 Вроде бы так )).

Тип хим. Реакций, в результате которых получают кислород - разложения.

Уважаемый Дмитрий Иванович Менделеев. Спасибо вам за всё. Вы открыли нам глаза( особенно в химии). Благодаря вам мы знаем из каких элементов состоит таблица Менделеева. Они все так хорошо и дружно распорядились благодаря вам. Вы можно сказать от..

Дано : m(ZnSO4) = 130 r m(H2SO4) - ? M(H2SO4) = 98 г / моль M(ZnSO4) = 161 г / моль n(ZnSO4) = 130 г / 161 г / моль = 0, 8075 моль Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O Из УХР следует, что n(H2SO4) = n(ZnSO4) = 0, 8075 моль m(H2SO4) = 0, 8075 моль * 98 г /..
При сжигании этана образовался углекислый газ объемом 32 л. Какие объемы исходных газов было использовано? (н. у.)
Запишите уравнения химических реакций, характеризующие свойства: а) MgO и SO3; б) Mg (OH) 2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
Запишите схемы образования химических связей для веществ состав которых отображают формулами kcl и cl2
Дано: BaCl2, NaOH, Na2SO4, AlCl3, HCl, K2CO3, CuSO3, Ba (NO3) 2 Нужно составить возможные реакции ионного обмена.
Опишите физические свойства присущие для веществ с молекулярными кристаллическими решетками Приведите примеры

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Галогены"
Галогены – это элементы VII A группы главной подгруппы. К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.

Так как это элементы VII A группы, значит на внешнем энэргетическом уровне у них семь электронов. До завершения уровня им не хватает одного электрона, поэтому они берут этот недостающий электрон у атомов металлов, при этом образуется ионное соединение – соль, где степень окисления галогена -1.

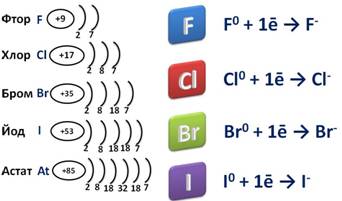
Галогены – сильные окислители, самый сильный из них фтор, который может быть только окислителем и проявлять степень окисления -1.


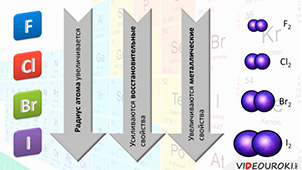
В группе сверху вниз – от фтора к йоду – радиус атома увеличивается, поэтому усиливаются восстановительные и металлические свойства.
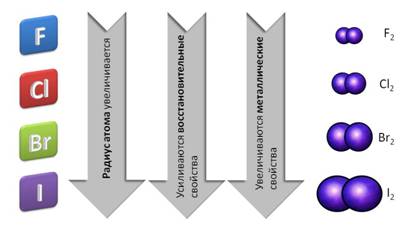
Все галогены представляют собой двухатомные молекулы, связь между атомами – ковалентная полярная. Все галогены имеют молекулярную кристаллическую решётку.
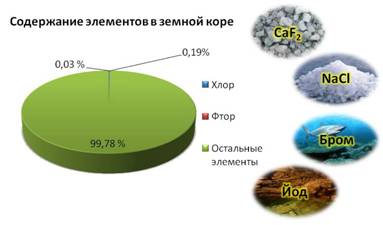
Галогены в природе существуют только в виде соединений с другими элементами. Наиболее распространены хлор и фтор, их содержание составляет 0,19% и 0,03% от массы земной коры.
Например, фтор входит в соcтав плавикового шпата, хлор входит в состав каменной соли, бром содержится в морской воде, а йод в подземных буровых водах.
Рассмотрим таблицу, в которой отражены физические свойства галогенов. Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.




Агрегатное состояние при н.у.
Температура
плавления, 0 С
Температура кипения, 0 С
Чёрно-серый (пары фиолетовые)
Из таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность. Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия. От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.

Фтор самый активный галоген, который при нагревании реагирует даже с золотом, серебром и платиной. Алюминий и цинк в атмосфере фтора воспламеняются. Так, в реакции цинка с фтором образуется фторид цинка. Цинк повышает свою степень окисления с 0 до +2, а фтор, наоборот, понижает степень окисления с 0 до -1. Атом цинка отдаёт по два электрона молекуле фтора. Цинк является восстановителем, а фтор – окислителем.

Остальные галогены реагируют с металлами в основном только при нагревании. Нагретый порошок железа загорается при взаимодействии с хлором. В результате этого взаимодействия образуется хлорид железа три. Железо повышает свою степень окисления с 0 до +3, а хлор понижает свою степень окисления с 0 до -1. При этом каждый атом железа отдаёт по 3 электрона молекуле хлора. Железо окисляется и является восстановителем, а хлор восстанавливается и является окислителем.

Медная проволока также сгорает в парах брома. При этом образуется бромид меди два. Медь повышает свою степень окисления с 0 до +2, а бром понижает свою степень окисления с 0 до -1. Каждый атом меди отдаёт по 2 электрона молекуле брома. Медь – восстановитель, а бром – окислитель.

Йод реагирует с алюминием, катализатором в этой реакции является вода. Алюминий повышает свою степень окисления с 0 до +3, а йод понижает свою степень окисления с 0 до -1. Каждый атом алюминия отдаёт по 3 электрона молекуле йода. Алюминий является восстановителем, а йод – окислителем. В результате этого взаимодействия образуется йодид алюминия.

Галогены также вытесняют друг друга из солей. Так, более активный галоген вытесняет из раствора соли менее активный.
Например, хлор вытесняет бром из раствора его соли, потому что хлор более активный галоген, чем бром. Хлор в данной реакции понижает свою степень окисления с 0 до -1, а бром повышает с -1 до 0. В результате чего, каждый бром отдаёт по 2 электрона молекуле хлора. Образуется новая соль – хлорид натрия и молекулярный бром. Хлор является окислителем, а бром – восстановителем.

Бром вытесняет йод из раствора йодида калия. В этой реакции бром понижает свою степень оксиления с 0 до -1, а йод повышает свою степень окисления с -1 до 0. При этом 2 электрона от йода переходят к молекуле брома. В результате взаимодействия образуется соль – бромид калия и простое вещество – йод. Бром является окислителем, а йод – восстановителем.

Для фтора эта реакция не характерна, потому что он взаимодействует с водой, а эти реакции протекают в растворе.

Галогены реагируют с водородом с образованием галогеноводородов. Например, с фтором водород реагирует со взрывом, с хлором – в присутствии света, а с бромом – при нагревании. В результате взаимодействия водорода с фтором образуется фтороводород, в результате взаимодействия водорода с хлором – хлороводород, в результате взаимодействия водорода с бромом – бромоводород.



Хлор открыт шведским химиком Шееле в 1774 году. Элемент получил название за цвет простого вещества (от греческого хлорос – жёлто-зелёный).


Бром открыт в 1826 г. французским химиком Баларом. Элемент назван так за запах простого вещества (от греческого бромос – зловонный).


Йод получен в 1811 г. французским учёным Куртуа, а название он получил за цвет паров простого вещества (от греческого иодэс – фиолетовый).


Читайте также:
- Анализ заболеваемости и производственного травматизма на предприятии кратко
- Какую роль играют голосеменные растения в природе кратко
- В чем противоречивость и ограниченность толстовской модели общества будущего кратко
- Подумайте что было общего в хозяйстве южного междуречья и египта ответ кратко
- Какие объекты открыты за пределами нашей галактики ответ кратко

