От чего зависит работа ферментов кратко
Обновлено: 07.07.2024
ФЕРМЕНТЫ, органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям. Вещества, оказывающие подобное действие, существуют и в неживой природе и называются катализаторами. Ферменты (от лат. fermentum – брожение, закваска) иногда называют энзимами (от греч. en – внутри, zyme – закваска). Все живые клетки содержат очень большой набор ферментов, от каталитической активности которых зависит функционирование клеток. Практически каждая из множества разнообразных реакций, протекающих в клетке, требует участия специфического фермента. Изучением химических свойств ферментов и катализируемых ими реакций занимается особая, очень важная область биохимии – энзимология.
Многие ферменты находятся в клетке в свободном состоянии, будучи просто растворены в цитоплазме; другие связаны со сложными высокоорганизованными структурами. Есть и ферменты, в норме находящиеся вне клетки; так, ферменты, катализирующие расщепление крахмала и белков, секретируются поджелудочной железой в кишечник. Секретируют ферменты и многие микроорганизмы.
Первые данные о ферментах были получены при изучении процессов брожения и пищеварения. Большой вклад в исследование брожения внес Л.Пастер, однако он полагал, что соответствующие реакции могут осуществлять только живые клетки. В начале 20 в. Э.Бухнер показал, что сбраживание сахарозы с образованием диоксида углерода и этилового спирта может катализироваться бесклеточным дрожжевым экстрактом. Это важное открытие послужило стимулом к выделению и изучению клеточных ферментов. В 1926 Дж.Самнер из Корнеллского университета (США) выделил уреазу; это был первый фермент, полученный в практически чистом виде. С тех пор обнаружено и выделено более 700 ферментов, но в живых организмах их существует гораздо больше. Идентификация, выделение и изучение свойств отдельных ферментов занимают центральное место в современной энзимологии.
Ферменты как белки.
Все ферменты являются белками, простыми или сложными (т.е. содержащими наряду с белковым компонентом небелковую часть).
Ферменты – крупные молекулы, их молекулярные массы лежат в диапазоне от 10 000 до более 1 000 000 дальтон (Да). Для сравнения укажем мол. массы известных веществ: глюкоза – 180, диоксид углерода – 44, аминокислоты – от 75 до 204 Да. Ферменты, катализирующие одинаковые химические реакции, но выделенные из клеток разных типов, различаются по свойствам и составу, однако обычно обладают определенным сходством структуры.
Не все белки, присутствующие в живых организмах, являются ферментами. Так, иную функцию выполняют структурные белки, многие специфические белки крови, белковые гормоны и т.д.
Коферменты и субстраты.
Многие ферменты с большой молекулярной массой проявляют каталитическую активность только в присутствии специфических низкомолекулярных веществ, называемых коферментами (или кофакторами). Роль коферментов играют большинство витаминов и многие минеральные вещества; именно поэтому они должны поступать в организм с пищей. Витамины РР (никотиновая кислота, или ниацин) и рибофлавин, например, входят в состав коферментов, необходимых для функционирования дегидрогеназ. Цинк – кофермент карбоангидразы, фермента, катализирующего высвобождение из крови диоксида углерода, который удаляется из организма вместе с выдыхаемым воздухом. Железо и медь служат компонентами дыхательного фермента цитохромоксидазы.
Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту, который ускоряет разрыв одних химических связей в его молекуле и создание других; образующийся в результате продукт отсоединяется от фермента. Этот процесс представляют следующим образом:
Продукт тоже можно считать субстратом, поскольку все ферментативные реакции в той или иной степени обратимы. Правда, обычно равновесие сдвинуто в сторону образования продукта, и обратную реакцию бывает трудно зафиксировать.
Механизм действия ферментов.
Скорость ферментативной реакции зависит от концентрации субстрата [S] и количества присутствующего фермента. Эти величины определяют, сколько молекул фермента соединится с субстратом, и именно от содержания фермент-субстратного комплекса зависит скорость реакции, катализируемой данным ферментом. В большинстве ситуаций, представляющих интерес для биохимиков, концентрация фермента очень мала, а субстрат присутствует в избытке. Кроме того, биохимики исследуют процессы, достигшие стационарного состояния, при котором образование фермент-субстратного комплекса уравновешивается его превращением в продукт. В этих условиях зависимость скорости (v) ферментативного превращения субстрата от его концентрации [S] описывается уравнением Михаэлиса – Ментен:
где KM – константа Михаэлиса, характеризующая активность фермента, V – максимальная скорость реакции при данной суммарной концентрации фермента. Из этого уравнения следует, что при малых [S] скорость реакции возрастает пропорционально концентрации субстрата. Однако при достаточно большом увеличении последней эта пропорциональность исчезает: скорость реакции перестает зависеть от [S] – наступает насыщение, когда все молекулы фермента оказываются занятыми субстратом.
Ферментативные реакции и энергия.
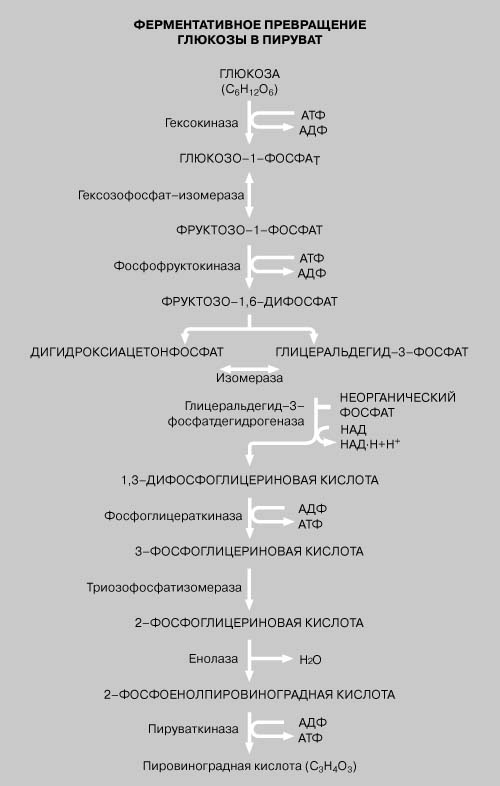
Высвобождение энергии при метаболизме питательных веществ, например при окислении шестиуглеродного сахара глюкозы с образованием диоксида углерода и воды, происходит в результате последовательных согласованных ферментативных реакций. В животных клетках в превращениях глюкозы в пировиноградную кислоту (пируват) или молочную кислоту (лактат) участвуют 10 разных ферментов. Этот процесс называется гликолизом. Первая реакция – фосфорилирование глюкозы – требует участия АТФ. На превращение каждой молекулы глюкозы в две молекулы пировиноградной кислоты расходуются две молекулы АТФ, но при этом на промежуточных этапах из аденозиндифосфата (АДФ) образуются 4 молекулы АТФ, так что весь процесс в целом дает 2 молекулы АТФ.
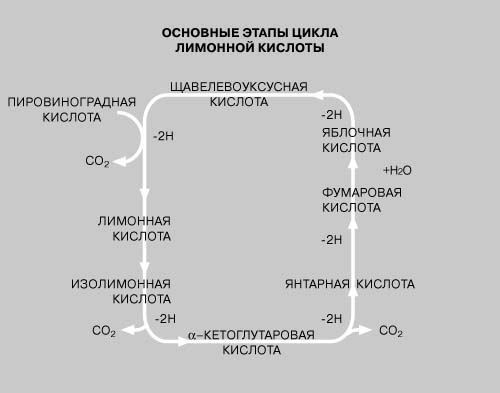
Далее пировиноградная кислота окисляется до диоксида углерода и воды при участии ферментов, ассоциированных с митохондриями. Эти превращения образуют цикл, называемый циклом трикарбоновых кислот, или циклом лимонной кислоты. См. также МЕТАБОЛИЗМ.
Окисление одного вещества всегда сопряжено с восстановлением другого: первое отдает атом водорода, а второе его присоединяет. Катализируют эти процессы дегидрогеназы, обеспечивающие перенос атомов водорода от субстратов к коферментам. В цикле трикарбоновых кислот одни специфические дегидрогеназы окисляют субстраты с образованием восстановленной формы кофермента (никотинамиддинуклеотида, обозначаемого НАД), а другие окисляют восстановленный кофермент (НАДЧН), восстанавливая другие дыхательные ферменты, в том числе цитохромы (железосодержащие гемопротеины), в которых атом железа попеременно то окисляется, то восстанавливается. В конечном итоге восстановленная форма цитохромоксидазы, одного из ключевых железосодержащих ферментов, окисляется кислородом, попадающим в наш организм с вдыхаемым воздухом. Когда происходит горение сахара (окисление кислородом воздуха), входящие в его состав атомы углерода непосредственно взаимодействуют с кислородом, образуя диоксид углерода. В отличие от горения, при окислении сахара в организме кислород окисляет собственно железо цитохромоксидазы, но в конечном итоге его окислительный потенциал используется для полного окисления сахаров в ходе многоступенчатого процесса, опосредуемого ферментами.
На отдельных этапах окисления энергия, заключенная в питательных веществах, высвобождается в основном маленькими порциями и может запасаться в фосфатных связях АТФ. В этом принимают участие замечательные ферменты, которые сопрягают окислительные реакции (дающие энергию) с реакциями образования АТФ (запасающими энергию). Этот процесс сопряжения известен как окислительное фосфорилирование. Не будь сопряженных ферментативных реакций, жизнь в известных нам формах была бы невозможна.
Ферменты выполняют и множество других функций. Они катализируют разнообразные реакции синтеза, включая образование тканевых белков, жиров и углеводов. Для синтеза всего огромного множества химических соединений, обнаруженных в сложных организмах, используются целые ферментные системы. Для этого нужна энергия, и во всех случаях ее источником служат фосфорилированные соединения, такие, как АТФ.
Ферменты и пищеварение.
Ферменты – необходимые участники процесса пищеварения. Только низкомолекулярные соединения могут проходить через стенку кишечника и попадать в кровоток, поэтому компоненты пищи должны быть предварительно расщеплены до небольших молекул. Это происходит в ходе ферментативного гидролиза (расщепления) белков до аминокислот, крахмала до сахаров, жиров до жирных кислот и глицерина. Гидролиз белков катализирует фермент пепсин, содержащийся в желудке. Ряд высокоэффективных пищеварительных ферментов секретирует в кишечник поджелудочная железа. Это трипсин и химотрипсин, гидролизующие белки; липаза, расщепляющая жиры; амилаза, катализирующая расщепление крахмала. Пепсин, трипсин и химотрипсин секретируются в неактивной форме, в виде т.н. зимогенов (проферментов), и переходят в активное состояние только в желудке и кишечнике. Это объясняет, почему указанные ферменты не разрушают клетки поджелудочной железы и желудка. Стенки желудка и кишечника защищает от пищеварительных ферментов и слой слизи. Некоторые важные пищеварительные ферменты секретируются клетками тонкого кишечника.
Большая часть энергии, запасенной в растительной пище, такой, как трава или сено, сосредоточена в целлюлозе, которую расщепляет фермент целлюлаза. В организме травоядных животных этот фермент не синтезируется, и жвачные, например крупный рогатый скот и овцы, могут питаться содержащей целлюлозу пищей только потому, что целлюлазу вырабатывают микроорганизмы, заселяющие первый отдел желудка – рубец. С помощью микроорганизмов происходит переваривание пищи и у термитов.
Ферменты находят применение в пищевой, фармацевтической, химической и текстильной промышленности. В качестве примера можно привести растительный фермент, получаемый из папайи и используемый для размягчения мяса. Ферменты добавляют также в стиральные порошки.
Ферменты в медицине и сельском хозяйстве.
Осознание ключевой роли ферментов во всех клеточных процессах привело к широкому их применению в медицине и сельском хозяйстве. Нормальное функционирование любого растительного и животного организма зависит от эффективной работы ферментов. В основе действия многих токсичных веществ (ядов) лежит их способность ингибировать ферменты; таким же эффектом обладает и ряд лекарственных препаратов. Нередко действие лекарственного препарата или токсичного вещества можно проследить по его избирательному влиянию на работу определенного фермента в организме в целом или в той или иной ткани. Например, мощные фосфорорганические инсектициды и нервно-паралитические газы, разработанные в военных целях, оказывают свой губительный эффект, блокируя работу ферментов – в первую очередь холинэстеразы, играющей важную роль в передаче нервного импульса.
Чтобы лучше понять механизм действия лекарственных препаратов на ферментные системы, полезно рассмотреть, как работают некоторые ингибиторы ферментов. Многие ингибиторы связываются с активным центром фермента – тем самым, с которым взаимодействует субстрат. У таких ингибиторов наиболее важные структурные особенности близки к структурным особенностям субстрата, и если в реакционной среде присутствуют и субстрат и ингибитор, между ними наблюдается конкуренция за связывание с ферментом; при этом чем больше концентрация субстрата, тем успешнее он конкурирует с ингибитором. Ингибиторы другого типа индуцируют в молекуле фермента конформационные изменения, в которые вовлекаются важные в функциональном отношении химические группы. Изучение механизма действия ингибиторов помогает химикам создавать новые лекарственные препараты.
| НЕКОТОРЫЕ ФЕРМЕНТЫ И КАТАЛИЗИРУЕМЫЕ ИМИ РЕАКЦИИ | |||
| Тип химической реакции | Фермент | Источник | Катализируемая реакция 1) |
| Гидролиз | Трипсин | Тонкий кишечник | Белки + H2O ® Разные полипептиды |
| Гидролиз | b-Амилаза | Пшеница, ячмень, батат и т.д. | Крахмал + H2O ® Гидролизат крахмала + Мальтоза |
| Гидролиз | Тромбин | Кровь | Фибриноген + H2O ® Фибрин + 2 Полипептида |
| Гидролиз | Липазы | Кишечник, семена с большимсодержанием жиров,микроорганизмы | Жиры + H2O ® Жирные кислоты + Глицерин |
| Гидролиз | Щелочная фосфатаза | Почти все клетки | Органические фосфаты + H2O ® Дефосфорилированный продукт + Неорганический фосфат |
| Гидролиз | Уреаза | Некоторые растительные клетки и микроорганизмы | Мочевина + H2O ® Аммиак + Диоксид углерода |
| Фосфоролиз | Фосфорилаза | Ткани животных и растений,содержащие полисахариды | Полисахарид (крахмал или гликоген из n молекул глюкозы) + Неорганический фосфат Глюкозо-1-фосфат +Полисахарид (n–1 глюкозных единиц) |
| Декарбоксилирование | Декарбоксилаза | Дрожжи, некоторые растенияи микроорганизмы | Пировиноградная кислота ® Ацетальдегид + Диоксид углерода |
| Конденсация | Альдолаза | Все животные клетки; многиерастения и микроорганизмы | 2 Триозофосфат Гексозодифосфат |
| Конденсация | Оксалоацетат-трансаце-тилаза | То же | Щавелевоуксусная кислота + Ацетил-кофермент А Лимонная кислота + Кофермент А |
| Изомеризация | Фосфогексозоизомераза | То же | Глюкозо-6-фосфат Фруктозо-6-фосфат |
| Гидратация | Фумараза | То же | Фумаровая кислота + H2O Яблочная кислота |
| Гидратация | Карбоангидраза | Разные ткани животных; зеленые листья | Диоксид углерода + H2O Угольная кислота |
| Фосфорилирование | Пируваткиназа | Почти все (или все) клетки | АТФ + Пировиноградная кислота Фосфоенолпировиноградная кислота + АДФ |
| Перенос фосфатной группы | Фосфоглюкомутаза | Все животные клетки; многиерастения и микроорганизмы | Глюкозо-1-фосфат Глюкозо-6- фосфат |
| Переаминирование | Трансаминаза | Большинство клеток | Аспарагиновая кислота + Пировино-градная кислота Щавелевоуксусная кислота + Аланин |
| Синтез, сопряженный сгидролизом АТФ | Глутаминсинтетаза | То же | Глутаминовая кислота + Аммиак + АТФ Глутамин + АДФ + Неорганический фосфат |
| Окисление-восстановление | Цитохромоксидаза | Все животные клетки, многиерастения и микроорганизмы | O2 + Восстановленный цитохром c ® Окисленный цитохром c + H2O |
| Окисление-восстановление | Оксидаза аскорбиновойкислоты | Многие растительные клетки | Аскорбиновая кислота + O2 ® Дегидроаскорбиновая кислота + Пероксид водорода |
| Окисление-восстановление | Цитохром c редуктаза | Все животные клетки; многиерастения и микроорганизмы | НАД·Н (восстановленный кофермент) + Окисленный цитохром c ® Восстановленный цитохром c + НАД (окисленный кофермент) |
| Окисление-восстановление | Лактатдегидрогеназа | Большинство животных кле-ток; некоторые растенияи микроорганизмы | Молочная кислота + НАД (окисленный кофермент) Пировиноградная кислота + НАД·Н (восстановленный кофермент) |
| 1) Одинарная стрелка означает, что реакция идет фактически в одну сторону, а двойные стрелки – что реакция обратима. | |||
Фёршт Э. Структура и механизм действия ферментов. М., 1980
Страйер Л. Биохимия, т. 1 (с. 104–131), т. 2 (с. 23–94). М., 1984–1985
Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохомия человека, т. 1. М., 1993
Механизм действия ферментов. Работа ферментов.
Ферменты обладают очень высокой специфичностью. Фишер (Fischer) в 1890 г. высказал предположение, что эта специфичность обусловливается особой формой молекулы фермента, точно соответствующей форме молекулы субстрата (или субстратов).
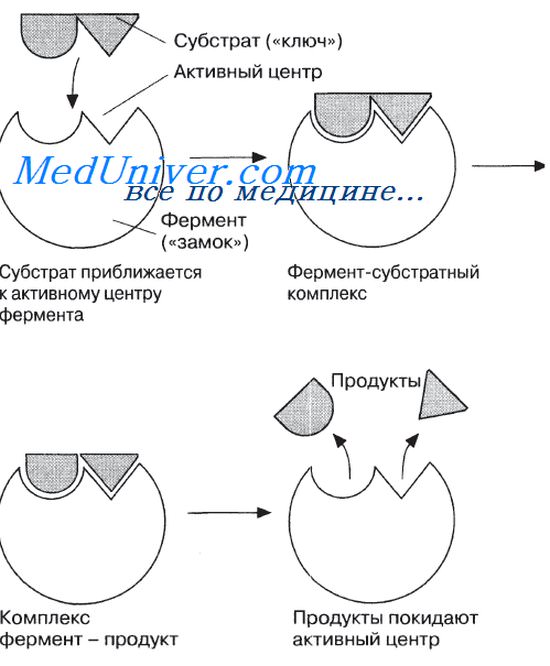
Молекулы большей части ферментов во много раз крупнее, чем молекулы тех субстратов, которые атакует данный фермент. Активный же центр фермента составляет лишь очень небольшую часть его молекулы, обычно от 3 до 12 аминокислотных остатков. Роль остальных аминокислот, составляющих основную массу фермента, заключается в том, чтобы обеспечить его молекуле правильную глобулярную форму, которая, как мы увидим далее, очень важна для наиболее эффективной работы активного центра фермента.
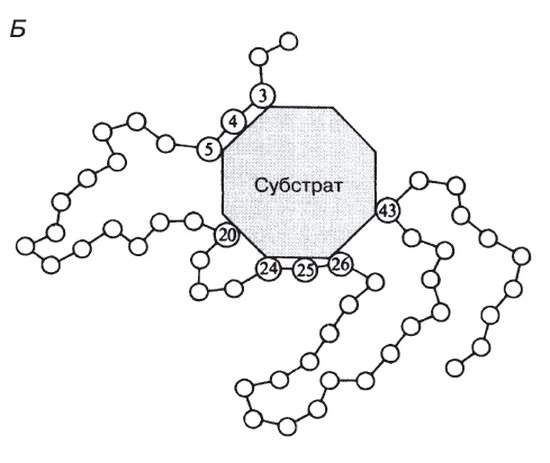
Образовавшиеся продукты по форме уже не соответствуют активному центру фермента. Они отделяются от него (поступают в окружающую среду), после чего освободившийся активный центр может принимать новые молекулы субстрата.
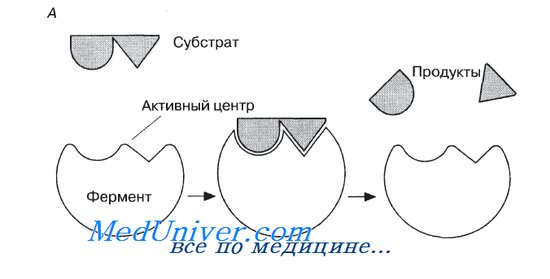
Подходящей аналогией в этом случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму. По мере выяснения отдельных деталей механизма различных реакций в эту гипотезу вносятся уточнения.
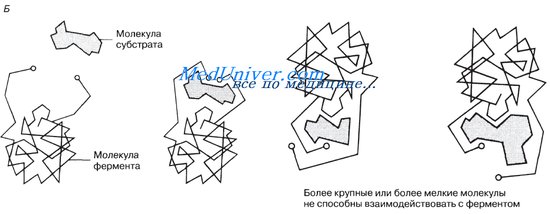
Представление о том, как работает фермент, можно получить с помощью рентгеноструктурного анализа и компьютерного моделирования. Рисунок иллюстрирует это на примере фермента лизоцима.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Ферменты в организме человека — это активные вещества с белковой природой, которые вырабатываются различными отделами человеческого организма (к примеру, частями пищеварительного тракта).
Ферменты человека отличаются общим принципом и механизмом действия. Осуществляется взаимодействие фермента с субстратом, при этом не целой молекулой, а отдельным активным центром. В результате происходит образования фермента — субстратного комплекса. По окончании реакции этот комплекс достаточно быстро распадается.
Сам фермент остается прежним и имеет возможность взаимодействия с новой молекулой.
Что такое субстрат?
Субстрат — часть молекулы, с которой и взаимодействует фермент.
Благодаря ферментам обеспечивается процесс переваривания пищи и стимулирование усвоения. Эти белковые молекулы оказывают влияние на такие группы веществ как:
- белки и пептиды;
- моно- и полисахариды;
- нуклеотиды, жиры и липиды.
Активность ферментов пищеварения зависит от некоторых факторов. Самый главный из них — температура.
Если температура повышается, то заметно возрастает скорость химической реакции. Повышение скорости молекул приводит к повышению возможности их столкновения.
Также увеличивается и шанс на то, что между ними произойдет реакция.
Повышающую активность фермента температуру называют оптимальной.
Скорость реакции заметно снижается и наблюдается процесс денатурации белка в случае, если температура реакции выходит за пределы оптимального диапазона. Если температура снижается, то и скорость реакции падает: причина — в инактивации фермента.
К слову, сейчас довольно популярна технология быстрого замораживания — она дает возможность долго хранить продукты. Быстрое замораживание прекращает рост и развитие микроорганизмов, инактивирует находящиеся внутри микроорганизмов ферменты и препятствует тому, что продукты питания будут разлагаться.
Особенности пищеварительных ферментов
Основным пищеварительным ферментом является пепсин. Его выработка происходит в желудке. Пепсин оказывает воздействие на различные белковые молекулы, входящие в состав пищи и разлагающие их на вещества попроще — аминокислоты. Также пепсин является основным ферментом желудка или основным ферментом пищеварения.
Такие ферменты как трипсин и химотрипсин — это вещества, входящие в группу панкреатических. Они вырабатываются поджелудочной железой и поступают в двенадцатиперстный отдел кишечника. В этом отделе желудочно-кишечного тракта осуществляется взаимодействие ферментов на белковые молекулы.
Трипсин является ферментом группы панкреатических энзимов, благодаря которому происходит расщепление белковых молекул.
Также важным пищеварительным ферментом является амилаза: она разлагает углеводы или сахара. Амилаза вырабатывается в ротовой полости и тонком кишечнике. К особенностям амилазы можно отнести способность разлагать такое сложное вещество как крахмал. Как результат такой реакции — образование мальтозы или небольшого размера углевода.
Мальтаза имеет способность воздействовать на углеводы. Формирование этого фермента происходит на специфическом субстрате — мальтозе. Отмечается воздействие белка на сахарозу, после которого она распадается на глюкозу и галактозу. Организм отлично усваивает оба этих вещества.
Внутри человеческого организма также происходит образование таких ферментов как нуклеазы. Их особенность заключается в возможности воздействия на ДНК и РНК, которые содержатся в пище. В результате такого воздействия происходит быстрый распад веществ на нуклеотиды — элементарные составляющие.
На нуклеиновые кислоты воздействуют, в том числе, такие ферменты как нуклеотидазы.
Нарушения выработки пищеварительных ферментов и их последствия
Нехватка выработки пищеварительных ферментов — большая проблема для человека. Такой дисбаланс приводит к тому, что реализация всех физиологических процессов нарушается. Несмотря на скептическое отношения, такие нарушения нуждаются в серьезном медицинском вмешательстве.
При снижении в человеческом организме количества энзимов, пища не переваривается нормально во всех отделах желудочно-кишечного тракта. В результате нарушения проблем пищеварения нарушается процесс всасывания.
Если ферменты отсутствуют, то различные питательные вещества перестают нести какую-либо пользу организму, в чем и заключается их функция. Организм сталкивается с недостатком жиров и углеводов. У него отсутствует возможность активно действовать.
Недостаток питательных веществ — одна из причин возникновения воспалительных процессов в желудке и кишечнике. Нарушается и характер питания: возникают заболевания поджелудочной железы, печени, дисбаланс обмена веществ.
Как понять, что выработка пищеварительных ферментов нарушена? Вот характерные симптомы:
- тяжесть и боль в желудке;
- вздутие живота;
- рвота;
- изменение характера стула;
- чувство бурления в животе;
- диарея;
- изжога и отрыжка.
Но не только недостаток ферментов сказывается на организме. Жизненно важные функции организма также нарушаются при избытке ферментов. Для определения количества ферментам проводятся специальные анализы деятельности пищеварительной системы.
Пример избытка ферментов — панкреатит или воспаление поджелудочной железы. Это заболевание характеризуется тем, что в стенках органов отмечается хроническое воспаление. Наиболее частые признаки — сильная головная боль, нарушение характера стула, обострение имеющихся хронических заболеваний.
Чтобы предупредить развитие панкреатита, проводят биохимический анализ процессов метаболизма, исследуют желудочный и поджелудочный сок.
При лечении онкологических заболеваний повсеместно используется энзимотерапия и ферментотерапия.
Главный принцип терапии ферментативных нарушений — изменение характера выработки пищеварительных ферментов. Определенные меры в ходе лечения конкретного отклонения применяются только после комплексного обследования. В некоторых случаях показана специализированная фермент замещающая терапия.

Ферменты – зачем нужны организму и как работают
На первый взгляд эта инфографика про ферменты, активные центры и субстраты выглядит, как странное и нелогичное сочетание геометрических фигур, но уверяем: к концу обзора вы обязательно научитесь понимать самое важное. О видах и работе ферментов, способах регуляции баланса энзимов в организме и о недостаточности этих важных соединений.
Как работают ферменты
В целом принцип действия ферментов выглядит довольно просто:
- После соединения с подходящим питательным веществом энзим обрабатывает полученное вещество (субстрат) – очищает его, меняет порядок расположения молекул в субстрате и т.д. Это необходимо для наилучшей, то есть максимально быстрой метаболической реакции;
- Получившийся продукт уже готов для транспортировки в нужную среду и доставки к определенным мишеням: туда, где потребность в питательных веществах выше.
А как фермент может определить потребность в тех или иных соединениях?
Виды ферментов и их функции в организме
Сегодня мир официальной, доказательной медицины опирается на такую классификацию:
Предмет пристального внимания всех, кто придерживается норм здорового питания. Ферментам этого класса поручена важная задача: участие в обмене жиров и углеводов, а также некоторых аминокислот и нуклеинов. Всего насчитывает 9 подклассов, и каждый из них, по такому же принципу разделения обязанностей, работает в своей узкой сфере: с соединениями, содержащими азот, или с переносом остаточных сахаров, селен-содержащих групп и т.д.
Наименование этой группы говорит само за себя – у этих ферментов активность связана со всем, что относится к реакциям гидролиза, то есть взаимодействия с водой. Подклассов 13, каждый из которых, по уже знакомому принципу, вступает в связь с пептидами, сахарами и другими веществами, требующими реакций гидролиза.
Роль этих ферментов не связана ни с окислением, ни с гидролизом. Если необходимо ускорить биохимическую реакцию, не касаясь окислительно-восстановительных и водосодержащих ресурсов, в этом случае катализатором выступают именно лиазы. Подклассов только 7, и все они направлены на разрыв углеродных связей.
Своеобразные свахи в мире ферментов – соединяют две молекулы, которые образуют новую связь. Это называется лигированием, и имеет большое значение для иммунитета, репликации ДНК, репарации клеток (способности исправлять повреждения в молекулах ДНК). Шесть подклассов, шесть направлений деятельности.
Последняя, седьмая группа ферментов – это так называемая сборная чемпионов всех упомянутых команд. Им поручена деликатная задача: ускорять реакции, в которых молекулы питательных веществ должны пройти через клеточные мембраны. Разделение на подгруппы выглядит немного сложнее, чем у прочих групп, но принцип такой:
–подкласс из шести видов энзимов, объединенных по виду переносимых молекул или ионов (водорода, аминокислот, пептидов и т.д.)
–подкласс из четырех видов энзимов, сгруппированных по реакциям, которые обеспечивают движение переносимых веществ, например, окислительно-восстановительные, гидролизные или по выделению углекислого газа (декарбоксилирование).
Кроме функциональности, тип ферментов определяется по локации – есть внутри-, или внеклеточные энзимы. Именно внутриклеточные рассматриваются как маркеры нарушений работы, болезней внутренних органов: почечной или печеночной недостаточности, болезней миокарда, предстательной железы. Внеклеточные – те, что помогают пищеварению, разбирая питательные вещества на молекулы такого размера, что смогут проходить через клетки кишечника, чтобы поступить в кровь.
Нехватка ферментов этого типа может спровоцировать развитие заболеваний желудочно-кишечного тракта и других систем жизнедеятельности.
Откуда берутся ферменты
Несмотря на то, что наш организм умеет синтезировать энзимы, для этого ему требуется основа: белковые соединения. Другой природы ферментов не существует, но это не значит, что все белки, потребляемые нами, являются энзимами (но все энзимы без сомнений белки).
Например, аминокислоты, приоритетно важные для поддержания метаболического равновесия – это тоже ферменты (однокомпонентные). Но чтобы синтезировать даже один, потребуется сложнейшая цепочка, иногда состоящая из миллиона аминокислот. От того, сколько, каких и в какой последовательности аминокислот будет использовано для построения энзима, и зависит его функционал.
Некоторые витамины также выступают прародителями ферментов, точнее, коэнзимов: тех самых активных центров, которые на молекуле энзима выполняют функцию стыковочной площадки. Как и с любыми питательными веществами, с катализаторами случается и дефицит, и – заметно реже – избыток.
Нехватка и избыток ферментов – чего ожидать
Недостаток ферментов, особенно пищеварительной группы – это и причина, и следствие. Это значит, что к дефициту энзимов могут привести заболевания внутренних органов, но с другой стороны, нехватку пищеварительных ферментов нередко провоцируют и нарушения пищевого поведения.
Переедание – в этом случае объема и активности ферментов просто не хватает, даже если желудочно-кишечный тракт здоров. К нехватке ферментов приводит и чрезмерная увлеченность фастфудом, но также и домашней, но чрезмерно жирной, высокоуглеводной едой. В этом случае результат недостаточности собственного объема энзимов – некорректное расщепление сложных молекул липидов, углеводов. Недостаточность энзимов чаще всего сказывается на здоровье поджелудочной железы, а затем к дефициту полезных питательных веществ, что отражается на функциональности других органов.
Если при разумной, здоровой диете наблюдаются расстройства желудка, болезни печени и другие патологии пищеварительной системы, недостаточность энзимов образуется из-за нарушения огромного числа метаболических процессов и реакций:
- При недостаточности функциональности печени, желчевыводящей системы: энзимы не активируются;
- Болезни поджелудочной железы: падает выработка ферментов, также могут наблюдаться временные состояния, связанные с недостаточностью энзимов на фоне необходимых ограничений в диете;
- Воспаления в желудке, в тонком кишечнике, где происходит всасывание питательных веществ, также приводит к недостатку ферментов из-за снижения их активации;
- Продолжительное лечение, хирургические операции на органах желудочно-кишечного тракта провоцирует дефицит и непосредственно энзимов, и других важных питательных веществ;
То есть, различные врожденные и приобретенные состояния, прямо связанные с функциональностью желудочно-кишечного тракта, являются главными подозреваемыми при недостатке ферментов.
Голодание и низкокалорийная диета – вот решение проблемы с недостатком ферментов, и это неверный ответ.
В отсутствии или в условиях недостаточности питания падает поступление белковых ресурсов, а именно из них метаболизм выбирает аминокислоты, которые синтезируются в энзимы. Гиповитаминозы (дефицит витаминов), диета с низким содержанием белковой пищи тесно связаны с недостаточностью синтеза энзимов пищеварительной системы. В этом случае снижается их выработка, постепенно провоцируя недостаточность метаболических процессов.
Активность энзимов непостоянна даже на фоне отсутствия заболеваний или ограничений в питании. В любых обстоятельствах энзимы быстро реагируют на любые факторы, влияющие на клетки нашего тела. У такой сверхчувствительности есть цель: вовремя приспособить клетку к изменившимся условиям, ответить на полученные стимулы. Низкая активность энзимов по отношению к клетке – это не есть угроза жизни всего организма, но угроза жизнеспособности клеток: любую ситуацию, имеющую отношение к недостатку энзимов затягивать или пускать на самотек определенно не стоит.

Т. Т. Березов. Биологическая химия. Под редакцией академика АМН СССР С. С. Дебова. Изд. 2е, переработанное и дополненное.
Коровкин Б. Ф. – Ферменты в жизни человека / Б. Ф. Коровкин. – М.: Медицина, 2016 г.
Попова Т.Н., Рахманова Т.П., Попов С.С. Медицинская энзимология: Учебное пособие. — Воронеж: Издательско-полиграфический центр Воронежского государственного университета, 2008.
Международный союз биохимии и молекулярной биологии. Новый класс ферментов: транслоказы.. IUBMB NEWS (Август 2018).
ТБГУ: Ферменты, иллюстрированная биохимия, Учебное пособие, 2018 г.


Улучшите 50 показателей здоровья с персональной формулой микронутриентов и медицинскими рекомендациями
Читайте также:

