Основание что это кратко
Обновлено: 06.07.2024
1. чаще ед. Начало существования, момент возникновения чего-нибудь. Год основания университета. Основание Петербурга относится к 1703 году.
2. Нижняя опорная часть предмета или сооружения, фундамент. Дом на каменном основании.
4. Существенная часть, отношение или условие, порождающее какое-нибудь явление (филос.). В идеалистической философии - принцип объяснения или подразделения понятий (филос.). Закон достаточного основания. Деление по разным основаниям.
5. Сторона геометрической фигуры, перпендикулярная ее высоте (мат.). Основание треугольника.
6. только мн. Главные положения, принципы; то же, что основа в 3 знач. (книж.). Основания геометрии.
7. Разумная причина, повод, то, что оправдывает, делает понятным какое-нибудь явление, действие, суждение. Серьезные основания. На каком основании вы это сделали?
8. Законоположение, распоряжение или документ, в силу которых совершается какое-нибудь официальное действие (офиц. канц.). Основание: выписка из протокола.
9. Химическое соединение, образующее с кислотами соль, то же, что база в 6 знач. (хим.). Водные основания, или гидраты.
• До основания - совсем, совершенно. Дом сгорел до основания. Основание степени (мат.) - число, возводимое в степень, т.е. повторяющееся множителем столько раз, сколько указано показателем степени. Основание перпендикуляра (мат.) - точка на прямой, из которой восстановлен перпендикуляр.

Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.

Рис. 1. Щёлочи в твёрдом состоянии.
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
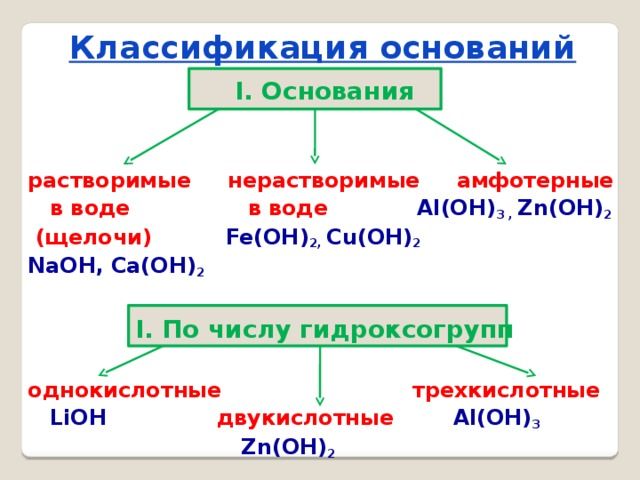
Рис. 2. Классификация оснований.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Щёлочи получают в результате взаимодействия оксида с водой:
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
Химические свойства
Основные химические свойства оснований описаны в таблице.
Реакции
Что образуется
Примеры
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами
Разложение при высокой температуре
Оксид металла и вода
С кислотными оксидами (реагируют щёлочи)
С неметаллами (вступают щёлочи)
Обмена с солями
Гидроксид и соль
Щелочей с некоторыми металлами
Сложная соль и водород
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
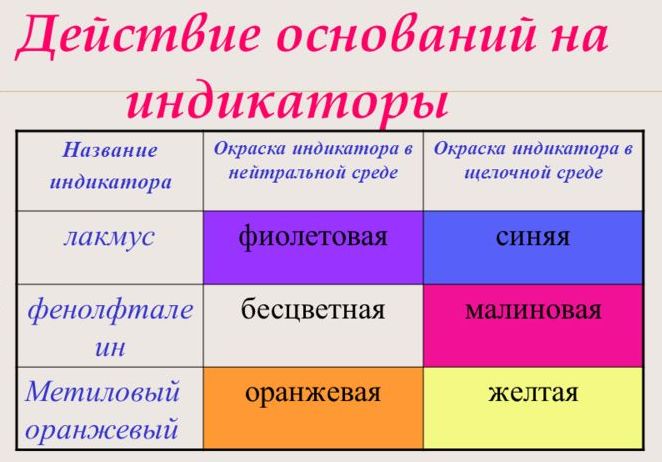
Рис. 3. Реакция индикаторов на основания.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Содержание
Получение






- Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь. \ Ca(OH)_2 >" width="" height="" />
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя. - Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы. \ Cu(OH)_2\downarrow + Na_2SO_4 >" width="" height="" />
- Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой. \ Ca(OH)_2 + H_2\uparrow >" width="" height="" />
- Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей: \ 2NaOH + H_2\uparrow + Cl_2\uparrow >" width="" height="" />
- Некоторые основания можно получить реакциями обмена: \ 2LiOH + BaSO_4\downarrow >" width="" height="" />
- Основания металлов встречаются в природе в виде минералов, например: гидраргиллита Al(OH)3, брусита Mg(OH)2.
Классификация
Основания классифицируются по ряду признаков.
- По растворимости в воде.
- Растворимые основания (щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
- Практически нерастворимые основания: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, Be(OH)2.
- Другие основания: NH3·H2O
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
- По количеству гидроксильных групп в молекуле.
- Однокислотные (гидроксид натрия NaOH)
- Двукислотные (гидроксид меди(II) Cu(OH)2)
- Трехкислотные (гидроксид железа(III) Fe(OH)3)
- По летучести.
- Летучие: NH3, CH3-NH2
- Нелетучие: щёлочи, нерастворимые основания.
- По стабильности.
- Стабильные: гидроксид натрия NaOH, гидроксид бария Ba(OH)2
- Нестабильные: гидроксид аммония NH3·H2O (гидрат аммиака).
По номенклатуре IUPAC неорганические соединения, содержащие группы -OH, называются гидроксидами. Примеры систематических названий гидроксидов:
- NaOH — гидроксид натрия
- TlOH — гидроксид таллия(I)
- Fe(OH)2 — гидроксид железа(II)
Если в соединении есть оксидные и гидроксидные анионы одновременно, то в названиях используются числовые приставки:
- TiO(OH)2 — дигидроксид-оксид титана
- MoO(OH)3 — тригидроксид-оксид молибдена
Для соединений, содержащих группу O(OH), используют традиционные названия с приставкой мета-:
- AlO(OH) — метагидроксид алюминия
- CrO(OH) — метагидроксид хрома
Для оксидов, гидратированных неопределённым числом молекул воды, например Tl2O3•n H2O, недопустимо писать формулы типа Tl(OH)3. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий:
Особо следует именовать соединение NH3•H2O, которое раньше записывали как NH4OH и которое в водных растворах проявляет свойства основания. Это и подобные соединения следует именовать как гидрат:
![]()
О чем эта статья:
Основания (гидроксиды) — это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
Общая формула оснований: Me(OH)n, где Me — химический символ металла, n — индекс, который зависит от степени окисления металла.
Примеры оснований: NaOH, Ba(OH)2, Fe(OH)2.
Названия оснований
Названия гидроксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если второй элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оснований:
Ni(OH)2 — гидроксид никеля (II);
Al(OH)3 — гидроксид алюминия.
У некоторых оснований существуют и тривиальные названия. Собрали их в таблице.
Тривиальные названия некоторых оснований
Классификация оснований
По растворимости в воде
В зависимости от растворимости в воде выделяют:
щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за своей едкости;
нерастворимые основания. К таким основаниям относятся Fe(OH)2, Cu(OH)2 и другие;
амфотерные гидроксиды. К амфотерным относятся те основания, которые образованы металлами со степенью окисления +3 или +4. Эти основания отличаются тем, что проявляют как основные свойства, так и кислотные.
Также есть основания, которые относятся к амфотерным, но образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2.
Напомним, что растворимость мы проверяем по таблице растворимости кислот и оснований в воде.
По числу гидроксогрупп
В зависимости от количества гидроксильных групп, способных замещаться на кислотный остаток, выделяют следующие виды оснований:
однокислотные: KOH, NaOH;
Физические свойства оснований
Основания при обычных условиях — это твердые кристаллические вещества без запаха, нелетучие, чаще всего белого цвета. В таблице приведены основания, которые имеют иную окраску.
Гидроксид лития LiOH
Гидроксид магния Mg(OH)2
Гидроксид кальция Ca(OH)2
Химические свойства оснований
Растворы щелочей изменяют окраску индикатора
Гидроксид-ионы, которые содержатся в растворе щелочи, взаимодействуют с индикатором, образуя новые соединения. Признак реакции — окраска раствора.
Взаимодействие с кислотными оксидами
Щелочи вступают в реакцию с любыми кислотными оксидами. Нерастворимые основания взаимодействуют только с кислотными оксидами, которые соответствуют сильным кислотам.
Кислотный оксид + основание = соль + вода
Взаимодействие с кислотами
Щелочи вступают в реакцию со всеми кислотами. Нерастворимые основания могут взаимодействовать только с сильными кислотами.
Основание + кислота = соль + вода
Взаимодействие основания с кислотой называют реакцией нейтрализации — это частный случай реакции обмена.
Взаимодействие с солями
Основания взаимодействуют с растворимыми солями по обменному механизму. В результате такой реакции должен выделиться осадок или газ (CO2, SO2, NH3).
Основание + соль = другое основание + другая соль
Термическое разложение
При нагревании нерастворимые основания разлагаются на соответствующий оксид (степень окисления металла остается неизменной) и воду.
Нерастворимое основание оксид металла + вода
Взаимодействие амфотерных гидроксидов со щелочами
Продукты реакции зависят от условий ее проведения.
При сплавлении двух оснований:
Амфотерный гидроксид (тв) + щелочь (тв) = средняя соль + вода
Если реакция проводится в растворе:
Амфотерный гидроксид (р-р) + щелочь (р-р) = комплексная соль
Получение оснований
Взаимодействие металла с водой
Активные металлы (металлы групп IA и IIA, кроме Be и Mg) активно взаимодействуют с водой при обычных условиях с образованием щелочей.
Нерастворимые основания данным способом получить невозможно, за исключением Mg(OH)2.
Металл + вода = гидроксид металла + водород
Гидроксид магния можно получить данным способом, но только при нагревании:
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
Этим способом получают только растворимые в воде основания.
Оксид металла + вода = щелочь
Электролиз
Гидроксид натрия и калия в промышленности получают с помощью электролиза — через раствор хлорида калия проводят постоянный электрический ток:
Электролиз хлорида натрия протекает по аналогичной схеме.
Получение нерастворимых оснований при взаимодействии соли со щелочью
Растворимая соль + щелочь = нерастворимое основание + другая соль
Вопросы для самопроверки
Вспомните определение оснований и приведите 2 примера этих веществ.
Какие виды оснований существуют? Чем они отличаются?
К какому виду оснований относится Zn(OH)2?
Взаимодействуют ли основания с основными оксидами? Приведите примеры веществ, с которыми основания вступают в реакцию.
Можно ли получить гидроксид алюминия с помощью взаимодействия алюминия с водой?
Основания и другие темы по химии изучать интереснее, когда понимаешь, как применять знания в реальной жизни. На онлайн-курсах по химии в Skysmart преподаватели приводят яркие примеры: от процессов в природе до использования химических реакций в промышленности. Приходите учиться — вводный урок бесплатный!
Читайте также:
- День народного единства что можно сделать с детьми в школе
- Особенности содержания и организации педагогического процесса в условиях разных видов доу
- Педагогическая поддержка ребенка и процесса его развития о с газман кратко
- Как сделать курицу как в школе
- Выскажите свое мнение какой момент в столетней войне был самым опасным для франции кратко