Микроскопический анализ это кратко
Обновлено: 05.07.2024
Зародившись в XVI веке оптические приборы произвели настоящую революцию, как в научной, так и в прикладной сферах биологических наук. Эти инструменты впервые позволили человеку заглянуть в мир микроскопических существ и отдельных клеток, дали возможность изучать биологические объекты чрезвычайно малых размеров и их отдельные элементы. С тех пор методы микроскопии прошли длинную эволюцию, постоянно совершенствуясь и достигая всё большей разрешающей способности. Благодаря этому, методы микроскопии нисколько не потеряли своей актуальности и по сей день, находя самое широкое применение в биологических и медицинских науках, лабораторных и клинических исследованиях, позволяя изучать морфологию и физиологию клеток – строительных блоков всех живых существ. Так же они применяются в исследованиях наноматериалов, при выполнении работ, требующих особой тонкости, таких как микрохирургия. С годами были разработаны различные конструкции микроскопа (прямые, инвертированные, стереоскопические микроскопы), а также большое количество модификаций метода микроскопии, таких как светлопольная, фазово-контрастная, темнопольная, люминесцентная, лазерная конфокальная и мультифотонная микроскопия. Микроскопия является неотъемлемой частью многих исследовательских работ, при этом регулярно появляются новые методы и перспективы для их применения.

2. Spasov A.A., Bugaeva L.I., Bukatin M.V., Kuzubova E.A., Rebrova D.N. The influence of a new antioxidatic preparation on the reproductive function of male-rats // European Journal of Natural History. – 2007. – № 1. – С. 115–116.
3. Stevens A., Yang H., Kovarik L., Yuan X. Compressive Sensing in Microscopy: a Tutorial // Microscopy and Microanalysis, 2016. Т. 22. № . S3. Р. 2084–2085. DOI: 10.1017/S1431927616011260.
4. Снегирева Л.В. Оптические методы исследования в биологии и медицине // Международный журнал экспериментального образования. – 2017. – № 2. – С. 51–52.
5. Феофанов А.В. Cпектральная лазерная сканирующая конфокальная микроскопия в биологических исследованиях // Успехи биологической химии. – 2007. – № 47. – С. 371–410.
Микроскопия – это изучение объектов и элементов чрезвычайно малых размеров. Человеческий глаз имеет предел разрешения и детализации таких объектов, диктуемый его природными свойствами. Для преодоления этого биологического ограничения используются различные приборы-микроскопы. На сегодняшний день, одним из ведущих методов исследования микрообъектов в биологических науках является оптическая (она же световая) микроскопия. Световые микроскопы являются важнейшими инструментами как при проведение некоторых рутинных медицинских анализов, так и в биологических и медико-биологических научных исследованиях. Они незаменимы при изучении морфологических свойств микробиологических объектов, к которым относятся насекомые и их части, многие паразиты, клетки растений и животных, простейшие и бактерии. Возможность изучения топографии, морфологии, ультраструктуры позволило человеку значительно расширить свои знания о микроорганизмах. В медицине, микроскопы позволяют проводить подсчёт клеток крови, анализ биопсий на структуру, морфологию и наличие определённых включений. С применением молекулярно-биологических техник, появилась возможность выявить локализацию отдельных химических веществ.
Сущность оптических методов
Современная световая микроскопия обеспечивает увеличение до 2–3 тысяч раз, что является достаточным для изучения различных форм жизни на клеточном уровне и других биологических объектов [1, 2]. Основными характеристиками любого микроскопа являются разрешающая способность и контраст. Разрешающая способность – минимальное расстояние, на котором находятся две точки, различаемые как раздельные объекты. Контраст –возможность различать объекты и отдельные детали от их фона. Если различие в яркости объекта и фона составляет менее 3 – 4 %, то его невозможно различить, даже если оптика микроскопа теоретически способна разрешить его детали. На контраст влияют как свойства объекта, которые изменяют световой поток по сравнению с фоном, так и способности оптики прибора уловить возникающие различия в свойствах луча. Главным ограничением для возможностей светового микроскопа является волновая природа света, которое не позволяет увидеть объекты, размеры которых сопоставимы с волновой длиной электромагнитного излучения светового диапазона, т.е. меньше 1 микрометра.
Для различных нужд создаются оптические системы различной конструкции [3, 4]:
Прямой микроскоп является наиболее часто встречаемой конструкцией. Такая схема используется чаще всего при изучение прозрачных и полупрозрачных микрообъектов размеров, сопоставимых с клетками. Лабораторные микроскопы особенно широко применяются в различных областях биологии (ботанике, микробиологии, цитологии) и медицины (обычно это микробиологический и гистологический анализ материала).
Инвертированная схема микроскопа отличается от прямой тем, что в ней объективы находятся не над, а под исследуемым предметом. Это позволяет оптимизировать конструкцию инструмента для работы с достаточно большими по своему объему объектами, вроде флаконов для культивирования клеток. В зависимости от назначения и особенностей конструкции, инвертированные микроскопы могут быть биологическими, люминесцентными, металлографическими и др. Подобные приборы широко используются при различных научных и лабораторных исследованиях в микробиологии и медицине.
Стереоскопические или стереомикроскопы имеют в своей конструкции два расположенных под углом объектива, и благодаря этому позволяют получать стереоскопическое изображение исследуемого объекта. Стереомикроскопы обладают существенно большей глубиной резкости, чем обычные, что позволяет использовать их для изучения относительно крупных и выпуклых микрообъектов – таких как части растений, грибов, колонии микроорганизмов. Выделяют два типа конструкции световых микроскопов: схема Грену и оптическая система с общим главным объективом.
Светлопольная микроскопия позволяет исследовать объекты в проходящем свете в светлом поле [2,5]. Данный вид микроскопии предназначен для исследования морфологии, размеров клеток, их взаимного расположения, структурной организации клеток и других особенностей. У светового микроскопа максимальная разрешающая способность составляет 0,2 мкм, что обеспечивает высокоточное увеличение микроскопа до 1500х.
Фазово-контрастная микроскопия (рис. 1) используется для получения высококонтрастных изображений прозрачных образцов, таких как живые клетки, микроорганизмы, тонкие кусочки ткани, литографические узоры, волокна, латексные дисперсии, осколки стекла и субклеточные частицы, включая ядра и другие органеллы. Метод контраста участка использует оптический механизм для того, чтобы перевести мельчайшие изменения в участке в соответствующие изменения в амплитуде, которые можно визуализировать как разницы в контрасте изображения. Одно из главных преимуществ микроскопии контраста участка в том, что живущие клетки можно рассмотреть в их естественном положении, без предварительного убийства. В результате динамика протекающих биологических процессов может наблюдаться и регистрироваться в высоком контрасте, с высокой четкостью мельчайших деталей образца.


Лазерная конфокальная микроскопия

Мультифотонная микроскопия схожа с конфокальной и обеспечивает четкие преимущества для трехмерной визуализации [6]. Она хорошо подходит для визуализации живых клеток, особенно в интактных тканях, таких как срезы мозга, эмбрионы, а так же целые органы или небольшие организмы. Эффективная чувствительность флуоресцентной микроскопии, особенно при работе с толстыми образцами, как правило, ограничена вспышкой без фокуса. Это ограничение значительно сокращается в конфокальном микроскопе, с помощью конфокального отверстия для отклонения фоновой флуоресценции фокуса и получения несжатых оптических секций менее 1 микрометра. Мультифотонная микроскопия имеет преимущества: 1. Вследствие значительно меньшего поглощения тканей и клеток в ИК – области по сравнению с УФ, уменьшается повреждение живых клеток фотоиндуцированными процессами. 2. Достигается большая глубина проникновения излучения в биологические объекты. 3. Отсутствует возбуждение и выцветание флуорохромов вне фокального микрообъема, поэтому конфокальная диафрагма не требуется.
Эпоха, когда оптическая микроскопия была чисто описательным инструментом прошла. В настоящее время формирование оптического изображения является лишь первым шагом к анализу данных. Микроскоп выполняет этот первый шаг в сочетании с электронными детекторами, процессорами изображений и устройствами отображения, которые можно рассматривать как расширения системы формирования изображения. Компьютеризированное управление фокусом, сценическим положением, оптическими компонентами, ставнями, фильтрами и детекторами широко распространено и позволяет проводить экспериментальные манипуляции, которые невозможны для человека при использовании механических микроскопов. Возрастающее применение электрооптики в флуоресцентной микроскопии привело к созданию оптических пинцетов, способных манипулировать субклеточными структурами или частицами, изображениями отдельных молекул и широким спектром сложных спектроскопических приложений.
1.1 Цель работы: Овладеть методикой приготовления микрошлифов, изучить устройство металлографического микроскопа и приобрести навыки металлографического анализа сплавов.
Краткое описание методики анализа
Микроскопический анализ – это исследование структуры и пороков металлов и сплавов с помощью металлографических микроскопов при больших увеличениях. Он позволяет установить качество металлов и сплавов (т.е. засоренность неметаллическими включениями – оксидами, сульфидами и т.д.), величину и форму зерен, морфологические особенности и размеры отдельных структурных составляющих.
Микроскопический анализ состоит из следующих этапов:
а) приготовление микрошлифов;
б) травление микрошлифов;
в) изучение микроструктуры под микроскопом.
Рассмотрим подробнее методику каждого из этих этапов.
1.2.1 Приготовление микрошлифов. Микрошлифом называется образец металла, специально приготовленный для исследования его структуры под микроскопом. Процесс приготовления микрошлифов заключается в шлифовании и полировании. Рассматриваемая поверхность микрошлифа должна быть абсолютно плоской и зеркальной.
Наиболее удобными размерами микрошлифа является цилиндр диаметром d = 12….15 мм, либо параллелепипед со стороной основания а = 12…15 мм и высотой h = 10 - 15 мм (рис. 1.1 а, б). Однако далеко не всегда можно изготовить микрошлифы рекомендованных размеров. Часто форма и размеры определяются конфигурацией исследуемых деталей или полуфабрикатов и могут быть значительно меньше или больше оптимальных, например, листы, проволока, мелкий режущий инструмент, обломки деталей, сварные швы и т.д. В этом случае для получения плоской полированной поверхности приходится прибегать к специальному закреплению их в приспособления. Если образец представляет собой тонкую пластинку или лист, его зажимают в струбцину (рис. 1.1 в). Если же образец имеет небольшие размеры и неправильную форму, его заливают в цилиндрической обойме бакелитом, эпоксидной смолой, органическим стеклом, или легкоплавким сплавом (рис. 1.1 г).
Рисунок 1.1 – Форма, размеры (а, б) и приспособления (в, г) для приготовления микрошлифов
Вырезка образца для микрошлифа производится ножовкой, фрезой, резцом, а при повышенной твердости – абразивными кругами, не допуская разогрева металла. Изучаемую поверхность образца заторцовывают напильником или наждачным кругом, периодически производя охлаждения в воде.
Шлифование предварительно заторцованной поверхности образца производят на специальной наждачной бумаге (ГОСТ 6456-82, ГОСТ 10054-82), помещенной на плоскую поверхность (например, на стекло), или на специальных шлифовальных машинах, где шлифовальная бумага закрепляется на вращающемся диске, диаметром 200 – 250 мм. Шлифование производят последовательно, уменьшая зернистость наждачной бумаги. При этом образец шлифуют в направлении, перпендикулярном рискам, изменяя на 90 ° направление шлифования при переходе на следующий номер бумаги. После окончания шлифования образец тщательно промывают водой для удаления частиц абразивного материала, а затем полируют. Полированием удаляют оставшиеся после тонкого шлифования мелкие дефекты поверхности, риски и т.п.
Полирование шлифов осуществляют механическим либо электролитическим методами. Механическое полирование осуществляют на вращающемся плоском диске, обтянутом полировальным материалом – фетром, сукном, на который наносятся мелкие частицы абразивных материалов – оксидов металлов (Al2O3, Cr2O3, MoO) в виде водной суспензии. Электролитическое полирование производят в ваннах, наполненных электролитом, причем образец выступает в качестве анода. Шлифованную поверхность образца располагают против катода, выполненного из нержавеющей стали. Под действием электролитического тока выступы шлифованной поверхности растворяются, а впадины сглаживаются, и образец сравнительно быстро приобретает полированную поверхность. Важным достоинством электролитического полирования является быстрота получения зеркальной поверхности и отсутствие каких-либо искажений в поверхностном слое, характерных для механического полирования (например, наклеп).
Полирование считается законченным, если на полированной поверхности под микроскопом не обнаруживаются риски, царапины и др. дефекты. После полирования образец промывают водой, затем спиртом и просушивают фильтровальной бумагой.
Изучение микроструктуры целесообразно начинать с рассмотрения микрошлифа в нетравленном виде, т.е. непосредственно после полирования, промывки и высушивания. Под микроскопом такой шлиф имеет вид светлого круга, на котором часто можно увидеть темные, желтые или другого цвета участки обычно небольших размеров. Эти участки являются следами неметаллических включений (оксидов, сульфидов, нитридов, силикатов). В нетравленном виде обычно изучается структура графитовых включений в чугунах (сером, ковком, модифицированном и пр.). Обнаруживаются также микротрещины и микропоры, зачастую встречающиеся в отливках и сварных швах.
1.2.2 Травление микрошлифов. После просмотра нетравленного шлифа для изучения микроструктуры его подвергают травлению. Метод химического избирательного травления основан на различии физико-химических свойств отдельных фаз и пограничных участков зерен. В результате различной интенсивности взаимодействия и растворения создается своеобразный рельеф на поверхности шлифа. Различия внешнего вида структурных составляющих после травления под микроскопом обусловлены различной их отражательной способностью.
Для осуществления травления микрошлиф погружают полированной поверхностью в раствор выбранного состава (некоторые составы приведены в табл. 1) и через некоторое время его вынимают для осмотра. Если полированная поверхность приобрела слегка матовый вид, травление считается законченным, и шлиф сразу же промывают водой, затем спиртом и высушивают фильтровальной бумагой. Продолжительность травления зависит от состава сплава, состава и концентрации травителя и определяется опытным путем. Травление можно осуществлять и электролитическим методом, аналогично электролитической полировки шлифов.
Таблица 1.1- Реактивы для травления микрошлифов
| Наименование сплава | Состав реактива | Назначение и особенности |
| Стали и чугуны | 1…5 % HNO3 в спирте | Окрашивает перлит в темный цвет, выявляет зерна феррита, структуру мартенсита и продуктов отпуска. |
| 3 – 5 % р-р пикриновой кислоты в спирте | Выявляет структуру цементованной и азотированной стали | |
| 2 - 4 мл HNO3, 22 г пикриновой кислоты, этиловый спирт 100 мл | Выявляет границы зерен закаленной стали | |
| Высоколегированные хромистые, марганцовистые, быстрорежущие стали | 10 мл HNO3, 20-30 мл HCl, глицерин 30 мл | Выявление макроструктуры мартенсита, аустенита, карбидов |
| Медь и её сплавы (латуни, бронзы) | 10 г FeCl3, 25 мл HCl, 100 мл воды | b-фаза в латунях окрашивается в темный цвет |
| Алюминий и его сплавы | 0,5 мл 48 %-й HF, 99,5 мл воды | Выявление структуры дуралюминов и литых сплавов на алюминиевой основе |
| Титан и его сплавы | 25 % HF (48 %), 25 % HNO3, 50 % глицерин |
1.2.3 Устройство металлографического микроскопа. Для изучения микроструктуры непрозрачных твердых тел используют металлографические микроскопы, рассмотрение объектов в которых производится в отраженном свете. В этом его основное отличие от биологического микроскопа, в котором прозрачные тела рассматривают в проходящем свете.
По устройству микроскопы бывают вертикальные и горизонтальные. Оптическая схема простейшего вертикального микроскопа МИМ-7 приведена на рис. 1.2. Она работает следующим образом. Свет мощной лампы 1 напряжением 17 В и мощностью 170 Вт, подключаемой через понижающий трансформатор ТР-17, проходит через коллектор 2, попадает на зеркало 3 и через линзу 4, апертурную диафрагму 5, линзу 6, призму 7 и линзу 8 поступает на плоско-параллельную отражательную пластинку 9, отражающую около 1/3 всего светового потока, а затем через объектив 10 на микрошлиф 11. Отразившись от шлифа, расположенного в фокальной плоскости объектива, лучи вновь попадают в объектив, проходят параллельным пучком через плоско-параллельную пластинку 9 и далее в ахроматическую линзу 12 и отразившись от зеркала 14, поступают в окуляр 13. Для фотографирования зеркало 14 выдвигают вместе с тубусом визуального наблюдения, и лучи проходят через один из трех фотоокуляров 15, которые нахо-дятся в одном поворачивающемся диске. Отражаясь от зеркала 16, лучи попадают на матовое стекло или на фотопластинку 17. Для фотографирования используют фотозатвор 19.
Оптическая система включает объектив, окуляр и ряд вспомогательных оптических элементов, зеркала, призмы и т. п. Объектив, направленный на объект (микрошлиф) дает действительное увеличенное обратное изображение шлифа и представляет собой сложное сочетание линз, расположенных в одной общей оправке. Окуляры, через которые исследователь наблюдает изображение, не только дают мнимое увеличение (т.е. увеличение промежуточного изображения), но и исправляют оптические дефекты, которые полностью не устраняются даже в объективах сложной конструкции. Увеличение окуляра меньше, чем объектива и подбирается таким образом, чтобы изображение было четким.
Обычные окуляры увеличивают от 2 до 15 раз, а компенсационные – до 25 раз, тогда как увеличение объективов составляет от 9 до 95 раз. Максимальное полезное увеличение микроскопа определяется по формуле:
где d1 – максимальная разрешающая способность человеческого глаза, равная 0,3 мм;
d2 – максимальная разрешающая способность оптической системы.
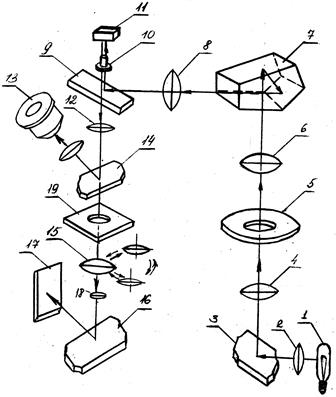
Рисунок 1.2 - Схема МИМ-7:
1 – осветитель; 2 – коллектор; 3 – зеркало; 4 – линза; 5 – апертурная диафрагма; 6 – линза; 7 призма; 8 – линза; 9 – отражательная пластина; 10 – объектив; 11 – микрошлиф; 12 – ахроматическая линза; 13 – окуляр; 14 – зеркало; 15 – линза фотоокуляра; 16 – зеркало; 17 – фотопластинка; 18 – линза; 19 – фотозатвор.
Под разрешающей способностью понимают способность давать отчетливое разделенное изображение двух близко расположенных точек рассматриваемого объекта. Максимальная разрешающая способность оптической системы определяется из условий дифракции по следующему уравнению:
где λ – длина волны света (для белого света λ = 600 нм);
n – коэффициент преломления;
a/2 - половина угла раскрытия входящего светового пучка.
Максимальное полезное увеличение микроскопа достигается, когда d2 имеет минимальное значение, т.е. при постоянной λ величина n× sin a/2 называемая числовой апертурой (А) будет максимальной. Поэтому надо стремиться к наибольшим величинам угла a/2 и коэффициента преломления n. Обычно в микроскопе ведут наблюдение в воздушной среде (n = 1). Для получения больших увеличений (меньшего d2) между внешней линзой объектива и поверхностью шлифа используют иммерсионные среды (например, кедровое масло; n = 1,52). Тогда разрешающая способность оптической системы составит d2 = 600/(2×1,5×1) = 0,2 мкм, а максимальное полезное увеличение – 1500 раз.
Для изучения микроструктуры отполированный и протравленный микрошлиф устанавливается на предметный столик, подготовленной поверхностью к объективу (вниз). Сначала фокусировка осуществляется путем поднятия или опускания столика плавным вращением винта грубой наводки до появления изображения в окуляре. После фиксации винта грубой наводки осуществляют точную наводку с помощью микрометрического винта и добиваются максимальной четкости изображения. Яркость изображения регулируется напряжением на трансформаторе, диафрагмами и светофильтрами. Столик со шлифом перемещается в горизонтальной плоскости в двух взаимно перпендикулярных направлениях с помощью специальных винтов, расположенных непосредственно на столике.
Широко используются также и горизонтальные микроскопы МИМ-8, бинокулярные вертикальные микроскопы ММР, ”NU-2Е”, ”Neophot-21”, ”Neophot-30” (производства Германии) с улучшенными оптическо-техническими возможностями и большим удобством.
1.2.4 Знакомство с методами количественного микроанализа. Рассмотренные ниже методы позволяют определять размеры зерен, количество и размеры структурных составляющих. Для определения величины зерен применяется ряд методов:
а) визуальным сравнением со стандартной шкалой (ГОСТ 5639-82).
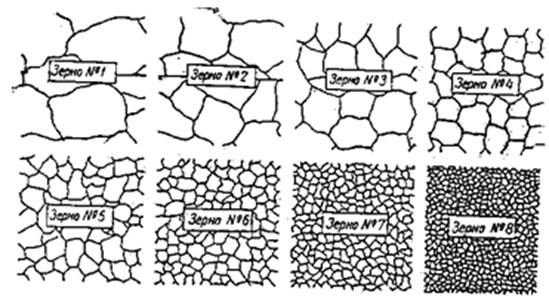
Определение ведут под микроскопом при увеличении 100 раз, путем сравнения размеров наблюдаемых зерен со стандартной шкалой (рис. 1.3). Зерна №№: 1 – 4 считаются крупными, а свыше № 6 – мелкими. По номеру зерна можно определить средний диаметр, площадь зерна с помощью стандартной шкалы (табл. 1.2).
б) с помощью окуляр-микрометра (метод секущих).
Окуляр-микрометр, в отличие от обычного имеет шкалу, состоящую из 100 делений. Чем больше выбранное увеличение микроскопа, тем крупнее наблюдаемые зерна. Естественно, что цена деления окуляр-микрометра (Ц) зависит от увеличения микроскопа, поэтому перед анализом её необходимо определять.
Определяют количество зерен (N) умещающихся на шкале окуляр-микрометра в произвольно выбранном диапазоне (Д). Тогда средний размер зерна составит:

Рисунок 1.3 - Шкала стандартных размеров зерна, × 10
Таблица 1.2 - Параметры оценки номера зерна (ГОСТ 5639-82)
| Номер зерна | Площадь зерна в мм 2 | Количество зерен на площади 1 мм 2 | Среднее количество зерен в 1 мм 3 | Средний диаметр зерна по расчету в мм | Средний диаметр зерна в мм | ||
| наимень- шая | средняя | наиболь- шая | наимень- шая | средняя | наиболь шая | ||
| -3 | 0,640 | 1,024 | 1,280 | 0,75 | 1,5 | 1,0 | 0,875 |
| -2 | 0,320 | 0,512 | 0,640 | 1,5 | 2,7 | 0,694 | 0,650 |
| -1 | 0,160 | 0,256 | 0,320 | 0,500 | 0,444 | ||
| 0,080 | 0,128 | 0,160 | 0,352 | 0,313 | |||
| 0,040 | 0,064 | 0,080 | 0,250 | 0,222 | |||
| 0,020 | 0,032 | 0,040 | 0,177 | 0,167 | |||
| 0,010 | 0,016 | 0,020 | 0,125 | 0,111 | |||
| 0,005 | 0,008 | 0,010 | 0,088 | 0,0788 | |||
| 0,0025 | 0,004 | 0,005 | 0,050 | 0,0553 | |||
| 0,00125 | 0,002 | 0,0025 | 0,041 | 0,0391 | |||
| 0,000625 | 0,001 | 0,00125 | 0,031 | 0,0267 | |||
| 0,000313 | 0,0005 | 0,000625 | 0,022 | 0,0196 | |||
| 0,000156 | 0,00025 | 0,000313 | 0,016 | 0,0138 | |||
| 0,000078 | 0,000125 | 0,000156 | 0,012 | 0,0099 | |||
| 0,000039 | 0,000062 | 0,000078 | 0,0079 | 0,0069 | |||
| 0,000019 | 0,000031 | 0,000039 | 0,0056 | 0,0049 |
Порядок выполнения работы
1.3.1 Ознакомиться с методикой приготовления микрошлифов и устройством металлографического микроскопа.
1.3.2 Из выданных заготовок изготовить и протравить микрошлиф.
1.3.3 Изучить и зарисовать микроструктуру микрошлифа (после шлифовки, в нетравленном и травленном состоянии).
1.4 Содержание отчета:
Ø Наименование и цель работы.
Ø Краткое описание методики приготовления микрошлифов, устройства металлографического микроскопа (привести оптическую схему), определения размера зерна.
Ø Результаты работы в виде зарисовок микроструктуры, расчетов размеров зерна.
Микроскопический анализ (микроанализ) металлов и сплавов заключается в исследовании строения (структуры) металла с помощью оптического или электронного микроскопа. Строение металла или сплава, наблюдаемое при помощи микроскопа, называется микроструктурой.
Между микроструктурой металлов и их свойствами существует четкая связь. Микроанализ позволяет:
- определить форму и размеры зерен;
- определить форму, размеры, содержание и относительное расположение фаз;
- выявить наличие имеющихся в металле неметаллических включений и микродефектов (микротрещины и микропоры).
Эта информация позволяет судить о свойствах металлов и сплавов, о предшествующей обработке этих материалов (литье, деформирование, термообработка и др.).
Микроанализу подвергают специально подготовленные образцы, называемые микрошлифами. Микрошлиф – это срез металла, отполированного до состояния зеркальной поверхности.
Микрошлифы готовят следующим образом.
Образец для микроанализа вырезают из того места, которое является наиболее важным в эксплуатационных условиях исследуемого металла. Наиболее удобны для работы образцы цилиндрической формы диаметром 10-12 мм и высотой 10-15 мм и прямоугольной формы с площадью основания 10 х 10 мм и высотой 10-15 мм;
Одну из плоскостей образца зачищают наждачным кругом; Полученную поверхность шлифуют наждачной бумагой различной зернистости;
Для получения зеркальной поверхности образец полируется на сукне или фетре, смоченном полирующей смесью;
Полученный микрошлиф промывается водой, а затем спиртом или бензином и просушивается фильтровальной бумагой.
Микрошлифы исследуются без травления или протравленными. В нетравленом шлифе можно наблюдать природу и характер расположения неметаллических включений: оксидов, сульфидов, графита, а также виды микродефектов – микротрещины, микропоры. Структура и ее особенности определяются на протравленных шлифах.
При травлении (например для сталей и чугунов раствором азотной кислоты в этиловом спирте) различные структуры разъедаются травлением с разной скоростью, поэтому образуется микрорельеф и его неровности создают сочетание света и тени: однородные структуры отражают больше света и видны светлыми, разнородные – темными (т.к. светлые лучи от них рассеиваются, не попадая в объектив). Максимальная неоднородность на границах зерен (где скопление примесей и искривлений кристаллической решетки), поэтому зерна резко очерчены, т.к. протравливаются сильнее.
Для исследования микроструктуры металлов и сплавов применяют металлографические микроскопы, которые позволяют рассматривать при увеличении непрозрачные тела в отраженном свете.
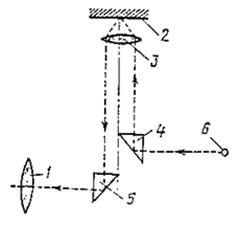 |  |
| Рисунок 2.1. - Ход лучей в металлографическом микроскопе | Рисунок 2.2 - Схема определения цены деления окуляра-микрометра |
Луч от источника света 6 (рисунок 2.1) преломляется призмой 4 и попадает через линзу объектива 3 на поверхность микрошлифа 2 и отражаясь от него опять через линзу объектива 3 через призму 5 в линзу окуляра 1 на которую обращен глаз исследователя.
Т.е. изображение точки объекта в микроскопе увеличивается дважды: объектив дает первое – промежуточное (Vоб.), окуляр – второе окончательное (Vок.). Следовательно общее увеличение микроскопа (Vм.) будет следующим:
В современных конструкциях увеличение микроскопа доходит до 2000 раза.
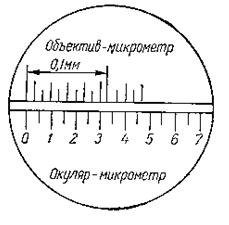
Увеличение микроскопа можно определить при помощи объектив-микрометра и окуляр-микрометра. Объектив-микрометр представляет собой стеклянную или металлическую пластинку, на которой нанесена шкала длиной 1 мм, разделенная на 100 равных делений (цена деления 0,01 мм). Окуляр-микрометр в отличие от обычного окуляра имеет между линзами стеклянную пластинку со шкалой. Совмещая обе шкалы, определяют размер шкалы окуляра при данном объективе (рисунок 2.2) по формуле:
где Цоб – цена деления шкалы объектива (0,01 мм); Т – число совмещенных делений объектива-микрометра; А – число совмещенных делений окуляр-микрометра.
С помощью окуляр-микрометра можно определить размеры зерен, протяженность какой-либо резко отличающийся структурной области.
По размерам природных зерен можно довольно точно сказать о механической прочности исследуемого металла. Чем крупнее зерно, тем ниже механическая прочность деталей.

Таким образом, работоспособность деталей зависит в первую очередь от размеров природного зерна.
Величина зерна определяется по шкале стандартных размеров (рисунок 2.3), где проставлены баллы – размеры зерна.
 |
| Рисунок 2.3 - Стандартная шкала размеров зерна |
Работоспособность (качество) металла зависит от размеров природного зерна, а также от вида рабочей нагрузки на деталь (таблица 2.1).
Таблица 2.1 - Качество металла в зависимости от размера зерна и нагрузки
| Размер зерна, балл | Средняя площадь зерна, мкм 2 | Вид нагрузки |
| статическая | циклическая | динамическая |
| неуд. | неуд. | неуд. |
| удов. | неуд. | неуд. |
| удов. | неуд. | неуд. |
| удов. | удов. | неуд. |
| качеств. | удов. | удов. |
| высококачеств. | качеств. | удов. |
| высококачеств. | высококачеств. | качеств. |
| высококачеств. | высококачеств. | высококачеств. |
Микроскопический анализ (микроанализ) металлов и сплавов заключается в исследовании строения (структуры) металла с помощью оптического или электронного микроскопа. Строение металла или сплава, наблюдаемое при помощи микроскопа, называется микроструктурой.
Между микроструктурой металлов и их свойствами существует четкая связь. Микроанализ позволяет:
- определить форму и размеры зерен;
- определить форму, размеры, содержание и относительное расположение фаз;
- выявить наличие имеющихся в металле неметаллических включений и микродефектов (микротрещины и микропоры).
Эта информация позволяет судить о свойствах металлов и сплавов, о предшествующей обработке этих материалов (литье, деформирование, термообработка и др.).
Микроанализу подвергают специально подготовленные образцы, называемые микрошлифами. Микрошлиф – это срез металла, отполированного до состояния зеркальной поверхности.
Микрошлифы готовят следующим образом.
Образец для микроанализа вырезают из того места, которое является наиболее важным в эксплуатационных условиях исследуемого металла. Наиболее удобны для работы образцы цилиндрической формы диаметром 10-12 мм и высотой 10-15 мм и прямоугольной формы с площадью основания 10 х 10 мм и высотой 10-15 мм;
Одну из плоскостей образца зачищают наждачным кругом; Полученную поверхность шлифуют наждачной бумагой различной зернистости;
Для получения зеркальной поверхности образец полируется на сукне или фетре, смоченном полирующей смесью;
Полученный микрошлиф промывается водой, а затем спиртом или бензином и просушивается фильтровальной бумагой.
Микрошлифы исследуются без травления или протравленными. В нетравленом шлифе можно наблюдать природу и характер расположения неметаллических включений: оксидов, сульфидов, графита, а также виды микродефектов – микротрещины, микропоры. Структура и ее особенности определяются на протравленных шлифах.
При травлении (например для сталей и чугунов раствором азотной кислоты в этиловом спирте) различные структуры разъедаются травлением с разной скоростью, поэтому образуется микрорельеф и его неровности создают сочетание света и тени: однородные структуры отражают больше света и видны светлыми, разнородные – темными (т.к. светлые лучи от них рассеиваются, не попадая в объектив). Максимальная неоднородность на границах зерен (где скопление примесей и искривлений кристаллической решетки), поэтому зерна резко очерчены, т.к. протравливаются сильнее.
Для исследования микроструктуры металлов и сплавов применяют металлографические микроскопы, которые позволяют рассматривать при увеличении непрозрачные тела в отраженном свете.
 |  |
| Рисунок 2.1. - Ход лучей в металлографическом микроскопе | Рисунок 2.2 - Схема определения цены деления окуляра-микрометра |
Луч от источника света 6 (рисунок 2.1) преломляется призмой 4 и попадает через линзу объектива 3 на поверхность микрошлифа 2 и отражаясь от него опять через линзу объектива 3 через призму 5 в линзу окуляра 1 на которую обращен глаз исследователя.
Т.е. изображение точки объекта в микроскопе увеличивается дважды: объектив дает первое – промежуточное (Vоб.), окуляр – второе окончательное (Vок.). Следовательно общее увеличение микроскопа (Vм.) будет следующим:
В современных конструкциях увеличение микроскопа доходит до 2000 раза.
Увеличение микроскопа можно определить при помощи объектив-микрометра и окуляр-микрометра. Объектив-микрометр представляет собой стеклянную или металлическую пластинку, на которой нанесена шкала длиной 1 мм, разделенная на 100 равных делений (цена деления 0,01 мм). Окуляр-микрометр в отличие от обычного окуляра имеет между линзами стеклянную пластинку со шкалой. Совмещая обе шкалы, определяют размер шкалы окуляра при данном объективе (рисунок 2.2) по формуле:
где Цоб – цена деления шкалы объектива (0,01 мм); Т – число совмещенных делений объектива-микрометра; А – число совмещенных делений окуляр-микрометра.
С помощью окуляр-микрометра можно определить размеры зерен, протяженность какой-либо резко отличающийся структурной области.
По размерам природных зерен можно довольно точно сказать о механической прочности исследуемого металла. Чем крупнее зерно, тем ниже механическая прочность деталей.
Таким образом, работоспособность деталей зависит в первую очередь от размеров природного зерна.
Величина зерна определяется по шкале стандартных размеров (рисунок 2.3), где проставлены баллы – размеры зерна.
 |
| Рисунок 2.3 - Стандартная шкала размеров зерна |
Работоспособность (качество) металла зависит от размеров природного зерна, а также от вида рабочей нагрузки на деталь (таблица 2.1).
Лабораторные анализы хоть один раз в жизни сдавал каждый человек, хотя, без сомнения, данные исследования проводятся гораздо чаще. Они входят в группу обязательных профилактических исследований и помогают выявить патологию, когда отсутствуют какие-либо симптомы.
Сложно переоценить важность лабораторной диагностики, ведь она предоставляет врачу до 80% важной диагностической информации. Она помогает подтвердить или опровергнуть диагноз, проследить динамику и эффективность лечения, выявить возбудителя заболевания и определить патологические процессы, происходящие в организме человека.
Лабораторная диагностика биологических материалов в медицине проводится с помощью специализированного оборудования, одним из которых является оптический прибор микроскоп. Различные исследования в медицине под многократным увеличением, которые проводятся с помощью микроскопа, называются микроскопия.
История появления микроскопа
Когда появился первый микроскоп доподлинно неизвестно, но попытки рассмотреть мелкие предметы с помощью увеличительного стекла (двояковыпуклой оптической линзы) предпринимались еще в Древнем Риме.
Первый прибор отдаленно похожий на микроскоп создали голландский оптик Ганс Янсен со своим сыном. Они первыми обнаружили, что при использовании двух линз можно получить многократно увеличенное изображение. Их аппарат напоминал скорее подзорную трубу, но в отличие от последней, не приближал предметы, а увеличивал их.
Первый микроскоп, похожий на современные аналоги, представлял собой металлическую пластину в центре которой располагалась линза. Его создал нидерландский натуралист Антони ван Ливенгук, с его помощью ему удалось сделать важные открытия в строении и функционировании человеческого организма. Он рассмотрел состав крови, структуру тканей, а также увидел бактерии. С помощь микроскопа Левенгука можно было получить увеличение до 270 раз.
К разработке микроскопа внесли свой вклад и русские ученые – Петр Кулибин и Михайло Ломоносов. Последний использовал микроскоп для своих исследований.
Виды микроскопических исследований
С помощью микроскопа можно исследовать различные клетки человеческого организма. Для исследования берутся различные биологические материалы – кровь, моча, сперма, мазки, отделяемое слизистых и т.д.
В медицине сегодня проводятся несколько видов микроскопических исследований – стереоскопическая, инфракрасная, люминесцентная, ультрафиолетовая, рентгеновская, поляризационная микроскопии.

Анализ крови позволяет определить количественный и качественный состав крови, соотношение ее форменных элементов, выявить атипичные или незрелые клетки. Микроскопический анализ мочи позволяет определить наличие солей, клеточных элементов и цилиндров, исследование позволяет выявить имеющиеся проблемы в водно-электролитном балансе организма, также в нарушения процессов обмена веществ.
Несмотря на то, что сегодня широко используются специальные электронные аппараты для проведения лабораторных исследований – анализаторы, визуальный осмотр биологических материалов для выявления атипичных или незрелых клеток по-прежнему выполняется медицинским персоналом с помощью микроскопов.
Определение понятия
Микроскопические методы исследования – это способы изучения очень мелких, неразличимых невооруженным глазом объектов с помощью микроскопов. Широко применяются в бактериологических, гистологических, цитологических и других исследованиях.
Микроскопия - один из главных методов диагностики инфекционных и инвазионных заболеваний, позволяющий определить вид возбудителя по форме, размерам, строению оболочки, цитоплазмы, ядра, взаиморасположению и способности окрашиваться определенными красителями; обнаружить яйца и личинки гельминтов, их фрагментов, вегетативных и цистных форм патогенных простейших.
Микроскоп – это оптический прибор, имеющий как минимум двухступенчатое увеличение. И одно из них принадлежит окуляру, который играет роль лупы. Только в отличие от бытовой лупы, окуляр имеет постоянное увеличение, его положение в микроскопе определено и жестко закреплено стандартом (высота окуляра).
Любой оптический микроскоп имеет базовые узлы, функциональное назначение которых не меняется от типа, класса прибора или страны производителя. Разница только в конструкторском и технологическом решениях, предложенных специалистами фирм-разработчиков, а также уровне мирового научно-технического прогресса. И как бы микроскоп не назывался – световой, цифровой, видеомикроскоп, фотомикроскоп, лазерный сканирующий микроскоп, анализатор изображения – в его основе будет базовый световой микроскоп, принцип которого был разработан еще Левингуком, Ньютоном, Карл Цейсом, Эрнстом Аббе.
Микроскоп – это оптико-механо-электрический прибор, объединяющий в себе три функциональные части:
· функция воспроизводящей системы – воспроизвести (создать, сформировать) изображение объекта таким образом, чтобы оно как можно точнее передавало детали объекта с соответствующим разрешением, увеличением, контрастом и цветопередачей;
· функция визуализирующей системы – передать изображение объекта, созданное воспроизводящей системой микроскопа, таким образом, чтобы оно с небольшим дополнительным увеличением (или без него) было видно достаточно резко на сетчатке глаза, фотопленке или пластинке, на экране телевизора или монитора компьютера;
· функция осветительной системы – создать световой поток, позволяющий осветить объект таким образом, чтобы воспроизводящая система микроскопа предельно точно могла выполнить свою основную функцию. При этом совместная работа обоих систем должна обеспечивать визуализацию изображения с использованием физико-химических свойств объекта.
Важнейшей характеристикой каждого объектива микроскопа является его разрешающая способность. Разрешающей способностью называется расстояние между двумя точками, при котором они видны раздельно (т.е. не сливаются в одну).
Для полного использования разрешающей способности иммерсионного объектива необходимо выполнять следующие основные правила:
1) Конденсор осветительного аппарата должен быть поднят до отказа (до уровня предметного столика).
2) Диафрагма конденсора полностью открыта.
Во всех без исключения случаях работа ведется с применением встроенной подсветки или плоского зеркала, так как конденсор рассчитан на работу с параллельными пучками света.
Одной из важных характеристик объектива является его свободное рабочее расстояние, т.е. расстояние между верхней поверхностью препарата и нижней поверхностью фронтальной линзы объектива при наведенном на фокус объективе. Эти расстояния следующие:
для объектива с увеличением 10х – 0,25 мм;
для объектива с увеличением 40х – 0,65 мм;
для объектива с увеличением 100х – 1,25 мм.
Знание этих расстояний необходимо для того, чтобы быстро сфокусировать объектив на препарат.
Микроскопы по объекту исследования можно разделить на следующие основные виды:
- микроскопы плоского поля – это микроскопы, оптическая схема которых обеспечивает воспроизведение объекта в двумерном пространстве – двумерное изображение. Объекты исследования – тонкие, в среднем, толщиной от 10 мм до 0,1 мм, просматриваемый слой от 1 мм до 0,001 мм. В этих микроскопах возможно наблюдение объемного изображения в пределах 100-200 мкм по высоте за счет особых способов освещения.
- стереоскопические микроскопы - это микроскопы, оптическая схема которых обеспечивает воспроизведение объекта в трехмерном пространстве – объемное, трехмерное изображение. Объекты исследования – габаритные, в среднем, толщиной от 100 мм до 1 мм, просматриваемый слой по высоте/глубине – от 50 мм до 0,5 мм, и плоские.
Конструктивно микроскопы могут быть выполнены в двух вариантах:
- прямые микроскопы (классическое построение схемы) – наблюдательная часть микроскопа расположена сверху объекта. Это относится к микроскопам плоского поля и стереомикроскопам.
- инвертированные микроскопы (перевернутое построение схемы) – наблюдательная часть микроскопа расположена снизу объекта. Это относится только к микроскопам плоского поля.
- лазерные микроскопы - освещение и наблюдение объекта с помощью лазерного излучения (смотрите пример ниже).
Порядок работы со световыми микроскопами
· Проверить состояние осветительного аппарата: поднять конденсор, открыть его диафрагму, включить питание и для установки интенсивности освещения медленно повернуть ручку настройки яркости, в случае отсутствия встроенной подсветки, поставить плоское зеркало.
· Поместить на столик микроскопа исследуемый препарат и установить в фокусе сухой объектив (10х) на расстояние несколько меньше свободного рабочего расстояния.
· Глядя в окуляр, произвести предварительную установку освещения с помощью ручки настройки яркости (или вращая зеркалом).
· Медленно поднимая тубус макровинтом, добиться резкого изображения препарата.
· Поставив сухой (40х) или иммерсионный (100х) объектив, опускать тубус микроскопа под контролем глаза, глядя сбоку. Опустить объектив на расстояние меньше свободного рабочего и, глядя в окуляр, макровинтом медленно поднимать тубус до тех пор, пока не появится мелькание препарата. Точная установка достигается с помощью микровинта. Не следует делать микровинтом более половины оборота в одну или другую сторону.
Микроскопия неокрашенных объектов
При работе с нативным материалом необходимо соблюдать два основных принципа: не загрязнить исследуемый объект микроорганизмами, не заразить себя и окружающую среду. При микроскопии необходимо помнить, что рассматривание неокрашенного препарата возможно только с ограниченным освещением, путем опускания конденсора или уменьшением отверстия ирис-диафрагмы. Для микроскопии неокрашенных объектов используется окуляр 10х и объектив 10х.
При освещении с помощью встроенной подсветки осветителя или плоского зеркала ирис-диафрагма частично закрыта, конденсор опущен. С помощью макровинта устанавливается поле зрения и проводится обзор препарата. С целью обнаружения объекта все нативные (неокрашенные) препараты просматривают под малым увеличением с помощью макровинта. Для лучшего рассмотрения объекта или его отдельных фрагментов используется сухой объектив с увеличением 40х и освещенность, с помощью поднятия конденсора и открытия ирис-диафрагмы под контролем глаза.
Микроскопия окрашенных объектов
При микроскопии окрашенного препарата необходимо помнить, что рассматривание возможно только при полном освещении. Для микроскопии окрашенных объектов используется окуляр 10х и объектив 10х.
Ирис-диафрагма открыта, конденсор поднят. С помощью макровинта устанавливается поле зрения и проводится обзор препарата. Достигается максимальное освещение препарата. При малом увеличении делается обзор препарата для обнаружения четко выраженных полей зрения. Изучение препарата проводится под большим увеличением с применением сухой системы объектив 40х. Для микроскопии окрашенных препаратов биологической жидкости, мокроты, биологического материала применяется иммерсионная система объектив 100х с нанесением на предметное стекло иммерсионного масла.
Метод люминесцентной микроскопии
Люминесценция, основа многих современных методов биологических исследований, позволяет наблюдать за взаимоотношениями молекул внутри клеток.
Фактором качественной работы для всех методов люминесцентных исследований является скорость.
Основной целью современной люминесцентной микроскопии является визуализация всех измерений объекта.
Метод с большим эффектом может быть использован для ускорения диагностики ряда заболеваний.
Люминесцентная микроскопия основана на способности некоторых веществ светиться под действием коротковолновых лучей света. При этом длина волны излучаемого при люминесценции света всегда будет больше, чем длина волны света, возбуждающего люминесценцию. Так, если освещать объект синим светом, он будет испускать лучи красного, оранжевого, желтого или зеленого цвета.
Препараты для люминесцентной микроскопии окрашивают специальными светящимися люминесцентными красителями – флуорохромами. Центральная часть клеток и присутствующие в препарате посторонние микробные клетки не светятся.
Ускоренная диагностика, идентификация возбудителя, обнаружение специфических антител в биологическом материале, биологической жидкости и во внешней среде осуществляется методами МФА, МИФ с применением люминесцирующих сывороток:
- иммуноглобулины диагностические туляремийные люминесцирующие – диагностика туляремии;
- иммуноглобулины диагностические бруцеллезные люминесцирующие – диагностика бруцеллеза;
-иммуноглобулины диагностические сибиреязвенные соматические люминесцирующие – диагностика сибирской язвы;
-иммуноглобулины диагностические сибиреязвенные антиспоровые адсорбированные флуоресцирующие – диагностика сибирской язвы;
-иммуноглобулины диагностические флуоресцирующие холерные адсорбированные лошадиные – диагностика холеры;
- антигенный препарат с хантавирусным антигеном - диагностика ГЛПС;
- иммуноглобулины диагностические флуоресцирующие для быстрой диагностики гриппа, ОРВИ.
Антигены, вирусы гриппа и другие возбудители ОРВИ в инфицированных клетках по их характерной локализации выявляются в результате взаимодействия антигенов с противовирусными антителами, маркированными флуоресцеинизотиоцианатом, методом МИФ. Метод иммунофлуоресцентного анализа (МИФ) является высоко чувствительным и специфичным качественным иммунодиагностическим тестом. К числу преимуществ метода относится его исключительная простота и возможность быстрого (за 1-2 часа) анализа клинических материалов с распознаванием широкого круга возбудителей, включая вирусы гриппа, парагриппа, респираторно-синцитиальный вирус, коронавирусы, аденовирусы, вирусы герпеса.
Общий метод: наблюдение. Частный метод: микроскопирование.
Christine E. Farrar, Zac H. Forsman, Ruth D. Gates, Jo-Ann C. Leong, and Robert J. Toonen, Hawai'i Institute of Marine Biology at the University of Hawai'i, Manoa
No dyes or digital software produced the brilliant color of these corals—the glory is all their own. Fluorescent molecules, innate to the corals and to the red algae that live inside and nourish them, shine like Christmas lights under different wavelengths of light emitted by a confocal microscope.
When she saw the corals under the lens for the first time, "my jaw just dropped," says Ruth Gates, a coral biologist at the University of Hawai'i, Manoa, and the narrator of the video. "Most people think corals are inanimate rocks," she says. "We showcase how beautiful and dynamic they are as animals." In the video, which compiles the images into three-dimensional, time-lapse animations, corals extend and retract their glowing tentacles. Tiny creatures crawl over the corals, all part of a complex and threatened ecosystem. In the future, Gates says, it might be possible to use confocal microscopy to classify different coral species or diagnose coral disease by their fluorescent patterns. Prior to applying this technique, she says, "that was not even a facet in our thinking about coral biology."
Читайте также:

