Конкурентное и неконкурентное ингибирование ферментов план урока
Обновлено: 28.06.2024
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Учитель: Павленко Алена Анатольевна
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу)
10.1.2.1 исследовать воздействия различных условий (температуры, pH , концентрации субстрата, ингибитора) на активность ферментов
сформировать знания о влиянии температуры, рН среды, концентрации фермента и субстрата, ингибиторов и активаторов на скорость ферментативных реакции
Умеет составлять планирование эксперимента
Умеет сформулировать правила техники безопасности при проведении исследования
Полезные выражения для диалогов и письма:
Я думаю, что этапами моего исследования будут…
Основанием для того, чтобы говорить так, служит то, что .
Это объясняется тем, что .
Мое объяснение …заключается в том, что
Учащиеся могут:
Обсуждать в устной и в письменной форме этапы планирования своего исследования.
Излагать свои идеи в виде схемы на плакате.
Обучение на протяжении всей жизни, умение применить свои знания в жизни. Развитие таких качеств как толерантность, сотрудничество через групповую работу на уроке.
Физика, химия: понимание явления диффузии основано на знаниях о молекулярном строении вещества.
Умение работать с интернет-ресурсами, с информацией, видеоматериалом
Запланированные этапы урока
Запланированная деятельность на уроке
Проверка готовности учащихся к уроку.
Мозговой штурм.
Что такое ферменты?
- Какое строение имеет молекула фермента?
-Перечислите свойства ферментов?
- Что такое специфичность действия ферментов и чем она объясняется?
- Что такое денатурация?
- Какова роль ферментов в клетке?
- Почему И.П.Павлов назвал ферменты возбудителями жизни?
- Какими способами клетка может управлять скоростями протекающих в ней процессов?
II. Пробуждение интереса. Парная работа. Данный вид деятельности позволяет учащимся продемонстрировать навыки умения планировать свою деятельность.
Учащиеся по выбору составляют план:
Путешествие на море
Оказания помощи пожилым людям
По завершению планирования учащиеся называют этапы своего планирования в виде вопросов. Класс обсуждает результаты, составляя на доске этапы планирования своей деятельности.
III. Групповая работа.
акторы, влияющие на скорость ферментативных реакций
1. Влияние температуры на скорость ферментативных реакций

Ответьте на вопросы:
1. Как изменяется скорость реакции в пределах от 0-40̊ С и почему?
2. Почему при высоких температурах ферментативные реакции останавливаются?
3. Почему при низких температурах скорость ферментативных реакций мала?
4. Какая температура является оптимальной и почему?
2. Влияние рН среды на скорость ферментативных реакций
Ответьте на вопросы:
Как зависит активность фермента от рН среды? Почему ферменты работают в основном в среде, близкой к нейтральной, а не в сильно кислых или щелочных средах?
2. Как будет выглядеть график скорости реакции для фермента желудочного сока-пепсина? (нарисовать в тетради)
3. Влияние концентрации фермента и субстрата


Ответьте на вопросы:
Опишите по графикам зависимость скорости реакции от концентрации фермента (рис.1) и субстрата (рис.2).
Почему при повышении концентрации субстрата скорость реакции возрастает до определенной величины, а далее остается неизменной?
4. Влияние ингибиторов и активаторов ферментов
Конкурентное ингибирование
В этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом . Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом ( ES на рисунке).
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Неконкурентное ингибирование
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Бесконкурентное ингибирование
При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Необратимое ингибирование
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае обратимого ингибирования
Аллостерическое ингибирование
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности.
Ответьте на вопросы:
Как влияют ингибиторы на активность ферментов?
Какие виды ингибирования существуют?
Опишите механизм действия каждого из них. В чем отличие их воздействия на фермент?
Какие вещества называются активаторами предложенного перечня соответствующие правила техники безопасности необходимые для конкретного эксперимента.
В конце урока учащиеся проводят рефлексию:
- что узнал, чему научился?
- что осталось непонятным ?
- над чем необходимо работать?
Где возможно учащиеся могут оценить свою работу и работу своих одноклассников по определенным критериям.

- Что такое специфичность действия ферментов и чем она объясняется?
- Что такое денатурация?
- Какова роль ферментов в клетке?
- Почему И.П.Павлов назвал ферменты возбудителями жизни?
- Какими способами клетка может управлять скоростями протекающих в ней процессов?
Цель сегодняшнего урока – изучить факторы, влияющие на скорость ферментативных реакций.
Отвечают на вопросы учителя.
Учащиеся отвечают на вопрос
Записывают тему урока в тетрадь.
3. Изучение нового материала
-Учитель организует работу по группам с раздаточным материалом.
-Предлагает рассмотреть графики зависимости скорости ферментативных реакций от различных факторов и ответить на вопросы (Приложение А).
Учащиеся работают материалом Приложения А. Переносят графики в тетрадь. Отвечают на предложенные вопросы в тетради. В случае затруднения при ответах на вопросы они могут обратиться к материалам в Приложении Б.
4. Осознание и осмысление учебной информации
Организует работу по обсуждению самостоятельной работы по вопросам Приложения А.
Участвуют в обсуждении, отвечают на вопросы.
5. Первичное закрепление учебного материала
Предлагает ответить на вопросы (Приложение В).
Принимают участие в обсуждении, отвечают на вопросы
6. Рефлексия (подведение итогов урока)
Просит высказывает собственное суждение об успешных достижениях на учебном занятии.
Высказывают собственное суждение об успешных достижениях на учебном занятии.
Каталитическая активность ферментов обусловлена конформацией белковой молекулы. Зависит от температуры, рН среды, концентрация фермента и субстрата. Кроме того, на активность ферментов оказывают влияние различные химические вещества: активаторы и ингибиторы.
Знания о зависимости скорости ферментативных реакций от различных факторов можно использовать в медицине, фармакологии и практической деятельности человека.
7. Информация о домашнем задании
1) Изучить текст §4 учебника и записи в тетради
- Какими способами организм человека может регулировать скорость химических реакций, протекающих в ней?
Записывают домашнее задание
ПРИЛОЖЕНИЕ А
Факторы, влияющие на скорость ферментативных реакций
1. Влияние температуры на скорость ферментативных реакций

Ответьте на вопросы:
1. Как изменяется скорость реакции в пределах от 0-40̊ С и почему?
2. Почему при высоких температурах ферментативные реакции останавливаются?
3. Почему при низких температурах скорость ферментативных реакций мала?
4. Какая температура является оптимальной и почему?
2. Влияние рН среды на скорость ферментативных реакций

Ответьте на вопросы:
Как зависит активность фермента от рН среды? Почему ферменты работают в основном в среде, близкой к нейтральной, а не в сильно кислых или щелочных средах?
2. Как будет выглядеть график скорости реакции для фермента желудочного сока-пепсина? (нарисовать в тетради)
3. Влияние концентрации фермента и субстрата


Ответьте на вопросы:
Опишите по графикам зависимость скорости реакции от концентрации фермента (рис.1) и субстрата (рис.2).
Почему при повышении концентрации субстрата скорость реакции возрастает до определенной величины, а далее остается неизменной?
4. Влияние ингибиторов и активаторов ферментов

В этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом. Таким образом, конкурентный ингибитор не связывается с фермент-субстратным комплексом (ES на рисунке).
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.

При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.
Необратимое ингибирование
Формирование стабильного комплекса ингибитора с ферментом, ведущее к его необратимой инактивации. Случай необратимого ингибирования можно обнаружить по тому признаку, что при разбавлении раствора не происходит повышения удельной активности фермента, как в случае обратимого ингибирования
Аллостерическое ингибирование
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности.
Ответьте на вопросы:
Как влияют ингибиторы на активность ферментов?
Какие виды ингибирования существуют?
Опишите механизм действия каждого из них. В чем отличие их воздействия на фермент?
Какие вещества называются активаторами? Опишите механизм действия активатора на фермент.
Приложение Б
В некотором ограниченном интервале температур скорость ферментативной реакции повышается с ростом температуры. В пределах от 0-40°С скорость ферментативной реакции удваивается при повышении температуры на каждые 10ºС. С повышением температуры движение молекул ускоряется, и у молекул реагирующих веществ оказывается больше шансов столкнуться друг с другом. Следовательно, и вероятность того, что реакция между ними произойдет, увеличивается. Температура, обеспечивающая наибольшую активность, называется оптимальной. Для большинства ферментов оптимальная температура равна той температуре, при которой они в норме находятся клетке (от 25 до 40°С).
При дальнейшем повышении температуры кинетическая энергия молекулы фермента становится достаточной для разрыва связей, поддерживающих вторичную и третичную структуру молекул фермента. (Как называется это явление?) Это сопровождается потерей каталитической активности.
Когда температура приближается к точке замерзания, ферменты инактивируются, но денатурация при этом не происходит. С повышением температуры их каталитическая активность восстанавливается.
На активность фермента и скорость реакции влияют различные концентрации ионов Н + и ОН - , т.е. рН среды. Большинство ферментов активны в узких пределах рН, чаще в нейтральной среде. Сдвиг концентрации ионов водорода может изменить электрический заряд белка фермента, что приведет к изменению конфигурации молекулы и падению активности. В первую очередь изменяется форма активного центра фермента. При слишком резких сдвигах рН фермент денатурирует, но она, как правило, в клетках обратима. Это позволяет предположить, что среда в которой находится фермент регулирует его активность.
Известно, что скорость химических реакций зависит от концентрации веществ. У ферментативных реакций есть особенность. Их скорость зависит, прежде всего от концентрации фермента. Скорость ферментативной реакции пропорциональна концентрации фермента. С возрастанием концентрации фермента растет скорость ферментативных реакций.
При определенной концентрации фермента скорость реакции возрастает с увеличением концентрации субстрата. Теоретически максимальная скорость реакции никогда не достигается, но наступает момент, когда дальнейшее увеличение концентрации субстрата не дает заметного изменения скорости реакции. При больших концентрациях субстрата активные центры молекул фермента оказываются насыщенными и молекулы субстрата могут соединиться с ферментом лишь после того, как образовавшийся ранее фермент-субстратный комплекс диссоциирует на продукт и свободный фермент.
Приложение В
Вопросы для закрепления
В настоящее время для длительного хранения пищевых продуктов широко используют такой способ как быстрое замораживание. Объясните, почему такой способ хранения продуктов эффективен?
В чем польза и вред лихорадки?
Вам даны три фермента – амилаза, пепсин и трипсин. Зная, где в пищеварительном тракте находятся эти ферменты, нарисуйте графики, которые соответствуют их активности каждого из ферментов.
Изобразите схемой причину потери активности фермента при изменении рН среды.
Во время второй мировой войны для борьбы с инфекционными заболеваниями широко использовали сульфаниламидные препараты. Известно, что в присутствии этих лекарств микроб не может синтезировать необходимые ему вещества из парааминобензойной кислоты. Как вы думаете почему?
Конкурентное ингибирование. Неконкурентное обратимое ингибирование.
В этом случае вещество, близкое по своей структуре к обычному субстрату фермента, соединяется с активным центром фермента, но не может прореагировать с ним. Находясь здесь, оно преграждает доступ к активному центру любой молекуле настоящего субстрата.
Поскольку в этом случае ингибитор и субстрат конкурируют за место на активном центре фермента, эту форму ингибирования называют конкурентным ингиЖированием. Для конкурентного ингибирования характерно, что, если концентрация субстрата увеличивается, то скорость реакции возрастает, т. е. это ингибирование обратимо.
Рисунок иллюстрирует один из примеров конкурентного ингибирования.
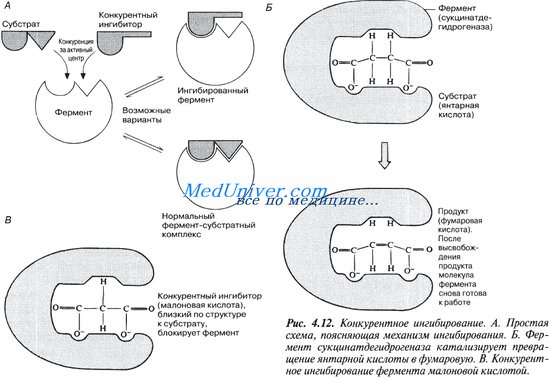
Явление конкурентного ингибирования помогает понять механизм действия некоторых лекарственных препаратов, в частности сульфаниламидов. Цель химиотерапии — уничтожить при помощи тех или иных химических препаратов возбудителя болезни, не повреждая при этом ткани организма-хозяина. Первыми такими препаратами были сульфаниламиды, антибактериальное действие которых было обнаружено в 30-е годы XX в. Во время второй мировой войны их широко применяли для борьбы с раневыми инфекциями. Сульфаниламиды по своей химической природе близки к парааминобензойной кислоте (ПАБК) — необходимому фактору роста многих патогенных бактерий. ПАБК требуется бактериям для синтеза фолиевой кислоты, которая служит у них одним из кофакторов ферментов. Сульфаниламиды ингибируют один из ферментов, участвующих в синтезе фолиевой кислоты из ПАБК.
Животные клетки нечувствительны к сульфаниламидам, хотя им для некоторых реакций и требуется фолиевая кислота. Объясняется это тем, что они используют уже образованную фолиевую кислоту; метаболический путь, который бы обеспечивал ее синтез, у них отсутствует.
Неконкурентное обратимое ингибирование
Ингибиторы этого типа не родственны по своей структуре субстрату данного фермента; в образовании комплекса с ингибитором участвует в этом случае не активный центр фермента, а какая-нибудь другая часть его молекулы. Это не препятствует соединению субстрата с ферментом, но делает невозможным катализ.
С повышением концентрации ингибитора скорость реакции все более снижается. К моменту насыщения ингибитором она оказывается практически равной нулю. В отличие от конкурентного инги-бирования в этом случае повышение концентрации субстрата на скорость реакции не влияет.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Биологические катализаторы"
Начнём с цитаты известного советского химика и инженера, академика Георгия Константиновича Борескова:
Неуютная картина, не правда ли? Поэтому сегодняшняя наша цель – разобраться, почему же Земля всё-таки выглядит более привычно для нашего глаза.

Для протекания многих химических реакций необходимы специальные условия. Чаще всего на скорость реакций влияют температура и давление. Чем они выше, тем быстрее протекает химическая реакция. Но её скорость можно увеличить, не изменяя внешних условий, а просто добавив к реагирующей смеси определённые вещества. Так, металлический родий почти в 10000 раз ускоряет разложение муравьиной кислоты на углекислый газ и водород. Такие вещества, увеличивающие скорость реакции, но не входящие в состав продуктов реакции, называются катализаторами.
В клетках живых организмов каждую секунду происходят тысячи химических реакций.
И это несмотря на то, что в живой клетке умеренная температура и нормальное давление. Например, бактерии из рода Азотобактер могут при обычных условиях разрывать прочнейшую молекулу азота, где атомы соединены тремя ковалентными связями и присоединять их к водороду. А для того, чтобы проделать то же самое человеку в промышленности, необходимо создать давление в 350 раз большее, чем на поверхности Земли и поднять температуру до 500 градусов Цельсия.
Естественно, бактерии не обходятся при этом без катализаторов. Кстати, люди также пытались применить их при получении аммиака. Перепробовав при этом более 20000 различных веществ.
Что же за всесильные вещества – эти катализаторы?
Катализаторами химических реакций в неживой природе могут быть самые различные вещества. Это и уже упомянутый нами экзотический родий, который используется для изготовления зеркал супермощных лазеров и обычный оксид марганца, применяемый для получения кислорода даже в школьной лаборатории.
Кроме того, неорганические катализаторы могут ускорять реакции с разными веществами. Например, родий не только эффективно разлагает муравьиную кислоту, но и борется с выбросами вредных оксидов азота в автомобильных катализаторах.
Другое дело – биологические, а значит, органические катализаторы. На них мы остановимся более подробно.
Многочисленные исследования прошлого нашей планеты говорят о том, что на начальном этапе зарождения жизни каталитической способностью обладали некоторые молекулы рибонуклеиновых кислот.

И тогда это свойство РНК имело очень важное значение. Сегодня же роль молекул РНК как катализаторов крайне мала. А основными биокатализаторами в клетке являются ферменты. Которых уже к 2013 году было описано более пяти тысяч видов.
Абсолютно все процессы в живом организме прямо или косвенно осуществляются с участием ферментов или энзимов, как их ещё называют. Это и фиксация углерода в процессе фотосинтеза, и расщепление питательных веществ в пищеварительном тракте, и синтез источника энергии для всех живых организмов – АТФ, и многое –многое другое.
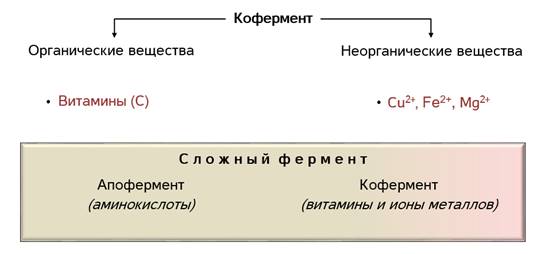
Как вы помните, по химической природе биологические катализаторы относятся к белкам. Они могут быть как простыми, состоящими только из аминокислот, так и сложными, включающими белок и небелковую часть – простетическую группу. Простетическая группа фермента называется кофермент, а белковая часть – апофермент.
В роли коферментов выступают органические и неорганические вещества. Среди органических это могут быть витамины, например, аскорбиновая кислота. А из неорганических – ионы различных металлов. Например, ионы меди, железа, магния.
Ферменты ускоряют химические реакции за счёт тесного взаимодействия с молекулами исходных реагирующих веществ – так называемых субстратов. Зачастую размеры молекул субстратов значительно меньше размеров молекул самих ферментов, хотя, казалось бы, должно быть наоборот. Поэтому с субстратом или субстратами, потому что их может быть несколько, взаимодействует не вся молекула фермента, а лишь небольшой её участок – активный центр фермента. Построен он чаще всего из нескольких аминокислотных остатков, которые образуют его уникальную структуру. Почему уникальную? Дело в том, что форма и химическое строение активного центра таковы, что с ним могут связываться только те субстраты, структура которых подходит к структуре активного центра.
Магия этого процесса неизвестна до сих пор. Несмотря на то, что человечество в ближайшее время планирует полёты на Марс, оно не в состоянии разобраться со своим организмом. Но существует теория. Её выдвинул ещё в 1890 году немецкий химик Эмиль Фишер.
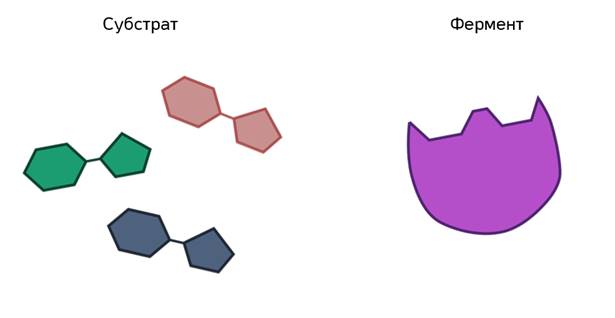
В этом комплексе молекула субстрата деформируется и в её структуре ослабляются определённые химические связи. Что приводит к облегчённому их разрыву и в конечном итоге к ускорению химической реакции.
После этого фермент-субстратный комплекс распадается на конечные продукты и свободный фермент, а активный центр последнего тут же готов принимать новые молекулы субстрата. Получаем такой же итог, как и в случае работы обычных химических катализаторов – скорость реакции увеличивается, а сам катализатор при этом не расходуется и может использоваться многократно.
Но в самом механизме работы органических и неорганических катализаторов есть кардинальное отличие. Каждый фермент действует только на определённый тип связи и ускоряет только одну определённую реакцию. То есть обладает специфичностью. Как вы поняли, специфичность объясняется соответствием активного центра только определённым субстратам. Поэтому, например, фермент мальтаза, разлагающий дисахарид мальтозу до двух молекул глюкозы оказывается не способным разрушать молекулы сахарозы. Несмотря на то, что сахароза также является дисахаридом.
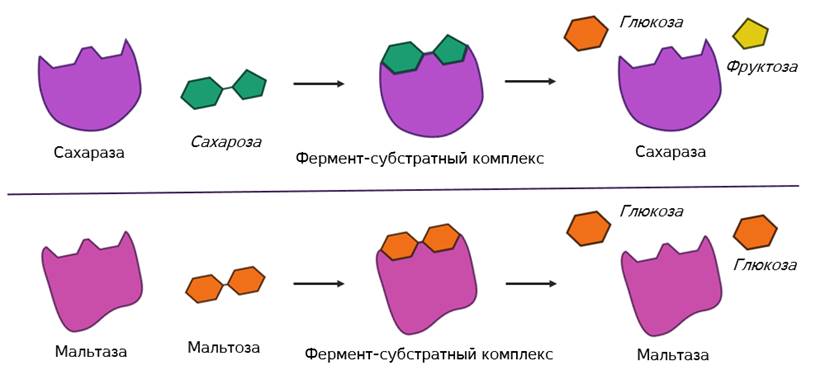
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Например, в желудке человека соляная кислота активирует фермент пепсин. Максимальная активность которого лежит в пределах рН от полутора до двух.
Ингибирование ферментов может быть обратимым и необратимым. Если вещество-ингибитор вызывает стойкое изменение пространственной структуры фермента, то такое ингибирование будет необратимым.
А вот обратимое ингибирование, в свою очередь, бывает двух типов. Давайте их рассмотрим.
С активным центром фермента могут связываться вещества, сходные по структуре с субстратом. Никакой реакции при этом нет, но между ингибиторами и субстратом происходит конкуренция за активный центр. Поэтому такой тип ингибирования называется конкурентным.
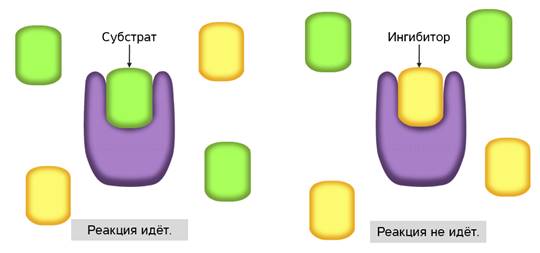
Конкурентное ингибирование широко используется в медицине. Антибиотики, противоопухолевые препараты, используемые в качестве лекарственных средств, являются конкурентными ингибиторами.
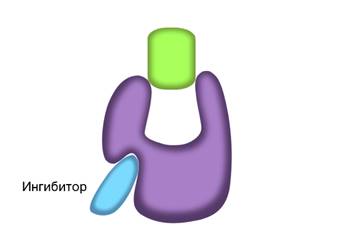
В неконкурентном ингибировании не участвуют вещества, сходные с субстратом. При таком типе ингибирования, молекулы ингибиторов присоединяются к регуляторному центру фермента. Это вызывает изменение пространственной структуры активного центра, что препятствует присоединению к нему молекул субстрата. Тем самым снижается скорость ферментативной реакции.
Уникальные способности ферментов уже много лет используются человеком в хозяйственной деятельности. В настоящее время развивается новая отрасль науки – промышленная энзимология. Которая, в свою очередь, является основой биотехнологии.
Мы уже упоминали об использовании ферментов в медицине. Фармацевтическая промышленность научилась производить искусственный аналог гормона надпочечников кортизола – преднизолон. Который используется при лечении ревматоидного артрита.
Широкое применение ферменты-энзимы находят также в пищевой промышленности. Их применяют в производстве сыров, соков, овощных и фруктовых пюре. Не обходится без применения ферментов хлебопечение, производство алкогольных напитков. Для улучшения вкуса, аромата и консистенции их применяют для обработки мяса.
В текстильной и кожевенной промышленности ферменты позволяют значительно увеличить выход овчины, а обработка кожи перед дублением делает её поверхность чистой, гладкой и тонкой.
Перспективным является применение ферментов, разлагающих целлюлозу. В результате этого из древесины, торфа, сельскохозяйственных и городских отходов можно получить ценные биотехнологические продукты: глюкозу, этанол, ацетон и другие. Особую актуальность это имеет в наши дни, когда проблема загрязнения окружающей среды выходит на передний план.
Читайте также:

