Какую роль в составе фермента играют коферменты какие вещества в организме являются их кратко
Обновлено: 06.07.2024
В настоящее время подробно изучено около 2000 ферментов. Как и белки, ферменты имеют сложную пространственную третичную и четвертичную структуру. Нативная (природная) структурная организация ферментов обеспечивает их каталитическую функцию. Нарушение ее под воздействием различных факторов приводит к потере активности ферментов.
Ферменты подразделяют на простые и сложные. Простые ферменты состоят только из белка. Это многие ферменты пищеварительного тракта — амилаза, пепсин, трипсин. Сложные ферменты состоят из белковой части, которая называется апоферментом, и небелковой, которая называется кофактором. Молекулу сложного фермента часто называют холоферментом. Кофакторы, которые слабо связаны с белковой частью фермента, называются коферментами (коэнзимами). Кофермент может легко переходить от одного фермента к другому. Кофакторы, прочно связанные с белковой частью фермента, называются простетической группой. Кофакторами могут быть различные органические вещества и их комплексы, а также минеральные вещества. Многие из них термостабильны, но могут окисляться атмосферным кислородом. В организме человека ряд кофакторов не синтезируется, а поступает с продуктами питания. Их строение и участие в биологических процессах рассмотрено далее.
В проявлении каталитической активности фермента принимает участие не вся его молекула, а только незначительная часть, которая называется активным центром. Активный центр — это часть молекулы фермента, которая взаимодействует с коферментом и субстратом и участвует в преобразовании вещества. Активный центр ферментов может быть образован несколькими функциональными группами отдельных аминокислот, расположенными в различных участках полипептидной цепи белка. Поэтому для проявления каталитической активности фермента важна его нативная структурная организация. При нарушении этой структуры изменяется активный центр, а значит, и активность фермента. Существуют ферменты, которые состоят из нескольких белковых молекул, т. е. имеют субъединичное строение. Они могут иметь несколько активных центров или единый центр, образованный при взаимодействии этих субъединиц.
Кофакторы. Каталитическая активность сложных ферментов проявляется только в присутствии коферментов:
Кофермент участвует в формировании активного центра фермента. Многие коферменты имеют сложное строение и включают витамины. Таким образом, регуляторное влияние витаминов на обмен веществ опосредовано через ферменты.
Исходя из особенностей строения коферменты разделяют на две большие группы — витаминосодержащие и невитаминные Отдельные коферменты входят в состав продуктов повышенной биологической ценности, которые используются в практике спорта для улучшения механизмов энергообразования, ускорения процессов восстановления, специфического построения конституции тела, поэтому остановимся более подробно на их характеристике.
Витаминосодержащие коферменты — никотинамидные, флавиновые, кофермент ацетилирования, тиаминпирофосфат, пиридоксалевые, кобаламидные и др. — различаются строением и выполняемыми функциями.
Никотинамидные коферменты (НАД и НАДФ) в своем составе содержат витамин РР (никотинамид), флавиновые (ФМН и ФАД) — витамин В2 (рибофлавин). Это кофакторы ферментов дегидрогеназ, катализирующих процессы биологического окисления питательных веществ. Они играют роль акцепторов и переносчиков водорода:
Кофермент ацетилирования (KoA-SH) содержит витамин В3 (пантотеновую кислоту), а также нуклеотид (АДФ) и р-меркаптоэтанол, содержащий SH-rpynny. Этот кофермент играет важную роль в обмене углеводов, липидов и белков. Он входит в состав ферментов, катализирующих пере-нос ацетильных остатков (СН3-СО-) в процессе распада углеводов и жир-ных кислот, а также синтеза жирных кислот, стероидов, ацетилхолина, превращения аминокислот.
Тиаминпирофосфатный кофермент (ТПФ) содержит витамин В, (тиа-мин). Он является коферментом ферментов, которые катализируют декарбоксилирование (-СО2) пировиноградной и других кетокислот, регулируют распад и окисление углеводов.
Пиридоксалевые и кобаламидные коферменты являются производными витамина В6 (пиридоксальфосфата) и витамина В12 (цианкобаламина) соответственно. Они входят в состав ферментов, которые катализируют превращение аминокислот и азотистых оснований, ускоряют процесс синтеза нуклеиновых кислот и белков.

Биотин (витамин Н) является простетической группой фермента ацетил-КоА-карбоксилазы, которая участвует в биосинтезе жирных кислот. Белок авидин, который находится в куриных яйцах, способен связываться с биотином и ингибировать этот фермент.
Убихиноновые коферменты (коферменты Q) являются производными жирорастворимых витаминов К и Е. Они участвуют в процессах тканевого дыхания и энергообразования.
Невитаминными кофакторами могут быть нуклеотиды (АТФ, ГТФ, ИТф, УДФ, ЦДФ), гемсодержащие соединения, пептиды и многие металлы. Нуклеотиды и ионы металлов помогают ферменту или субстрату принять форму, необходимую для их взаимодействия. Гем является простетической группой цитохромов (компонентов дыхательной цепи), каталазы и других ферментов.
В настоящее время подробно изучено около 2000 ферментов. Как и белки, ферменты имеют сложную пространственную третичную и четвертичную структуру. Нативная (природная) структурная организация ферментов обеспечивает их каталитическую функцию. Нарушение ее под воздействием различных факторов приводит к потере активности ферментов.
Ферменты подразделяют на простые и сложные. Простые ферменты состоят только из белка. Это многие ферменты пищеварительного тракта — амилаза, пепсин, трипсин. Сложные ферменты состоят из белковой части, которая называется апоферментом, и небелковой, которая называется кофактором. Молекулу сложного фермента часто называют холоферментом. Кофакторы, которые слабо связаны с белковой частью фермента, называются коферментами (коэнзимами). Кофермент может легко переходить от одного фермента к другому. Кофакторы, прочно связанные с белковой частью фермента, называются простетической группой. Кофакторами могут быть различные органические вещества и их комплексы, а также минеральные вещества. Многие из них термостабильны, но могут окисляться атмосферным кислородом. В организме человека ряд кофакторов не синтезируется, а поступает с продуктами питания. Их строение и участие в биологических процессах рассмотрено далее.
В проявлении каталитической активности фермента принимает участие не вся его молекула, а только незначительная часть, которая называется активным центром. Активный центр — это часть молекулы фермента, которая взаимодействует с коферментом и субстратом и участвует в преобразовании вещества. Активный центр ферментов может быть образован несколькими функциональными группами отдельных аминокислот, расположенными в различных участках полипептидной цепи белка. Поэтому для проявления каталитической активности фермента важна его нативная структурная организация. При нарушении этой структуры изменяется активный центр, а значит, и активность фермента. Существуют ферменты, которые состоят из нескольких белковых молекул, т. е. имеют субъединичное строение. Они могут иметь несколько активных центров или единый центр, образованный при взаимодействии этих субъединиц.
Кофакторы. Каталитическая активность сложных ферментов проявляется только в присутствии коферментов:
Кофермент участвует в формировании активного центра фермента. Многие коферменты имеют сложное строение и включают витамины. Таким образом, регуляторное влияние витаминов на обмен веществ опосредовано через ферменты.
Исходя из особенностей строения коферменты разделяют на две большие группы — витаминосодержащие и невитаминные Отдельные коферменты входят в состав продуктов повышенной биологической ценности, которые используются в практике спорта для улучшения механизмов энергообразования, ускорения процессов восстановления, специфического построения конституции тела, поэтому остановимся более подробно на их характеристике.
Витаминосодержащие коферменты — никотинамидные, флавиновые, кофермент ацетилирования, тиаминпирофосфат, пиридоксалевые, кобаламидные и др. — различаются строением и выполняемыми функциями.
Никотинамидные коферменты (НАД и НАДФ) в своем составе содержат витамин РР (никотинамид), флавиновые (ФМН и ФАД) — витамин В2 (рибофлавин). Это кофакторы ферментов дегидрогеназ, катализирующих процессы биологического окисления питательных веществ. Они играют роль акцепторов и переносчиков водорода:
Кофермент ацетилирования (KoA-SH) содержит витамин В3 (пантотеновую кислоту), а также нуклеотид (АДФ) и р-меркаптоэтанол, содержащий SH-rpynny. Этот кофермент играет важную роль в обмене углеводов, липидов и белков. Он входит в состав ферментов, катализирующих пере-нос ацетильных остатков (СН3-СО-) в процессе распада углеводов и жир-ных кислот, а также синтеза жирных кислот, стероидов, ацетилхолина, превращения аминокислот.
Тиаминпирофосфатный кофермент (ТПФ) содержит витамин В, (тиа-мин). Он является коферментом ферментов, которые катализируют декарбоксилирование (-СО2) пировиноградной и других кетокислот, регулируют распад и окисление углеводов.
Пиридоксалевые и кобаламидные коферменты являются производными витамина В6 (пиридоксальфосфата) и витамина В12 (цианкобаламина) соответственно. Они входят в состав ферментов, которые катализируют превращение аминокислот и азотистых оснований, ускоряют процесс синтеза нуклеиновых кислот и белков.
Биотин (витамин Н) является простетической группой фермента ацетил-КоА-карбоксилазы, которая участвует в биосинтезе жирных кислот. Белок авидин, который находится в куриных яйцах, способен связываться с биотином и ингибировать этот фермент.
Убихиноновые коферменты (коферменты Q) являются производными жирорастворимых витаминов К и Е. Они участвуют в процессах тканевого дыхания и энергообразования.
Невитаминными кофакторами могут быть нуклеотиды (АТФ, ГТФ, ИТф, УДФ, ЦДФ), гемсодержащие соединения, пептиды и многие металлы. Нуклеотиды и ионы металлов помогают ферменту или субстрату принять форму, необходимую для их взаимодействия. Гем является простетической группой цитохромов (компонентов дыхательной цепи), каталазы и других ферментов.

Рис. 1 — Брожение с использованием дрожжей – типичный пример ферментативной реакции
Человечество давно пользуется полезными свойствами этих ферментов. Например, уже много веков из молока с помощью сычужного фермента делают сыр.
Ферменты отличаются от катализаторов тем, что действуют в живом организме, тогда как катализаторы – в неживой природе. Отрасль биохимии, которая изучает эти важнейшие для жизни вещества, называется энзимологией.
Общие свойства ферментов
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию. Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры.
Основные свойства ферментов:
- специфичность: способность фермента действовать только на специфический субстрат, например, липазы – на жиры;
- каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
- способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Классификация
В зависимости от роли в химических реакциях, различаются такие классы ферментов:
Классы
Особенности
Катализируют окисление своих субстратов, перенося электроны или атомы водорода
Участвуют в переносе химических групп из одного вещества в другое
Расщепляют крупные молекулы на более мелкие, добавляя к ним молекулы воды
Катализируют расщепление молекулярных связей без процесса гидролиза
Активируют перестановку атомов в молекуле
Образуют связи с атомами углерода, используя энергию АТФ.
В живом организме все ферменты делятся на внутри- и внеклеточные. К внутриклеточным относятся, например, ферменты печени, участвующие в реакциях обезвреживания различных веществ, поступающих с кровью. Они обнаруживаются в крови при повреждении органа, что помогает в диагностике его заболеваний.
Внутриклеточные ферменты, которые являются маркерами повреждения внутренних органов:
- печень – аланинаминотрансефраза, аспартатаминотрансфераза, гамма-глютамилтранспептидаза, сорбитдегидрогеназа;
- почки – щелочная фосфатаза;
- предстательная железа – кислая фосфатаза;
- сердечная мышца – лактатдегидрогеназа
Внеклеточные ферменты выделяются железами во внешнюю среду. Основные из них секретируются клетками слюнных желез, желудочной стенки, поджелудочной железы, кишечника и активно участвуют в пищеварении.
Пищеварительные ферменты
Пищеварительные ферменты – это белки, которые ускоряют расщепление крупных молекул, входящих в состав пищи. Они разделяют такие молекулы на более мелкие фрагменты, которые легче усваиваются клетками. Основные типы пищеварительных ферментов – протеазы, липазы, амилазы.
При ферментативном расщеплении питательных веществ выделяется энергия, которая расходуется для процессов обмена веществ и жизнедеятельности. Без участия ферментов, подобные процессы происходили бы слишком медленно, не обеспечивая организм достаточным энергетическим запасом.
Кроме того, участие ферментов в процессе пищеварения обеспечивает распад питательных веществ до молекул, способных проходить через клетки кишечной стенки и поступать в кровь.
Амилаза
Амилаза вырабатывается слюнными железами. Она действует на крахмал пищи, состоящий из длинной цепи молекул глюкозы. В результате действия этого фермента образуются участки, состоящие из двух соединенных молекул глюкозы, то есть фруктоза, и другие короткоцепочечные углеводы. В дальнейшем они метаболизируются до глюкозы в кишечнике и оттуда всасываются в кровь.
Слюнные железы расщепляют только часть крахмала. Амилаза слюны активна в течение короткого времени, пока пища прожевывается. После попадания в желудок фермент инактивируется его кислым содержимым. Большая часть крахмала расщепляется уже в 12-перстной кишке под действием панкреатической амилазы, вырабатываемой поджелудочной железой.
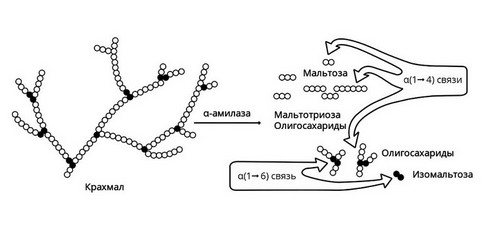
Рис. 2 — Амилаза начинает расщепление крахмала
Короткие углеводы, образовавшиеся под действием панкреатической амилазы, попадают в тонкий кишечник. Здесь с помощью мальтазы, лактазы, сахаразы, декстриназы они расщепляются до молекул глюкозы. Нерасщепляющаяся ферментами клетчатка выводится из кишечника с каловыми массами.
Протеазы
Белки или протеины - существенная часть человеческого рациона. Для их расщепления необходимы ферменты – протеазы. Они различаются по месту синтеза, субстратам и другим характеристикам. Некоторые из них активны в желудке, например, пепсин. Другие вырабатываются поджелудочной железой и активны в просвете кишечника. В самой железе выделяется неактивный предшественник фермента – химотрипсиноген, который начинает действовать только после смешивания с кислым пищевым содержимым, превращаясь в химотрипсин. Такой механизм помогает избежать самоповреждения протеазами клеток поджелудочной железы.
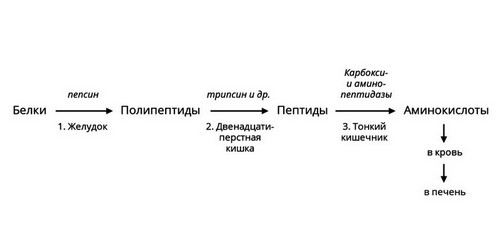
Рис. 3 — Ферментативное расщепление белков
Протеазы расщепляют пищевые белки на более мелкие фрагменты – полипептиды. Ферменты – пептидазы разрушают их до аминокислот, которые усваиваются в кишечнике.
Липазы
Пищевые жиры разрушаются ферментами-липазами, которые также вырабатываются поджелудочной железой. Они расщепляют молекулы жира на жирные кислоты и глицерин. Такая реакция требует наличия в просвете 12-перстной кишки желчи, образующейся в печени.
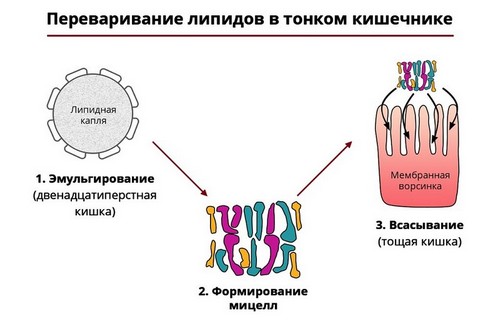
Рис. 4 — Ферментативный гидролиз жиров
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Показания для использования этого лекарства:
- хронический панкреатит, муковисцидоз и другие причины недостаточной секреции ферментов поджелудочной железы;
- воспалительные заболевания печени, желудка, кишечника, особенно после операций на них, для более быстрого восстановления пищеварительной системы;
- погрешности в питании;
- нарушение функции жевания, например, при стоматологических заболеваниях или малоподвижности пациента.
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике. Это особенно важно для детей, страдающих муковисцидозом.
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом.
Метаболизм является основой всей жизнедеятельности организмов, а обмен веществ неотделим от катализа ферментов. Ферменты — это каталитически активные организмы, продуцируемые живыми клетками. По сути, подавляющее большинство ферментов — это белки, некоторые — РНК, то есть рибонуклеиновая кислота, носитель генетической информации.
Белки с ферментативной активностью подразделяются на простые белки и связывающие белки. Простые белковые ферменты состоят из аминокислот и не содержат других веществ (таких как пепсин). Белковые ферменты состоят из простых белков и кофакторов, таких как лактатдегидрогеназа, трансаминаза и так далее. Простая белковая часть, из которой состоит фермент, называется ферментным белком или основным ферментом, а простетическая часть называется коферментами. Связывающий фермент обычно представляет собой комбинацию первичного фермента и кофермента и становится целым ферментом, который функционирует как фермент.
Роль ферментов в организме
В организме содержится множество ферментов, которые контролируют многие метаболические процессы: метаболизм, питание и преобразование биоэнергии. Большинство реакций, тесно связанных с жизненными процессами, являются реакциями, катализируемыми ферментами.
Роль ферментов в катализе
Самая важная роль фермента — катализ. Он позволяет упорядоченно осуществлять сложный метаболизм веществ в клетках, адаптируя метаболизм веществ к нормальным физиологическим функциям. Если дефицит или активность фермента ослаблены из-за генетических дефектов или по другим причинам, каталитическая реакция фермента может быть ненормальной, что приведет к нарушению метаболизма вещества или даже к заболеванию.
Каталитический механизм фермента в основном включает кислотно-основной катализ и ковалентный катализ. Кислотно-основной катализ относится к каталитическому действию переноса протона для ускорения реакции. Ковалентный катализ означает, что субстрат или часть субстрата образует ковалентную связь с катализатором и затем переносится на второй субстрат. Многие реакции переноса группы, катализируемые ферментами, осуществляются путем ковалентного катализа.
В организме человека имеется большое количество ферментов, которые сложны по структуре и разнообразны. Например, когда люди жуют рис и приготовленные на пару булочки, то чем дольше они жуют, тем слаще вкус. Это обьясняется следующим образом: крахмал в рисе гидролизуется до мальтозы под действием амилазы слюны, секретируемой ротовой полостью.
Следовательно, люди, которые больше жуют во время еды, могут хорошо смешивать пищу и слюну, что полезно для пищеварения. Кроме того, белок, который человеческое тело принимает из пищи, должен быть гидролизован до аминокислот с помощью различных протеолитических ферментов в пищевой промышленности, таких как пепсин, а затем конкретные аминокислоты выбираются другими ферментами для восстановления необходимых белков в определенном порядке. Здесь происходит множество сложных химических реакций.
Как ферменты снижают энергию активации реакции?
Каталитический механизм фермента заключается в снижении энергии активации реакции. Химическая реакция может быть проведена, потому что часть молекул субстрата была активирована, чтобы стать активированными молекулами, и чем больше активированных молекул, тем выше скорость реакции. Комплекс фермент-субстрат реагирует с образованием продукта, высвобождая фермент, который связывается с другой молекулой субстрата и увеличивает скорость химической реакции за счет уменьшения активации реакции.
Ферменты могут ускорить химическую реакцию, но не могут изменить точку равновесия химической реакции. Это означает, что фермент способствует прямой реакции и обратной реакции в той же пропорции, поэтому роль фермента заключается в сокращении времени, необходимого для достижения равновесия.
Ферменты (энзимы) — это белковые вещества, играющие очень важную роль в различных биохимических процессах в организме. Они необходимы для переваривания пищевых продуктов, стимуляции деятельности головного мозга, процессов энергообеспечения клеток, восстановления органов и тканей. Наиболее важной функцией ферментов является ускорение и запуск биохимических реакций в организме, многие, если не большинство, из которых, идут только в присутствии соответствующих энзимов. Функция каждого из ферментов уникальна, т.е. каждый фермент активизирует только один биохимический процесс. В связи с этим в организме существует огромное количество энзимов.
В зависимости от того, какие виды реакций организма катализируют ферменты, они выполняют различные функции. Чаще всего их подразделяют на две основные группы: пищеварительные и метаболические.
Пищеварительные ферменты выделяются в желудочно-кишечном тракте, разрушают питательные вещества, способствуя их абсорбции в системный кровоток. Различают три основные категории таких ферментов: амилаза, протеазы, липаза. Амилаза расщепляет углеводы и находятся в слюне, панкреатическом секрете и в содержимом кишечника. Различные виды амилазы расщепляют различные сахара. Протеазы, находящиеся в желудочном соке, панкреатическом секрете и в содержимом кишечника, помогают переваривать белки. Липаза, находящаяся в желудочном соке и панкреатическом секрете, расщепляет жиры.
Метаболические ферменты катализируют биохимические процессы внутри клеток. Каждый орган или ткань организма имеет свою сеть ферментов.
Некоторые виды пищевых продуктов содержат ферменты. К сожалению, ферменты очень чувствительны к высокой температуре и легко разрушаются при нагревании. Для того, чтобы организм получил дополнительное количество ферментов, следует или есть продукты, содержащие их, в сыром виде или принимать биологически активные пищевые добавки с такими ферментами.
Ферментами богаты продукты растительного происхождения: авокадо, папайя, ананасы, бананы, манго, ростки.
Большинство формул биологически активных пищевых добавок содержит различные пищеварительные ферменты и получены из продуктов животного или грибкового происхождения.
Протеолитическими ферментами являются пепсин, трипсин, реннин, панкреатин и хи-мотрипсин. Помимо улучшения пищеварения, эти ферменты оказывают противовоспалительное действие. Панкреатин используют при ферментной недостаточности поджелудочной железы, муковисцидозе, нарушениях пищеварения, пищевой аллергии, аутоиммунных заболеваниях, вирусных инфекциях и спортивных травмах.
Обычно пищеварительные ферменты принимают после еды, но если вы едите продукты, прошедшие технологическую обработку или измельченные, то во время еды.
Все препараты и БАД, содержащие ферменты, следует хранить в прохладном месте. Таблетки и жидкости в холодильнике, порошок и капсулы — в сухом прохладном месте.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
Читайте также:
- Календарно тематический план в доу на неделю
- Какие ветры господствуют над индийским океаном в результате чего они образуются кратко
- Почему нельзя перебегать улицу перед близко идущим транспортом физика 7 класс кратко
- Почему история в школе такая нудная
- Информационно просветительская деятельность с родителями в доу

