Какой процесс называют кипением какова зависимость температуры кипения от давления кратко
Обновлено: 07.07.2024
Температура кипения — это температура, при которой происходит кипение жидкости, которая находится под постоянным давлением .
Температура кипения — это температура, при которой происходит кипение жидкости, которая находится под постоянным давлением. Согласно уравнению Клапейрона — Клаузиуса с ростом давления температура кипения увеличивается, а с уменьшением давления температура кипения соответственно уменьшается. Узнать как температура кипения воды будет зависеть от давления вы сможете из таблицы.
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарение и кипение.
Кипение
Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
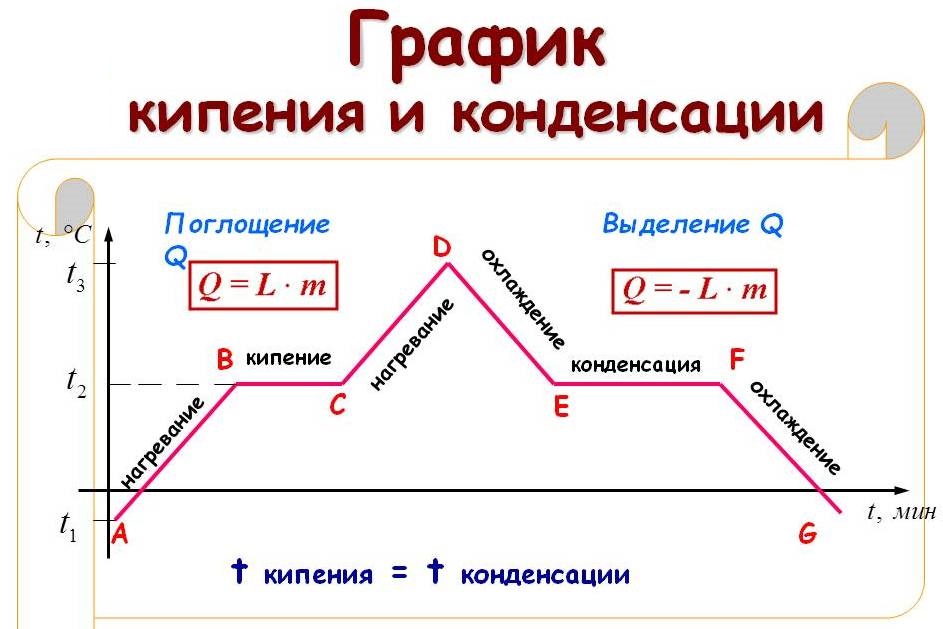
На рисунке приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АВ), кипения (ВС), нагревания пара (CD), охлаждения пара (DE), конденсации (EF) и последующего охлаждения (FG).
Удельная теплота парообразования
Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельная теплота парообразования (L) — это величина, равная отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования — [L] = Дж/кг.
Чтобы рассчитать количество теплоты Q, которое необходимо сообщить веществу массой тп для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования (L) умножить на массу вещества: Q = Lm.
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
Температура кипения воды равна 100 °C; можно подумать, что это неотъемлемое свойство воды, что вода, где бы и в каких условиях она ни находилась, всегда будет кипеть при 100 °C.
Но это не так, и об этом прекрасно осведомлены жители высокогорных селений.
В чем же тут дело? Какой физический фактор вмешивается в явление кипения? Какое значение имеет высота над уровнем моря?
Этим физическим фактором является давление, действующее на поверхность жидкости. Не нужно забираться на вершину горы, чтобы проверить справедливость сказанного.
Помещая подогреваемую воду под колокол и накачивая или выкачивая оттуда воздух, можно убедиться, что температура кипения растет при возрастании давления и падает при его уменьшении.
Вода кипит при 100 °C только при определенном давлении – 760 мм Hg.
Кривая температуры кипения в зависимости от давления показана на рис. 98. На вершине Эльбруса давление равно 0,5 атм, этому давлению и соответствует температура кипения 82 °C.

А вот водой, кипящей при 10–15 мм Нg, можно освежиться в жаркую погоду. При этом давлении температура кипения упадет до 10–15 °C.
Интересную картину можно наблюдать, если поместить открытый сосуд с водой под колокол и откачивать воздух. Откачка заставит воду закипеть, но кипение требует тепла. Взять его неоткуда, и воде придется отдать свою энергию. Температура кипящей воды начнет падать, но так как откачка продолжается, то падает и давление. Поэтому кипение не прекратится, вода будет продолжать охлаждаться и в конце концов замерзнет.
Такое кипение холодной воды происходит не только при откачке воздуха. Например, при вращении гребного корабельного винта давление в быстро движущемся около металлической поверхности слое воды сильно падает и вода в этом слое закипает, т.е. в ней появляются многочисленные наполненные паром пузырьки. Это явление называется кавитацией (от латинского слова cavitas – полость).
Снижая давление, мы понижаем температуру кипения. А увеличивая его? График, подобный нашему, отвечает на этот вопрос. Давление в 15 атм может задержать кипение воды, оно начнется только при 200 °C, а давление в 80 атм заставит воду закипеть лишь при 300 °C.
Кривая, изображающая температуру кипения в зависимости от давления, является одновременно и кривой упругости пара в зависимости от температуры.
Цифры, нанесенные на график температуры кипения (или на график упругости пара), показывают, что упругость пара меняется очень резко с изменением температуры. При 0 °C (т.е. 273 K) упругость пара равна 4,6 мм Hg, при 100 °C (373 K) она равна 760 мм, т. е, возрастает в 165 раз. При повышении температуры вдвое (от 0 °C, т.е. 273 K, до 273 °C, т.е. 546 K) упругость пара возрастает с 4,6 мм Hg почти до 60 атм, т.е. примерно в 10000 раз.
Поэтому, напротив, температура кипения меняется с давлением довольно медленно. При изменении давления вдвое – от 0,5 атм до 1 атм, температура кипения возрастает от 82 °C (т.е. 355 K) до 100 °C (т.е. 373 K) и при изменении вдвое от 1 атм до 2 атм – от 100 °C (т.е. 373 K) до 120 °C (т.е. 393 K).
Та же кривая, которую мы сейчас рассматриваем, управляет и конденсацией (сгущением) пара в воду.
Превратить пар в воду можно либо сжатием, либо охлаждением.
Как во время кипения, так и в процессе конденсации точка не сдвинется с кривой, пока превращение пара в воду или воды в пар не закончится полностью. Это можно сформулировать еще и так: в условиях нашей кривой и только при этих условиях возможно сосуществование жидкости и пара. Если при этом не подводить и не отнимать тепла, то количества пара и жидкости в закрытом сосуде будут оставаться неизменными. Про такие пар и жидкость говорят, что они находятся в равновесии, и пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Кривая кипения и конденсации имеет, как мы видим, еще один смысл – это кривая равновесия жидкости и пара. Кривая равновесия делит поле диаграммы на две части. Влево и вверх (к большим температурам и меньшим давлениям) расположена область устойчивого состояния пара. Вправо и вниз – область устойчивого состояния жидкости.
Кривая равновесия пар – жидкость, т.е. кривая зависимости температуры кипения от давления или, что то же самое, упругости пара от температуры, примерно одинакова для всех жидкостей. В одних случаях изменение может быть несколько более резким, в других – несколько более медленным, но всегда упругость пара быстро растет с увеличением температуры.
К квантовой теории абсолютного нуля температуры
6. Математическая статистика и корреляционная зависимость
6. Математическая статистика и корреляционная зависимость Математическая статистика – наука о математических методах систематизации и использования статистических данных для решения научных и практических задач. Математическая статистика тесно примыкает к теории
К квантовой теории абсолютного нуля температуры
Изменение давления с высотой
Изменение давления с высотой С изменением высоты давление падает. Впервые это было выяснено французом Перье по поручению Паскаля в 1648 г. Гора Пью де Дом, около которой жил Перье, была высотой 975 м. Измерения показали, что ртуть в торричеллиевой трубке падает при подъеме на
Влияние давления на температуру плавления
Влияние давления на температуру плавления Если изменить давление, то изменится и температура плавления. С такой же закономерностью мы встречались, когда говорили о кипении. Чем больше давление, тем выше температура кипения. Как правило, это верно и для плавления. Однако

На этом уроке мы уделим внимание такому виду парообразования, как кипение, обсудим его отличия от рассмотренного ранее процесса испарения, введем такую величину, как температура кипения, и обсудим, от чего она зависит. В конце урока введем очень важную величину, описывающую процесс парообразования – удельную теплоту парообразования и конденсации.
Читайте также:
- Кого винит катерина кабанова кратко
- Чем отличаются фосфолипиды от остальных групп сложных липидов какова их основная функция кратко
- План урока изо 5 класс одежда говорит о человеке
- Что такое духовный концерт 6 класс кратко
- Как можно объяснить конфликт между резус отрицательной матерью и резус положительным плодом кратко

