Какое значение имеет в химии классификация веществ кратко
Обновлено: 02.07.2024
Классификация веществ позволяет при ознакомлении с простейшими представителями каждого класса соединений получить общее представление о соединениях всех классов.
Классификация веществ в химии имеет огромное значение, благодаря ей мы можем разделять вещества на кислоты, щелочи, основания и т. д. В свою очередь эти категории мы ещё можем разделять на подклассы. То есть благодаря существованию классификации мы можем "разложить по полочкам" все вещества и не путаться в них.

Классификация является важнейшим методом систематизации. Смысл классификации прост. Все многообразие объектов, требующих осмысления или какой-либо обработки, организуется в виде упорядоченной системы. Классификация позволяет выделить из всего многообразия объектов группы с интересующими исследователя свойствами и сосредоточиться на их изучении. Классификация объектов проводится с целью установления наследственных связей между объектами. Свойство наследования позволяет изучать характеристики всех объектов класса, не привязываясь к конкретному экземпляру. Классификация позволяет систематизировать знания об объектах любой природы и назначения.
Самая простая классификация заключается в том, что все известные вещества делят на неорганические и органические.
Неорганические вещества по составу делят на простые и сложные. Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гидроксиды, соли. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобразующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды и кислоты соответственно. Основания делятся на растворимые (щелочи) и нерастворимые и т.д.
В зависимости от строения углеродной цепи органические соединения разделяют на соединения с открытой цепью ациклические и циклические - с замкнутой цепью атомов. Циклические делятся на две группы: карбоциклические соединения и гетероциклические. Карбоциклические соединения, в свою очередь, включают два ряда соединений: алициклические и ароматические. Как ациклические, так и циклические углеводороды могут содержать кратные (двойные или тройные) связи. Такие углеводороды называют непредельными (ненасыщенными), в отличие от предельных (насыщенных), содержащих только одинарные связи.
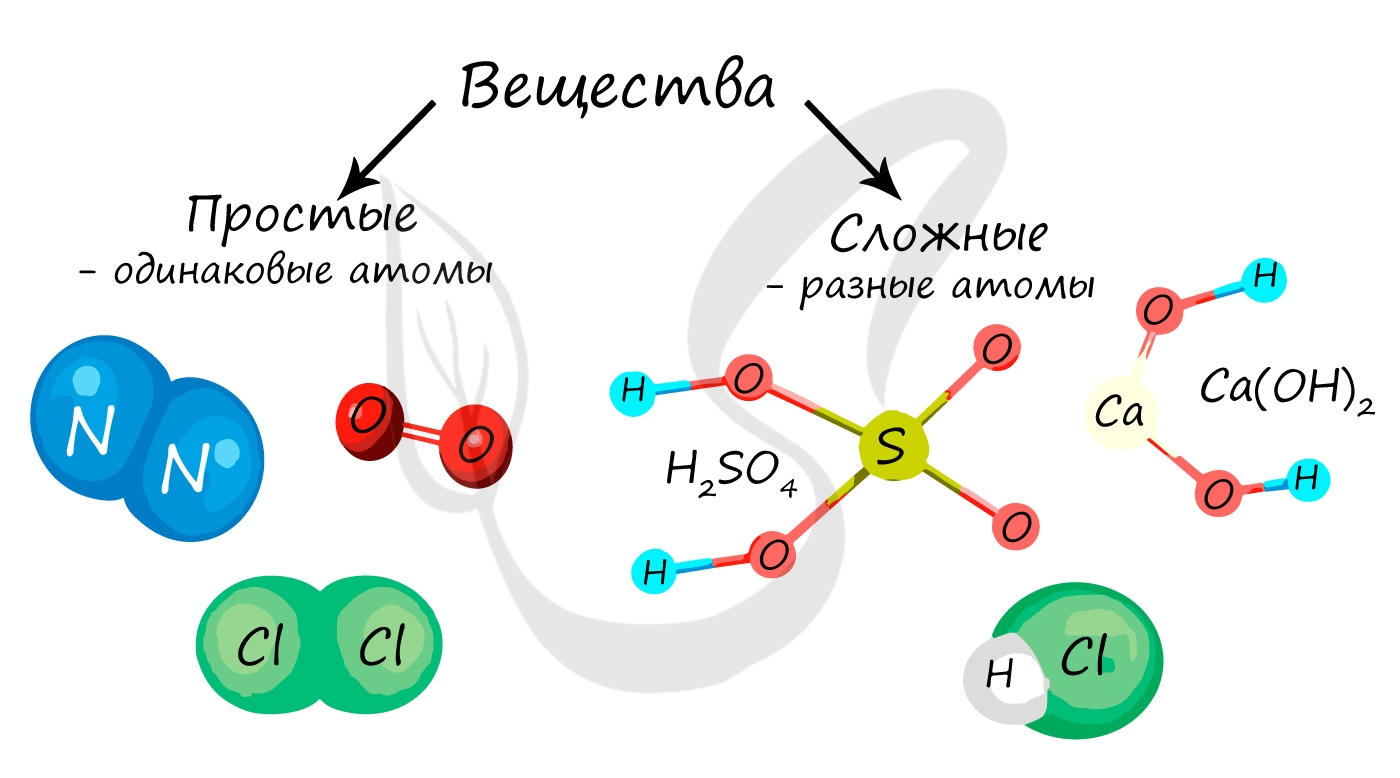
Вещество в химии - любая совокупность атомов и молекул. Вещества в химии подразделяются на простые и сложные.
Простые и сложные вещества
Простые вещества состоят из атомов одного химического элемента, то есть их образуют два и более одинаковых атома: H2, N2, O2, O3(озон), Mn, Fe.
Сложные вещества состоят из атомов двух и более видов: KMnO4, H2SO4, HCl.
Предмет химии (греч. chymos - сок)
У любой науки есть предмет изучения и методами, с помощью которых изучается предмет. Химия - наука о веществах, их превращениях и явлениях, которые сопровождают эти превращения.
Хочу заметить важную деталь: необходимо четко разделять химические и физические реакции. При химических реакциях происходят изменения в составе молекул: одни атомы сменяются другими, молекулы рвутся на части и собираются снова в обновленном виде.
При физических реакциях молекулы неизменны, связи атомов внутри них не подвергается изменениям.

- Выделение газа
- Появление запаха
- Изменение окраски раствора или реагирующих веществ
- Выпадение осадка
- Образование воды
- Выделение тепла
- Поглощение тепла

Аллотропия
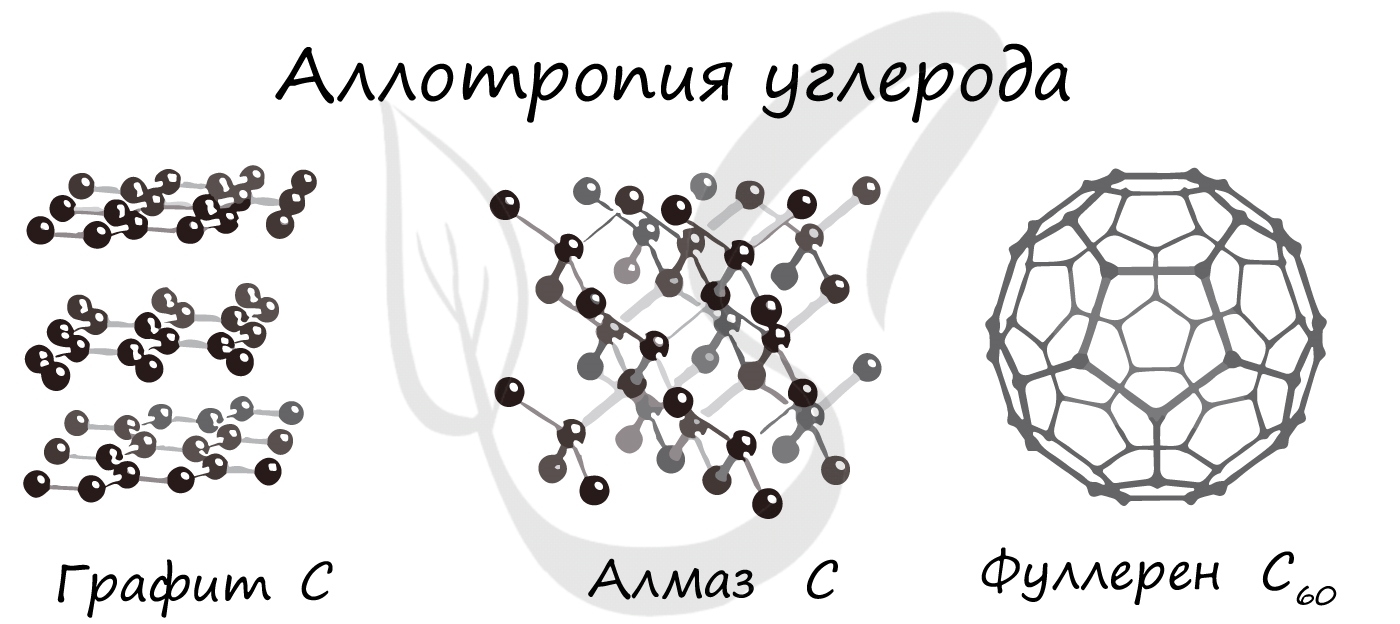
Аллотропия (греч. allos - иной + tropos образ) - свойство некоторых химических элементов принимать различные физические формы, существовать в виде двух и более простых веществ.
Такие уникальные способности имеются у углерода. Его известнейшие аллотропные модификации: алмаз, графит и фуллерен. В разделе химических связей мы вернемся к ним, однако будет хорошо, если вы уже сейчас запомните: алмаз и графит имеют атомное строение, фуллерен - молекулярное.
Обратите внимание: вы можете догадаться о строении веществ по их формуле. У фуллерена молекулу составляют 60 атомов углерода. Мы изучали, что молекула - это как минимум два атома, соединенных вместе. Таким образом, уже по формуле, очевидно, что строение фуллерена молекулярное.
Среди аллотропных модификаций фосфора выделяют: белый, красный и черный фосфор. Белый (P4) фосфор имеет молекулярное строение, а красный и черный (P∞) - атомное.

Аллотропные модификации серы включают ромбическую, моноклинную, и пластическую серу. Ромбическая (S8) и моноклинная сера (S8) имеют молекулярное строение. Пластическая сера (S∞) представляет собой длинные цепочки атомов, тем не менее также характеризуется молекулярным строением.
Надо заметить, что с течением времени, пластическая и моноклинная модификации серы, неустойчивые, превращаются в ромбическую, наиболее устойчивую.

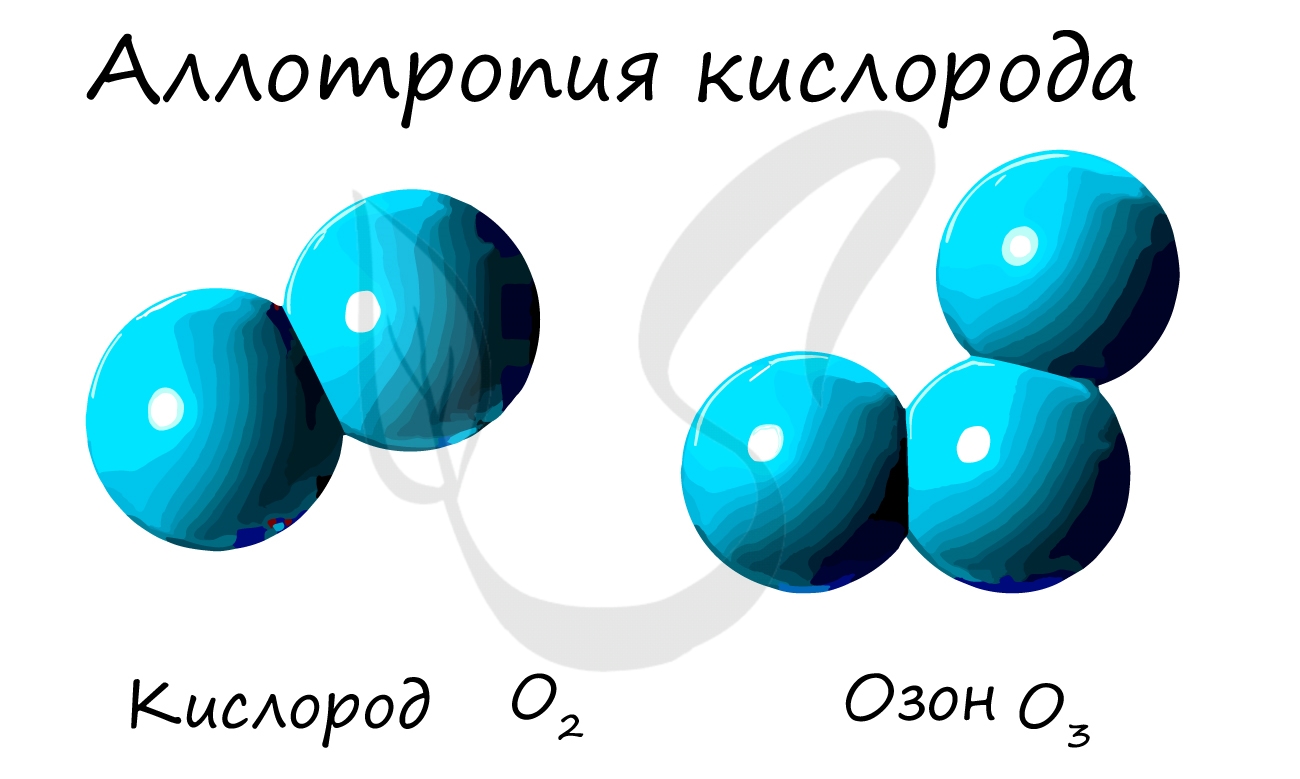
Из аллотропных модификаций кислорода наиболее известен озон (греч. ozo - иметь сильный запах). Озон - неустойчивая модификация кислорода, образуется в озоновом слое под действием ультрафиолетового излучения. Имеет молекулярное строение и формулу - O3.
Озон - ядовитый газ. Применяется как окислитель при отбеливании, при очистке воды и кондиционировании воздуха. В медицине существует целое направление, посвященное лечению с применение озона - озонотерапия.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Среднее относительное содержание какого-либо химического элемента в природе называют его распространенностью (кларком) и выражают в массовых или атомных долях, а также в процентах. Химический состав и закономерности распространения и распределения элементов на Земле изучает геохимия.

Рис. 1 Распространение химических элементов в земной коре.
Простые вещества
Простое вещество – сочетание атомов одного и того же элемента. В зависимости от типа химической связи между атомами элементов среди простых веществ различают металлы (металлическая связь) и неметаллы (ковалентная связь).
Один и тот же элемент способен образовывать несколько простых веществ – аллотропных модификаций. Явление аллотропии может быть обусловлено разным составом молекул данного элемента, либо способом размещения молекул или атомов в кристаллах.
Так, атомы фосфора (валентные электроны 3s 2 3p 3 ), имеющие три неспаренных электрона, могут объединяться в полимерные слои Р2 (рис. 2 I) с пирамидальным распределением связей или образовывать четырехатомные молекулы Р4 тетраэдрической формы (рис. 2 II)

Рис. 2. Аллотропные модификации фосфора: I – Р2; II – P4.
В соответствии с характером изменения структуры и типа химической связи изменяются свойства простых веществ (плотность, температура плавления и кипения, электропроводность и т.д.). Так, аргон, хлор и сера в твердом состоянии – диэлектрики, кремний – полупроводник, а алюминий, магний и натрий – проводники.
Химические свойства, а также способы получения простых веществ (металлов и неметаллов) будут рассмотрены позднее.
Двухэлементные (бинарные) соединения
В зависимости от типа химической связи бинарные соединения – ионные, ковалентные, металлические и со смешанным типом химической связи. В соответствии с закономерным развитием электронных структур атомов характер химической связи однотипных соединений в периодах и группах Периодической системы закономерно изменяется.
Рассмотрим это явление на примере бинарных соединений элементов второго периода (рис. 3). Так, при переходе от I к VIII группе в периоде полярность химической связи уменьшается.

Рис. 3 Бинарные соединения элементов второго периода
Так, в ряду фторидов тип химической связи изменяется от ионного (LiF) с последующим уменьшением полярности до ковалентного неполярного (F2).
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений (кислотно-основная активность). Так, в случае оксидов в ряду от Li2O до N2O5 ослабевают основные свойства и усиливаются кислотные: Li2O – сильно основный оксид, BeO – амфотерный, а B2O3, CO2 и N2O5 – кислотные.
Трехэлементные соединения
При взаимодействии резко различных по химической природе бинарных соединений образуются новые химические соединения, среди которых наиболее распространены трехэлементные соединения:
Трехэлементные соединения могут быть ионными, ионно-ковалентными и ковалентными в зависимости от типа химической связи между внутренней и внешней сферами.
Помимо комплексных соединений среди трехэлементных соединений различают смешанные соединения, твердые растворы и эвтектики.
Смешанные соединения получают при взаимодействии соединений элементов в равной степени склонных к образованию комплексов:
CuS + FeS = CuFeS2
Твердые растворы получаются если взаимодействуют электроположительные элементы, способные образовывать близкие по строению и размеру структурные единицы:
Механическая смесь кристаллов (эвтектика) получается, когда между собой не взаимодействуют соединения элементов, близких по химическим свойствам, но различающихся по строению и размеру атомов или ионов:

Химия изучает превращения химических веществ, которых на сегодняшний день известно более 20 миллионов. Поэтому важна классификация химических соединений, т. е. объединение их в группы или классы, обладающие сходными свойствами. Данный урок поможет изучить современную классификацию неорганических веществ и познакомит с правилами составления их названий по химическим формулам.
Читайте также:
- Эссе как организовать исследовательский проект современная школа
- Какой статус имеет законодательная власть с учетом признания принципа народного суверенитета кратко
- Какая связь между освоением железа и формированием военной демократии история кбр кратко
- Почему человек ощупывает предмет руками чтобы лучше изучить его кратко
- Как вы считаете почему процесс модернизации в 19 веке почти не коснулся стран востока кратко

