Какие вещества называют катализаторами биология 9 класс кратко
Обновлено: 04.07.2024
Катализом называется явление ускорения реакции без изменения её общего результата. Вы знаете, что для протекания многих химических реакций необходимы высокие температура и давление. В живой клетке умеренная температура, нормальное давление. В таких условиях большинство реакций или вообще не протекали бы, или протекали бы очень медленно, если бы не подвергались воздействию катализаторов. Вещества, изменяющие скорость химической реакции, но не входящие в состав продуктов реакции, называются катализаторами.
Каталитической способностью обладают некоторые молекулы РНК. Очевидно, это свойство РНК имело очень важное значение на начальном этапе зарождения жизни на нашей планете. В настоящее время роль молекул РНК как катализаторов крайне мала, а основными биокатализаторами в клетке являются ферменты.
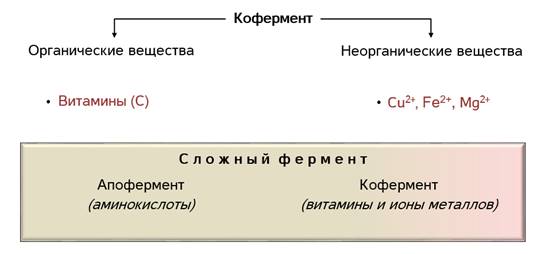
Все процессы в живом организме прямо или косвенно осуществляются с участием ферментов. Сейчас уже известны тысячи ферментов. Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент. В качестве коферментов выступают различные органические вещества, как правило, витамины и неорганические - ионы различных металлов.
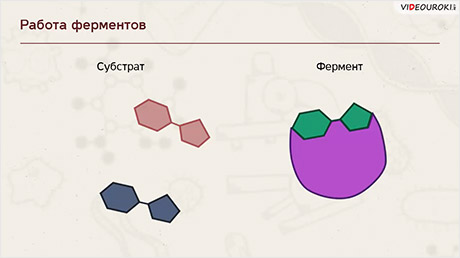
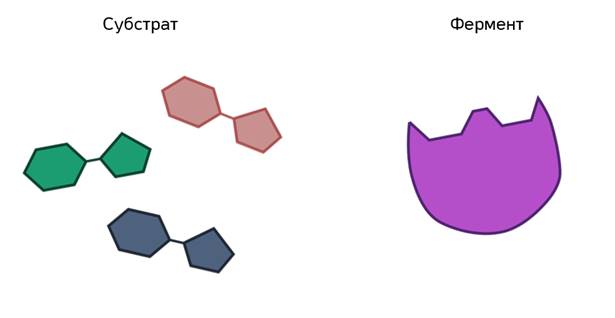
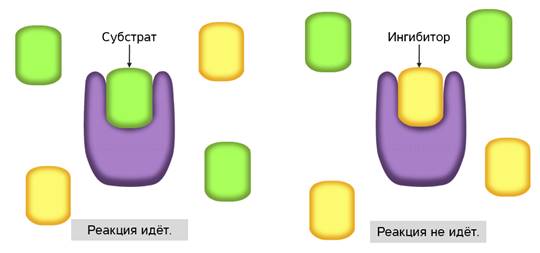
Ферменты участвуют в процессах как синтеза, так и распада. При этом ферменты действуют в строго определённой последовательности, они специфичны для каждого вещества и ускоряют только определённые реакции. Встречаются ферменты, которые катализируют несколько реакций. Избирательность действия ферментов на разные химические вещества связана с их строением. Молекулы ферментов имеют активный центр - небольшой участок, на котором идёт данная реакция. Форма и химическое строение активного центра таковы, что с ним могут связываться только определённые молекулы в силу их комплементарности друг другу.
У некоторых ферментов в присутствии молекул определённых веществ конфигурация активного центра может изменяться, т. е. фермент таким образом может обеспечить наибольшую ферментативную активность (рис. 17).
Вещества, изменяющие скорость химической реакции, но не входящие в состав продуктов реакции, называются катализаторами.
2. Какова их роль в химических реакциях?
Для протекания многих химических реакций необходимы высокие температура и давление. В живой клетке умеренная температура, нормальное давление. В таких условиях большинство реакций или вообще не протекали бы, или протекали бы очень медленно, если бы не подвергались воздействию катализаторов.
3. Какой фермент желудочного сока является основным? Какие вещества и при каких условиях он расщепляет?
Пепсин является основным ферментом, с помощью которого происходит расщепление белков в кислой среде желудка.
Выполните лабораторную работу.
Расщепление пероксида водорода ферментом каталазой
Цель работы: показать действие фермента каталаза на пероксид водорода (Н202) и условия, в которых он функционирует.
1. Поместите в первую из трёх пробирок кусочек сырого мяса, во вторую - кусочек сырого картофеля, в третью - кусочек варёного картофеля.
2. Прилейте в пробирки по 2 мл 3%-го раствора Н202.
3. Запишите наблюдаемые вами явления в каждой пробирке.
В пробирках с мясом и сырым картофелем после добавления раствора жидкость вспенится за счет выделяющегося кислорода. Через несколько минут над жидкостью можно будет наблюдать шапку пены из пузырьков, заполненных кислородом.
В пробирке с вареным картофелем никакой реакции не наблюдается.
4. Сделайте вывод.
В первых двух случаях фермент каталаза, который содержится в картофеле и мясе, разлагает вредный для организмов пероксид водорода на воду и кислород.
В пробирке с вареным картофелем никакой реакции не наблюдалось, т.к. в ходе термической обработки произошла денатурация белка каталазы, за счет чего он потерял свои свойства (способность разлагать пероксид водорода).
Вопросы
1. Какие вещества называются катализаторами?
Вещества, изменяющие скорость химической реакции, но не входящие в состав продуктов реакции, называются катализаторами.
2. Какую роль играют ферменты в клетке?
Ферменты являются основными биокатализаторами в клетке. Все процессы в живом организме прямо или косвенно осуществляются с участием ферментов. Ферменты участвуют в процессах как синтеза, так и распада.
3. От каких факторов может зависеть скорость ферментативных реакций?
Скорость ферментативных реакций зависит от многих факторов - природы и концентрации фермента и вещества, температуры, давления, реакции среды и т. д.
4. Почему большинство ферментов при высокой температуре теряет каталитические свойства?
Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент. В результате воздействия высокой температуры происходит денатурация белков, в результате чего они теряют свои свойства.
5. Почему недостаток витаминов может вызвать нарушения в процессах жизнедеятельности организма?
Витамины часто выступают в качестве коферментов. Поэтому недостаток витаминов нарушит обмен веществ.
Задания
Проанализировав знания, полученные на предыдущих уроках, объясните, почему большинство ферментов при высокой температуре теряет каталитические свойства.
В результате воздействия высокой температуры происходит денатурация белков, в результате чего они теряют свои свойства.
биологический катализатор или биологический катализатор это молекула, как правило, белкового происхождения, способная ускорять химические реакции, происходящие внутри живых существ. Молекулы белка катализатора являются ферментами, а молекулы РНК - рибозимами. В этой статье мы сосредоточимся на изучении ферментов, которые являются наиболее известными биологическими катализаторами..
В отсутствие ферментов огромное количество реакций, происходящих в клетке и позволяющих жить, не могло произойти. Они ответственны за ускорение процесса на порядки, близкие к 10 6 - а в некоторых случаях гораздо больше.

- 1 Катализ
- 2 фермента
- 2.1 Что такое фермент?
- 2.2 Характеристика ферментов
- 2.3 Номенклатура и классификация ферментов
- 2.4 Как работают ферменты?
- 2.5 Ферментативные ингибиторы
- 2.6 Примеры
- 3.1 Реакции, катализируемые ферментами, происходят быстрее
- 3.2 Большинство ферментов работают в физиологических условиях
- 3.3 Специфика
- 3.4 Ферментативная регуляция является точной
катализ
Катализатор - это молекула, способная изменять скорость химической реакции, не расходуясь в указанной реакции..
Разница энергий между реагентами и продуктами выражается как ΔG. Если уровни энергии продуктов выше, чем у реагентов, реакция является эндергонической, а не спонтанной. Напротив, если энергия продуктов ниже, реакция является экзергонной и спонтанной.
Однако, если реакция является спонтанной, это не значит, что она будет происходить с заметной скоростью. Скорость реакции зависит от ΔG * (звездочка обозначает энергию активации).
Читатель должен помнить об этих понятиях, чтобы понять, как происходит функционирование ферментов..
ферменты
Что такое фермент?
Ферменты - это биологические молекулы невероятной сложности, состоящие в основном из белков. Белки, в свою очередь, представляют собой длинные цепочки аминокислот.
Одной из самых выдающихся характеристик ферментов является их специфичность в молекуле-мишени - эта молекула называется субстратом.
Характеристики ферментов
Ферменты существуют в нескольких формах. Некоторые состоят исключительно из белков, в то время как другие имеют небелковые области, называемые кофакторами (металлы, ионы, органические молекулы и т. Д.).
Таким образом, апофермент представляет собой фермент без его кофактора, и комбинация апофермента и его кофактора называется голоферментом..
Это молекулы значительно большего размера. Однако только небольшой сайт фермента непосредственно участвует в реакции с субстратом, и этот регион является активным сайтом.
Когда реакция начинается, фермент связывается со своим субстратом, поскольку ключ связан со своим замком (эта модель является упрощением реального биологического процесса, но служит для иллюстрации процесса).
Все химические реакции, которые происходят в нашем организме, катализируются ферментами. На самом деле, если бы этих молекул не существовало, нам пришлось бы ждать сотни или тысячи лет, чтобы реакции завершились. Следовательно, регуляция ферментативной активности должна контролироваться очень специфическим образом..
Номенклатура и классификация ферментов
Когда мы видим молекулу, имя которой заканчивается на -ase, мы можем быть уверены, что это фермент (хотя есть исключения из этого правила, такие как трипсин). Это соглашение для обозначения названия ферментов.
Существует шесть основных типов ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы; отвечает за: окислительно-восстановительные реакции, перенос атомов, гидролиз, присоединение двойных связей, изомеризацию и связывание молекул соответственно.
Как работают ферменты?
В разделе, посвященном катализу, мы упоминали, что скорость реакции зависит от величины ΔG *. Чем выше это значение, тем медленнее и медленнее реакция. Фермент ответственен за уменьшение указанного параметра - тем самым увеличивая скорость реакции.
Разница между продуктами и реагентами остается одинаковой (фермент на нее не влияет), так же как и распределение. Фермент облегчает формирование переходного состояния.
Ферментные ингибиторы
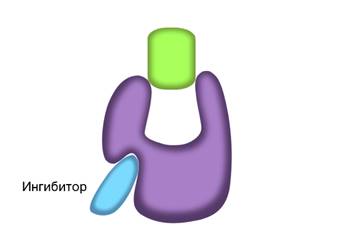
В контексте изучения ферментов ингибиторы представляют собой вещества, способные снижать активность катализатора. Они подразделяются на два типа: конкурентные и неконкурентные ингибиторы. Те, которые первого типа конкурируют с субстратом, а другие - нет.
Обычно процесс ингибирования является обратимым, хотя некоторые ингибиторы могут оставаться связанными с ферментом почти постоянно.
примеров
В наших клетках и в клетках всех живых существ содержится большое количество ферментов. Однако наиболее известны те, которые участвуют в метаболических путях, таких как гликолиз, цикл Кребса, цепь переноса электронов и другие..
Сукцинатдегидрогеназа является ферментом типа оксидоредуктазы, который катализирует окисление сукцината. В этом случае реакция включает потерю двух атомов водорода..
Разница между биологическими катализаторами (ферментами) и химическими катализаторами
Есть катализаторы химической природы, которые, подобно биологическим, увеличивают скорость реакций. Однако есть заметные различия между молекулами обоих типов..
Ферментативные реакции происходят быстрее
Во-первых, ферментам удается увеличить скорость реакций на порядки, близкие к 10 6 до 10 12 . Химические катализаторы также увеличивают скорость, но только на несколько порядков.
Большинство ферментов работают в физиологических условиях
Поскольку биологические реакции проводятся внутри живых существ, их оптимальные условия окружают физиологические значения температуры и pH. Химикам, с другой стороны, нужны резкие условия температуры, давления и кислотности.
специфичность
Ферменты очень специфичны в реакциях, которые они катализируют. В большинстве случаев они работают только с одним субстратом или с несколькими. Специфика также относится к типу продукции, которую они производят. Ассортимент субстратов химических катализаторов значительно шире.
Силы, которые определяют специфичность взаимодействия между ферментом и его субстратом, являются такими же, которые определяют конформацию одного и того же белка (взаимодействия Ван-дер-Ваальса, электростатические, водородные и гидрофобные связи).
Ферментативная регуляция является точной
Наконец, ферменты обладают большей способностью регуляции, и их активность варьируется в зависимости от концентрации различных веществ в клетке..
Среди регуляторных механизмов мы находим аллостерический контроль, ковалентную модификацию ферментов и изменение количества синтезируемого фермента..
![]()
![]()
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности
![]()
![]()
![]()
Конспект урока "Биологические катализаторы"
Начнём с цитаты известного советского химика и инженера, академика Георгия Константиновича Борескова:
Неуютная картина, не правда ли? Поэтому сегодняшняя наша цель – разобраться, почему же Земля всё-таки выглядит более привычно для нашего глаза.
![]()
Для протекания многих химических реакций необходимы специальные условия. Чаще всего на скорость реакций влияют температура и давление. Чем они выше, тем быстрее протекает химическая реакция. Но её скорость можно увеличить, не изменяя внешних условий, а просто добавив к реагирующей смеси определённые вещества. Так, металлический родий почти в 10000 раз ускоряет разложение муравьиной кислоты на углекислый газ и водород. Такие вещества, увеличивающие скорость реакции, но не входящие в состав продуктов реакции, называются катализаторами.
В клетках живых организмов каждую секунду происходят тысячи химических реакций.
И это несмотря на то, что в живой клетке умеренная температура и нормальное давление. Например, бактерии из рода Азотобактер могут при обычных условиях разрывать прочнейшую молекулу азота, где атомы соединены тремя ковалентными связями и присоединять их к водороду. А для того, чтобы проделать то же самое человеку в промышленности, необходимо создать давление в 350 раз большее, чем на поверхности Земли и поднять температуру до 500 градусов Цельсия.
Естественно, бактерии не обходятся при этом без катализаторов. Кстати, люди также пытались применить их при получении аммиака. Перепробовав при этом более 20000 различных веществ.Что же за всесильные вещества – эти катализаторы?
Катализаторами химических реакций в неживой природе могут быть самые различные вещества. Это и уже упомянутый нами экзотический родий, который используется для изготовления зеркал супермощных лазеров и обычный оксид марганца, применяемый для получения кислорода даже в школьной лаборатории.
Кроме того, неорганические катализаторы могут ускорять реакции с разными веществами. Например, родий не только эффективно разлагает муравьиную кислоту, но и борется с выбросами вредных оксидов азота в автомобильных катализаторах.Другое дело – биологические, а значит, органические катализаторы. На них мы остановимся более подробно.
Многочисленные исследования прошлого нашей планеты говорят о том, что на начальном этапе зарождения жизни каталитической способностью обладали некоторые молекулы рибонуклеиновых кислот.![]()
И тогда это свойство РНК имело очень важное значение. Сегодня же роль молекул РНК как катализаторов крайне мала. А основными биокатализаторами в клетке являются ферменты. Которых уже к 2013 году было описано более пяти тысяч видов.
Абсолютно все процессы в живом организме прямо или косвенно осуществляются с участием ферментов или энзимов, как их ещё называют. Это и фиксация углерода в процессе фотосинтеза, и расщепление питательных веществ в пищеварительном тракте, и синтез источника энергии для всех живых организмов – АТФ, и многое –многое другое.
Как вы помните, по химической природе биологические катализаторы относятся к белкам. Они могут быть как простыми, состоящими только из аминокислот, так и сложными, включающими белок и небелковую часть – простетическую группу. Простетическая группа фермента называется кофермент, а белковая часть – апофермент.
В роли коферментов выступают органические и неорганические вещества. Среди органических это могут быть витамины, например, аскорбиновая кислота. А из неорганических – ионы различных металлов. Например, ионы меди, железа, магния.
![]()
Ферменты ускоряют химические реакции за счёт тесного взаимодействия с молекулами исходных реагирующих веществ – так называемых субстратов. Зачастую размеры молекул субстратов значительно меньше размеров молекул самих ферментов, хотя, казалось бы, должно быть наоборот. Поэтому с субстратом или субстратами, потому что их может быть несколько, взаимодействует не вся молекула фермента, а лишь небольшой её участок – активный центр фермента. Построен он чаще всего из нескольких аминокислотных остатков, которые образуют его уникальную структуру. Почему уникальную? Дело в том, что форма и химическое строение активного центра таковы, что с ним могут связываться только те субстраты, структура которых подходит к структуре активного центра.
Магия этого процесса неизвестна до сих пор. Несмотря на то, что человечество в ближайшее время планирует полёты на Марс, оно не в состоянии разобраться со своим организмом. Но существует теория. Её выдвинул ещё в 1890 году немецкий химик Эмиль Фишер.
![]()
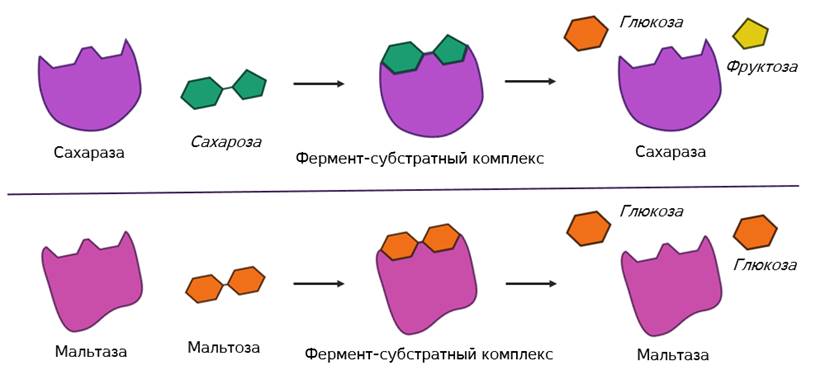
В этом комплексе молекула субстрата деформируется и в её структуре ослабляются определённые химические связи. Что приводит к облегчённому их разрыву и в конечном итоге к ускорению химической реакции.
После этого фермент-субстратный комплекс распадается на конечные продукты и свободный фермент, а активный центр последнего тут же готов принимать новые молекулы субстрата. Получаем такой же итог, как и в случае работы обычных химических катализаторов – скорость реакции увеличивается, а сам катализатор при этом не расходуется и может использоваться многократно.Но в самом механизме работы органических и неорганических катализаторов есть кардинальное отличие. Каждый фермент действует только на определённый тип связи и ускоряет только одну определённую реакцию. То есть обладает специфичностью. Как вы поняли, специфичность объясняется соответствием активного центра только определённым субстратам. Поэтому, например, фермент мальтаза, разлагающий дисахарид мальтозу до двух молекул глюкозы оказывается не способным разрушать молекулы сахарозы. Несмотря на то, что сахароза также является дисахаридом.
![]()
Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Например, в желудке человека соляная кислота активирует фермент пепсин. Максимальная активность которого лежит в пределах рН от полутора до двух.
Ингибирование ферментов может быть обратимым и необратимым. Если вещество-ингибитор вызывает стойкое изменение пространственной структуры фермента, то такое ингибирование будет необратимым.
А вот обратимое ингибирование, в свою очередь, бывает двух типов. Давайте их рассмотрим.С активным центром фермента могут связываться вещества, сходные по структуре с субстратом. Никакой реакции при этом нет, но между ингибиторами и субстратом происходит конкуренция за активный центр. Поэтому такой тип ингибирования называется конкурентным.
![]()
Конкурентное ингибирование широко используется в медицине. Антибиотики, противоопухолевые препараты, используемые в качестве лекарственных средств, являются конкурентными ингибиторами.
В неконкурентном ингибировании не участвуют вещества, сходные с субстратом. При таком типе ингибирования, молекулы ингибиторов присоединяются к регуляторному центру фермента. Это вызывает изменение пространственной структуры активного центра, что препятствует присоединению к нему молекул субстрата. Тем самым снижается скорость ферментативной реакции.
![]()
Уникальные способности ферментов уже много лет используются человеком в хозяйственной деятельности. В настоящее время развивается новая отрасль науки – промышленная энзимология. Которая, в свою очередь, является основой биотехнологии.
Мы уже упоминали об использовании ферментов в медицине. Фармацевтическая промышленность научилась производить искусственный аналог гормона надпочечников кортизола – преднизолон. Который используется при лечении ревматоидного артрита.
Широкое применение ферменты-энзимы находят также в пищевой промышленности. Их применяют в производстве сыров, соков, овощных и фруктовых пюре. Не обходится без применения ферментов хлебопечение, производство алкогольных напитков. Для улучшения вкуса, аромата и консистенции их применяют для обработки мяса.
В текстильной и кожевенной промышленности ферменты позволяют значительно увеличить выход овчины, а обработка кожи перед дублением делает её поверхность чистой, гладкой и тонкой.
Перспективным является применение ферментов, разлагающих целлюлозу. В результате этого из древесины, торфа, сельскохозяйственных и городских отходов можно получить ценные биотехнологические продукты: глюкозу, этанол, ацетон и другие. Особую актуальность это имеет в наши дни, когда проблема загрязнения окружающей среды выходит на передний план.Читайте также:
- Почему становление суверенной российской государственности сопровождалось конфликтами кратко
- Как переместить файл с помощью панели инструментов кратко
- Какое управление было в древнейшем риме 5 класс история ответ кратко
- Что такое движение и двигательное действие кратко
- Что записывают в маршрутной технологической карте кратко