Какие перспективы открывают методы генной инженерии в селекции микроорганизмов кратко
Обновлено: 06.07.2024
Ответ. Микрооргани́змы, (микро́бы) — название собирательной группы живых организмов, которые слишком малы для того, что бы быть видимыми невооружённым глазом (их характерный размер — менее 0,1 мм) . В состав микроорганизмов входят как безъядерные (прокариоты) , так и эукариоты: бактерии, некоторые грибы, археи, протисты, но не вирусы, которые обычно выделяют в отдельную группу. Большинство микроорганизмов состоят из одной клетки, но есть и многоклеточные микроорганизмы. Изучением этих организмов занимается наука микробиология.
2. Какие способы размножения характерны для микроорганизмов?
Прокариотические клетки размножаются путем прямого (поперечного) деления. В процессе роста в клетках начинает нарастать количество общего азота, РНК и ДНК. Нуклеоид увеличивается в объеме, и в точках прикрепления к цитоплазматической мембране двухцепочечная ДНК под действием ферментов разрывается по водородным связям. Происходят репликация ДНК и синтез комплементарных вторичных цепочек, которые расходятся по полюсам клетки. Они в дальнейшем станут нуклеоидами дочерних клеток.
После деления нуклеоида начинается образование поперечной двухслойной перегородки, которая формируется за счет цитоплазматической мембраны. Различают изоморфное и гетероморфное деления клеток. При изоморфном делении перегородка формируется на середине клетки, в результате чего образуются две одинаковые по величине клетки. В некоторых случаях деление носит асимметричный характер, при котором дочерняя клетка отделяется от одного из концов бактерии и новые клетки имеют неодинаковую величину. Такое деление называют гетероморфным. Оно может наблюдаться в старых культурах, после обработки микроорганизмов малыми дозами пенициллина, некоторыми химическими веществами, при ультрафиолетовом облучении и воздействии других факторов. В результате такого воздействия происходит нарушение координации между ростом и делением клетки, в результате чего бактерия увеличивается, а деление ее не осуществляется.
Разделившиеся клетки могут отделяться одна от другой или оставаться рядом, формируя дипло- или стрептобактерии, стрептококки, стафилококки и сарцины. Это зависит от характера распределения слизистого слоя вокруг разделившейся клетки, от свойств питательной среды и др. У большинства бактерий делящая перегородка располагается, как правило, перпендикулярно длине, у кокков - в любой плоскости. У спирохет в редких случаях перегородка может располагаться и вдоль клетки. Бактерии характеризуются высоким темпом размножения, который обусловлен небольшим временем генерации, т. е. периодом, в течение которого осуществляется деление клетки. Например, время генерации кишечных палочек в оптимальных условиях составляет около 20 мин. Продолжительность периода зависит от вида бактерии, ее возраста, характера среды, условий культивирования и т. п.
Теоретически вычислено, что при делении клетки через каждые 20-30 мин количество бактерий за 24 ч составило бы 10-15 млрд. клеток, а через 5 сут. размножения одна клетка дала бы такую живую массу потомства, которая заполнила бы собой бассейны морей и океанов нашей планеты. Однако в действительности такого быстрого размножения микробов не происходит, так как в естественных условиях отрицательно влияют на размножение накапливающиеся продукты метаболизма, ультрафиолетовые лучи, низкая и высокая температуры внешней среды и др.
Рост микроорганизмов в жидкой питательной среде может проявляться помутнением и изменением цвета среды, наличием или отсутствием пристеночного кольца и поверхностной пленки различного характера, наличием или отсутствием осадка. При выращивании на обезжиренном молоке молочнокислые бактерии вызывают в первые сутки культивирования свертывание молока с образованием однородного плотного сгустка без обильного выделения молочной сыворотки и газа, с кисломолочными вкусом и запахом.
При размножении на плотных питательных средах микроорганизмы образуют колонии (от nar.colonia - поселение), которые представляют собой видимые скопления особей одного вида и формирующиеся в результате размножения, как правило, одной клетки. Они бывают круглой, розеткообразной, звездчатой, древовидной формы, могут иметь поверхность гладкую, выпуклую, плоскую, куполообразную, вдавленную. Колонии отмечаются также по строению края, который, может быть ровным (S-форма) и шероховатым (R-форма). По величине колонии подразделяют на крупные (свыше 4 мм) в диаметре, средние (2-4 мм), мелкие (1-2 мм) и карликовые (меньше 1мм).
Колонии отличаются также по консистенции, плотности, прозрачности, цвету. Они бывают слизистыми, сметанообразными, влажными, сухими, прозрачными, полупрозрачными и непрозрачными, окрашенными и бесцветными. Различные виды микроорганизмов образуют специфические колонии на плотных питательных средах и дают характерный рост на жидких средах. Особенности роста микробов на питательных средах называют культуральными свойствами. Их учитывают при определении видов микроорганизмов.
3. Какова роль микроорганизмов в жизни человека?
Ответ. Жизнедеятельность микроорганизмов – необходимое условие существования на Земле органического мира. Благодаря деятельности микробов осуществляется минерализация органических остатков, что обеспечивает непрерывное поступление в атмосферу углекислоты, без которой невозможен фотосинтез растениями. Они принимают самое активное участие в различных геологических процессах. Выветривание горных пород, формирование почв, образование селитры, различных руд (в том числе серных), известняков, нефти, каменного угля, торфа – все эти и многие другие процессы протекают при непосредственном участии микроорганизмов.
Со многими микробами люди сталкиваются с очень давних времен: при закваске теста, изготовлении кисломолочных продуктов, пива, вина, уксуса и пр. Микроорганизмы участвуют в процессах самоочищения окружающей среды. Их жизнедеятельность лежит в основе промышленных процессов, связанных с выпуском антибиотиков, витаминов, стимуляторов роста, кормов для скота и пр.
С помощью микроорганизмов из шлама можно извлекать полезные ископаемые, предотвращать опасность взрыва гремучего глаза в шахтах и т.д.
В подавляющем большинстве микробы или безвредны, или приносят пользу и становятся активными помощниками человека.
Без преувеличения можно сказать, что польза, какую приносят микроорганизмы, значительно больше, чем вред, который они причиняют.
Однако, как правило, при обычных ситуациях мы забываем об этом. И очень часто, когда говорим о микробах, вспоминаем прежде всего болезнетворных, потому что очень трудно забыть страх перед невидимыми возбудителями многих болезней.
На протяжении миллионов лет макро- и микроорганизмы взаимно приспосабливались и стали необходимыми друг другу. Микробы – нормальные обитатели организма человека или животного стали неотъемлемыми спутниками макроорганизма и играют значительную роль в их жизни. Так представители нормальной микрофлоры кишечника завершают переваривание питательных веществ, способствуют более эффективному их использованию макроорганизмом. Многие микробы, обитающие в кишечнике, являются антагонистами гнилостных и болезнетворных бактерий, а также вырабатывают витамины, которые используются организмом человека или животного.
Нормальная микрофлора человека и животного – необходимое условие сохранения здоровья макроорганизма. Нарушение микробных биоценозов в разных органах и системах организма ведет к развитию патологических процессов, снижению активности защитных сил организма, развитию дисбактериоза. Если новорожденного выращивать в стерильных условиях, кормить стерильной пищей, т.е. лишить его нормальной микрофлоры, он будет плохо развиваться, отстанет в росте и может погибнуть.
Вопросы после § 67
1. Для получения каких видов продукции человек использует микроорганизмы?
Ответ. К микроорганизмам относят всех прокариот, а из эукариот – простейших, микроскопические формы грибов и водорослей. Все они находят широкое применение в промышленности, сельском хозяйстве, медицине и энергетике. Роль микроорганизмов в производстве лекарств, биологически активных соединений, кормовых добавок, бактериальных удобрений, в хлебопечении, виноделии, в производстве многих молочных продуктов невозможно переоценить. В связи с этим постоянно ведется поиск новых высокопродуктивных штаммов микроорганизмов.
2. Чем селекция микроорганизмов отличается от селекции растений и животных?
Ответ. От методов селекции высших эукариот они отличаются существенно. До недавнего времени основными методами получения высокопродуктивных штаммов микроорганизмов были искусственный мутагенез и последующий отбор групп генетически идентичных клеток – клонов. После выделения из дикого штамма микроорганизмов, обладающих полезными для человека свойствами, проводится отбор наиболее продуктивных штаммов среди них. Следующий этап, как правило, – применение искусственного мутагенеза, позволяющего усилить появление различных мутаций. В качестве мутагенов используются ионизирующие излучения, некоторые химические вещества, а также ультрафиолетовое излучение, обладающее хотя и низкой проникающей способностью, но достаточной для появления мутаций у микроорганизмов. Вероятность возникновения мутаций у микроорганизмов та же, что и у всех других организмов, – примерно 1 мутация на 1 млн особей по каждому гену. Однако, учитывая то, что получить миллионное и миллиардное потомство у микроорганизмов нетрудно, вероятность выделения мутаций по данному гену достаточно высокая.
Для получения культуры микроорганизмов – мутантов с нужными качествами учеными-селекционерами разработаны специальные методы отбора. Отобранный клон подвергается многократному пересеву на питательную среду с контролем на образование требуемого продукта. Цель такого многократного клонирования – получение наиболее однородной популяции клеток. После получения продуктивных штаммов приступают к их размножению. Использование данной технологии позволило селекционерам получить штаммы, продуктивность которых в сотни и тысячи раз выше по сравнению с исходными штаммами микроорганизмов, взятыми из природы.
3. Какие методы используются в селекции микроорганизмов?
Ответ. Продуктивность диких форм бактерий невысокая, поэтому человек совершенствует и выводит новые штаммы.
В селекции микроорганизмов применяют традиционные и новейшие методы. К традиционным методам относят экспериментальный мутагенез и отбор по продуктивности. Экспериментальный мутагенез - это воздействие на организм различных мутагенов с целью получения мутации. Этот метод имеет свои особенности при селекции бактерий:
- у селекционера имеется неограниченное количество материала для работы: за считанные дни в чашках Петри или пробирках на питательных средах можно вырастить бактерий
- значительно меньшее количество генов, их генетическая регуляция более простая, взаимодействия генов просты или отсутствуют миллиарды клеток;
- более эффективное использование мутационного процесса, поскольку геном микроорганизмов гаплоидный, что позволяет выявить любые мутации уже в первом поколении;
- простота генетической организации
Но возможности традиционной селекции ограничены. Успехи же таких наук как молекулярная биология и генетика в изучении микроорганизмов, а так же возрастающие потребности практического использования микробных продуктов привели к созданию новейших методов целенаправленного и контролируемого получения микроорганизмов с заданными свойствами.
К новейшим методам селекции относят генную инженерию. В генной инженерии используют два способа:
- выделение нужного гена из генома одного организма и внедрение его в геном бактерий;
- синтез искусственным путем гена и внедрение его в геном бактерий.
4. В чем особенности методов генной инженерии?
Ответ. Успехи, достигнутые молекулярной биологией и генетикой в изучении микроорганизмов, а также ограниченность возможностей традиционной селекции привели к созданию новых методов целенаправленного и контролируемого получения микроорганизмов с заданными свойствами.
В основе этих технологий лежат приемы генной инженерии. Они позволяют выделять необходимый ген и вводить его в новое генетическое окружение с целью создания организма с новыми, заранее предопределенными признаками.
Методы генной инженерии остаются еще очень сложными и дорогостоящими. Но уже сейчас с их помощью в промышленности получают такие важные медицинские препараты, как интерферон, гормоны роста, инсулин и другие.
5. Какие перспективы открывают методы генной инженерии в селекции микроорганизмов?
Ответ. Для того чтобы обеспечить себя доброкачественной пищей и сырьем и при этом не привести планету к экологической катастрофе, человечеству необходимо научиться эффективно изменять наследственную природу живых организмов. Поэтому не случайно главной задачей селекционеров в наше время стало решение проблемы создания новых форм растений, животных и микроорганизмов, хорошо приспособленных к индустриальным способам производства, устойчиво переносящих неблагоприятные условия, эффективно использующих солнечную энергию и, что особенно важно, позволяющих получать биологически чистую продукцию без чрезмерного загрязнения окружающей среды. Принципиально новыми подходами к решению этой фундаментальной проблемы является использование в селекции генной и клеточной инженерии. Генная (генетическая) инженерия. Это раздел молекулярной генетики, связанный с целенаправленным созданием новых молекул ДНК, способных размножаться в клетке-хозяине и осуществлять контроль за синтезом конечных продуктов метаболизма. Возникнув на стыке химии нуклеиновых кислот и генетики микроорганизмов, генная инженерия занимается расшифровкой структуры генов, их синтезом и клонированием, встраиванием выделенных из клеток живых организмов или вновь синтезированных генов в клетки растений и животных с целью направленного изменения их наследственных свойств. Для осуществления переноса генов (или трансгенеза) от одного вида организмов в другой, отдаленный по своему происхождению, необходимо выполнить несколько сложных операций:
• выделение генов (отдельных фрагментов ДНК) из клеток бактерий, растений или животных. В отдельных случаях эту операцию заменяют искусственным синтезом нужных генов;
• соединение (сшивание) отдельных фрагментов ДНК любого происхождения в единую молекулу в составе плазмиды;
• введение гибридной плазмидной ДНК, содержащей нужный ген, в клетки хозяина;
• копирование (клонирование) этого гена в новом хозяине с обеспечением его работы.
• для такого переноса можно использовать естественные механизмы, созданные природой;
• получать фрагменты хромосом значительно легче, чем выделять отдельные гены и пытаться встраивать их в геном реципиента.
Клеточная инженерия основана на использовании методов культивирования изолированных клеток и тканей на искусственной питательной среде в экспериментальных условиях. Этот метод основан на способности растительных клеток в результате регенерации формировать целое растение из единичной клетки. Условия регенерации разработаны для многих культурных растений: картофеля, пшеницы, ячменя, кукурузы, томата и др. Работа с этими объектами делает возможным использование в селекции нетрадиционных методов клеточной инженерии, таких, как соматическая гибридизация, гаплоидия, клеточная селекция, преодоление нескрещиваемости в культуре и др. Соматическая гибридизация — это слияние двух различных клеток в культуре тканей. Сливаться могут разные виды клеток одного организма и клетки разных, иногда очень далеких видов, например: мыши и крысы, кошки и собаки, человека и мыши. Очень важное направление клеточной инженерии связано с ранними стадиями эмбриогенеза. Например, оплодотворение яйцеклеток в пробирке уже сейчас позволяет преодолевать некоторые распространенные формы бесплодия у человека. У сельскохозяйственных животных с помощью инъекции гормонов удается получить от одной коровы-рекордистки десятки яйцеклеток, оплодотворить их в пробирке спермой породистого быка, а затем имплантировать в матку других коров и таким путем получить от одного ценного экземпляра в 10 раз больше потомства, чем это было возможно обычным путем. Культуру растительных клеток выгодно использовать для быстрого размножения медленно растущих растений: женьшеня, маслинной пальмы, малины, персиков и др. Так, при обычном разведении куст малины может дать не более 50 отростков и год, в то время как с помощью культуры клеток можно получить более 50 тыс. растений. При таком разведении иногда возникают растения более продуктивные, чем исходный сорт. Так были получены новые ценные сорта картофеля и грейпфрута.

Содержание:
Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
Если внести в растение, микроорганизм, организм животного или даже человека новые гены, можно наделить его новой желательной характеристикой, которой до этого он никогда не обладал. С этой целью сегодня генная инженерия используется во многих сферах. Например, на ее основе сформировалась отдельная отрасль фармацевтической промышленности, представляющая собой одну из современных ветвей биотехнологии.

История развития
Истоки
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК. Этот фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их в качестве шаблона для последующего копирования генетической информации.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.

Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
- ZFN разрезает ДНК и вставляет туда заготовленный заранее новый фрагмент с помощью белков с ионами цинка (отсюда название — Zinc Finger Nuclease).
- TALEN делает то же самое, только используя TAL-белки. Для обеих технологий приходится создавать отдельные белки, а это очень долгая работа, поэтому пока два этих метода особого применения не нашли.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.
Использование генной инженерии позволило сократить применение инсектицидов (препаратов для уничтожения насекомых) на 40–60%.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.
Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
Генетическая инженерия, по словам ученых, открывает перед человечеством большие возможности по уничтожению генетических заболеваний и созданию организмов, которые ранее не существовали. Но в то же время все не так просто, и подтверждением тому является технология CRISPR/Cas9, которая функционирует вовсе не идеально. Ошибки, которые она допускает, достаточно редки, но подобных ошибок достаточно и одной, чтобы иметь для человека фатальные последствия.
Изначально данная система была создана не учеными, а самой природой.
Это механизм, который на молекулярном уровне существует внутри бактерий и который позволяет им бороться в паразитами, в частности, бактериофагами. Таким образом, он фактически работает как иммунитет против инфекций. CRISPR – это определенные участки ДНК, в которых содержатся фрагменты ДНК-вирусов, ранее заражавших предков бактерий, существующих сегодня, но побежденных внутренней защитой этих бактерий. Данные фрагменты носят название спейсеры. Они разделяются между собой повторяющимися последовательностями.
После проникновения бактериофага внутрь бактерии, все повторяющиеся последовательности и спейсер, который к ним примыкает, используются кА шаблон для синтеза молекул crРНК. Таким образом происходит образование множества разных цепочек РНК, которые связаны с белком Cas9, задача которого заключается в том, чтобы разрезать ДНК вируса. Но сделать это белок сможет только после того, как crРНК отыщет фрагмент вирусной ДНК, который ей соответствует. После того, как чужеродная нуклеиновая кислота разрывается Cas9, она уничтожается другими нуклеазами.
Для замены в геноме одного специфического участка другим, нужно синтезировать направляющую РНК, по принципу своего действия аналогичной crРНК. Эта РНК указывает белку Cas9, в каком месте ДНК необходимо разорвать две цепочки модифицируемого организма. Но необходимо учитывать, что ген нужно не испортить, а лишь модифицировать его, в частности, убрать мутацию или заменить нуклеотиды. И опять помогает природа. Естественные процессы восстановления сразу же начинают регенерировать прерванную цепочку. При этом некоторые фрагменты РНК, которые расположены рядом с разрывом, удаляются, и на их место вставляются похожие последовательности. Ученые могут вставить на их место собственные последовательности ДНК и изменить геном.
Но ничего идеального не существует. Система CRISPR/Cas9, несмотря на достаточно высокую точность, се же иногда делает ошибки. Одна причина кроется в самой системе. Бактерии не нужно, чтобы фрагмент вирусной ДНК на 100 процентов совпадал с crРНК. Бактерии необходимо, чтобы некоторые нуклеотиды отличались. Таким образом микроорганизм получает больше шансов побороть инфекции. Но в генной инженерии последствия могут быть гораздо серьезнее – изменения можно внести в те места, где это не требуется. Если подобное произойдет в процессе экспериментов на мышах, ничего страшного не произойдет, но если подобная ошибка случится в процессе редактирования человеческого генома, это может обернуться настоящей трагедией.
Таким образом, совершенно неудивительна озабоченность западных специалистов исследованиями, проводящимися в Китае. Азиатские ученые при помощи системы CRISPR/Cas9 пустили в ход генные модификации человеческого эмбриона. На территории Европы и Соединенных Штатов Америки подобные эксперименты были запрещены, но относительно недавно их разрешила- исключительно в исследовательских целях – Великобритания. Предполагается, что подобные эмбрионы должны уничтожаться через несколько недель после получения, чтобы исключить риск выведения генетически модифицированных людей.
В начале декабря в одном из изданий была опубликована статья исследователей из Торонтского университета, в которой говорится о создании анти- CRISPR – системы, позволяющей при определенных условиях выключать механизм. Она дает возможность предотвратить возможные ошибки путем подавления белка Cas9 в случае связи направляющей РНК не с тем ферментом. Состоит такая анти- CRISPR из тех белков, которые кодируются генами одного из бактериальных вирусов и подавляют нуклеазу.
В настоящее время технология CRISPR применяется при лечении таких серьезных заболеваний, как рак легких и лейкоз. Помимо этого, технологию испытывают для очистки от ВИЧ иммунных клеток. Чем больше ученым удастся отыскать новых способов модернизации этого метода, тем больше возможностей его применения у них появится.

Несмотря на существование очевидных преград и трудностей, которые подчас встают на пути развития и внедрения продуктов генной инженерии (ГИ), XXI век уже невозможно представить без плодов этой важной и многообразной технологии в арсенале современного биолога. Наиболее часто используемым организмом в ГИ являются бактерии.
Что такое ГИ и зачем она нам нужна? Почему бактерии так популярны у генных инженеров? В каком виде проще всего внести нужный ген в бактерию? С какими трудностями можно столкнуться, работая с этими организмами? Что произошло раньше: создание первой генноинженерной бактерии или открытие структуры ДНК и генома? Об этом и многом другом читайте под катом.
0. Краткий ликбез по биологии
В данном пункте приведено краткое описание так называемой Центральной догмы молекулярной биологии. Если вы обладаете базовыми знаниями в молекулярной биологии, то смело переходите к пункту 1.

Центральная догма молекулярной биологии в одной картинке
Итак, начнём. Вся информация о всех стадиях развития и свойствах любого организма, будь то прокариоты (бактерии), археи или эукариоты (все остальные одно- и многоклеточные), закодирована в геномной ДНК, которая представляет собой комплекс двух комплементарных друг другу полинуклиотидных цепей, образующих двойную спираль (комплементарные нуклеотиды ДНК: A-T и G-C). Хромосомы эукариот представляют собой линейные двухцепочечные молекулы ДНК, а хромосомы прокариот закольцованы. Зачастую гены составляют лишь небольшую часть всего генома (у человека — около 1,5%).

Две комплементарные друг другу цепи ДНК. Пунктирными линиями показаны водородные связи между основаниями. Как видно, аденин и тимин образуют между собой две водородные связи, а гуанин и цитозин — три. Поэтому связь G-C прочнее и GC-богатые участки двухцепочечной ДНК сложнее разделить на две цепочки.
Цепочки ДНК и РНК.
Последовательности ДНК и РНК всегда записывают от 5'-конца к 3'-концу. На то есть ряд причин:
- Синтез новых цепочек ДНК и РНК начинается с 5'-конца (ДНК-полимеразы (ферменты, синтезирующие комплементарную цепь ДНК на матрице ДНК или РНК) и РНК-полимеразы (ферменты, синтезирующие комплементарную цепь РНК на матрице ДНК или РНК) идут по матрице в направлении 3' -> 5', стало быть новая цепь синтезируется в направлении 5' -> 3');
- Рибосома читает кодоны, передвигаясь по мРНК в направлении 5' -> 3';
- Последовательность аминокислот записана в кодирующей цепи ДНК в направлении 5' -> 3' (значащая часть мРНК представляет собой точную копию участка кодирующей цепи ДНК с заменой тимина на урацил и с гидроксильной группой (-OH) вместо водорода в положении 2', разумеется);

Процесс трансляции, катализируемый рибосомой. На рисунке находящиеся в составе мРНК кодоны UUU и UCG распознаются находящимися в составе молекул тРНК антикодонами AAA и AGC. Транспортная РНК с антикодоном CCC уже отдала свою аминокислоту растущей белковой цепочке, а тРНК с антикодоном CAG ждёт своей очереди. Показанный на рисунке участок молекулы мРНК состоит из четырёх кодонов: GGGUUUUCGGUC. Кодон GGG соответствует аминокислоте глицину, UUU — фенилаланину, UCG — серину, GUC — валину. Значит данный участок мРНК кодирует фрагмент белка с аминокислотной последовательностью глицин-фенилаланин-серин-валин.
Рибосомные РНК — незаменимые компоненты рибосомы. Основной функцией рРНК является обеспечение процесса трансляции: она участвует в считывании информации с мРНК при помощи адапторных молекул тРНК и катализе образования пептидных связей между присоединёнными к тРНК аминокислотами и растущей цепью белка.
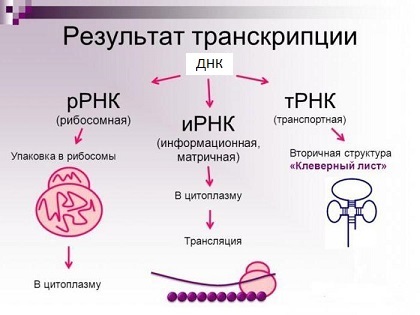
Основные типы молекул РНК (на самом деле их куда больше).


В случае с генами, кодирующими белок процесс расшифровки генетической информации выглядит так:

Прокариотический транскприпционный комплекс. Указанные на рисунке буквы являются общепринятыми обозначениями соответствующих субъединиц. σ70 — сигма фактор генов домашнего хозяйства E. coli

Кодоны в стандартном генетическом коде. Спасибо википедии за картинку.
1) Для каких целей используются бактерии в генной инженерии и почему именно они
Бактерия в генной инженерии — это потенциальный исходный материал для создания:
Интересным является тот факт, что первые успешные опыты в области генной инженерии бактерий произошли задолго до эпохальной работы Уотсона и Крика. Более того, на основании этих опытов был доказан сам факт того, что информация содержится именно в ДНК, после чего учёные могли не тратить своё время на гипотезы об РНК и белке.
Таким образом, было доказано, что носителем информации о признаках является именно ДНК. Кроме того, было наглядно показано, что возможно самопроизвольное проникновение инородной молекулы ДНК в бактериальную клетку.
Почему бактерии так популярны при очевидных недостатках (например, отсутствие эукариотических посттрансляционных модификаций)? Всё просто. Они неприхотливы в работе, просты в использовании и не требуют дорогих питательных сред.
2) Как создаётся генетическая конструкция, которую внедряют в бактерию
Современная генная инженерия бактерий в основном представляет собой внедрение плазмидного вектора (модифицированной бактериальной плазмиды, содержащей целевой ген и набор других необходимых элементов, о которых речь пойдёт ниже). Изменение хромосомы бактерии менее типично, но эта процедура также не является чем-то диковинным: например, ген РНК-полимеразы бактериофага Т7 был введёт в хромосому кишечной палочки с помощью вектора на основе профага λ в процессе создания одного из популярных в лабораторной плактике штаммов. Причин, по которым зачастую исследователь выберет внедрение гена в составе плазмидного вектора три:
- во-первых, внедрить плазмидный вектор в бактерию дешевле, чем встроить что-то в хромосому;
- во-вторых, методология обеспечения стабильности и наследования плазмидного вектора в бактериальной клетке, а также сама процедура создания нужной генетической конструкции хорошо отработана и проста в исполнении;
- в-третьих, с плазмидными векторами всё и так прекрасно работает.
Кроме гена и промотора основными элементами плазмидного вектора являются:
-
— область начала репликации плазмиды. Нужна для поддержания постоянного количества плазмиды и её наследования дочерними клетками;
Другим примером может служить, использование гена β-глюкуронидазы (GUS). Данный фермент превращает определённые соединения в окрашенные или флуоресцирующие, что может быть обнаружено визуально по окрашенности колонии. Естественно, данные соединения нужно добавлять в питательную селективную среду. Ещё один пример — использование гена зелёного флуоресцентного белка (GFP) (хотя использование GUS и GFP более типично для работ с клетками растений и животных);
Упрощённая схема плазмидного вектора. На рисунке обозначены ori, ген резистентности к антибиотику и полилинкер, содержащий 10 сайтов рестрикции эндонуклеазами.
Что ж, вектор у нас на руках. Как в него встроить ген? И вообще, где этот ген взять?
Допустим, что мы знаем последовательность нуклеотидов нужного нам гена. Тогда поступают следующим образом:
- Химически синтезировать короткие одноцепочечные полинуклеотиды таким образом, чтобы они частично перекрывались;
- Объединить эти фрагменты с помощью ПЦР.
Слева изображён процесс сборки гена методом перекрывающихся праймеров (более подробно процедура описана в спойлере ниже). Справа изображён процесс вставки гена в вектор.


На рисунке синими полосками показаны частоты кодонов у землеройки, тупайи, домашней кошки, лошади, мышиного лемура, шимпанзе и человека. Красной полосой отмечена частота кодонов у кишечной палочки E. coli.
-
Система на основе регуляторных элементов лактозного оперона E. coli (lac-оперона) и сильного промотора.
Дело в том, что у кишечной палочки есть свои правила питания. Во-первых, существует механизм подавления активности lac-оперона, который включён только тогда, когда в клетку не поступает лактоза. Это логично: зачем тратить силы на синтез того, что не пригодится? Но как только лактоза начинает поступать в клетку в достаточном количестве этот механизм выключается.
Однако, есть второй механизм подавления активности lac-оперона. Если в среде есть глюкоза, то клетка питается исключительно глюкозой, так как она активирует второй механизм ингибирования транскрипции lac-оперона. Таким образом, lac-оперон активен только тогда, когда в окружающем клетку пространстве есть только лактоза. Минусом лактозного оперона является крайне слабый промотор, поэтому в штаммах продуцентах он заменён на сильный. Сильные промоторы часто получают из патогенов. Наиболее широко используемые в генной инженерии прокариот сильные промоторы выделены из бактериальных вирусов — бактериофагов. Например, широко используется промотор фага Т7.
К слову, некоторые сильные промоторы для генной инженерии растений также выделены из вирусов, например, это промотор вируса мозаики цветной капусты.

Как было указано выше, у E. coli нет РНК-полимеразы, которая бы узнавала промоторы бактериофагов, поэтому предварительно в продуцент встраивают ген РНК-полимеразы соответствующего бактериофага.
Можно поступить и по-другому: вообще не добавлять в питательную среду глюкозу и лактозу, а потом, когда культура дорастёт до нужной плотности, добавить то, что клетка примет за лактозу, но не сможет метаболизировать или разрушить. Сейчас в качестве такого индуктора используют ИПТГ.
Читайте также:
- Что такое симбиотрофы кратко
- Почему в условиях рынка необходима динамичность банковской системы кратко
- Содержательная интеграция деятельности воспитателя со специалистами доу во 2 младшей группе
- Какие документы должны быть в школе по методической работе
- Христианство как основа средневековой философии кратко

