Как влияет тепловое движение молекул и атомов на агрегатное состояние вещества кратко
Обновлено: 02.07.2024
Да, собственно, никак.
Во всех случаях характер теплового движения молекул и атомов хаотичен.
Для агрегатного состояния важно соотношение потенциальной энергии взаимодействия молекул и кинетической энергии теплового движения.
Пригрей парня и ответ сам придёт, даже как молекулы о беременности вопрос решают
Мы постоянно добавляем новый функционал в основной интерфейс проекта. К сожалению, старые браузеры не в состоянии качественно работать с современными программными продуктами. Для корректной работы используйте последние версии браузеров Chrome, Mozilla Firefox, Opera, Microsoft Edge или установите браузер Atom.
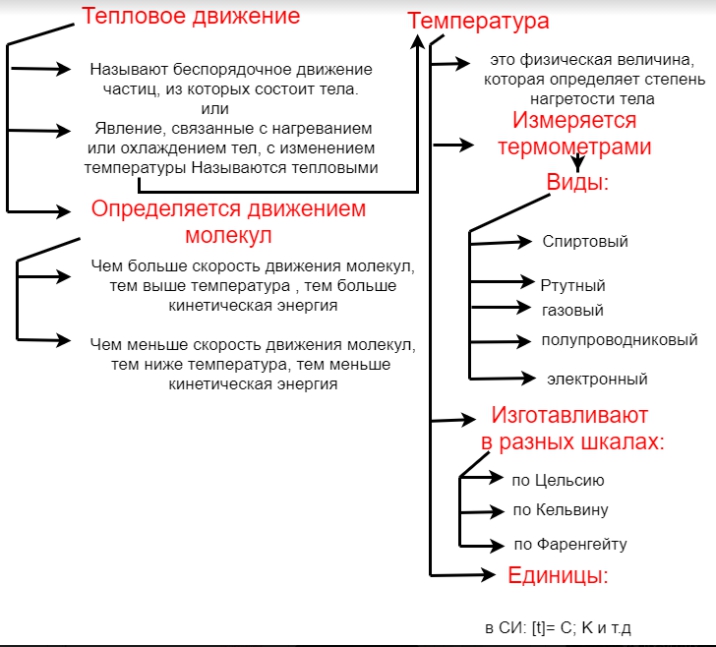
1. Понятие о тепловом явлении
В окружающем нас мире происходят различные физические явления, которые связаны с нагреванием и охлаждением тел. Словами холодный, теплый, горячий, мы указываем на степень нагревания тела. То есть указываем на различную температуру тел. Следовательно температурой называют физическую величину которая определяет степень нагревания тела. Явления, связанные с нагреванием или охлаждением тел, то есть изменением температуры, называют тепловыми. К тепловым явлениям относятся, например нагревания и охлаждения воздуха, таянии льда, плавления металлов, испарение воды и другие.
2. Понятие о температуре. Виды термометров
Температурой называют физическую величину, которая определяет степень нагревания тела.
Температура измеряется разными термометрами:
- Спиртовой термометр.
- Ртутный термометр.
- Газовый термометр.
- Полупроводниковый термометр.
- Электронный термометр.
Температуру измеряют в градусах по Цельсию. Кроме шкалы по Цельсию существуют еще шкала по Кельвину и шкала по Фаренгейту.
3. Зависимость кинетической энергии движения молекул от температуры
- Зависимость кинетической энергии движения молекул от температуры
Молекулы или атомы, из которых состоят тела, находятся в непрерывном беспорядочном движении. Их количество, в окружающих телах очень велико. Так как движение частиц связано с температурой, то чем выше температура, тем скорость движения молекул или атомов больше. Чем меньше температура, тем скорость движения частиц меньше. Поэтому скорость движения молекул зависит от температуры. Температура тела находится в тесной связи со средней кинетической энергией молекул. Чем выше температура тела, тем больше средняя кинетическая энергия его молекул. При понижении температуры тела, средняя кинетическая энергия его молекул уменьшается.
В тепловом движении участвуют все молекулы тела, поэтому с изменением теплового движения, изменяется и состояние тела, его свойства. Так, при повышении температуры, лед начинает таять, превращаясь в жидкость. Если понижать температуру, например ртути, то она из жидкости превращается в твердое состояние.
4. Понятие теплового движения частиц
Беспорядочное движение частиц, из которых состоят тела, называют тепловым движением.
Молекулы или атомы, из которых состоят тела, находятся в непрерывном беспорядочном движении. Их количество в окружающих нас телах очень велико. Например, в одном кубическом сантиметре воды содержится 3,34*10 в 22 степени. И поэтому изучить движение молекул, очень сложно.
Как уже отмечалось выше, одним из важнейших параметров, характеризующих молекулу, является минимальная потенциальная энергия взаимодействия EP0. Силы притяжения, действующие между молекулами стремятся сконденсировать вещество, т.е. сблизить его молекулы до расстояния r0 (рис.3), когда их потенциальная энергия взаимодействия минимальна и равна EP0, но этому сближению препятствует хаотическое тепловое движение молекул. Интенсивность этого движения определяется средней кинетической энергией молекулы, которая имеет порядок kT, где k - постоянная Больцмана. Агрегатные состояния вещества существенным образом зависят от соотношения величин EP0 и kT.
Предположим, что температура рассматриваемой системы молекул столь высока, что kT >> EP0. В этом случае интенсивное хаотическое тепловое движение мешает силам притяжения соединить молекулы в агрегаты из нескольких частиц, сблизившихся до расстояния r0: при соударениях большая кинетическая энергия молекул будет легко разбивать эти агрегаты на составляющие молекулы и, таким образом, вероятность образования устойчивых агрегатов будет как угодно малой. В этих обстоятельствах рассматриваемые молекулы, очевидно, будут находиться в газообразном состоянии.
Если температура системы частиц очень низкая, т.е. kT
Подытоживая, можно сказать, если вещество находится при
очень низкой температуре, то молекулы имеют очень малую кинетическую энергию и силы притяжения удерживают молекулы вместе в упорядоченной плотно упакованной структуре, или решетке. При этом молекулы совершают колебания возле узлов (положений равновесия) кристаллической решетки с амплитудой тем меньшей, чем ниже температура. Если к кристаллу подвести энергию, его температура повышается, и молекулы все сильнее колеблются относительно своих равновесных положений. Если к кристаллу подведена достаточная энергия, то упорядоченная структура молекулярного кристалла разрушается кинетической энергией теплового движения и молекулы получают возможность свободно "скользить" одна вдоль другой, хотя по-прежнему соприкасаются друг с другом. Эта ситуация соответствует жидкому состоянию, а температура перехода между кристаллическим и жидким состоянием определяется по порядку величины определяется из равенства kTпл = EP0 , где Tпл - температура плавления вещества. Жидкость по-прежнему удерживается силами притяжения, хотя молекулы имеют достаточно большую кинетическую энергию движения, чтобы оставаться в фиксированных положениях равновесия. Если к жидкости подвести еще дополнительную энергию, молекулы начинают двигаться достаточно быстро и способны преодолевать силы притяжения, полностью отделяясь друг от друга и двигаясь в пространстве по независимым траекториям. Эта ситуация соответствует газообразному состоянию, а температура перехода между жидкостью и газом называется температурой кипения.

В заключение этого параграфа отметим, какие виды движений испытывает молекула вещества, находящегося в определенном агрегатном состоянии.
При нормальных условиях расстояние между молекулами в газе в десятки раз (см.пример параграфа 1.1) превышают их размеры; большую часть времени они движутся прямолинейно без взаимодействия и только значительно меньшую часть времени, когда находятся на близких расстояниях от других молекул, взаимодействуют с ними, меняя направление своего движения. Таким образом, в газообразном состоянии движение молекулы выглядит так, как схематично показано на рис.6,а.

В твердом состоянии каждая молекула (атом) вещества находится в равновесном положении (узел кристаллической решетки), возле которого она совершает малые колебания, причем направление (к примеру, аа ′ на рис.6,б) и амплитуда этих колебаний случайно изменяются (к примеру, на направление bb ′ ) через время, значительно большее периода этих колебаний; частоты колебаний молекул, расположенных в разных местах, в общем случае, неодинаковы. Траектория движения отдельной молекулы твердого тела в общих чертах представлена на рис.6,б.
Молекулы твердого тела упакованы так плотно, что расстояние между ними примерно равно их диаметру, т.е. расстоянию r0 на рис.3. Из опыта известно, что плотность жидкого состояния примерно на 10 % меньше плотности твердого, при прочих равных условиях. Поэтому расстояние между молекулами жидкого состояния несколько больше r0. Учитывая, что в жидком состоянии молекулы обладают еще и большей кинетической энергией теплового движения, следует ожидать, что, в отличие от твердого состояния, они могут, совершая колебательное движение, достаточно легко менять свое местоположение, перемещаясь на расстояние, существенно не превышающее диаметр молекулы. Траектория движения молекулы жидкости в главных чертах выглядит так, как схематически показано на рис.6,в. Таким образом, движение молекулы в жидкости сочетает в себе поступательное движение, как это имеет место в газе, с колебательным, что наблюдается в твердом теле.
Несмотря на неодинаковый характер движения молекул в различных агрегатных состояниях, общим является случайность, непредсказуемость этих движений. Средняя кинетическая энергия этих беспорядочных движений определяет тепловое состояние вещества, его температуру.
Как уже отмечалось выше, одним из важнейших параметров, характеризующих молекулу, является минимальная потенциальная энергия взаимодействия EP0. Силы притяжения, действующие между молекулами стремятся сконденсировать вещество, т.е. сблизить его молекулы до расстояния r0 (рис.3), когда их потенциальная энергия взаимодействия минимальна и равна EP0, но этому сближению препятствует хаотическое тепловое движение молекул. Интенсивность этого движения определяется средней кинетической энергией молекулы, которая имеет порядок kT, где k - постоянная Больцмана. Агрегатные состояния вещества существенным образом зависят от соотношения величин EP0 и kT.
Предположим, что температура рассматриваемой системы молекул столь высока, что kT >> EP0. В этом случае интенсивное хаотическое тепловое движение мешает силам притяжения соединить молекулы в агрегаты из нескольких частиц, сблизившихся до расстояния r0: при соударениях большая кинетическая энергия молекул будет легко разбивать эти агрегаты на составляющие молекулы и, таким образом, вероятность образования устойчивых агрегатов будет как угодно малой. В этих обстоятельствах рассматриваемые молекулы, очевидно, будут находиться в газообразном состоянии.
Если температура системы частиц очень низкая, т.е. kT ′ на рис.6,б) и амплитуда этих колебаний случайно изменяются (к примеру, на направление bb ′ ) через время, значительно большее периода этих колебаний; частоты колебаний молекул, расположенных в разных местах, в общем случае, неодинаковы. Траектория движения отдельной молекулы твердого тела в общих чертах представлена на рис.6,б.
Молекулы твердого тела упакованы так плотно, что расстояние между ними примерно равно их диаметру, т.е. расстоянию r0 на рис.3. Из опыта известно, что плотность жидкого состояния примерно на 10 % меньше плотности твердого, при прочих равных условиях. Поэтому расстояние между молекулами жидкого состояния несколько больше r0. Учитывая, что в жидком состоянии молекулы обладают еще и большей кинетической энергией теплового движения, следует ожидать, что, в отличие от твердого состояния, они могут, совершая колебательное движение, достаточно легко менять свое местоположение, перемещаясь на расстояние, существенно не превышающее диаметр молекулы. Траектория движения молекулы жидкости в главных чертах выглядит так, как схематически показано на рис.6,в. Таким образом, движение молекулы в жидкости сочетает в себе поступательное движение, как это имеет место в газе, с колебательным, что наблюдается в твердом теле.
Несмотря на неодинаковый характер движения молекул в различных агрегатных состояниях, общим является случайность, непредсказуемость этих движений. Средняя кинетическая энергия этих беспорядочных движений определяет тепловое состояние вещества, его температуру.
Любое вещество состоит из мельчайших частиц — молекул. Молекула — это наименьшая частица данного вещества, сохраняющая все его химические свойства. Молекулы расположены в пространстве дискретно, т. е. на некоторых расстояниях друг от друга, и находятся в состоянии непрерывного беспорядочного (хаотичного) движения.
Поскольку тела состоят из большого числа молекул и движение молекул беспорядочно, то нельзя точно сказать, сколько ударов будет испытывать та или иная молекула со стороны других. Поэтому говорят, что положение молекулы, её скорость в каждый момент времени случайны. Однако это не означает, что движение молекул не подчиняется определённым законам. В частности, хотя скорости молекул в некоторый момент времени различны, у большинства из них значения скорости близки к некоторому определённому значению. Обычно, говоря о скорости движения молекул, имеют в виду среднюю скорость (v$cp ).

Нельзя выделить какое-то определённое направление, в котором движутся все молекулы. Движение молекул никогда не прекращается. Можно сказать, что оно непрерывно. Такое непрерывное хаотическое движение атомов и молекул называют — тепловое движение. Такое название определяется тем, что скорость движения молекул зависит от температуры тела. Чем больше средняя скорость движения молекул тела, тем выше его температура. И наоборот, чем выше температура тела, тем больше средняя скорость движения молекул.

Броуновское движение
Движение молекул жидкости было обнаружено при наблюдении броуновского движения — движения взвешенных в ней очень мелких частиц твердого вещества. Каждая частица беспрерывно совершает скачкообразные перемещения в произвольных направлениях, описывая траектории в виде ломаной линии. Такое поведение частиц можно объяснить, считая, что они испытывают удары молекул жидкости одновременно с разных сторон. Различие в числе этих ударов с противоположных направлений приводит к движению частицы, поскольку ее масса соизмерима с массами самих молекул. Движение таких частиц впервые обнаружил в 1827 г. английский ботаник Броун, наблюдая под микроскопом частицы цветочной пыльцы в воде, почему оно и было названо — броуновское движение.
Читайте также: