Как определить атомность спирта кратко
Обновлено: 07.07.2024
Формула винного, или этилового, спирта (этанола) С2Н5ОН, несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловицем и немецким ученым Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Спирты (алкоголи) – это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп – ОН у насыщенных атомов углерода.
Общая формула спиртов: R(OH)m, m≥1, где R – УВ радикал; m – число функциональных гидроксильных групп – ОН, которое определяет атомность спирта.
Классификация спиртов по строению УВ радикала:![]()
Предельные одноатомные спирты (алканолы)
Общая формула: CnH2n+1OH, n≥1
Гомологический ряд
Изомерия и номенклатура
Первые два члена гомологического ряда – СН3ОН и С2Н5ОН – не имеют изомеров, относящихся к классу спиртов. Для остальных алканолов возможны 2 типа изомерии (в пределах своего класса):
— изомерия цепи (углеродного скелета);
— изомерия положения функциональной группы – ОН.


Спирты изомерны другому классу соединений – простым эфирам (R-O-R):

Электронное строение
Физические свойства
Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностъю (О, N, F, Сl) другой молекулы. Чем большим положительным зарядом обладает атом водорода и чем больше способность другого атома отдавать свои неподеленные электронные пары, тем легче образуется водородная связь (ВС) и тем она прочнее.
Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол и пропанол неограниченно растворяются в воде, с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается, высшие спирты не растворяются в воде.
Химические свойства
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О-Н, С-О, С-Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
I.Реакции замещения
1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О-Н.
а) Взаимодействие с активными металлами с образованием алкоголятов металлов:
Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются:

б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакции этерификации):
2. Замещение гидроксильной группы вследствие разрыва связи С-О.

а) Взаимодействие с галогеноводородами с образованием галогеналканов:
Следует отметить, что спирты можно превратить в галогенпроизводные действием и других реагентов, например хлоридов фосфора:
R – OH + PCl5 → R – Cl + POCl3 + HCl
б) Взаимодействие с аммиаком с образованием аминов.

Реакции идут при пропускании смеси паров спирта с аммиаком при 300 o С над оксидом алюминия:

При избытке спирта алкильными радикалами могут замещаться 2 или 3 атома водорода в молекуле NН3:
II. Реакции отщепления
1.Дегидратация, т.е. отщепление воды
Дегидратация спиртов может быть двух типов: межмолектлярная и внутримолекулярная.

а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—O—R’. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:

Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.

Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
2.Дегидрирование (разрыв связей О – Н и С – Н)

а) При дегидрировании первичных спиртов образуются альдегиды:
В организме человека этот процесс происходит под действием фермента (алкогольдегидрогеназы).

б) При дегидрировании вторичных спиртов образуются кетоны:
в) Третичные спирты не дегидрируются.
III. Реакции окисления
1.Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла:
2.Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Cu), перманганата калия, дихромата калия и др.

Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования:
Способы получения алканолов
Кроме прямой гидратации этилена, существует также сернокислотная гидратация, протекающая в две стадии:
— на первой стадии этилен поглощается серной кислотой:
— на второй стадии этилсерная кислота гидролизуется с образованием этилового спирта и серной кислоты:

При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты:
2.Гидролиз галогеналканов
При действии водного раствора NaOH атом галогена в галогеналкане замещается группой —ОН:
Обратите внимание, что при действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена (см. способы получения алкенов).
3. Гидрирование альдегидов и кетонов
Как уже было отмечено выше, дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция — гидрирование альдегидов и кетонов — является, таким образом, их восстановлением.
4.Специфические методы получения метанола и этанола
Этанол образуется при брожении (ферментации) углеводов – глюкозы или крахмала:
Предельные многоатомные спирты
Свойства многоатомных спиртов рассмотрим на примере простейшего трехатомного спирта – глицерина, или пропантриола-1,2,3:
Физические свойства
Глицерин – вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с t о кип.=230 о С. Смешивается с водой во всех отношениях.
Химические свойства
I. Замещение атомов водорода гидроксильных групп

1.Как и одноатомные спирты, многоатомные спирты взаимодействуют со щелочными металлами; при этом могут образовываться моно-, ди- и тризамещенные продукты:
Нерастворимый в воде Cu(OH)2 голубого цвета растворяется в глицерине с образованием ярко-синего раствора глицерата меди (II). Эта реакция является качественной реакцией на все многоатомные спирты.

3.Многоатомные спирты, как и одноатомные, взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров:
II. Замещение гидроксильных групп

Наиболее известными реакциями этого типа является взаимодействие многоатомных спиртов с галогеноводородами. Например, при взаимодействии глицерина с хлороводородом ОН-группы последовательно замещаются атомами хлора:
Способы получения глицерина

1.Гидролиз жиров – основной способ получения глицерина:
2. Синтез из пропилена

В последнее время глицерин получают из пропилена. Существует несколько вариантов этого синтеза. По одному из них пропилен хлорируют при t o = 440—500 о С, полученный аллилхлорид гидролизуют раствором NaOH. На полученный в результате гидролиза аллиловый спирт действуют пероксидом водорода Н2О2, который в присутствии катализатора присоединяется к спирту по двойной связи с образованием глицерина. Весь процесс можно представить схемой:
Применение важнейших спиртов


В медицине С2Н5ОН применяется как дезинфицирующее средство и средство для компрессов, используется для приготовления экстрактов и настоек, как растворитель для многих лекарственных препаратов.

*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Похожие решебники
Популярные решебники 10 класс Все решебники

Главная задача сайта: помогать школьникам и родителям в решении домашнего задания. Кроме того, весь материал совершенствуется, добавляются новые сборники решений.


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Понятие о спиртах"
Понятие о спиртах
Спирты – это органические вещества, в молекулах которых углеводородный радикал связан с гидроксильной группой – ОН.
Число гидроксильных групп – ОН в молекуле определяет атомность спирта. Если в молекуле спирта одна группа ОН, значит это одноатомный спирт, если две группы ОН, значит это двухатомный спирт, если три группы ОН, то это трёхатомный спирт.
Общая формула спиртов CnH2n+1OH, или R–OH, где R – это углеводородный радикал.
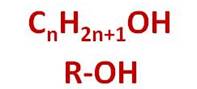
Запомни, друг, и я и ты:
В них углерод и гидроксид,
И каждый спирт легко горит.
R – это значит: радикал,
Насыщенный иль непредельный.
Он может быть велик и мал,
Но это разговор отдельный…
Названия одноатомных спиртов образуются от названий соответствующих углеводородов с прибавлением суффикса – ол.

Спирты, имеющие от одного до одиннадцати атомов углерода находятся в жидком агрегатном состоянии, начиная с двенадцати атома углерода – это спирты представляющие собой твёрдые вещества. Первые три представителя спиртов имеют алкогольный запах, они бесцветны и хорошо растворимы в воде. Среди спиртов отсутствуют газы из-за наличия водородных связей, кроме этого водородная связь обуславливает более высокие температуры кипения спиртов по сравнению с углеводородами с тем же числом атомов углерода.
Рассмотрим спирт метанол и этанол.
Метанол, или метиловый спирт CH3OH представляет собой бесцветную жидкость, кипит при температуре 64,7 0 C. С водой смешивается в любых соотношениях, имеет своеобразный запах. Метанол чрезвычайно ядовит, опасны и его пары. Метанол является ядом нервно-паралитического действия, употребление небольшой его дозы приводит к потере зрения и даже смерти человека.


Метиловый спирт впервые был получен при сухой перегонке древесины. По этой причине его ещё называют древесным спиртом.


Формулу древесного спирта установил французский химик Дюма в 1834 году и только через двадцать пять лет метиловый спирт был получен синтетическим путём.


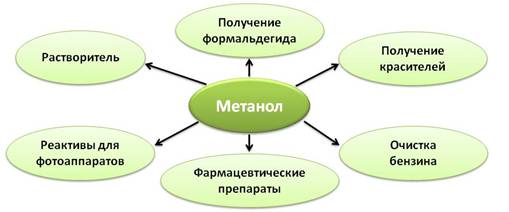
Горит метанол бесцветным пламенем. Его используют как растворитель, для получения формальдегида, красителей, реактивов для фотоаппаратов, получения фармацевтических препаратов и для очистки бензина.
Этанол, или этиловый спирт C2H5OH представляет собой бесцветную жидкость со слабым запахом и жгучим вкусом. Он легче воды и обладает характерным алкогольным запахом. Этанол – летучая жидкость. Его температура кипения 78,3 0 C. Смешивается с водой во всех соотношениях и является хорошим растворителем.

Этиловый спирт – наркотик. При приёме внутрь он быстро всасывается в кровь, проникая в головной мозг, спирт действует на нервные клетки и вызывает опьянение. Под влиянием спиртного у человека ослабляет внимание, затормаживается реакция, изменяется поведение. Употребление спиртных напитков приводи к тяжёлому заболеванию – алкоголизму.

Химические свойства спиртов обусловлены наличием в них функциональных групп – OH.
Таким образом, функциональная группа – это группа атомов, определяющая наиболее характерные свойства классов органических соединений.
Атом водорода при группе OH очень подвижный, поэтому спирты проявляют слабые кислотные свойства.

По этой причине спирты вступают в химические реакции с активными металлами. В результате взаимодействия этанола с натрием образуется соединение – этилат натрия и водород. Продукты замещения атома водорода гидроксильной группы на атом металла называют алкоголятами.



Для спиртов характерны реакции окисления. Например, при окислении этанола образуется уксусный альдегид. Эту реакцию иллюстрирует следующий опыт. Накалим медную проволоку на пламени спиртовки. На проволоке образуется чёрный налёт. Затем опустим эту проволоку в пробирку с этиловым спиртом. Чёрный налёт растворяется и проволока опять приобретает прежний вид. Кроме этого, изменяется и запах, потому что этиловый спирт окислился до альдегида, имеющего специфический запах.

При полном окислении этанола образуется углекислый газ и вода. Он легко воспламеняется и горит слабо светящимся голубоватым пламенем.

При взаимодействии спиртов с галогеноводородами образуются галогеналканы. Например, в реакции этанола с бромоводородом образуется бромэтан и вода.
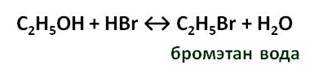
В промышленности этанол получают реакцией гидратации этилена в присутствии серной кислоты.

Таким методом получают технический этиловый спирт, который содержит примеси метилового спирта. Пищевой этиловый спирт получают ферментативным расщеплением сахаристых веществ.
Ректификат – этиловый спирт, содержащий четыре с половиной процента воды, а абсолютный спирт – это безводный спирт. Денатурат – это этанол, содержащий цветные и дурнопахнущие вещества.
Этиловый спирт, в громадных количествах, используется для технических нужд. Его применяют как растворитель в лакокрасочной и химико-фармацевтической промышленности, для синтеза красителей и синтетического каучука, получения пластмасс, духов, при консервировании анатомических препаратов, для получения уксусной кислоты, антифризов, взрывчатых веществ, бытовой химии.

Особенно большое значение этиловый спирт приобрёл после того, как в 1930 году химик Лебедев открыл способ производства каучука из этанола.

Этиловый спирт используют в медицине для компрессов, обтираний, дэзинфекции кожи перед уколом.

Его широко применяют для изготовления настоек и экстрактов, а также для лекарств. Этиловый спирт – основное сырьё ликёроводочных и винных производств.

Для получения этилового спирта используют также реакцию брожения сахаристых веществ.
При брожении глюкозы образуется этанол и углекислый газ.

Рассмотрим многоатомные спирты: двухатомный спирт этиленгликоль и трёхатомный спирт – глицерин.
Этиленгликоль – бесцветная густая жидкость, тяжелее воды. Кипит при температуре 197 0 C, замерзает при температуре 13 0 C. Он ядовит и имеет сладкий вкус. Этиленгликоль не имеет запаха и смешивается с водой в любых соотношениях, он гигроскопичен.


Этиленгликоль применяют в качестве антифризов, для получения лавсана и взрывчатых веществ.

Трёхатомный спирт – глицерин представляет собой сиропообразную бесцветную жидкость со сладким вкусом, температура кипения 290 0 C, температура замерзания -17 0 C. Глицерин хорошо растворим в воде и гигроскопичен.

Глицерин открыл знаменитый шведский химик Шееле в 1779 году. Он нагревал оливковое масло с кислотой и получил мазь, которая оказалась сладкой на вкус. Из мази Шееле выделил вязкую жидкость, которую назвал масляный сахар. Это и был глицерин.


Глицерин применяется в кожевенной промышленности, водные растворы глицерина используют в качестве антифризов, для производства взрывчатых веществ, в текстильной и пищевой промышленности, в фармацевтической и косметической промышленности.

Качественной реакцией на многоатомные спирты является реакция со свежеприготовленным гидроксидом меди (II). Сначала нужно получить гидроксид меди (II). Для этого к раствору гидроксида натрия прильём раствор медного купороса, в результате у нас образуется осадок голубого цвета – это гидроксид меди (II).

После этого, к этому осадку добавим глицерин, осадок растворяется и раствор приобретает ярко-синий цвет.
Таким образом, спирты содержат функциональную группу – ОН, метанол и этанол – представители насыщенных одноатомных спиртов. Характерные свойства спиртов определяются наличием в их молекулах функциональной группы – ОН. Этанол и метанол широко используются во многих отраслях промышленности. Представителями многоатомных спиртов являются этиленгликоль и глицерин. Качественной реакцией на многоатомные спирты является реакция с гидроксидом меди (II). Этиленгликоль и глицерин используют также во многих отраслях производства.
По числу гидроксильных групп - ОН (о, аш) , сколько этих групп, столько и атомов, то есть, если одна гидроксильная группа, то и спирт одноатомный, а так спирты бывают одноатомные, двухатомные и трёхатомные и всё.
Мы постоянно добавляем новый функционал в основной интерфейс проекта. К сожалению, старые браузеры не в состоянии качественно работать с современными программными продуктами. Для корректной работы используйте последние версии браузеров Chrome, Mozilla Firefox, Opera, Microsoft Edge или установите браузер Atom.

По числу гидроксильных групп - ОН, сколько этих групп, столько и атомов.

Что такое атомность спирта ?
Что такое атомность спирта ?
Классифицируйте спирты по этому признаку .

Что определяется номером периода?
Что определяется номером периода?
Заряд ядра атома?
Число энергетических уровней?
Число валентных электронов?

Какие элементы определяет пламенный атомно - абсорбционный анализ?
Какие элементы определяет пламенный атомно - абсорбционный анализ?

Помогите, пожалуйста какие свойства предельных одноатомных спиртов определяются наличием в их молекуле гидроксильной группы, а какие - нет?
Помогите, пожалуйста какие свойства предельных одноатомных спиртов определяются наличием в их молекуле гидроксильной группы, а какие - нет?

Основность и атомность (как спирта) молочной кислоты соответственно равны?
Основность и атомность (как спирта) молочной кислоты соответственно равны.

Приведите уравнение реакций восстановление глюкозы в 6 атомный спирт?
Приведите уравнение реакций восстановление глюкозы в 6 атомный спирт.

Качественая реакция на много атомные спирты?
Качественая реакция на много атомные спирты.

СРОЧНО?
Для окисления предельного одно атомного спирта массой 3, 7 г до альдегида потребовалось 4, 0 г оксида меди(||) Определитель молекулярную формулу спирта.

Здравствуйте помогите, получите одно атомные спирты при восстановлении : а) этилизипропилкетона б) пропанола - 1?
Здравствуйте помогите, получите одно атомные спирты при восстановлении : а) этилизипропилкетона б) пропанола - 1.

При сгорании 3, 68 грамм много атомного спирта образовалось 2, 88 л углекислого газа при нормальных условиях и 2, 89 грамма воды?
При сгорании 3, 68 грамм много атомного спирта образовалось 2, 88 л углекислого газа при нормальных условиях и 2, 89 грамма воды.
В процессе взаимодействия 0, 1 моль данного спирта с избытком натрия выделяется 3, 6 л водорода.
Приведите структурную формулу много атомного спирта и уравнения реакций.
Читайте также:


