Как и почему происходит образование осадка кратко
Обновлено: 02.07.2024
Создание оптимальных условий осаждения при количественных определениях имеет еще большее значение, чем при качественном анализе, так как всякая потеря вещества здесь совершенно недопустима. Поэтому необходимо остановиться на этом - подробнее.
Прежде всего рассмотрим процесс образования осадков. Этот процесс, несомненно, сложнее, чем можно ожидать на основании уравнения реакции. Так, судя по уравнению
Ba 2+ + SO4 2- - BaSO4
можно думать, что для образования сульфата бария нужно только, чтобы встретились в растворе два иона: Ba2+ и SO2T. Но это, конечно, не так.
Осадок BaSO4 выпадает в виде кристаллов, а из двух ионов кристаллическая решетка построена быть не может. Процесс образования твердой фазы в растворе очень сложен.
Почти всегда наблюдается так называемый индукционный период, который длится от момента смешения растворов реагентов, содержащих реагирующие вещества, до появления видимого осадка. Для различных веществ индукционный период различен; например, при осаждении BaSO* он сравнительно велик, при осаждении AgCl - очень непродолжителен.
Наличие индукционного периода объясняется тем, что образование осадка проходит через ряд стадий. В начале образуются зародышевые, или первичные кристаллы. Для их образования в пространстве должно встретиться в определенном соотношении и при определенном расположении довольно большое число реагирующих ионов. В растворе ионы окружены гидратной оболочкой, при формировании осадка она должна быть разрушена.
Образовавшиеся первичные кристаллы еще не создают поверхности раздела, т. е. образование этих первых частиц твердой фазы и соединение их (агрегация) в более крупные, состоящие из десятков, сотен молекул, еще не вызывает выделения вещества в осадок. Эта стадия формирования осадка соответствует существованию коллоидных систем. Затем первичные кристаллы или их агрегаты образуют более крупные частицы и выпадают в осадок. Этот процесс может идти двумя путями, которые определяют форму осадка, т. е. образование кристаллического или аморфного осадка. В первом случае при прибавлении в раствор порций осаждающего реагента не появляются новые центры кристаллизации, новые агрегаты. Раствор некоторое время остается в пересыщенном состоянии.
При постепенном введений осадителя выделение вещества из пересыщенного раствора происходит преимущественно на поверхности ранее образовавшихся зародышевых кристаллов, которые постепенно растут, так что в конце концов получается кристаллический осадок, состоящий из сравнительно небольшого числа относительно крупных кристаллов.
Так идет осаждение обычно тогда, когда растворимость осадка не слишком мала, особенно если приняты меры к повышению ее путем нагревания или прибавления тех или иных реактивов, например кислот.
Иначе происходит процесс образования аморфных осадков. В этом случае прибавление каждой порции осадителя вызывает быстрое возникновение в жидкости огромного количества мельчайших зародышевых кристаллов, которые растут уже не вследствие отложения на их поверхности соответствующего вещества, а в результате их соединения в более крупные, агрегаты, оседающие под влиянием силы тяжести на дно сосуда. Другими словами, происходит коагуляция первоначально образующегося коллоидного раствора.
Поскольку связь между отдельными зародышевыми кристаллами в получающихся агрегатах сравнительно непрочная, эти агрегаты могут снова распадаться с образованием коллоидного раствора.
Форма выделяющегося осадка зависит от индивидуальных свойств веществ. Например, полярные, сравнительно хорошо рас-, творимые вещества (BaSO4, AgCl, PbSO4 и т. п.) выпадают в кристаллическом состоянии.
Но та или иная форма осадка не только связана с индивидуальными свойствами вещества, но и зависит от условий осаждения. Например, при осаждении из разбавленных водных растворов BaSO4 выпадает в виде кристаллического осадка. Если, однако, осаждать его из смеси воды с 30-60% спирта, сильно понижающего растворимость сульфата бария, то образуется коллоидный раствор или аморфный осадок. С другой стороны, осаждая сульфиды в присутствии пиридина C5H5N, получают" некоторые из них в виде кристаллов. Можно считать экспериментально
доказанным, что любое вещество может быть получено как в виде кристаллического, так и в виде аморфного осадка. Однако образование одной из этих форм обычно связано с созданием таких условий, которые неприемлемы при количественных определениях. Поэтому, в зависимости от индивидуальных свойств образующихся соединений, одни из них получаются при анализе в виде кристаллических, другие - в виде аморфных осадков. Задача аналитика состоит в том, чтобы создать условия, при которых выпадающий осадок был бы возможно более чистым и удобным для дальнейшей обработки, т. е. для отделения фильтрованием и промывания.
Оптимальные условия осаждения и старения оказываются весьма различными в случае образования аморфных и кристаллических осадков.
Произведение растворимости является одной из основных характеристик осадка. Пользуясь этой характеристикой, можно изменять растворимость осадка, рассчитывать оптимальные условия осаждения, предвидеть, какими реакциями осаждения лучше пользоваться для определения тех или иных ионов.
Из уравнения (3.1.) вытекают условия образования в растворе осадка:
Осадок малорастворимого электролита образуется только в том случае, когда произведение концентраций его ионов (П) в растворе превышает величину произведения растворимости этого соединения, т.е. когда раствор становится пересыщенным относительно данного малорастворимого соединения. Из ненасыщенного раствора осадок не выделяется, происходит растворение твёрдой фазы.
ПРИМЕР 3.6 Определить, образуется ли осадок PbCО 3 при смешении 400 мл 0,001 М Pb(NO) 2 и 100 мл 0,01 М К 2 СО 3 .
Решение: Найдём молярные концентрации веществ в момент смешения по формуле:
Концентрации ионов, образующих осадок, равны:
См 2 (Pb(NO) 2), т.к. при диссоциации из 1 моль соли образуется 1 моль ионов свинца.
[СО 3 2- ]= См 2 (К 2 СО 3), т.к. при диссоциации из 1 моль соли образуется 1 моль ионов СО 3 2- .
Отсюда ПР = ·[СО 3 2- ]= 0,0008·0,002=1,6·10 -5 .
Полученное значение больше ПРPbCO 3 = 7,5·10 -14 , следовательно, раствор пересыщен относительно карбоната свинца и осадок образуется.
ПРИМЕР 3.7 При каком соотношении концентраций ионов Ва 2+ и Рb 2+ их карбонаты при введении ионов СО 3 2- будут выпадать одновременно? ПРВаСО 3 =7∙10 -9 , ПРРbСО 3 =1,5∙10 -13 .
Решение: Концентрацию вводимых карбонат-ионов обозначим через ССО 3 2- , тогда:
Итак, карбонаты бария и свинца будут выпадать одновременно из раствора, если СВа 2+ >СРb 2+ в 46700 раз. Если отношение СВа 2+ / СPb 2+ >46700, то первым из раствора будет выпадать ВаСО 3 до тех пор, пока отношение СВа 2+ / СPb 2+ не будет равным 46700. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов бария и свинца меньше 46700, то первым начнет осаждаться карбонат свинца. Осаждение карбоната свинца будет протекать до тех пор, пока отношение СВа 2+ / СPb 2+ не достигнет значения, при котором ВаСО 3 и РbСО 3 будут осаждаться одновременно.
- Алгоритм линейной цифровой фильтрации. Условие физической реализуемости.
- Базисные условия поставки – Инкотермс-2000. Условия группы E, F, C, D. Условие FOB и условие CIF.
- Билет 1. Циклический алгоритм. Блок-схемы циклов с предусловием, с постусловием и цикла с параметром. Программирование циклического процесса
- Важным условием успеха фирмы является надежная система слежения за конкурентами и анализа их действий.
- Возрастание и убывание функций, необходимое и достаточное условие.
- Вопрос 1. Ядерная реакция. Условием протекания цепной ядерной реакции деления
- Вопрос № 13. Окисление углерода в электропечи, механизм и условие удаления пузырька СО.
ОБРАЗОВАНИЕ И РАСТВОРЕНИЕ ОСАДКОВ
1. Произведение растворимости и растворимость. Условие выпадения осадка
2. Произведение растворимости при неполной диссоциации малорастворимого соединения
3. Факторы, влияющие на полноту осаждения
4. Растворение осадков
Произведение растворимости и растворимость.
Условие выпадения осадка
Гетерогенными называются химические и физико-химические процессы, которые происходят в системах, состоящих из нескольких фаз. Фазы могут быть жидкими, твердыми и газообразными.
Фаза – это отдельные части гетерогенной системы, разграниченные поверхностями раздела.
Мы будем рассмотривать фазовое равновесие жидкость – твердое вещество, как имеющее наибольшее значение для разделения элементов, качественного и количественного определения.
Рассмотрим равновесие в системе малорастворимого сильного электролита А а В в, опустив для простоты заряды ионов:
А а В втв ó aA + bВ
Это равновесие описывается термодинамической константой равновесия:
Активность твердой фазы есть величина практически постоянная, произведение двух констант даст новую константу, которую называют термодинамическим произведением растворимости (ПР) :
В растворе над осадком малорастворимого сильного электролита произведение активностей ионов в степенях соответствующих стехиометрических коэффициентов есть величина постоянная при данных условиях (температура, давление, растворитель).
ПР Т = f (T, р, природы растворителя)
В немецкой литературе ПР обозначается Lp (löslichkeitsprodukt), в английской – Sp (solubility product).
Растворимость S – это способность веществ образовывать гомогенную систему с растворителем.
Растворимость измеряют в моль/л, г/100мл, г/мл и т.д.
Чем меньше растворимость, тем труднее растворяется электролит
BaSO 4 (ПР = 1,05·10 -10) с трудом при кипячении растворяется только в концентрированной серной кислоте,
CaSO 4 (ПР = 9,1·10 -6) довольно хорошо растворим в воде – гипсовая вода
Для малорастворимого сильного электролита АВ, который состоит из ионов одинаковой зарядности, растворимость S – это равновесная концентрация иона А или иона В.
Если обозначить эту концентрацию через x, то
ПР = [A]·[B] = x 2
Для осадка электролита, состоящего из ионов разной зарядности А a B b , равновесие в насыщенном растворе
А а В b тв ó aA + bВ
Отсюда [A] = a·S и [B] = b·S
ПР (А а В b)= [A] a ·[B] b = a ·[ b·S] b = a a ·b b ·S a+b . Отсюда
Если произведение концентраций ионов (ионное произведение) труднорастворимого электролита меньше его произведения растворимости, раствор является ненасыщенным. В тот момент, когда ионное произведение достигнет величины ПР данного электролита, раствор станет.насыщенным относительно этого электролита. Если ионное произведение превысит величину ПР, начинается выпадение осадка:
i" nP Ag ci -пересыщенный [раствор.
Осадок образуется в том случае, когда произведение концентраций. ионов малорастворимого электролита превысит величину произведения растворимости электролита при данной температуре.
Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается. Зная объем и концентрацию смешиваемых растворов, можно рассчитать, будет ли выпадать осадок образующейся соли.
Пример. Выпадает ли осадок при смешении равных объемов 0,2 М растворов РЬ(.ЫОз) 2 и NaCl? ПРрьс1 2 =2,4-10~ 4 .
Решение. При смешении объем раствора возрастет вдвое и концентрация каждого иэ> веществ уменьшится вдвое, т. е. станет 0,1 М или 1-Ю -1 моль/л. Таковы же будут концентрации РЬ 2 + и С1~. Следовательно
Полученная величина превышает ПРрьа 2 (2,4-Ю -4). Поэтому часть соли PbCfo выпадет в осадок.
Из всего сказанного выше мы можем сделать вывод о влиянии различных факторов на образование осадков.
1. Влияние концентрации растворов. Трудиораство-римый электролит с достаточно большой величиной ‘ПР нельзя осадить из разбавленных растворов. Например, осадок РЬСЬ не будет выпадать при смешении равных объемов 0,1 М растворов Pb(N0 3)2 и NaCl.
При смешении равных объемов концентрации каждого из веществ станут 0,1: 2 = 0,05 М или 5-10 ~ 2 моль/л. Ионное произведение
Полученная величина меньше ПР Р ьс1 2 . следовательно выпадения осадка не произойдет.
2. Влияние количества осадителя. Для возможно более полного осаждения употребляют избыток осадителя.
Например, осаждаем соль ВаС0 3:
ВаС1 2 + Na 2 C0 3 = BaC0 3 J + 2NaCl
Большое значение имеет степень диссоциации осадителя. Концентрация ионов, вступающих в реакцию, у слабого электролита во ‘много раз меньше концентрации самого электролита, а следовательно, осаждение мало-диссоциированным реактивом будет гораздо менее полным.
3. Влияние одноименного иона. Растворимость труднорастворимых электролитов понижается в присутствии
других сильных электролитов, имеющих одноименные ионы.
Если к ненасыщенному раствору BaS0 4 прибавлять понемногу раствор Na 2 S04, то ионное произведение, которое ‘было сначала меньше nP Ba so 4 (1,1-Ю -10), постепенно достигнет ПР и превысит его. Начнется выпадение осадка.
Соли с одноименным ионом понижают растворимость солей с довольно большой растворимостью.
4. Солевой эффект. Соли, не имеющие одноименного иона, тоже влияют на растворимость электролитов, но влияни в данном случае противоположное: растворимость электролита повышается. Так, например, раство римость PbS0 4 повышается в присутствии нитратов калия или натрия, а растворимость AgCl повышается в присутствии сульфатов «атрия или калия. Описанное явление называется солевым эффектом.
5. Влияние температуры. Произведение растворимости является постоянной величиной при постоянной температуре. С увеличением температуры величина произведения растворимости возрастает, поэтому осаждение, как правило, проводят из холодных растворов. Осаждение из горячих растворов проводят лишь тогда, когда температура благоприятно влияет на характер осадка (переход из аморфного состояния в кристаллическое, предотвращение образования коллоидных растворов и т. д.).
Знание численной величины произведения растворимости позволяет сделать прогноз, будет ли выпадать осадок малорастворимого соединения в результате обменной реакции. Например, для того чтобы при сливании растворов AgNO 3 и K 3 PO 4 выпал осадок Ag 3 PO 4 в результате обменной реакции
3 Ag + + PO 4 3– ® Ag 3 PO 4 ¯
необходимо, чтобы образующийся раствор был перенасыщен ионами серебра и фосфат-ионами. Важно понимать, что ПР – это характеристика, относящаяся к насыщенному раствору, поэтому выпадение осадка произойдёт в том случае, если, в полученном растворе произведение концентраций (ПК) ионов, образующих осадок, больше, чем произведение растворимости (ПР) или, более кратко, условие выпадения осадка: ПК > ПР .
Пример 5.2. Определить будет ли выпадать осадок Ag 3 PO 4 при сливании 1 литра раствора Na 3 PO 4 с концентрацией 5·10 –5 моль/л и 1 литра раствора AgNO 3 с концентрацией 2·10 –3 моль/л. ПР(Ag 3 PO 4) = 1,3·10 –20 .
При решении подобных задач необходимо в первую очередь найти в исходных растворах число моль тех ионов, которые могут образовать осадок (в данном случае – это ионы Ag + и PO 4 3–).
В растворе Na 3 PO 4: n(Na 3 PO 4) = C(Na 3 PO 4)·V раствора (Na 3 PO 4);
n(Na 3 PO 4) = 5·10 –5 моль/л · 1 л = 5·10 –5 моль = n(PO 4 3–).
В растворе AgNO 3: n(AgNO 3) = C(AgNO 3)·V раствора AgNO 3 ;
n(AgNO 3) = 2·10 –3 моль/л · 1 л = 2·10 –3 моль = n(Ag +).
В растворе, образующемся после смешивания, число моль ионов Ag + и PO 4 3– до образования осадка будет таким же, как и в исходных растворах, а объём раствора станет равен 2 литрам:
V общий ≈ V раствора Na 3 PO 4 + V раствора AgNO 3 = 1 л + 1 л = 2 л.
C(Ag +) = n(Ag +) / V общий = 2·10 –3 моль / 2 л = 1·10 –3 моль/л;
C(PO 4 3–) = n(PO 4 3–) / V общий = 5·10 –5 моль / 2 л = 2,5·10 –5 моль/л.
Образование осадка происходит в результате реакции, протекающей по уравнению 3 Ag + + PO 4 3– ® Ag 3 PO 4 ¯, поэтому произведение концентраций (ПК) ионов Ag + и PO 4 3– в полученном растворе следует рассчитывать по уравнению:
ПК = C 3 (Ag +)·C(PO 4 3–) = (1·10 –3) 3 ·2,5·10 –5 = 2,5·10 –14 .
Так как ПК = 2,5·10 –14 > ПР(Ag 3 PO 4) = 1,3·10 –20 , раствор перенасыщен ионами Ag + и·PO 4 3– , следовательно, осадок Ag 3 PO 4 образуется.
Пример 5.3. Определить будет ли выпадать осадок PbCl 2 при сливании 200 мл 0,005 М раствора Pb(NO 3) 2 и 300 мл 0,01М раствора NaCl ПР(PbCl 2) = 1,6·10 –5 .
Расчёт количеств ионов Pb 2+ и Cl – в исходных растворах:
В растворе Pb(NO 3) 2: n(Pb(NO 3) 2) = C(Pb(NO 3) 2)·V раствора (Pb(NO 3) 2);
n(Pb(NO 3) 2) = 0,005 моль/л · 0,2 л = 0,001 моль = n(Pb 2+).
В растворе NaCl: n(NaCl) = C(NaCl)·V раствора NaCl;
n(NaCl) = 0,01 моль/л · 0,3 л = 0,003 моль = n(Cl –).
В растворе, образующемся после смешивания, число моль ионов Pb 2+ и Cl – до образования осадка будет таким же, как и в исходных растворах, а объём раствора станет равен 0,5 литра:
V общий ≈ V раствора Pb(NO 3) 2 + V раствора NaCl = 0,2 л + 0,3 л = 0,5 л.
Концентрации ионов Ag + и PO 4 3– в полученном растворе будут следующими:
C(Pb 2+) = n(Pb 2+) / V общий = 0,001 моль / 0,5 л = 0,002 моль/л = 2·10 –3 моль/л;
C(Cl –) = n(Cl –) / V общий = 0,003 моль / 0,5 л = 0,006 моль/л = 6·10 –3 моль/л.
Образование осадка происходит в результате реакции, протекающей по уравнению Pb 2+ + 2 Cl – ® PbCl 2 ¯, поэтому произведение концентраций (ПК) ионов Pb 2+ и Cl – в полученном растворе следует рассчитывать по уравнению:
Атмосферные осадки - это вода в жидком или в твердом состоянии, которая выпадает с неба. Осадки попадают на почву либо могут осесть на других предметах. Сколько осадков на определенной местности выпало - можно замерять. Измеряют среднегодовое условное количество высотой уровня воды в мм рт.ст. При этом твердые разновидности осадков заранее разогревают до жидкого состояния. В год, по данным статистики, на Земле выпадает примерно 1000 мм. В тропиках, на пустынных областях идет не больше 300 мм, а суше всего в пустынной территории Атакама, где в год фиксируется приблизительно 3-х мм уровень.
Какие бывают осадки?
Осадки, образующиеся из облаков в твердом или жидком качестве, вода или формируемые из воздуха массы на поверхность планеты попадают в следующих видах.
Дождевые осадки
При особых условиях облачные капельки объединяются в наиболее объемные и увеличиваются в массе. Они не в состоянии удерживаться в атмосферном слое и отправляются на поверхность планеты. Это явление и называется дождем.
- В умеренном климате может идти до 15 раз за 12 месяцев;
- У экваторной зоны на суше, где наиболее мощнейшие восходящие потоки, - до 150 раз ежегодно.
- Над океанической местностью град увидеть практически невозможно.
Важно! В России были созданы уникальные методики выявления опасных облаков и работают специальные службы устранения градовых явлений. Градовые облака “расстреливают” особыми химикатами.
Снежные массы
Зимой на территории России, а также многих Европейских стран, идет снег. Облака в этот период состоят не из капель жидкости, а из мини-кристаллов — микро-иголок, которые, объединяясь вместе, формируют снежинки. Вышеописанные осадки именуются гидрометеоритами. Помимо них, в природе можно наблюдать и такие, которые образуются прямо из воздушных масс.
Другие виды осадков
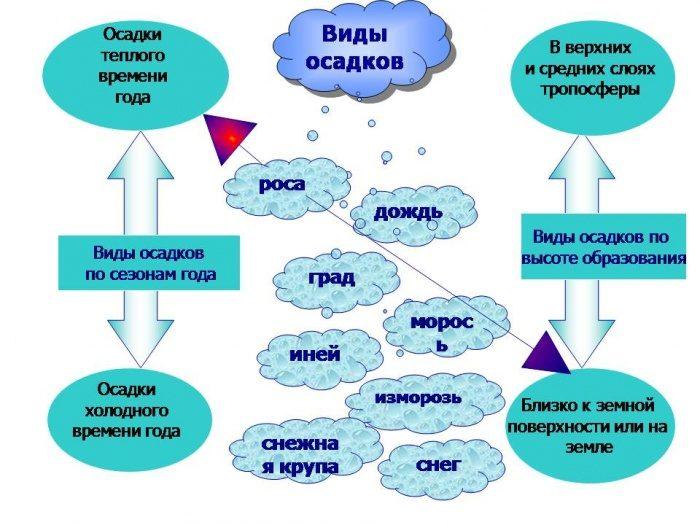
- Роса (от латинского - влага, жидкость). Осаждается в качестве капель, заметить которые можно на растениях и прочих предметах, когда температура воздуха опускается. В такой ситуации пар, становясь холоднее, переходит из газа в жидкости и осаждается. Обычно росу можно видеть в ночное, вечернее или утреннее время.
- Туман . Это объединение мельчайших капелек или кристалликов льда внизу тропосферы, обычно у поверхности. Туманность сокращает видимость часто до 1-2 метров. Туманность бывает адвективной (когда охлаждается теплый влажный воздух над наиболее прохладной поверхностью земли или водоема) и радиационной (происходит из-за охлаждения грунта). В определенных областях туманность наблюдается часто - это береговая линия в областях холодных течений. К примеру, на юге американской территории, на тихоокеанском берегу и в пустынной местности Атакама. Здесь идет ледяное Перуанское течение. Холод от глубинных вод приводит к формированию туманности, из которой на берегу можно видеть морось - исключительный источник влаги в пустынной местности.
- Изморозь . Оседает в качестве рыхлых кристалликов льда, которые нарастают на растительной культуре и прочих предметах. Случается это из-за намерзания капелек охлажденного тумана. Можно наблюдать изморозь в тихую морозную погоду, когда водяной пар переходит в состояние кристаллизации из-за снижения температурного режима в атмосфере.
- Иней . Тончайший слой кристалликов льда, которые формируются в ночное время, когда ясно, холодно, спокойно. Заметить иней можно на грунте, растениях и предметах с низкой температурой, причем наиболее низкой, чем температурный режим в атмосфере. Кристаллики инея, как и кристаллики изморози, формируются благодаря сублимации парообразной воды.
Еще немного о формировании осадков
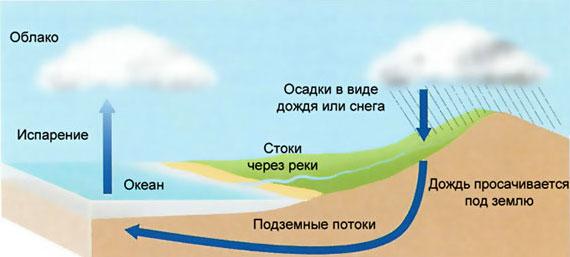
Схема выпадения и осаждения - одна, и она основывается на постоянном круговороте жидкости в природе. Поговорим об этом более подробно. Стартует все с того, что солнечные лучи греют нашу планету. Под воздействием тепла массы вод, которые присутствуют в водоемах, образуются в парообразное состояние, соединяясь с воздушными массами. Процессы образования пара в большем или меньшем количестве происходят на протяжении суток, не прекращаясь. Количество образования пара зависит от широты места, а также от того, насколько интенсивно греет солнце. Затем влажные воздушные массы нагреваются и по знакомым физическим законам уходят вверх. Поднявшись на особую высоту, воздух становится холодным, а влага, присутствующая в нем, формируются в мини-капли или в ледяные кристаллики. Дальше - конденсируется, и именно из этих составляющих сформированы облака.
Отправившаяся на поверхность земли жидкость со временем опять пополняет водоемы. Затем цикл идет по кругу.
Классификация
- Характеру выпадения;
- Происхождению;
- Физическому состоянию;
- Сезонности.
- Ливневые
- Обложные
- Моросящие
- Конвективные . Образуются в жарком климатическом поясе, где зной и испарение. Однако могут идти и в умеренном климате.
- Фронтальные . Формируются, когда соединяются 2 воздушные массы с различными температурами, и выпадают из наиболее теплых воздушных масс. Можно видеть в мягких и холодных климатах.
- Орографические . Наблюдаются на гористых местностях. Чрезвычайно сильные.
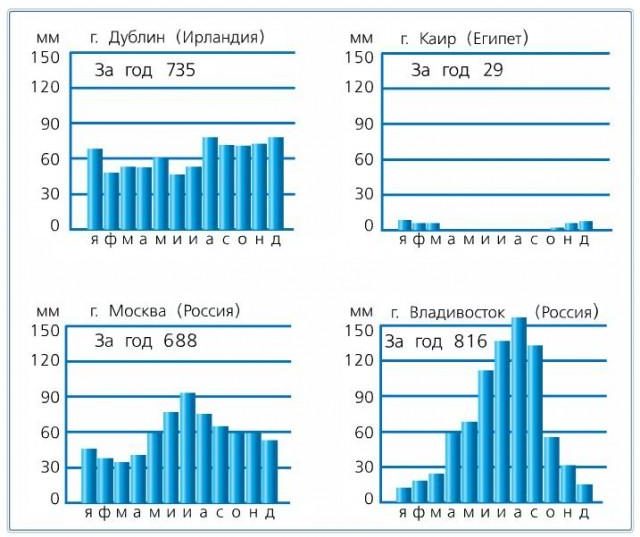
Важно! Проводя сравнение годового числа атмосферных осадков на Амазонке и пустынной территории Сахара на метеокарте, можно видеть, как неравномерно распределяются осадки. Почему? Осадки несут влажный воздух, образующийся над океаном. Это отлично заметно на примере территорий с муссонами. Муссон в летнее время уносит с океана огромное количество влаги, и начинаются ливневые поры.
Роль ветра, рельефа, давления атмосферы
- Теплые течения ведут к их развитию (течение Мозамбика у восточного африканского побережья, Гольфстрим у европейских территорий);
- Холодные - напротив, не дают образования осадков (Перуанское течение на западном побережье южноамериканской территории).
Важно! Больше всего осадков выпало на Гавайской территории - 11684 мм и в Черапунджи - 11600 мм. Меньше всего - в пустынной зоне Атакама и в Ливии - меньше 50 мм за 12 месяцев.
В процессе растворения твердого вещества в растворе наступает момент, когда число ионов, переходящих в раствор, уравнивается с числом ионов, переходящих в осадок. В тот момент, когда ионное произведение электролита достигнет величины ПР для него, раствор станет насыщенным относительно этого электролита. Ясно, что, если ионное произведение превысит величину ПР, раствор станет пересыщенным и начнется выпадение осадка.
Осадок образуется в том случае, когда произведение концентраций ионов труднорастворимого электролита начнет превышать величину произведения растворимости электролита при данной температуре. Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается.
Разберем влияние различных факторов на образование осадка.
1.Концентрация раствора. Труднорастворимый электролит нельзя выделить в осадок путем смешивания разбавленных растворов соответствующих солей, поскольку произведение концентраций ионов, образующих труднорастворимый электролит, будет меньше ПР для данного электролита. Например, осадок РbCl2 не будет выпадать при смешении равных объемов 0.05 моль/л растворов Pb(NОз)2 и NаС1. После смешивания концентрации каждого из веществ будут 0,05:2=0,025 моль/л, или 2,5• 10 -2 моль/л. Ионное произведение будет равно:
[Рb 2+ ] * [С1-] 2 = 2.5•10 -2 *(2.5•10 -2 ) 2 =1,56•10 -5
Полученная величина меньше ПРPbCl2( 1,7*10 -5 ), следовательно, выпадения осадка не произойдет.
Влияние концентрации растворов на образование осадков необходимо учитывать как в качественном, так и в количественном анализе. Так, например, открывая присутствие ионов Na + с помощью реактива К[Sb(ОН)6], мы должны помнить, что произведение растворимости oбразующейся соли Na[Sb(ОН)6] достаточно большая величина и осадок может выпасть лишь приконцентрации солей натрия в растворе не менее 0.5 н. и при действии насыщенного раствора К[Sb(ОН)6]. Величину произведения растворимости всегда необходимо учитывать в систематическом ходе анализа.
При количественном определении различных веществ гравиметрическим методом произведение растворимости осаждаемого вещества не должно быть более1*10 -8 иначе
невозможно практически выделить определяемое вещество в осадок. Количество осадителя. Для возможно полного осаждения употребляют избыток осадителя. Например, осаждаем ион Ba + в в виде соли ВаСОз:
После прибавления эквивалентного количества Na2СОз и выделения осадка ВаСОз в растворе остается некоторое количество ионов Ва 2+ . Если затем прибавить избыток осадителяNа2Соз, в растворе увеличится концентрация ионов СО3 2- . Так как величина ПРBaCO3 неизменна при постоянной температуре, повышение концентрации ионов СО3 2- повлечет за собой соответственное уменьшение концентрации ионов Ва 2+ в растворе (дополнительное количествоВаСОз выделится в осадок), т. е. увеличится полнота осаждения этого иона.
Однако большого избытка осадителя следует избегать по ряду причин вследствие возможности образования комплексных солей, кислых солей и т. д. Например, если осаждать ионы Рb 2+ в виде сульфата, прибавление большого избытка серной кислоты приведет к повышению растворимости осадка вследствие образования кислой соли:
Прибавление избытка осадителя при осаждении амфотерных гидроксидов приведет к растворению осадка:
На практике обычно употребляют не более чем полуторакратный избыток осадителя. Большое значение имеет степень диссоциации осадителя. Концентрация ионов, вступающих в реакцию, у слабого электролита во много раз меньше концентрации ионов сильного электролита, а, следовательно, осаждение малодиссоциированным реактивом будет гораздо менее полным и практически не применяется.
Одноименный ион. Растворимость труднорастворимых электролитов снижается в присутствии других сильных электролитов, имеющих одноименный ион. Если к ненасыщенному раствору ВаSO4 прибавлять понемногу раствор сульфата натрия Na2SO4, то ионное произведение, бывшее сначала меньше ПРBaSO4, постепенно достигнет и превысит его. Начнется выпадение осадка. Соли с одноименным ионом снижают растворимость солей, имеющих небольшое значение ПР.
Солевой эффект. Прибавление в раствор электролита соли с разноименными ионами повышает растворимость электролита. Так, например, растворимость PbSO4 повышается в присутствии КNОз или NаNОз, а растворимость АgСl повышается в присутствии Na2SO4 или К2SO4. Описанное явление называется солевым эффектом.

Физическая причина этого явления следующая. Большое количество посторонних ионов мешает ионам труднорастворимой соли, находящимся в растворе, сталкиваться друг с другом и с поверхностью осадка.Все это ускоряет процесс растворения осадка.
Температура. Произведение растворимости является постоянной величиной при постоянной температуре. С увеличением температуры произведение растворимости возрастает. Поэтому осаждение, как правило, проводят из холодных растворов. Осаждение из горячих растворов проводят лишь тогда, когда температура благоприятно влияет на характер осадка (переход из аморфного состояния в кристаллическое, предотвращение образования коллоидных растворов и т. д.).
В процессе растворения твердого вещества в растворе наступает момент, когда число ионов, переходящих в раствор, уравнивается с числом ионов, переходящих в осадок. В тот момент, когда ионное произведение электролита достигнет величины ПР для него, раствор станет насыщенным относительно этого электролита. Ясно, что, если ионное произведение превысит величину ПР, раствор станет пересыщенным и начнется выпадение осадка.
Осадок образуется в том случае, когда произведение концентраций ионов труднорастворимого электролита начнет превышать величину произведения растворимости электролита при данной температуре. Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается.
Разберем влияние различных факторов на образование осадка.
1.Концентрация раствора. Труднорастворимый электролит нельзя выделить в осадок путем смешивания разбавленных растворов соответствующих солей, поскольку произведение концентраций ионов, образующих труднорастворимый электролит, будет меньше ПР для данного электролита. Например, осадок РbCl2 не будет выпадать при смешении равных объемов 0.05 моль/л растворов Pb(NОз)2 и NаС1. После смешивания концентрации каждого из веществ будут 0,05:2=0,025 моль/л, или 2,5• 10 -2 моль/л. Ионное произведение будет равно:
[Рb 2+ ] * [С1-] 2 = 2.5•10 -2 *(2.5•10 -2 ) 2 =1,56•10 -5
Полученная величина меньше ПРPbCl2( 1,7*10 -5 ), следовательно, выпадения осадка не произойдет.
Влияние концентрации растворов на образование осадков необходимо учитывать как в качественном, так и в количественном анализе. Так, например, открывая присутствие ионов Na + с помощью реактива К[Sb(ОН)6], мы должны помнить, что произведение растворимости oбразующейся соли Na[Sb(ОН)6] достаточно большая величина и осадок может выпасть лишь приконцентрации солей натрия в растворе не менее 0.5 н. и при действии насыщенного раствора К[Sb(ОН)6]. Величину произведения растворимости всегда необходимо учитывать в систематическом ходе анализа.
При количественном определении различных веществ гравиметрическим методом произведение растворимости осаждаемого вещества не должно быть более1*10 -8 иначе
невозможно практически выделить определяемое вещество в осадок. Количество осадителя. Для возможно полного осаждения употребляют избыток осадителя. Например, осаждаем ион Ba + в в виде соли ВаСОз:
После прибавления эквивалентного количества Na2СОз и выделения осадка ВаСОз в растворе остается некоторое количество ионов Ва 2+ . Если затем прибавить избыток осадителяNа2Соз, в растворе увеличится концентрация ионов СО3 2- . Так как величина ПРBaCO3 неизменна при постоянной температуре, повышение концентрации ионов СО3 2- повлечет за собой соответственное уменьшение концентрации ионов Ва 2+ в растворе (дополнительное количествоВаСОз выделится в осадок), т. е. увеличится полнота осаждения этого иона.
Однако большого избытка осадителя следует избегать по ряду причин вследствие возможности образования комплексных солей, кислых солей и т. д. Например, если осаждать ионы Рb 2+ в виде сульфата, прибавление большого избытка серной кислоты приведет к повышению растворимости осадка вследствие образования кислой соли:
Прибавление избытка осадителя при осаждении амфотерных гидроксидов приведет к растворению осадка:
На практике обычно употребляют не более чем полуторакратный избыток осадителя. Большое значение имеет степень диссоциации осадителя. Концентрация ионов, вступающих в реакцию, у слабого электролита во много раз меньше концентрации ионов сильного электролита, а, следовательно, осаждение малодиссоциированным реактивом будет гораздо менее полным и практически не применяется.
Одноименный ион. Растворимость труднорастворимых электролитов снижается в присутствии других сильных электролитов, имеющих одноименный ион. Если к ненасыщенному раствору ВаSO4 прибавлять понемногу раствор сульфата натрия Na2SO4, то ионное произведение, бывшее сначала меньше ПРBaSO4, постепенно достигнет и превысит его. Начнется выпадение осадка. Соли с одноименным ионом снижают растворимость солей, имеющих небольшое значение ПР.
Солевой эффект. Прибавление в раствор электролита соли с разноименными ионами повышает растворимость электролита. Так, например, растворимость PbSO4 повышается в присутствии КNОз или NаNОз, а растворимость АgСl повышается в присутствии Na2SO4 или К2SO4. Описанное явление называется солевым эффектом.
Физическая причина этого явления следующая. Большое количество посторонних ионов мешает ионам труднорастворимой соли, находящимся в растворе, сталкиваться друг с другом и с поверхностью осадка.Все это ускоряет процесс растворения осадка.
Температура. Произведение растворимости является постоянной величиной при постоянной температуре. С увеличением температуры произведение растворимости возрастает. Поэтому осаждение, как правило, проводят из холодных растворов. Осаждение из горячих растворов проводят лишь тогда, когда температура благоприятно влияет на характер осадка (переход из аморфного состояния в кристаллическое, предотвращение образования коллоидных растворов и т. д.).
Атмосферный воздух не может удерживать водяной пар в неограниченном количестве. В облаках также накапливаются ледяные кристаллы и капли воды. Избыточная влага атмосферы должна исчезать, уступая место новым каплям. Атмосферные осадки – это избытки водяного пара, которые выпадают на поверхность земли. Все погодные осадки состоят из воды. Источником их выпадения может быть воздух или облака.
В науке любой осадок – это гидрометеор. Для измерения используются миллиметры. Изначально замеряется толща воды, которая оказалась на земле после дождя. Чтобы провести исследование, используются специальные приборы – осадкомеры. Для измерений на большой территории применяют метеорологический радиолокатор.
Ежегодно на землю выпадает от пятисот до одной тысячи миллиметров гидрометеоров. В различных регионах и странах количество осадков отличается. Большое влияние оказывает погодный режим, климат, рельеф, удаленность от водоема.
Как образуются осадки – назовите виды атмосферных осадков
Осадки образуются при поднятии вверх воздушных масс. Воздух для этого должен сильно прогреться от земли. Ярким примером являются экваториальные и тропические страны. Высокая температура воздуха способствует нагреву поверхности земли. Она быстро нагревает воздух, он постоянно поднимается с большой скоростью. Часто идут дожди, обеспечивая влажность в тропических лесах и регионах экватора.
Теория также рассматривает второй вид стимуляции гидрометеоров. Происходит столкновение теплой воздушной массы с холодной или с горными системами. Так как теплый воздушный пар легче, он постепенно движется по горам или холодным массам. Во время движения его температура снижается. Происходит формирование облаков, начинается дождь или снег.
Из облаков или воздуха может выпасть только вода. Существует два типа осадков: твердый и жидкий. Рассмотрим разновидности жидких гидрометеоров:
- Дожди. В летнюю пору на землю падают крупные капли. Их размер обусловлен поднятием теплого воздуха от земной поверхности. Он не дает капелькам дробиться. В весенний и осенний период дождь моросит. Если его источником являются слоистые облака – это обложной дождь. Вода, выпадающая из кучево-дождевого облака, называется ливнем;
- Роса. Время появления росы – ночь или раннее утро, а источником является водяной пар. Ночью температура снижается, вместо газообразного состояния он становится жидким. Увидеть росу можно в ясную погоду, при отсутствии ветров в теплое время года;

- Морось. Слоистые облака выпускают миниатюрные капли с минимальной скоростью. Создается впечатление, будто они зависают в воздухе.
Какие бывают осадки в природе, как образуются осадки кратко
Распределение осадков по земле неравномерное. Максимальный объем воды выливается над экваториальными широтами. Ближе к тропическому климатическому поясу гидрометеоров становится меньше. Увеличение отмечается снова в умеренном поясе, сокращение – в полярных зонах.
На карте используются линии, соединяющие точки с одинаковым количеством осадков. Это изогиеты или изолинии. Они отграничивают определенные участки, которые следует закрашивать цветами, постепенно повышая насыщенность. В холодную погоду атмосфера наполнена воздухом с низкой температурой, поэтому вода замерзает и попадает на поверхность земли. Такой вид осадков называется твердыми гидрометеорами. Это:
- Снег. Образование происходит в облаках, которые после оказываются в воздушных потоках. Зимой их температура не превышает нуля градусов, поэтому вода замерзает, становится тяжелее и падает на поверхность. Это и есть снег. После застывания капли формируют кристаллы. По мнению большинства ученых, каждая снежинка обладает уникальной, неповторимой формой. Одинаковых снежинок не бывает;
- Град. Этот вид осадков характерен только для теплых сезонов. Часто град провоцирует душная, жаркая погода. Воздушные массы сильно прогреваются и быстро движутся вверх, забирая испарения. Это способствует формированию кучевых облаков. Потоки воздействуют на капли воды, она набирает массу, замерзает и покрывается кристаллической оболочкой. На землю падает град;
- Иней. Водяной пар превращается в иней осенью и зимой в холодный период. Каждый предмет покрывается тонким слоем. Эти ледяные кристаллы миниатюрные. Они покрывают окна, землю, траву, ручки дверей и прочее. Иней тает достаточно медленно, что способствует охлаждению земли.

Что такое режим осадков, какие бывают виды осадков
Режим осадков – это характер выпадения дождей в определенном городе, стране или климатическом поясе. Есть регионы с частыми сезонами дождей или засушливые области, когда осадки практически не выпадают. Это называется режимом осадков. Рассмотрим на примере:
Читайте также:

