Из чего делают йод очень кратко
Обновлено: 02.07.2024
1. Аликберова Л. Занимательная химия: Книга для учащихся, учителей и родителей. — М.: АСТ-ПРЕСС, 1999 — 560 с.: ил.
2. Гельджинс, Ю.А. Определение содержания йода в продуктах питания / Ю.А. Гельджинс, П.Л. Синкевич // Химия в школе. – 2007. – № 10. – С. 61-64.
3. Глинка Н. Л. Общая химия: учебное пособие для ВУЗов – 26 – е изд; под ред. В. А. Рабиновича. – Л.: Химия, 1987 с 704.
Цель: исследование физических и химических свойств йода; влияния йода на организм человека.
- изучить литературу о свойствах, значении йода в организме человека;
- познакомиться с историей открытия йода, его распространением в природе;
- получить йод в лаборатории, изучить его физические и химические свойства;
- определить содержание йода в некоторых продуктах питания;
- рассчитать суточную норму потребления морской капусты.
Методы исследований: описание, наблюдение, эксперимент.
Йод – химический элемент VII группы периодической системы Д.И. Менделеева. Атомный номер - 53. Относительная атомная масса 126,9045. Из имеющихся в природе галогенов – самый тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат. Молекула элементного йода, как и прочих галогенов, состоит из двух атомов.
Окутано мистикой открытие йода – пятьдесят третьего по счету химического элемента. Это произошло незадолго до войны с Наполеоном, в 1811 году. Именно Франция готовилась к большим сражениям и запасалась порохом. Для его производства использовалась селитра, которую добывали даже из морских водорослей. В них и был обнаружен новый химический элемент. Французский химик Бернар Куртуа не только производил селитру, но и наблюдал за необычными реакциями, соединяя различные реактивы. В лаборатории всегда находилась его любимая кошка, следившая за работой ученого. Ей даже позволялось сидеть на плече хозяина. Однажды, наблюдая с плеча ученого за его работой, она внезапно прыгнула на стол и разбила две колбы с реактивами. В то же мгновение над столом поднялись клубы фиолетового дыма. Это и были пары йода. А в колбах находились: в одной – серная кислота, а в другой – зола водорослей в этиловом спирте. Когда колбы упали и разбились, их содержимое перемешалось и произошла химическая реакция с выделением нового элемента. Йодид натрия из водорослей, взаимодействуя с серной кислотой, выделяет йод I2; одновременно образуется сернистый газ – диоксид серы SO2 и вода:
Физические свойства йода
Плотность йода 4,94 г/см3, tпл 113,5 °С, tкип 184,35 °С. Однако увидеть жидкий йод не так-то просто. И не только потому, что этому мешают интенсивно окрашенные фиолетовые пары. Жидкий йод можно получить, нагревая его под давлением. Дело в том, что молекулы йода в кристалле очень слабо связаны друг с другом, поэтому кристаллы легко возгоняются, т. е. испаряются без плавления. Чтобы кристаллический йод перешел в жидкость, нужно либо нагревать его очень быстро (чтобы плавление происходило быстрее возгонки), либо проводить опыт в закрытой посуде небольшого объема, чтобы создать над жидким йодом достаточное давление паров. При температуре плавления давление паров йода над жидкостью приближается к 100 мм рт. ст. Если давление будет меньше, жидкость не образуется или очень быстро испарится – вот почему в открытой посуде кристаллы следует нагревать быстро.
Распространение в природе
Среднее содержание йода в земной коре 4*10 - 5 % по массе. В мантии и магмах и в образовавшихся из них породах (гранитах, базальтах) соединения йода рассеяны; глубинные минералы йода неизвестны. История йода в земной коре тесно связана с живым веществом и биогенной миграцией. В биосфере наблюдаются процессы его концентрации, особенно морскими организмами (водорослями, губками). Основным резервуаром йода для биосферы служит Мировой океан (в 1 литре в среднем содержится 5*10 -5 грамм йода).
Получение йода и его возгонка [4].
Поместим на дно колбы немного порошка иодида калия в объеме около 3 горошин, столько же оксида марганца (IV) и 1-2 мл концентрированной серной кислоты. Палочкой все перемешаем и введем в колбу пробирку с налитой в неё холодной водой. При подогревании колбы появляются фиолетовые пары йода. На холодных стенках пробирки они переходят в твердое состояние, образуя красивые кристаллы, т.е. происходит возгонка. При возгонке твёрдое вещество, не плавясь, сразу переходит в пар, который снова превращается в твёрдое вещество, минуя жидкое состояние. Уравнение происходящей реакции: MnO2 + 2KI + 2H2SO4 = I2 + MnSO4 + K2SO4 + 2H2O (Приложение 1)
Растворимость йода в воде и в спирте [4].
Вещество переходит в раствор, когда частицы растворенного вещества (молекулы или ионы) равномерно распределяются между молекулами растворителя. Растворителями могут быть разные жидкости. Например, вода: на основе воды получаются водные растворы. Или спирт: на основе спирта - спиртовые растворы. Всем нам знаком аптечный йод - это спиртовой раствор йода, раствор для дезинфекции ран. А растворяется ли йод в воде? В колбах - кристаллики йода. В первую пробирку добавим воды. Во вторую - этиловый спирт. В воде йод растворяется плохо, а в спирте – хорошо (Приложение 2).
Техника безопасности. Не следует вдыхать пары йода во избежание поражения слизистых оболочек.
Растворимость йода в воде и в растительном масле.
В пробирку нальем воды и добавим немного подсолнечного масла. Перемешаем и увидели, что масло с водой не смешивается. В пробирку капнем две-три капли йодной настойки и сильно встряхнула. Заметили, что слой масла приобрел тёмно-коричневую окраску, а слой воды — бледно-жёлтую, т.е. большая часть йода перешла в масло (Приложение 3).
Йод – едкое вещество. Чтобы убедиться в этом, несколько капель йодной настойки поместим на цинковую и стальную пластины. Через некоторое время жидкость обесцветилась, а на поверхности металлов остались пятна. Цинк и железо прореагировали с йодом с образованием солей — йодидов: Zn + I2 = ZnI2; Fe + I2 = FeI2. На этом свойстве йода основан один из способов нанесения надписей на металл (Приложение 4).
Кристаллизация йода под микроскопом.
На предметное стекло поместим каплю спиртового раствора йода. Наблюдали в объективе микроскопа процесс кристаллизации йода. Это был интересный процесс (Приложение 5).
Образование иодида серебра [1].
К раствору иодида калия прибавим немного раствора нитрата серебра. Наблюдали образование желтого осадка иодида серебра:
Иодид серебра при действии света темнеет вследствие выделения свободного серебра: 2AgI→ 2Ag + I2 (Приложение 6)
Взаимодействие йода с крахмалом.
йод + крахмал => соединение темно-синего цвета
(желт.) (прозр.) (синий)
К разбавленному раствору крахмала добавим немного раствора йода. Появляется синее окрашивание. Нагреем синий раствор. Окраска постепенно исчезает, так как образующееся соединение неустойчиво. При охлаждении раствора окраска вновь появляется. Данная реакция иллюстрирует обратимость химических процессов и их зависимость от температуры (Приложение 7).
Определение йода в продуктах питания [2].
1. Определение йода в соли, обработанной йодистым калием.
Навеску исследуемой пробы массой 10 г поместим в коническую колбу вместимостью 250 см3и растворила в 100 cм3 дистиллированной воды. К полученному раствору прибавим градуированной пипеткой 1 см3 раствора серной кислоты (1 моль/дм3), пипеткой 5 см3 прильем раствор иодида калия с массовой долей его 10%, перемешаем, закроем колбу пробкой и поместим её на 10 мин в тёмное место. По истечении указанного времени колбу извлекли, добавили 1 см3 1 %-ного раствора крахмала, по интенсивности окраски определяют качественное наличие йода в данном продукте.
2. Определение йода в сухой морской капусте, киви, яблоке.
Определение содержания йода в таких продуктах, как морские водоросли, киви, яблоки осуществлялось по методике определения йода в соли, навеска массой 10г помещалась в дистиллированную воду, выдерживалась в течение суток, при добавлении серной кислоты и иодида калия выделялся свободный йод. В лабораторных условиях невозможно количественное определение йода, поэтому было проведено качественное его определение по интенсивности синей окраски после добавления к раствору крахмала (Приложение 8).
Результаты исследования продуктов на наличие йода
Сухая морская капуста, обжаренная с кимчи
Как оказалось, большое количество йода содержится в йодированной соли. Через 2 часа появилось яркое синее окрашивание в колбе с яблоком, неяркое в колбе с киви. Через сутки появилось неяркое окрашивание - с морской капустой. Хотя из литературы по этой теме мы знаем, что этот продукт наиболее богат йодом, но я думаю, что незначительное окрашивание может быть связано с тем, что данный продукт обжарен на оливковом масле. В морской капусте содержится 0,25% йода, который считается необходимым микроэлементом для поддержания жизнедеятельности организма. Кстати, при добыче и последующей термообработке количество этого вещества уменьшается. Нам стало интересно узнать: каково содержание йода в салате из морской капусты? По той же самой методике поместили её в дистиллированную воду, выдерживали в течение суток, затем добавляла серной кислоты, раствора иодида калия, крахмал. Практически сразу же появилось интенсивное синее окрашивание, что подтверждает содержание йода в морской капусте (Приложение 9).
3. Расчет количества сухой морской капусты, обеспечивающий суточную потребность в йоде.
Норма потребления йода для школьников = 120 мкг/сут. Норма потребления йода для взрослых = 150 мкг/сут. (1 миллиграмм [мг] = 1000 микрограмм [мкг]). При кулинарной обработке содержание йода в пище существенно снижается (на 30-50%). Морская капуста (сухая) в 100 г — 50-220 мкг йода. А в скольких г морской капусты содержится120мкгйода? Составили пропорцию:
Пусть в 100 г –220 мкг йода
х г капусты–120 мкг х =54 г

Вывод: потребление в сутки 54 г сухой морской капусты обеспечивает суточную потребность школьника в йоде. Можно дать рекомендации: использовать только йодированную соль, которую необходимо хранить в плотно закрытых ёмкостях; желательно использовать в пищу йодированные продукты, а также морепродукты. Изучение свойств йода уже привело к появлению биологически активных добавок, которые содержат микроэлемент йод.
Заключение. В практической части своей работы мы выполнили опыты с йодом, которые понятны и интересны. Выполнив опыты, сделали вывод, что простое вещество и химический элемент — это довольно далёкие друг от друга понятия. Химический элемент – йод, открытый в 1811г. Бернаром Куртуа, в наше время нашёл широкое применение в промышленности, технике, но самое главное в медицине и не только как антисептическое средство, а как микроэлемент, который очень важен для поддержания здоровья щитовидной железы. Мы надеемся, что дальнейшее изучение йода приведёт к открытию новых возможностей применения этого элемента. Знакомство с элементом йод оказалось очень полезным. Мы узнали, насколько он нужен и важен! Мы убедились, что работа над подобным проектом дает большой шаг в нашем развитии, и надеемся, что для нас эта работа – не последняя.


Блестящий тёмно-серый неметалл. В газообразном состоянии — фиолетовый.

Содержание
- 1 Название и обозначение
- 2 История
- 3 Нахождение в природе
- 4 Физические свойства
- 4.1 Изотопы
- 6.1 В медицине
- 6.2 В криминалистике
- 6.3 В технике: рафинирование металлов
- 6.3.1 Источники света
- 6.3.2 Производство аккумуляторов
- 6.3.3 Лазерный термоядерный синтез
- 6.3.4 Радиоэлектронная промышленность
- 7.1 Й од и щитовидная железа
- 7.2 Токсичность
![йод]()
Название и обозначение
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Нахождение в природе
![йод кристаллический]()
Йод — редкий элемент. Его кларк — всего 400 мг/т . Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде ( 20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях ( 2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн , 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода, например, чилийская Atacama Minerals производит свыше 720 тонн йода в год. Наиболее известный из минералов йода — лаутарит Ca(IO3)2. Некоторые другие минералы йода — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
Физические свойства
![йод кристаллический]()
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде ( 0,28 г/л ), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.
![йод кристаллы]()
Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127 I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅10 7 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131 I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ .
![йод цилиндр]()
Химические свойства
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
- С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
- Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I − :
Последняя реакция также используется в аналитической химии для определения йода.
- При растворении в воде йод частично реагирует с ней (По "Началам Химии" Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
- Реакция образования нитрида трийода:
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
- Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
Применение
В медицине
![раствор йода]()
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода ( 125 I, 132 I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием йода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк .
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность ]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн
![йод кристаллы]()
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг ) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг .
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность
![кристаллы йода]()
Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
Агрохимикаты , статья из раздела: Питательные элементы
![]()
Йод – химический элемент, не имеющий значительного распространения в литосфере. Играет важную роль в протекании жизненно важных процессов в организме человека и животных. Является компонентом (действующим веществом) специальных йодсодержащих комплексных удобрений, добавляется в минеральные удобрения. Применяется для обработки семян и некорневых подкормок.
![Йод]()
В наибольшей степени йод известен нам в качестве медицинского средства. Его спиртовая настойка применяется как антисептик для обработки свежих ран, йодид калия назначают в качестве средства профилактики эндемического зобы, он же является лекарством при дефицитных состояниях, а йод, меченый радиоактивной меткой, используется для лечения аденом и рака щитовидной железы. Необходимость в йоде настолько высока, что это вещество способно беспрепятственно проникать через неповрежденную кожу и практически полностью усваиваться из поглощаемой пищи.
Представляется, что для других живых организмов данный элемент необходим в той же степени, что и для нас. Однако, например, для растений он не считается незаменимым. Впрочем, применение удобрений с его содержанием повышает урожайность некоторых культур и обусловливает высокое содержание йода в плодах, что позитивно сказывается на здоровье человека.
![Йод - Кристаллы йода]()
Кристаллы йода
![Йод - Кристаллы йода]()
Физические и химические свойства
Йод (Iodum), I – химический элемент главной подгруппы VII группы периодической системы Менделеева. Атомный номер – 53, атомная масса – 126,904. Природный йод состоит из одного стабильного изотопа. Галоген. В нормальных условиях имеет вид кристаллов черно-серого цвета с фиолетовым металлическим блеском. [1] Обладает резким запахом. Температура кипения – 113,6°C, температура плавления – 185,5°C.
Вследствие большой химической активности в природе йод находится исключительно в связанном состоянии.
При нагревании при атмосферном давлении йод сублимируется (возгоняется) и превращается в пары фиолетового цвета со специфическим запахом. При охлаждении эти пары кристаллизуются сразу, минуя жидкое состояние.
Молекулы простых веществ, образованные атомами йода, как и у всех прочих галогенов, двухатомны.
Йод малорастворим в воде, значительно лучше растворяется в органических растворителях: сероуглероде, этиловом спирте, диэтиловом эфире, бензоле, хлороформе.
Как свободный галоген, элемент проявляет высокую химическую активность и вступает во взаимодействие со всеми простыми веществами. Быстро с выделением большого количества теплоты протекает реакция взаимодействия галогенов с металлами.
Йод – энергичный окислитель. Это свойство проявляется и при взаимодействии со сложными веществами. [3]
Содержание в природе
Концентрация йода в большинстве горных пород варьирует в пределах от 0,1 до 6 мг/кг. Максимальное количество этого элемента содержится в богатых органическим веществом сланцах. Йод образует мало самостоятельных минералов, но присутствует во многих в виде изоморфных примесей. К распространенным минералам йода относятся йодиды серебра, меди, а также полигалиды, йодаты и периодаты.
Большое количество йода содержится в нитратных отложениях. Например, в чилийской селитре его среднее содержание составляет 200 мг/кг, максимальное – до 400 мг/кг.
Соединения йода легкорастворимы, и при выветривании горных пород данный элемент высвобождается в значительных количествах. Йод интенсивно выносится поверхностными водами в океаны и моря, однако активная сорбция углеродом, глинами и органикой оказывает значительное воздействие на круговорот йода в природе.
Геохимия йода во многом обусловлена его участием в биологических процессах. Значительное содержание элемента в донных отложениях связано с содержанием органического углерода. Осадки в восстановительной среде содержат больше йода, чем в окислительной. [4]
Основным источником поступления и накопления вещества в почвах является йод атмосферы. В атмосферу йод поступает в основном из морей и океанов. Этому способствуют не только химические процессы, но и разбрызгивание и распыление воды океанов и морей. Поскольку водная поверхность занимает почти 70 % поверхности земного шара, то постоянное поступление йода в атмосферу и выпадение его на поверхность суши в составе осадков имеет большое значение в процессе его миграции в природе. [5]
Содержание йода в почвах СНГ, (мг/кг), согласно данным: [5]
Почвы
Среднее содержание
Пределы колебаний
Почвы тундры торфянистые
Подзолистые
Серые лесные
Черноземные и каштановые
Cероземные
Красноземные
Содержание йода в различных типах почв
Присутствие йода в почвах в виде минералов не установлено. Он обнаруживается в почвенных горизонтах в основном в составе органических веществ. В связи с этим йод аккумулируется в верхних почвенных горизонтах. Установлено, что значительная его часть находится в почве в связанных формах, сорбированных гумифицированной или свежей органикой и глинами, или входит в кристаллические решетки минералов. [4]
Почвы значительно отличаются друг от друга по содержанию йода. Его количество в почвах колеблется от 0,1 до 50 мг/кг. Среднее значение – 5 мг/кг. Почвы содержат в 20–30 раз больше йода по сравнению с собственными материнскими породами.
Содержание йода зависит и от механического состава почвы. Установлено, что легкие пески и супеси значительно беднее тяжелых почв – глин и суглинков. В связи с этим, йодная недостаточность встречается в зонах распространения почв, легких по механическому составу.
Чем больше органической составляющей содержится в почве, чем больше в ней коллоидной и мелкой фракции, тем богаче она йодом. Кислые почвы беднее йодом по сравнению с менее кислыми либо нейтральными. Это происходит по причине вымывания йода из почвы в кислой среде.
Распределение по профилю отличается следующей закономерностью: верхний слой более богат йодом, а материнская порода содержит гораздо меньшее количество данного элемента. Исключение – осадочные породы морского происхождения, как правило, содержащие очень большое количество йода.
Подзолы, серые лесные, сероземные почвы содержат малое количество йода.
Солонцы Завольжья, буроземы Ферганского хребта – низкое содержание йода.
Торфянистые почвы тундры – высокое содержание йода. Однако здесь связи йода с органическим веществом прочны настолько, что элемент становится недоступным или малодоступным для растений.
Черноземы – высокое содержание йода. Почти вдвое богаче йодом, чем почвы нечерноземья (подзолы и серые лесные).
Каштановые почвы – высокое содержание йода.
Горные и равнинные почвы одной и той же местности содержат разное количество йода. Больше его в равнинных почвах.
Пойменные почвы содержат йода больше, чем в почвы водораздельных пространств. [5]
![Йод - Морские водоросли]()
Морские водоросли
![Йод - Морские водоросли]()
Морские водоросли – отличаются высоким содержанием йода.
Роль в растении
Биохимические функции
На сегодняшний день считается, что йод не является жизненно необходимым элементом для развития растений. Однако в литературе приводятся многочисленные примеры его благотворного влияния на их рост. Это явление пока не имеет точного объяснения. [4]
Скорее всего, йод принимает участие в регулировании деятельности ферментных систем. [1]
Стимулирующее действие йода на растения отмечается при его содержании 0,1 мг/кг в питательном растворе. Токсический эффект наблюдался при концентрации йода 0,5–1,0 мг/кг.
Взаимосвязь между содержанием данного элемента в растениях и его состоянием в почве – вопрос спорный. Вероятнее всего, изменчивость концентрации йода в растениях мало зависит от характера и типа почв. Однако установлена зависимость концентрации йода в ветвях лиственницы и ели от типа почв.
Как уже указывалось, наиболее доступны растениям растворимые формы галогена. Именно поэтому морские виды растений содержат гораздо большие концентрации йода. Его наличие в килограмме сухой массы морских растений варьирует от 53 до 8800 мг.
Механизм поглощения йода растениями изучен плохо. Установлено, что органические формы элемента растениями не усваиваются. Данный галоген становится доступным растительности только после разложения органических веществ бактериями.
Количественное содержание йода в некоторых растениях может значительно изменяться, но порядок его содержания зависит от вида растения. В овощах и мясистых грибах йода содержится больше, чем в других растениях суши. Более высокие концентрации йода обнаруживаются в наземных частях растений, гораздо меньше – в корнях. Установлена сезонная изменчивость содержания йода. Летом она наиболее низка.
Растения обладают способностью адсорбировать йод из атмосферы. Атмосферный йод является важным источником поступления данного элемента в растения. [4]
Недостаток (дефицит) йода.
Считается, что йод не является жизненно необходимым элементом для растений, и на его недостаток растения явно не реагируют. [4]
Роль йода в жизни животных и человека
Наличие и концентрация йода в растениях важны для человека и животных. Он входит в состав тироксина – гормона щитовидной железы, который играет важную роль в регуляции окислительно-восстановительных процессов в клетках живого организма. Суточная потребность человека в йоде – 100–200 мг. [2]
Йодная недостаточность у человека и животных в настоящее время распространена очень широко и выражается в заболевании эндемическим зобом (болезнь щитовидной железы, возникающая при недостатке йода). [6]
Избыток йода
Данных о влиянии избытка йода в результате техногенного загрязнения также немного. Внесение в почву большого количества золы бурых водорослей вызывает симптомы йодовой токсичности, сходные с таковыми у брома: краевой хлороз взрослых листьев, изменение окраски молодых листовых пластинок до темно-зеленой. [4]
Вегетационные опыты с томатами и гречихой на различных почвах показали, что доза йода в 1,1 кг/га не влияла на растения, а доза в 11 кг/га на некоторых почвах оказалась токсичной. [2]
При поступлении избытка йода в организм человека ослабляется синтез йодистых соединений щитовидной железы. [6]
Содержание йода в удобрениях, (мг/кг), согласно данным: [2]
Удобрение
Содержание йода
Содержание йода в различных соединениях
Йод получают окислением йодоводорода (НI) различными окислителями. В промышленности его получают из бромидов и йодидов, действуя на их растворы хлором.
Соединения йода имеются в морской воде, но в очень малых количествах. Поэтому непосредственное выделение их из воды довольно затруднительно. Существуют некоторые водоросли, накапливающие йод в своих тканях. Их зола служит сырьем для получения данного галогена.
Значительное количество йода (10–50 мг/л) содержится в подземных буровых водах. В России именно они являются основным источником получения йода. Встречается этот элемент в виде солей калия – иодата KIO3 и периодата KIO4. Данные соединения сопутствуют залежам нитрата натрия (селитры) в Чили и Боливии. [3]
Способы применения удобрений с содержанием йода
При применении йодсодержащих удобрений наиболее экономически оправдана предпосевная обработка семян, а для обогащения урожая йодом – некорневая обработка.
В отдельных регионах, например, Забайкалье, рекомендовано в первую очередь применение йодистого калия, как отдельно, так и в комплексе с сернокислым цинком (2:1) на серых лесных, каштановых и лугово-аллювиальных почвах, на посевах кормовых культур. [1]
Эффект от применения йодсодержащих удобрений
Исследованиями, проведенными в 1930–1936 гг. в Уманском с/х институте, было подтверждено, что предпосевная обработка семян различных культур раствором йодного калия заметно обогащает пищевые продукты йодом. [2]
Сахарная свекла на среднеподзолистом суглинке под влиянием йодистого калия повышала урожай корней и увеличивала их сахаристость. Морские водоросли, содержащие йод, также увеличивали урожай корней данного корнеплода.
Картофель на легких дерново-подзолистых почвах под влиянием йода повышал урожай клубней и увеличивал их крахмалистость. Кроме того, в нем возрастало содержание калия.
Удобрения , содержащие Йод
Хлопчатник, обработанный йодиднафтенатом (отходы йодного завода), быстрее растет, и увеличивается его урожайность.
Кукуруза под влиянием внекорневой подкормки йодистым калием увеличивает урожай зерна. При этом содержание азота в неусвояемой животными фракции белков в зерне кукурузы снизилось, а содержание хлорофилла в листьях повысилось. [2] Предпосевная обработка и некорневая подкормка растворами солей йода повышает содержание каротина в растении на 30–40 %, при этом сохранность каротина в витаминной муке в течение 9–10 месяцев повышается в 3–4 раза. В ходе производственных опытов было установлено, что урожай кукурузы за 12 лет возрос в среднем на 30 %. [1]
Овес. При обработке семян йодистым калием увеличилась урожайность зеленой массы, [2] а также содержание каротина.В ходе производственных опытов было установлено, что урожай овса за 12 лет возрос в среднем на 34 %. [1]
Подсолнечник. При обработке семян йодистым калием увеличилась урожайность зеленой массы и одновременно повысилось содержание масла в семенах. Однако при увеличении концентрации йодистого калия наблюдалось снижение урожайности. [2]
Томат, лук, капуста, огурец. Под влиянием йодистого калия отмечено повышение урожая в результате внекорневой подкормки. Не меньший эффект оказывает и предпосевная обработка семян. [1]
Удобрения, содержащие йод, значительно увеличивают концентрацию йода в растениях. Например, использование йодистого калия в смеси с карбоаммофоской, а также карбоаммофоски, промышленным способом обогащенной йодистым калием (KI – 300 г/га), привело к увеличению содержания йода в сене клевера-тимофеевки в 3 раза, а в овсе – в 5–6 раз. [1]
Внесение слабого водного раствора элементарного йода в почву и опрыскивание листьев данным раствором оказывает положительное влияние на ускорение развития различных видов растений и повышает их устойчивость к болезням и вредителям.
Установлено, что йод предохраняет салат от проволочника, томаты – от мозаичной болезни и корневой гнили, гладиолусы и львиный зев – от ржавчины, хризантемы становятся устойчивыми к воздействию нематод. [2]
Кроме того, обработка почвы перед посевом раствором йода и последующее опрыскивание рассады этим же раствором один раз в две недели приводит к более раннему созреванию томатов, салата и огурцов. [1]
![Табл_I_Йод.jpg]()
Кристаллы йода в стеклянной колбе. Фото: Dnn87/Wikimedia Commons CC-BY-3.0
![Табл_I_Википедия.jpg]()
Википедия, без сомнения, полезный ресурс, но рассматривать её как истину в последней инстанции, нужно с большой осторожностью. Фото: Nohat/Wikimedia Commons CC BY-SA 3.0
![Табл_I_Пузырёк.jpg]()
Йод – хороший антисептик для обработки ран. Фото: scienceowl CC BY-SA 3.0
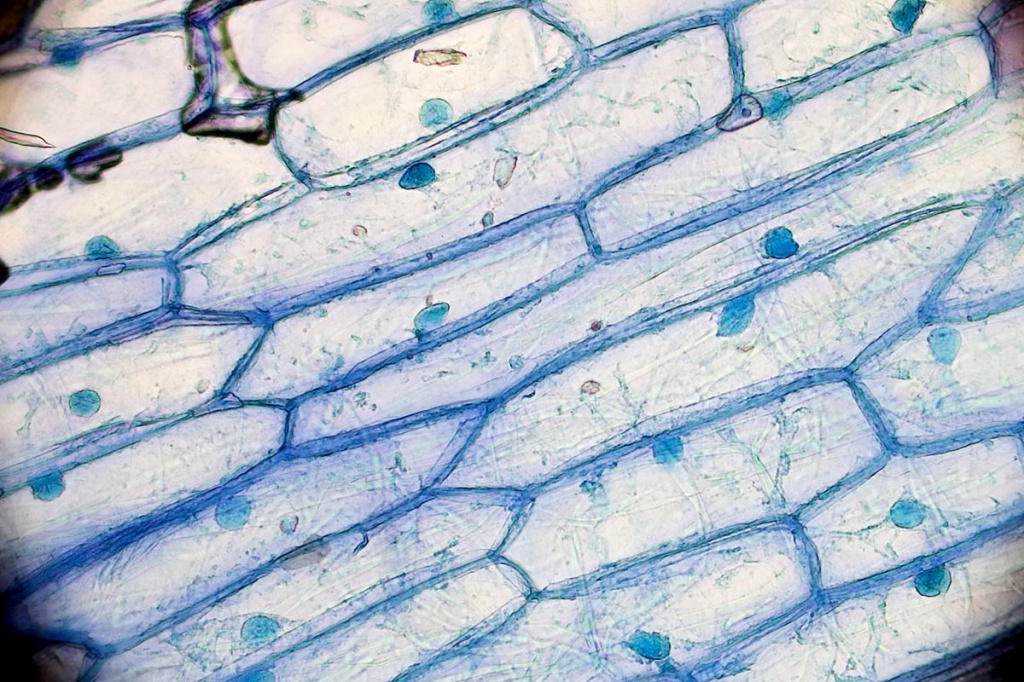
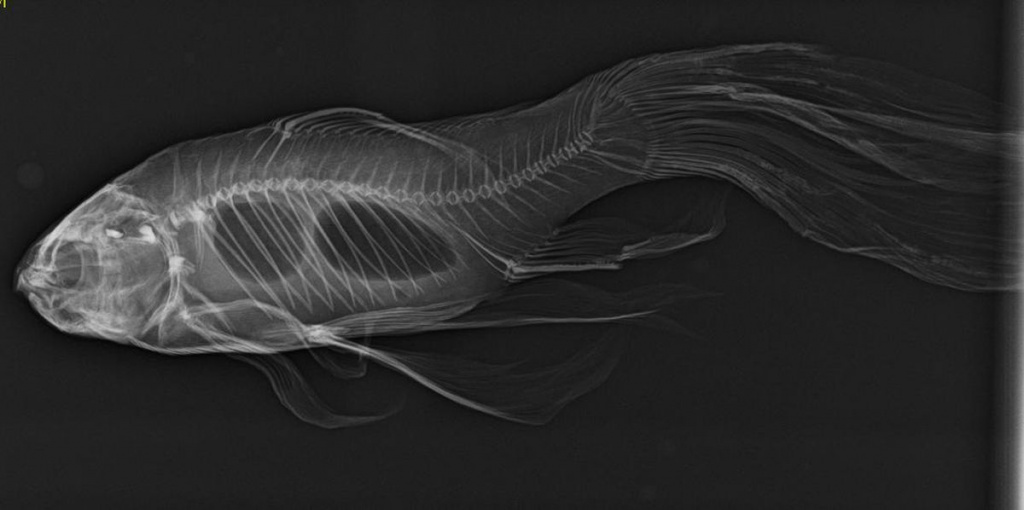
Способность йода, как впрочем, и его соседа по аптечке – зелёнки стойко окрашивать кожу можно использовать в познавательных целях, если, конечно, у вас есть микроскоп. Самый обычный йод помогает увидеть ядра клеток луковой кожуры или рассмотреть зёрна картофельного крахмала. Но контрастирование с помощью йода используется не только в домашних опытах, но и в современных рентгенологических методах исследования. Суть контрастирования заключается в том, что если какой-нибудь орган или область в теле человека плохо поглощает проходящие рентгеновские лучи и, соответственно, не виден на снимке, то ситуацию исправляют с помощью специальных веществ, хорошо эти самые лучи задерживающих. Как правило, чем больше размер атома, тем лучше он ловит рентгеновское излучение, поэтому мягкие ткани, в состав которых преимущественно входят лёгкие элементы вроде углерода, азота или кислорода, плохо видны на рентгеновских снимках, а кости, в которых много кальция и фосфора, – намного лучше.
![Табл_I_Кожура.jpg]()
![Табл_I_Рыба.jpg]()
Но если много йода в организме – это очень плохо, то недостаток этого элемента ничем не лучше. Причина тому – тиреоидные гормоны, в составе которых есть йод, и которые вырабатываются щитовидной железой. Эти гормоны влияют на множество процессов в организме: от обмена веществ до умственных способностей. Поэтому если вместе с пищей в организм не будет поступать достаточное количество йода, необходимое для выработки этих гомонов, то это может привести к тяжёлым последствиям. Например, на многих средневековых картинах, да и на полотнах более позднего периода, можно увидеть людей с утолщением на шее или, как его ещё называют, – зобом. Причина этому – увеличение размеров щитовидной железы, которая начинает расти, пытаясь компенсировать недостаточное количество вырабатываемых гормонов. Но если в организме отсутствует необходимый строительный материал для синтеза гормона – йод, то и рост железы ничего не даёт: зоб растёт, а толку от него никакого. Кстати, рост зоба уже довольно давно связали со снижением умственных способностей – ещё Наполеон отмечал, что новобранцы с зобом плохо понимают команды, рассеянны, невнимательны, а то и просто слабоумны.
![Табл_I_Зоб.jpg]()
![Табл_I_Грядка.jpg]()
В морской воде, а также во всём, что растёт и плавает в морях и океанах, много йода. Именно поэтому диетологи настоятельно рекомендуют включать в рацион что-нибудь, выросшее в солёных водах, хотя бы морскую капусту. Кстати, долгое время йод в промышленных масштабах получали именно из морских водорослей. Вдоль берегов строили специальные печи, в которых сжигали дары морей, а получившуюся золу, в которой было до 5% йода, отправляли на дальнейшую переработку. Однако в двадцатом веке такой способ уступил место экстракции йода из подземных солевых вод. В природе же остался ещё один естественный канал поступления йода на сушу – через атмосферу. Вода, испаряющаяся с поверхности моря, содержит пусть и небольшой, но разнообразный набор солей и других химических веществ, в том числе и соединения йода. Подхваченный воздушными массами такой водяной пар может переноситься на десятки и даже сотни километров вглубь территории, где конденсируется и выпадает вместе с дождём, избавляя местных жителей от проблем с йододефицитом.
![Табл_I_Ламинария.jpg]()
![Табл_I_Ледники.jpg]()
![Табл_I_Дождик.jpg]()
Но ещё до того как первый самолёт распылил над облаками йодистое серебро, это химическое вещество стало знаменитым благодаря одному французу, которого звали Луи Дагер. В начале девятнадцатого века ещё не была изобретена фотография, хотя первые попытки запечатлеть изображение, образно говоря, на бумаге уже вовсю предпринимались разными исследователями. Например, Нисефор Ньепс смог запечатлеть изображение на пластинке, покрытой слоем специального битума. На тех участках пластинки, куда падал солнечный свет, битум становился нерастворимым в некоторых маслах, в то время как битум на других участках успешно смывался маслом. В результате на пластинке оставалось не очень чёткое чёрно-белое изображение – гелиогравюра, а сам метод получил название гелиография.
Луи Дагер пошёл другим путём и экспериментировал с серебряными пластинками, на которых был нанесён тонкий слой йодистого серебра, а оно, как уже было известно, распадается на свету на серебро и йод. Поэтому если на такую пластинку спроецировать изображение, то на тёмных местах йодистое серебро останется, а на засвеченных – превратится в металлическое серебро. Однако что делать дальше с такой пластинкой, долгое время не знали, пока Дагер в одном из своих опытов не обнаружил, что если на такую пластинку подействуют пары ртути, то они прореагируют с серебром, образуя серую амальгаму – по сути, проявляя скрытое изображение. Если после этого с пластинки смыть оставшийся йодид серебра, то получится чёткое изображение, почти как на фотографии. Однако, строго говоря, это не настоящая фотография, а дагеротип – так сам Дагер назвал своё изобретение. Дело в том, что дагеротип – это по сути изображение на зеркале, которое смотрится по-разному под разным углом, в то время как фотография – это уже полноценное изображение на бумаге. Однако качество изображения, которое давала дагеротипия, было настолько хорошее, что ещё пару десятков лет с момента изобретения дагеротипы успешно использовались в портретных ателье по всему миру, пока их оттуда не вытеснили уже настоящие фотографии.
![Табл_I_Дагер.jpg]()
Помимо того, что йод помог Луи Дагеру в буквальном смысле сохранить свет на серебряном зеркале, йод ещё помогает этот самый свет создавать. Обычные лампы накаливания до прихода вездесущих светодиодов были основным бытовым источником света. Тёплый ламповый свет в таких лампах создаётся нагретой почти до трёх тысяч градусов Цельсия вольфрамовой спиралью. При таких высоких температурах даже такой тугоплавкий материал как вольфрам понемногу начинает испаряться, в результате спираль становится всё тоньше и тоньше, пока просто не перегорит. Чтобы продлить срок службы лампочки, в неё закачивают инертный газ, который не вступает ни с чем в химическое взаимодействие, но мешает вольфраму испаряться, хотя это лишь тормозит, но не останавливает процесс. Другой способ продлить лампочке жизнь заключается в обратном – внутрь стеклянной колбы закачивается не инертный, а очень активный, если так можно выразиться, газ, например, бром или йод. Как это меняет внутренний мир лампочки?
![Табл_I_Лампочка.jpg]()
Атомы вольфрама, испарившиеся со спирали, вступают в химическую реакцию с йодом. Получившееся соединение, в отличие от самого вольфрама, весьма летуче, и даже если оно осядет на внутренней поверхности стеклянной колбы, оно спустя некоторое время оттуда заново испариться. Поэтому рано или поздно, когда молекула йодида вольфрама попадёт на раскалённую спираль, оно развалится на части: вольфрам вернётся обратно на спираль, а испарившийся йод будет искать себе нового металлического спутника. И такой цикл будет повторяться раз за разом на протяжении всего срока службы лампочки. Единственное условие, при котором будет происходить этот процесс – высокая температура стеклянных стенок лампочки, которая нужна, чтобы с них испарялись йодиды вольфрама. Именно из-за необходимости поддерживать высокую температуру галогеновые лампочки, в отличие от обычных делают такими маленькими.
![Табл_I_Галогенка.jpg]()
В заключение расскажем о том, как йод помогает астрономам искать экзопланеты, и как с его помощью можно отличить хороший мёд от плохого. Найти планету у далёкой звезды весьма непросто. Если некоторые планеты нашей Солнечной системы можно увидеть даже невооружённым глазом, то экзопланеты на орбитах даже самых близких к нам звёзд не видны ни в один оптический телескоп. Однако астрономы всё же ухитрились открыть уже более четырёх тысяч из них. Рассказ обо всех методах поиска планет за пределами Солнечной системы – это отдельная и большая тема, поэтому ограничимся лишь одним из способов обнаружения, как раз тем, где проявляет себя наш разносторонний химический элемент.
![Табл_I_Телескоп.jpg]()
![Табл_I_Доплер.jpg]()
Иллюстрация эффекта Доплера для движущегося слева направо источника волн. Фото: ESA/Hubble (L. Calçada) CC BY 4.0
Когда мы говорим, что планета вращается вокруг звезды, мы немного лукавим. На самом деле оба тела вращаются вокруг центра масс системы, просто если масса звезды намного больше массы планеты, то положение этого центра практически совпадает с положением звезды. Но практически – не значит полностью, и если звезда не такая большая, а планета не такая маленькая, вроде нашего Юпитера, и к тому же расположена довольно близко к звезде, то вот это вращение звезды относительно центра масс системы уже становится заметным. Возвращаясь к нашему примеру с мотоциклом, представим, что мы сидим на трибуне и наблюдаем, как мотоциклист мчится по круговому треку. Когда он удаляется от нас, его звук становится более низким, а когда, наоборот, приближается, то более высоким. Теперь заменяем воображаемого мотоциклиста на звезду, звук на свет, а зрителя на трибуне на астронома на Земле, и получаем аналогичную картину: наблюдаемый цвет звезды будет с определённой периодичностью изменяться.
Теперь, если мы сможем зафиксировать эти маленькие повторяющиеся изменения в спектре звезды, то с уверенностью сможем сказать, что у этой звезды есть своя собственная большая планета. Есть лишь одна проблема, что если мы поставим прибор, который будет фиксировать изменения в спектре звезды, скажем, в течение нескольких месяцев, то колебания его настроек на таком продолжительном отрезке времени поглотят все полезные данные. И вот именно эту проблему решает йод! Если поместить на пути звездного луча ячейку с парами йода, и измерять уже не просто спектр звезды, а постоянно сравнивать его с неизменяющимся спектром йода, то можно поймать очень маленькие изменения спектра звезды, как раз необходимые для обнаружения экзопланеты. Йод был выбран потому, что его спектр поглощения очень хорошо подходит для подобных целей, хотя, справедливости ради, нужно сказать, что это не единственный способ калибровки спектрометров.
![Табл_I_Экзопланета.jpg]()
Как выглядят экзопланеты в реальности мы пока можем только гадать. Фото: NASA/JPL-Caltech CC BY 2.0
Читайте также: