Характеристика магния по плану 9 класс химия кратко
Обновлено: 02.07.2024
Дать характеристику хим. Элементу под номером 12, по его положению в периодической системе.
Магний (Mg) располагается в 3 периоде, во II группе, главной подгруппе, имеет порядковый номер 12. Массовое число: A = 24 Число протонов: P = 12 Число электронов: ē = 12 Число нейтронов: N = A - Z = 24 - 12 = 12 Электронные оболочки атома магния Mg 12Mg 1s2 2s2 2p6 3s2 Валентные электроны 12Mg ↑↓ 3s 3p 12Mg* ↑ ↑ 3s 3p Магний – s-элемент, металл. Степени окисления минимальная: 0 максимальная: +2 Высший оксид: MgO – оксид магния. Проявляет основные свойства: MgO + 2HCl ⟶ MgCl2 + H2O Высший гидроксид: Mg(OH)2 – гидроксид магния. Проявляет основные свойства: Mg(OH)2 + 2HCl ⟶ MgCl2 + 2H2O
Магний является металлом, обладает 12-м по счету номером в Периодической системе, расположен в 3-м периоде, II группе А-подгруппы.
Международное обозначение в химии — Mg (Magnesium). Заряд ядра магния составляет +12, а атомный вес равен 24,132 а.е.м. При обычных условиях металл отличается легкостью, хорошей ковкостью, имеет серебристый цвет.
Химические свойства магния:
- не вступает в реакцию со щелочами;
- взаимодействие с кислотами приводит к полному растворению магния и выделению водорода;
- при нагреве на воздухе происходит сгорание металла с выделением теплоты и яркого свечения;
- смесь магниевого порошка и активных окислителей взрывоопасна;
- при увеличении температуры магний активно реагирует с водой.
В воздушной среде магний окисляется. Процесс формирует на поверхности защитную пленку, которая разрушается при нагреве до 600°C. Реакция сопровождается ослепительно-белой вспышкой пламени, образованием оксида и нитрида. Утилитарные свойства магния зависят от степени чистоты. В очищенном состоянии металл пластичен, легко подается механической обработке.
Магний в природе встречается в формах:
Металл в большой концентрации содержится в следующих материалах:
- брусит;
- кизерит;
- бишофит и др.
Помимо минеральных залежей, металл обнаружен в:
- морской воде;
- рапе (насыщенном соляном растворе солей).
Места расположения залежей осадочного происхождения:
- магнезит в гидротермальных источниках;
- доломит в осадочных карбонатных прослойках;
- самородные фрагменты металла, сформированные газами.
Строение электронных оболочек, электронная формула атома магния
Расположение магния в 3-м периоде указывает на наличие у металла трех электронных слоев. Один из них является внешним и содержит валентные электроны. Атом магния обладает положительно заряженным ядром (+12) с 12 протонами и 12 нейронами, что является разницей между атомным весом и порядковым номером. Вокруг ядра перемещаются 12 электронов, что отображено на схеме:
+ 12 M g ) 2 ) 8 ) 2
1 s 2 2 s 2 2 p 6 3 s 2
Магний является s-элементом. Энергетическая диаграмма атома металла с валентными электронами имеет следующий вид:
( M g 2 + ) . В соединениях вещество обладает степенью окисления +2.
M g 0 – 2 e → M g 2 +
Химические соединения, уравнения реакций
Качественная реакция в случае магния представляет собой взаимодействие соли магния с какой-либо щелочью. В результате образуется студенистый осадок гидроксида магния.
Взаимодействие хлорида магния и гидроксида калия с образованием гидроксида магния и хлорида калия:
M g C l 2 + 2 K O H = M g ( O H ) 2 + 2 K C I
Магний является сильным восстановителем, что объясняет способность металла реагировать практически со всеми неметаллами.
Взаимодействие магния с азотом при температуре 780-800°C с образованием нитрида магния:
3 M g + N 2 = M g 3 N 2
Сгорание магния в кислородной среде при температуре 600-650°C приводит к образованию оксида магния:
2 M g + O 2 = 2 M g O
Активная реакция магния на влажный хлор при комнатной температуре с образованием хлорида магния:
M g + C l 2 = M g C l 2
Реакция магния с водородом протекает при температуре 175°C в условиях высокого давления и при наличии катализатора M g I 2 . В результате образуется гидрид магния:
M g + H 2 = M g H 2
Магний способен активно вступать в химические реакции со сложными веществами.
Реакция магния с горячей водой с образованием гидроксида магния и водорода:
M g + 2 H 2 O = M g ( O H ) 2 ↓ + H 2 ↑
Взаимодействие магния с кислотами можно рассмотреть на примере реакции металла и разбавленной соляной кислоты с образованием хлорида магния и водорода:
M g + 2 H C l = M g C l 2 + H 2 ↑
Взаимодействие магния с разбавленной азотной кислотой приводит к синтезу нитрата магния, оксида азота (I) и выделению воды:
4 M g + 10 H N O 3 = 4 M g ( N O 3 ) 2 + 2 N 2 O ↑ + 5 H 2 O
При контакте магния с сероводородной кислотой в условиях нагрева до 500°C образуются сульфид магния и водород:
M g + H 2 S = M g S + H 2
Взаимодействие магния с газом аммиаком при температуре 600-850°C приводит к образованию нитрида магния и водорода:
3 M g + 2 N H 3 = M g 3 N 2 + 3 H 2
Примером реакции магния с оксидами является процесс взаимодействия металла с оксидом азота (IV) при температуре 150°C в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
M g + 4 N O 2 = M g ( N O 3 ) 2 ↓ + 2 N O
Взаимодействие магния с оксидом кремния при температуре менее 800°C в атмосфере водорода приводит к образованию силицида магния и оксида магния:
4 M g + S i O 2 = M g 2 S i + M g O
При повышении температуры до 1000°C образуются кремний и оксид магния:
2 M g + S i O 2 = S i + 2 M g O
Производство, где применяется
Существует несколько способов получения магния. Наиболее распространенным является электролиз, который активно применяют в промышленных масштабах.
Электролиз расплава хлорида магния с образованием магния и хлора:
M g C l 2 = M g ↓ + C l 2 ↑
Разложение нитрида магния при температуре 700-1500°C с образованием магния и азота:
M g 2 N 2 = 3 M g + N 2
Восстановление оксида магния с помощью углерода при температуре выше 2000°C с образованием магния и угарного газа:
M g O + C = M g + C O
Восстановление оксида магния с помощью кальция при температуре 1300°C приводит к образованию магния и оксида кальция:
M g O + C a = C a O + M g
Некогда наиболее известной являлась область применения металла, связанная с производством фотоаппаратов с магниевой вспышкой. В настоящее время вещество получило распространение во многих отраслях промышленности. Материал используют в разных видах:
Применение магния в промышленности:
- огнеупорные материалы, магний является сырьем для синтеза компонентов металлургических печей;
- сырье для выработки легких и сверхлегких сплавов, необходимых для ракетостроения, авиастроения, автомобильной промышленности;
- получение ферросиликомагния в виде сплава магния, кремния и железа для выплавки чугуна.
Магний используют при разработке оружия. Свойство металла гореть ослепляющим пламенем применяют в производстве таких боеприпасов, как:
- зажигательные бомбы;
- сигнальные ракеты;
- трассирующие пули.
Научная и другие сферы применения магния:
- изготовление энергоемких электрических батарей, сухих элементов на основе металла, его соединений;
- производство линз и разной оптики с помощью компонентов в виде выращенных кристаллов фторида магния;
- осушение газов с помощью перхлората магния;
- электролит химических источников тока на основе бромида магния;
- выпуск пиротехнической продукции;
- соединения магния используют в медицине.
Современные ученые активно работают над созданием магниево-серных батарей. Такие аккумуляторы должны превосходить в эффективности и емкости ионно-литиевые батареи.
Биологическая роль и токсикология
Магний имеет большое значение для жизни и здоровья человека. Элемент изначально входит в состав живых организмов. Продукты повседневного питания, включая хлеб, молоко, мясо, содержат минимальное количество магния, который обеспечивает и нормализует следующие внутренние процессы:
- белковый синтез;
- работа нервной системы, сердца;
- расширение сосудов;
- отделение желчи;
- функционирование желудочно-кишечного тракта;
- выведение холестерина из организма;
- сокращение мышц.
Магний является составным компонентом хлорофилла. Вещество участвует в процессе фотосинтеза. В хлорофилле содержится примерно 2,7 % магния от общей массы. Вещество сконцентрировано в зеленых частях растительных организмов. Магний влияет на механизм формирования в листьях пигментов, в том числе ксантофилла и каротина. Из него состоит запасное вещество — фитин, который содержат семена растений.
Определена суточная норма магния для взрослых людей. Она составляет 300 мг для женщин и 400 мг — для мужчин. Данная потребность может быть увеличена при наличии следующих факторов:
- психические и физические нагрузки;
- стресс;
- злоупотребление алкоголем;
- потливость.
При поступлении магния в организм усваивается лишь треть от общего количества вещества. Продукты с большой концентрацией магния:
- какао;
- отруби;
- орехи;
- тыквенные семечки;
- зеленые овощи.
При избытке или дефиците магния развиваются такие патологии, как:
- артрит, остеопороз;
- судороги, мышечные спазмы;
- головная боль;
- сбои в работе пищеварительной системы, сердца;
- бессонница, перманентная усталость, раздражительность.
Передозировка магния приводит к следующим последствиям:
- пониженное артериальное давление;
- тошнота, рвота;
- угнетение центральной нервной системы, рефлекторной функции, дыхания;
- кома, паралич дыхательных путей, сердца.
Магний обладает небольшой токсичностью. Опасен в процессе горения. Если смотреть на горящее вещество, можно обжечь сетчатку глаза и временно ослепнуть.
О том, что для организма человека очень полезен такой химический элемент, как магний, сейчас говорят часто. Этот микроэлемент является основным действующим веществом различных лекарств и входит в состав многих поливитаминов. Но также один из видов вещества применяется в металлургии. Неудивительно, что в настоящее время ведётся активная добыча этого представителя периодической таблицы Менделеева.
- История открытия
- Определение и физическая характеристика
- Химические свойства
- Нахождение в природе
- Получение в промышленности
- Применение вещества
- Магний в организмах
- Переизбыток и недостаток

История открытия
Новая эра развития химии началась в XVII веке. В этот период химик из Англии по фамилии Гро совершил открытие, приблизившее учёных к выделению магния. В 1695 г. во время выпаривания эпсомской минеральной воды он получил горькую соль, обладавшую свойством слабительного.
Через несколько лет исследования показали, что взаимодействие вещества с содой и карбонатом калия даёт белый рыхлый порошок. Этот же результат был получен во время прокаливания минерала, который был найден рядом с городом Магнезия в Греции. Из-за этого сходства соль стали назвать белой магнезией.
Следует отметить, что реактив имел различные примеси. Чистый элемент в 1829 г. вывел французский химик Антуан Александр Брутус Бюсси.
Определение и физическая характеристика
Вещество является представителем II группы периодической системы химических элементов.
Ему можно дать следующую характеристику:
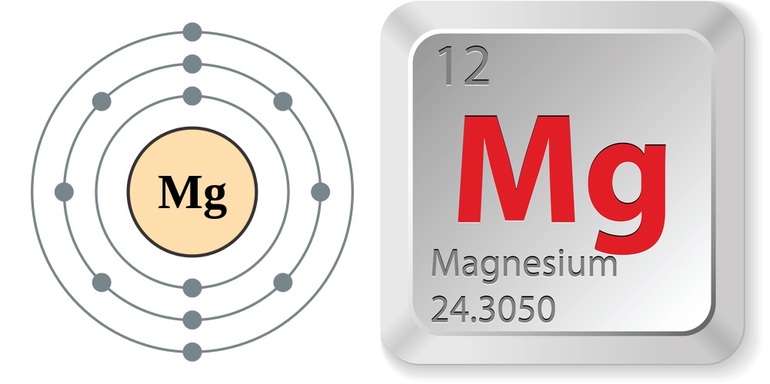
- Магний принято обозначать Mg.
- Атомный номер вещества 12.
- Молярная масса элемента составляет 24,305 атомных единиц.
- Заряд ядра равен 12.
- В каждом атоме число электронов — 12.
- Кристаллическая решётка вещества имеет α-форму Ca гранецентрированная кубическая. Она отличается устойчивостью при обычной температуре.
- Плотность — 1,738 г/см³.
- Плавится металл при температуре 650 °C.
- Кипит вещество при 1090 °C.
- Чистый элемент отличается пластичностью. Его можно легко прессовать, прокатывать и резать.
Реагент в компактном состоянии представляет собой блестящий металл серебристо-белого цвета. Под воздействием воздуха он тускнеет, так как на поверхности образуется плёнка окиси.
Горит металлический реагент ослепительным пламенем белого цвета. Скорость, с которой вспыхивает вещество, во много раз превосходит скорость одёргивания руки. Из-за этого физического свойства магния человеку, поджигающему элемент, необходимо соблюдать все положенные правила техники безопасности. В противном случае, он получит серьёзный ожог кожи. Для наблюдения за процессом горения следует использовать тёмные очки или стекло. Без этих мер предосторожности повышает риск получения ожога сетчатки, который приводит к временной слепоте.
Химические свойства
Все стабильные соединения элемента имеют валентность равную двум, а электронная формула магния или схематичное строение его атома имеет вид: 1s2 2s2 2p6 3s2.

Даже при нагревании до 350 °C компактный магний подвергается незначительному окислению, поскольку он покрыт оксидной плёнкой. Горит реагент при температуре от 600 до 650 °C, при этом образуются оксид и нитрит элемента. Нитрит также можно получить, нагрев вещество до 500 °C в азотной среде.
Элемент относится к активным веществам. Кроме того, выделяют следующие химические свойства магния:

- Не вступает в реакцию с холодной водой, которая не насыщена воздухом.
- Постепенно вытесняет водород из кипятка.
- С водяным паром реагирует при температуре не ниже 400 °C.
- В жидком виде выделяет из влажного воздуха водород, поглощая его.
- Застывая, элемент практически полностью выводит водород.
- При нагревании водородной атмосферы до 400−500 °С вещество вступает в реакцию с ней, образуя гидрид магния.
- Вытесняет большую часть металлических элементов из растворов их солей, образованных на основании воды.
- В холодных условиях, соединяясь с влажным хлором, образует хлорид магния.
- В нагретом состоянии вступает в реакцию с галогенами.
- Большая часть солей элемента хорошо растворяется в воде.
- При контакте с едкими щелочами выпадает осадок, образованный из растворов солей магния.
- При пониженной температуре не вступает в реакцию с водными щелочными растворами, но подвержен растворению в гидрокарбонатах щелочных металлических реагентов и аммониевых солей.
- Не растворяется в концентрированной серной кислоте.
- От растворения в плавиковой кислоте защищён плёнкой из устойчивого фторида.
- Взаимодействует с разбавленными минеральными кислыми соединениями при низких температурах.
Реагент представляет собой сильный восстановитель. Нагретый магний вытесняет некоторые металлы и неметаллы из оксидов и галогенидов. Существует множество металлоорганических соединений вещества, которые делают его одним из важнейших элементов органического синтеза.
Реагент легко создаёт сплавы со многими металлами, а потому на нём основывается производство множества очень важных лёгких материалов.
Нахождение в природе
Земля очень богата магнием. Всего шесть химических реагентов встречаются в природе чаще, чем это вещество. Большая часть элемента находится в мантии планеты, в земной коре его меньше. Чаше всего его обнаруживают в основных породах и граните. И также элемент содержится в различных минералах, образованных магмой.
В основном чистый магний добывают из трёх минералов:
- карналлита;
- доломита;
- магнезита.

В России самые большие залежи магнезита находятся на Среднем Урале и в Оренбургской области. Карналлит добывается около города Соликамска, следует отметить, что это месторождение самое крупное в мире. Наиболее распространённый минерал доломит встречается в Московской и Ленинградской областях, а также других регионах страны.
В биологической среде планеты соединения магния постоянно перемещаются и изменяются. Лишь малая часть элемента задерживается в круговороте веществ, происходящем на материках, большое количество реагента уносится реками в океан. Несмотря на то что по содержанию в морской воде магний уступает только натрию, непосредственно сама жидкость не имеет насыщения элементом, а его соли в открытом океане не выпадают в осадок.
Вещество в составе различных соединений накапливается в солях, остающихся после того, как из лагун испаряется вода.
Получение в промышленности
В промышленных условиях для получения магния чаще всего применяют электролиз безводного хлорида или обезвоженного карналлита. Процесс проходит следующим образом:

- Электролиз проходит при температуре от 720 до 750 °C.
- По мере выделения элементов состав ванны корректируется, часть электролита при этом удаляется, а сырьё добавляется.
- Расплавленный искомый металл всплывает на поверхность, и его регулярно извлекают.
- Полученное вещество содержит много примесей. Для очистки элемент проходит рафинирование в специальных печах под слоем флюсов.
- Очищенный металл разливают в изложницы.
- Следующая очистка заключается в том, что реагент сублимируют несколько раз в вакууме.
Кроме этого метода, на производстве применяются металлотермический и углетермический способы получения магния. В первом случае брикеты из раскалённого и разложившегося доломита смешивают с восстановителем и нагревают в вакууме при температуре 1300 °C. Полученные в результате магниевые пары образуют конденсат, когда температура опускается до 400−500 °С. Чтобы очистить металл, применяют переплавку под флюсом или в вакууме. Чистый элемент разливают в изложницы.
При использовании второго метода брикеты, состоящие из угля и магниевой окиси, разогревают в электрических печах до 2100 °C. Превратившийся в пар металл отгоняют и конденсируют.
Также вещество добывают из морской воды. Для этого сырьё в очень больших баках смешивают с суспензией гидроксида кальция, который получают, перемалывая морские раковины. В результате происходящей химической реакции образуется особая суспензия, которая после высыхания становится хлоридом магния. После этого продукт подвергают электролитическим процессам.
Кроме морской воды, для выгонки магния может использоваться вода некоторых соленых озер. В Российской Федерации такие озёра находятся в Крыму, Поволжье и других регионах.
Применение вещества
Наибольшее количество металла потребляет металлургия. На его основе создаётся множество сплавов. Часто вещество используют в металлотермических процессах, чтобы получить редкие металлы, а также те, которые трудно восстановить. Применяется реагент для раскисления и десульфурации металлических веществ. Различные порошковые смеси на основе магния используются в качестве осветительных и зажигательных.
Соединения, содержащие реагент, нашли широкое применение в различных сферах жизнедеятельности. К примеру, в медицине, лекарства с магнием позволяют избавить пациентов от спазмов и судорог, успокоить нервы и так далее.
Магний в организмах
Магний содержится во всех растениях и животных. Вещество концентрируется в некоторых морских организмах. Максимальное количество металлического элемента содержится в известковых губках — до 4%.
Люди и животные получают металлический элемент с пищей. Суточная норма потребления для человека составляет от 0,3 до 0,5 г. У детей и беременных женщин потребность в веществе несколько выше. У здорового человека в крови должно содержаться около 4,3 мг/% магния. В организме основным потребителем реагента является печень, но большая часть поглощённого ею металла постепенно переходит в кости и мышцы.
Переизбыток и недостаток
Магний практически безвреден для организма, хотя некоторым его соединениям и присвоен II класс опасности. В основном же металл в разных видах приносит лишь пользу. А страдают люди, животные и растения чаще всего от недостатка или переизбытка вещества.
Когда металла в организме слишком мало, увеличивается риск развития сахарного диабета, болезней почек и кишечника. У людей, страдающих от недостатка микроэлемента, часто болит голова, начинается бессонница, появляются спазмы мышц, быстро наступает утомление. При отсутствии лечения это может привести к различным более серьёзным заболеваниям, повышается возможность заболеть раком.

Прежде чем приступать к восстановлению уровня вещества в организме, необходимо проконсультироваться с врачом и установить степень потребности в веществе. После сдачи анализов доктор назначит переменный или постоянный на протяжении какого-то времени приём соответствующих лекарственных препаратов, принимать которые следует строго по инструкции.
При переизбытке микроэлемента у людей появляются следующие болезни:
- артрит;
- нарушение речи;
- тошнота;
- сонливость;
- и так далее.
Когда в почве содержится недостаточное количество вещества, у растений начинается мраморность листвы и хлороз. Отсутствие магния в рационе вызывает у крупного рогатого скота травяную тетанию.
Магний относится к жизненно необходимым микроэлементам. Сложно переоценить роль этого вещества в животных и растительных организмах. Его отсутствие в достаточном количестве способно возбудить множество заболеваний.
напишем строение атома магния и его электронную формулу:
а). Модель атома магния при помощи
б). Модель атома, через электронную
формулу (электронная конфигурация):
электронная формула алюминия ₊₁₂Mg
в).Электронно-графическая модель атома:
4. Простое вещество магний металл, состоит из
одного атома , валентность магния в соединениях равна 2, степень
окисления+2 . Магний –восстановитель.
5. Молекулы атомов в 2 группе, главной подгруппе
одноатомные. С увеличением заряда ядра от бериллия до радия неметаллические свойства уменьшаются, а
6. Молекулы атомов простых веществ в периоде: натрий, магний, алюминий, кремний —
одноатомные; фосфора четырехтомные P₄, серы многоатомные (S)n,хлора двухатомные CI₂. От натрия к хлору меняются
свойства веществ: натрий, магний — металлы, алюминий -амфотерный металл, кремний полуметалл, фосфор, сера, хлор — неметаллы. Также слева направо в периоде меняются окислительно-восстановительные свойства. Натрий, магний, алюминий — восстановители. Кремний, фосфор, сера, хлор — могут быть как восстановителями, так окислителями.
7. Формула высшего оксида: MgO – основной оксид
8. Формула гидроксида: Mg(OH)₂- основание не
растворимое в воде.
9. Летучего соединения с водородом не образует, а соединение магния с водородом — это гидрид алюминия MgH₂ -Представляет собой твёрдое белое нелетучее
1) Название элемента -калий,
химический символ — K, порядковый номер — № 19 ,
атомная масса Ar=39 Группа — 1, подгруппа- главная , 4-й период
Заряд ядра атома калия Z=+19 (в ядре 19 протонов-
p⁺ и 20 нейтронов — n⁰)
Вокруг ядра атома 4 энергетических уровня, на
которых располагаются 19 электронов.
3) Исходя из вышеизложенного
напишем строение атома калия и его электронную формулу:
а). Модель атома калия при помощи
б). Модель атома, через электронную
формулу (электронная конфигурация):
электронная формула калия ₊₁₉K 1s²2s²2p⁶3s²3p⁶4s¹
в).Электронно-графическая модель атома:
4. Простое вещество калий щелочной металл, состоит из
одного атома , валентность калия в соединениях равна 1, степень
окисления+1 . Калий –восстановитель.
5. Молекулы атомов в 1 группе, главной подгруппе одноатомные. С увеличением заряда ядра от лития до франция неметаллические свойства уменьшаются, а металлические усиливаются.
6. Молекулы атомов простых веществ в периоде: от калия до криптона меняются от типичных металлов до неметаллов
7. Формула высшего оксида: K₂O – основной оксид
8. Формула гидроксида: KOH- основание растворимое в воде, щелочь
9. Летучего соединения с водородом не образует. Гидрид калия — это неорганическое бинарное химическое соединение белого цвета. Химическая формула KH. Гидрид калия образует бесцветные ионные кристаллы с решеткой типа NaCl. Хорошо растворим в расплавленном калии, не растворяется в органических растворителях. Обладает высокой теплопроводностью. Гидрид калия является ионным соединением K⁺H⁻.
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
Читайте также:
- Почему гражданская война затянулась на 4 года в сша кратко
- План квартиры с мебелью для урока английского
- Какие черты устного народного творчества можно найти в стихотворении бородино 5 класс кратко
- Почему одних людей называют жаворонками а других совами обж кратко
- Как правильно выбрать профессию кратко

